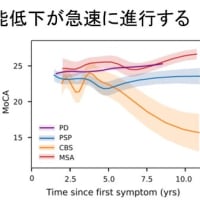
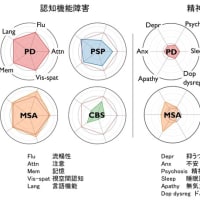
ハンチントン病(HD)モデルマウスとして,Bates 等が作成したR6/2がある.このマウスはヒトHD遺伝子のexon 1(150 CAG repeatを含む) を導入したトランスジェニック(Tg)マウスであり,ポリグルタミン病における核内封入体の発見の契機となった有名なTgマウスである.このマウスは不思議なことに耐糖能異常を呈することが知られている.また実際にヒトのハンチントン病でも10-25%に耐糖能異常が存在するという報告があるり(Lancet 24; 1356-1358, 1972).
今回,SwedenよりこのR6/2マウスの耐糖能異常に関する研究結果が報告された.まず12w(ヒトでは進行期に相当する)の時点で,wild typeと比較し,低インスリン血症を伴う高血糖が認められ,経静脈的に行った糖負荷テストにてインスリン分泌低下が存在することを確認した.病理学的に膵島細胞を調べたところ,huntingtinによる封入体が,とくにβ細胞において経時的に,劇的に増加することが分かった.またβ細胞は通常,加齢とともに増加するが,R6/2マウスではこの増加が見られなかった(12wの時点で,β細胞と膵臓インスリン含量はwild typeと比較し,それぞれ35±5%,16±3%であった).またβ細胞には異常な細胞死は認められなかったが,通常認められるはずの分裂細胞が認められなかった.さらにパッチ・クランプテストの結果,電気的異常を認め,β細胞においてexocytosisの異常が存在することが分かった(インスリンを含む分泌顆粒のexocytosisが96%減少していた).
以上の結果はR6/2マウスにおける耐糖能異常が,β細胞の複製の障害による減少と,インスリン分泌顆粒のexocytosisの障害というふたつの原因で生じていることを示している.今回の研究ではその発症機序までは明らかにされていないが,膵機能障害がβ細胞の細胞死によって生じたのでないという点は非常に興味深く,神経細胞変性の病態機序の解明に役に立つかもしれない.
Hum Mol Genet 14; 565-574, 2005
今回,SwedenよりこのR6/2マウスの耐糖能異常に関する研究結果が報告された.まず12w(ヒトでは進行期に相当する)の時点で,wild typeと比較し,低インスリン血症を伴う高血糖が認められ,経静脈的に行った糖負荷テストにてインスリン分泌低下が存在することを確認した.病理学的に膵島細胞を調べたところ,huntingtinによる封入体が,とくにβ細胞において経時的に,劇的に増加することが分かった.またβ細胞は通常,加齢とともに増加するが,R6/2マウスではこの増加が見られなかった(12wの時点で,β細胞と膵臓インスリン含量はwild typeと比較し,それぞれ35±5%,16±3%であった).またβ細胞には異常な細胞死は認められなかったが,通常認められるはずの分裂細胞が認められなかった.さらにパッチ・クランプテストの結果,電気的異常を認め,β細胞においてexocytosisの異常が存在することが分かった(インスリンを含む分泌顆粒のexocytosisが96%減少していた).
以上の結果はR6/2マウスにおける耐糖能異常が,β細胞の複製の障害による減少と,インスリン分泌顆粒のexocytosisの障害というふたつの原因で生じていることを示している.今回の研究ではその発症機序までは明らかにされていないが,膵機能障害がβ細胞の細胞死によって生じたのでないという点は非常に興味深く,神経細胞変性の病態機序の解明に役に立つかもしれない.
Hum Mol Genet 14; 565-574, 2005