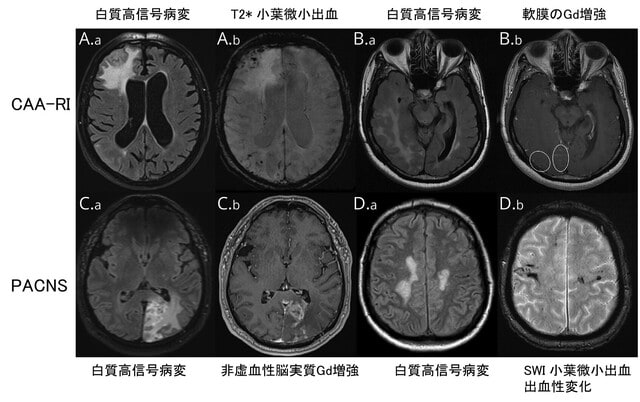
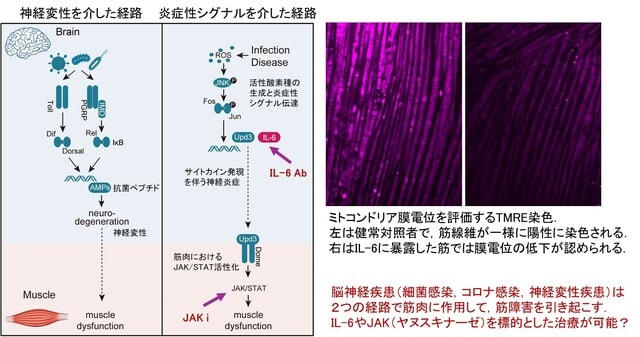
以前,Brain Nerve誌の特集号「芸術と神経学(2021)」のなかで,高尾昌樹先生がジストニアを描いた画家としてエゴン・シーレを紹介されていましたが,フロリダ大学のMichael S. Okun教授はご自身のTwitterで,アメデオ・モディリアーニ(1884-1920)の絵を紹介されていました.この印象的な絵は見たことがありましたが,モディリアーニについてよく知りませんでしたので調べてみたところ,Mov Disord Clin Pract誌に下記の論文がありました.
論文には1枚目の絵「 Portrait of a woman with hat」が紹介されていて,「モディリアーニはジストニアのような上半身の伸長,弯曲,ねじれによって,しばしば肖像画に官能性を呼び起こした.特に内縁の妻ジャンヌ・エビュテルヌを描いた作品では顕著である.傾いた顔に2本の指が軽く触れているポーズは,斜頸で観察される感覚トリックの典型である」と書かれていました(感覚トリックはある部位を触ることによってジストニア症状が緩和される現象のことです).
2枚目の絵「Jeanne Hebuterne in Red Shawl」もタイトルから分かるようにエビュテルヌを描いたもので,やはり頸部のジストニアを認めます.ただしこれらのポーズは,イタリア・ルネサンス期に流行した「ヴァージン・アンヌシャンテ(Virgin Annunciate:受胎告知)」であるとの指摘もあるようです.
モディリアーニは35歳の若さで結核性髄膜炎で亡くなりましたが,その翌日,エビュテルヌは5階の窓から飛び降り,身ごもっていた子供とともに自殺されたそうです.
エビュテルヌが頸部ジストニアであったという証拠はありません.一方,モディリアーニ自身が頸部ジストニアであったという確たる証拠はないものの,何枚かの写真には頭部の傾斜と右胸鎖乳突筋の肥大が写っているとの記載があります.
Newby RE, et al. A History of Dystonia: Ancient to Modern. Mov Disord Clin Pract. 2017;4(4):478-485.

論文には1枚目の絵「 Portrait of a woman with hat」が紹介されていて,「モディリアーニはジストニアのような上半身の伸長,弯曲,ねじれによって,しばしば肖像画に官能性を呼び起こした.特に内縁の妻ジャンヌ・エビュテルヌを描いた作品では顕著である.傾いた顔に2本の指が軽く触れているポーズは,斜頸で観察される感覚トリックの典型である」と書かれていました(感覚トリックはある部位を触ることによってジストニア症状が緩和される現象のことです).
2枚目の絵「Jeanne Hebuterne in Red Shawl」もタイトルから分かるようにエビュテルヌを描いたもので,やはり頸部のジストニアを認めます.ただしこれらのポーズは,イタリア・ルネサンス期に流行した「ヴァージン・アンヌシャンテ(Virgin Annunciate:受胎告知)」であるとの指摘もあるようです.
モディリアーニは35歳の若さで結核性髄膜炎で亡くなりましたが,その翌日,エビュテルヌは5階の窓から飛び降り,身ごもっていた子供とともに自殺されたそうです.
エビュテルヌが頸部ジストニアであったという証拠はありません.一方,モディリアーニ自身が頸部ジストニアであったという確たる証拠はないものの,何枚かの写真には頭部の傾斜と右胸鎖乳突筋の肥大が写っているとの記載があります.
Newby RE, et al. A History of Dystonia: Ancient to Modern. Mov Disord Clin Pract. 2017;4(4):478-485.