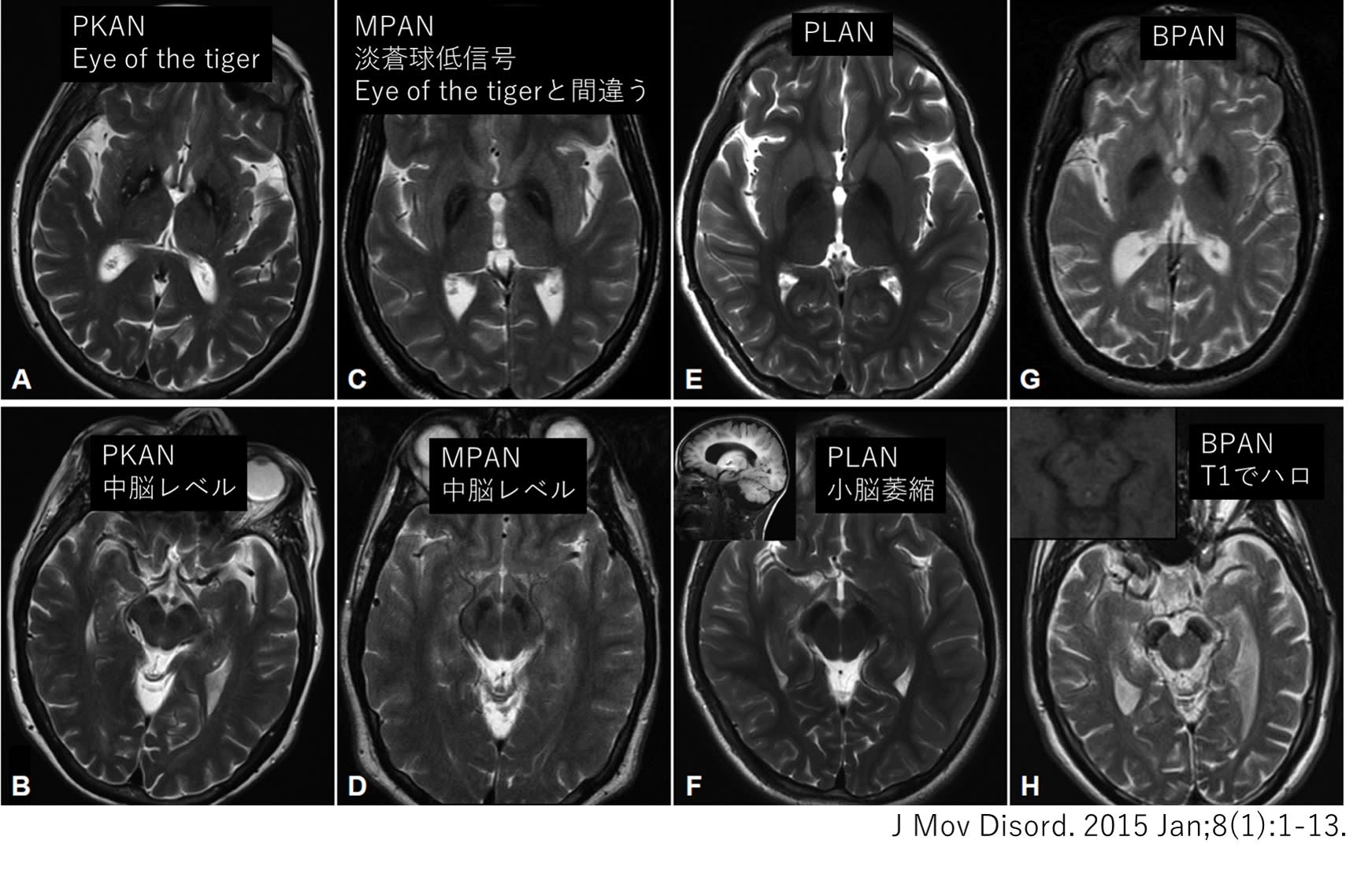
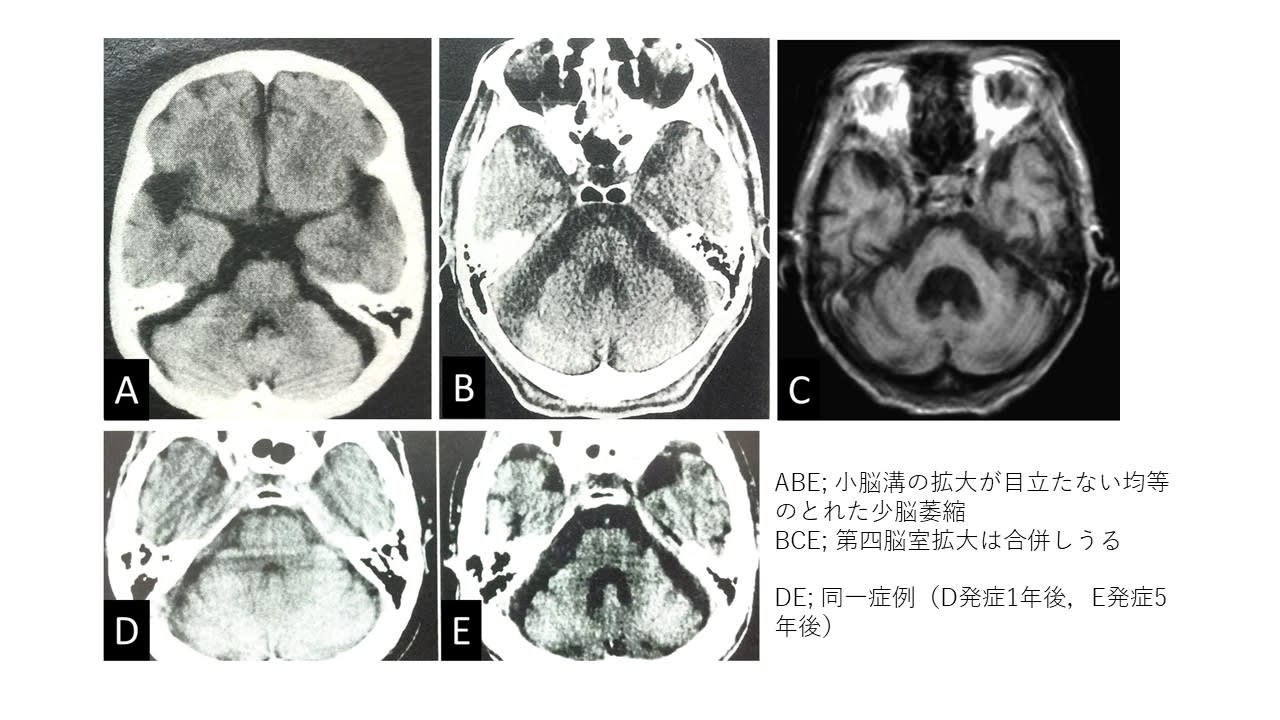
新潟大学医歯学総合病院では複数の臨床診療科(神経内科,耳鼻咽喉科,呼吸器内科,摂食嚥下リハビリ,循環器内科)が協力して,本邦で一番多い脊髄小脳変性症である多系統萎縮症(MSA)の臨床研究に取り組んできた(Niigata MSA study).MSAにおける突然死メカニズムと予防法の解明を目指した研究である.今回,総括ともいうべき総説論文をParkisnonism and Related Disorders誌に掲載していただいた.2001年から15年かけて行ってきた研究であり感慨深い.
この研究は,私の盟友である耳鼻咽喉科医がその必要性を訴えて開始したものである.自身が担当したMSA患者さんが突然死されたことから,この研究が必要と考え,睡眠呼吸障害に詳しい呼吸器内科医と,詳しくはない神経内科医(私)に声がかかり始まった.それから15年間で多くのことが分かったが,大きく,以下の4点に要約できる.
1.突然死は,CPAPのみならず気管切開術でも防げず,これらの治療は場合によっては(floppy epiglottisや中枢性睡眠時無呼吸症候群症状を介して)症状の増悪を引き起こしうること.
2.突然死のメカニズムは少なくとも4つあり(中枢性呼吸調節障害,窒息,CPAPによる上気道閉塞,心臓自律神経障害),複数の診療科による集学的アプローチを要すること.
3.突然死の多くは人工呼吸器装着により防止できること.
4.MSAは認知機能障害を合併しうることから,告知や治療の自己決定という倫理的問題に直面すること.
今回,論文の査読者から4の倫理的問題を提起するだけではなく,見解を述べるよう求められた.以下が現時点での私どものスタンスである.
1.突然死リスクの告知は,患者さん・家族に大きな不安をもたらすことを重視し,画一的に伝えるのではなく,危険性が高い症例を中心に,年齢,経過,性格,教育レベルなどを考慮して,症例ごとに検討したうえで行うべきである.危険性については,自律神経障害や睡眠呼吸障害・上気道閉塞が高度な症例ほど高いと言われているが,さらなる危険因子の同定が必要である.
2.気管切開術や人工呼吸器装着といった治療の選択は,認知機能を正しく評価した上で,これまで明らかになっている知見を共有して行うことが望ましい.
MSA診療の難しさは,複数の診療科による集学的アプローチを要することと,臨床倫理的な問題への取り組みを要することである.いずれも難しい問題であるが,本論文の私どものアプローチをぜひご覧頂き,ご検討を頂きたい.図は私どもが提唱している突然死防止のアルゴリズムである.
Shimohata T et al. Mechanisms and prevention of sudden death in multiple system atrophy. Parkisnonism and Related Disorders (2016)

この研究は,私の盟友である耳鼻咽喉科医がその必要性を訴えて開始したものである.自身が担当したMSA患者さんが突然死されたことから,この研究が必要と考え,睡眠呼吸障害に詳しい呼吸器内科医と,詳しくはない神経内科医(私)に声がかかり始まった.それから15年間で多くのことが分かったが,大きく,以下の4点に要約できる.
1.突然死は,CPAPのみならず気管切開術でも防げず,これらの治療は場合によっては(floppy epiglottisや中枢性睡眠時無呼吸症候群症状を介して)症状の増悪を引き起こしうること.
2.突然死のメカニズムは少なくとも4つあり(中枢性呼吸調節障害,窒息,CPAPによる上気道閉塞,心臓自律神経障害),複数の診療科による集学的アプローチを要すること.
3.突然死の多くは人工呼吸器装着により防止できること.
4.MSAは認知機能障害を合併しうることから,告知や治療の自己決定という倫理的問題に直面すること.
今回,論文の査読者から4の倫理的問題を提起するだけではなく,見解を述べるよう求められた.以下が現時点での私どものスタンスである.
1.突然死リスクの告知は,患者さん・家族に大きな不安をもたらすことを重視し,画一的に伝えるのではなく,危険性が高い症例を中心に,年齢,経過,性格,教育レベルなどを考慮して,症例ごとに検討したうえで行うべきである.危険性については,自律神経障害や睡眠呼吸障害・上気道閉塞が高度な症例ほど高いと言われているが,さらなる危険因子の同定が必要である.
2.気管切開術や人工呼吸器装着といった治療の選択は,認知機能を正しく評価した上で,これまで明らかになっている知見を共有して行うことが望ましい.
MSA診療の難しさは,複数の診療科による集学的アプローチを要することと,臨床倫理的な問題への取り組みを要することである.いずれも難しい問題であるが,本論文の私どものアプローチをぜひご覧頂き,ご検討を頂きたい.図は私どもが提唱している突然死防止のアルゴリズムである.
Shimohata T et al. Mechanisms and prevention of sudden death in multiple system atrophy. Parkisnonism and Related Disorders (2016)