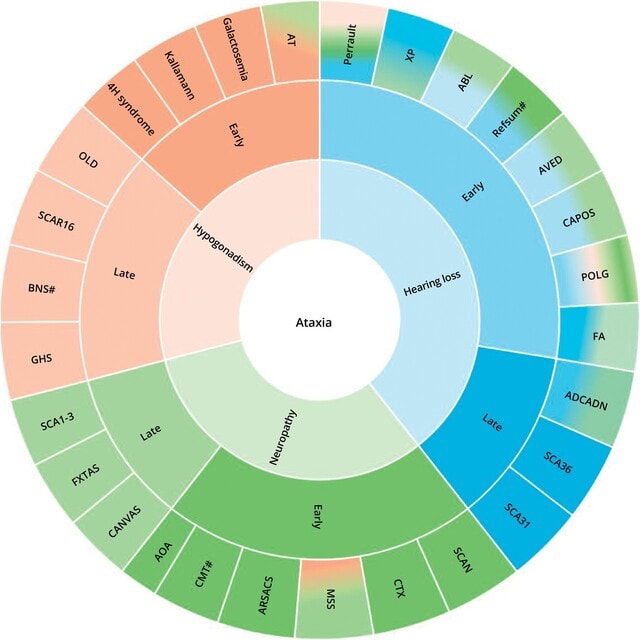
Mov Disord誌の衝撃的な論文です.小脳性運動失調症は稀なものも含めると300種類以上の疾患を鑑別する必要がありますが,アルゼンチンのチームは,AIによる驚きの仮想アシスタントを開発しました.OMIM,Orphanet,GeneReviewsなどの情報源から151の運動失調症を選び,臨床像を抽出し,決定木アルゴリズムを構築して作成しました.性別や発症年齢,臨床所見などの質問を通じて(図1,2),回答として鑑別診断リストを提示します.有効性の検証は,文献から抽出した453の遺伝性・非遺伝性の症例を用いました.その結果,仮想アシスタントの正診率は90.9%,一方,運動異常症専門医21人は平均で18.3%,chat GPT-4は19.4%でした!(図3)GPT-4は架空の疾患名(いわゆるハルチネーション)を7件も回答しました.


なぜ運動異常症専門医の正診率がこんなに低いのか疑問でしたが,453症例には頻度の高い疾患から極めて稀な疾患まで均等に含まれているためでした.例えばSCAではタイプ1から50まですべて3例ずつ,常染色体潜性失調症(SCAR)もみな3例,そのほかAOA1/2/4,NPC,CTX,Sandhoff,Tay-Sachs,Sialidosis,Gordon Holmes,Joubert,Lafora,KSS,HSP7,FXTASのような稀ながら知っている疾患から,pontocerebellar hypoplasia type 11,ceroid lipofuscinosis type 11,C9orf72-ataxiaなどよく知らない疾患まで含まれていました.
「正解がある問題に対してはもはやAIに敵わない」と思いました.教室の若いドクターにも「みんなはこういう時代に診療することになるんだよ」と話しました.じつは最近読んだ,大変勉強になった本「人生の経営戦略――自分の人生を自分で考えて生きるための戦略コンセプト20(山口周著;図4)」に以下の記載がありました.人間が担ってきた認知的労働がAIにより代替されることへの3つの対抗策として,
1)正解のある仕事を避ける
2)感性的・感情的な知性を高める
3)問題を提起する力を高める
が挙げられていました.
1)は正解を出す能力の価値が下がる時代に突入することをまず意識しなさいということだと思います.2)の感性的・感情的な知性を高めるとは,感情を読み取る力や共感力(empathy),心に響く伝え方といったストーリーテリングの力などの人間ならではの知性を磨きなさいということだと思います.幸いAIには他者の気持ちを察したり,場の空気を感じ取ったりすることはまだ困難です.3)は正解を出す能力が過剰に提供されると,ボトルネックとなるのはその前のステップ「課題設定のプロセス」ということです.医師として,研究者として何に取り組むのか,取り組むべき課題はなにかを考える力を磨きなさいということです.そして2)3)の力を高めるためには,医学の知識だけではダメで,教養=リベラルアーツが求められることになると思います.これからの時代の脳神経内科医は,診断はAIに任せるにしても,神経症候をきちんと正しく取ること,感情・感性を磨くこと,さらにQ取り組むべき課題を見極めることが大切なのだと思います.
Alessandro L, et al. Artificial Intelligence-Based Virtual Assistant for the Diagnostic Approach of Chronic Ataxias. Mov Disord. 2025 Mar 22.(doi.org/10.1002/mds.30168)


なぜ運動異常症専門医の正診率がこんなに低いのか疑問でしたが,453症例には頻度の高い疾患から極めて稀な疾患まで均等に含まれているためでした.例えばSCAではタイプ1から50まですべて3例ずつ,常染色体潜性失調症(SCAR)もみな3例,そのほかAOA1/2/4,NPC,CTX,Sandhoff,Tay-Sachs,Sialidosis,Gordon Holmes,Joubert,Lafora,KSS,HSP7,FXTASのような稀ながら知っている疾患から,pontocerebellar hypoplasia type 11,ceroid lipofuscinosis type 11,C9orf72-ataxiaなどよく知らない疾患まで含まれていました.
「正解がある問題に対してはもはやAIに敵わない」と思いました.教室の若いドクターにも「みんなはこういう時代に診療することになるんだよ」と話しました.じつは最近読んだ,大変勉強になった本「人生の経営戦略――自分の人生を自分で考えて生きるための戦略コンセプト20(山口周著;図4)」に以下の記載がありました.人間が担ってきた認知的労働がAIにより代替されることへの3つの対抗策として,
1)正解のある仕事を避ける
2)感性的・感情的な知性を高める
3)問題を提起する力を高める
が挙げられていました.
1)は正解を出す能力の価値が下がる時代に突入することをまず意識しなさいということだと思います.2)の感性的・感情的な知性を高めるとは,感情を読み取る力や共感力(empathy),心に響く伝え方といったストーリーテリングの力などの人間ならではの知性を磨きなさいということだと思います.幸いAIには他者の気持ちを察したり,場の空気を感じ取ったりすることはまだ困難です.3)は正解を出す能力が過剰に提供されると,ボトルネックとなるのはその前のステップ「課題設定のプロセス」ということです.医師として,研究者として何に取り組むのか,取り組むべき課題はなにかを考える力を磨きなさいということです.そして2)3)の力を高めるためには,医学の知識だけではダメで,教養=リベラルアーツが求められることになると思います.これからの時代の脳神経内科医は,診断はAIに任せるにしても,神経症候をきちんと正しく取ること,感情・感性を磨くこと,さらにQ取り組むべき課題を見極めることが大切なのだと思います.
Alessandro L, et al. Artificial Intelligence-Based Virtual Assistant for the Diagnostic Approach of Chronic Ataxias. Mov Disord. 2025 Mar 22.(doi.org/10.1002/mds.30168)