今回のキーワードは,Long COVID発症の4大メカニズム,COVID罹患後に再活性化するウイルスの種類によりlong COVIDへの影響や症状が異なる,ヒト剖検脳の検討でSARS-CoV-2ウイルスは延髄と中脳の一部に感染・炎症をきたす.COVID-19は特定の脳機能領域に萎縮を引き起こす,SARS-CoV-2ウイルスは脳血管の周皮細胞に感染し虚血性障害を招く,COVID-19を認める虚血性脳卒中では血行再建治療後の頭蓋内出血の合併率が高く臨床転帰が悪い,です.
Long COVIDとCOVID-19による脳神経障害のメカニズムがどんどん解明されつつあります.驚いたのは,Long COVIDの中核症状のひとつの疲労が,もともと感染していたEBウイルス再活性化と密接な関連があったこと,SARS-CoV-2ウイルスは脳内でも特定の部位(眼窩前頭皮質,延髄,中脳黒質!など)を侵すことが分かってきたこと,そして頭蓋内ではACE-2を発現する周皮細胞が標的となり虚血性障害が生じることです.EBウイルス持続感染と多発性硬化症の関連が話題になっていますが,神経疾患の発症リスク因子としてのCOVID-19持続感染はおそらく今後の重要なテーマになっていくのではないかと思います.
◆Long COVID発症の4大メカニズム.
Long COVIDの原因はウイルスの持続感染,感染によって引き起こされた自己免疫,EBウイルスなどの潜在ウイルスの再活性化,炎症によって引き起こされた組織の機能障害が有力である(図1).ある臓器における局所的な炎症反応は,離れた組織や臓器に持続的な変化を引き起こす可能性が指摘されている.例えばマウスモデルでは感染ウイルスが1週間以内に検出されなくなる呼吸器感染であっても,感染後7週間までミクログリアの活性化やオリゴデンドロサイトの損失,髄鞘の減少など中枢神経における長期の変化を引き起こす.これら以外にも,微小血栓の形成,血小板活性化,コルチゾール減少,ミトコンドリア機能障害などが報告されている.
Lancet Infect Dis. Feb 14, 2023.(doi.org/10.1016/S1473-3099(23)00053-1)

◆COVID罹患後に再活性化するウイルスの種類によりlong COVIDへの影響や症状が異なる.
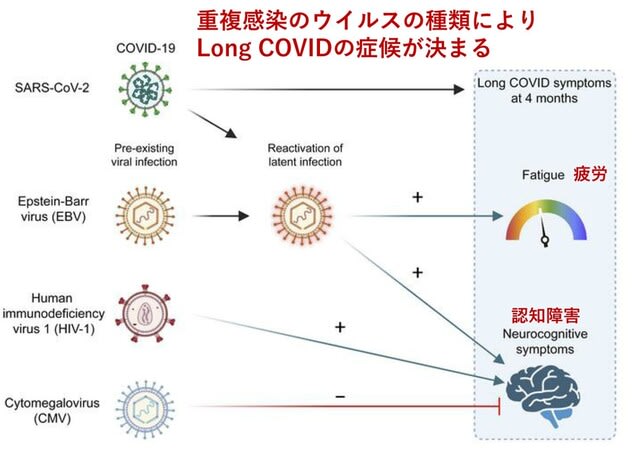
COVID-19感染歴のある成人280人において,EBウイルス(EBV)とCMウイルス(CMV)の再活性化が及ぼす影響について検討した研究が米国から報告された.最初の診断から4カ月後の疲労や認知機能障害などのlong COVID症状は,最近のEBV再活性化(早期抗原拡散IgG陽性)や高いEBNA IgGレベルと独立して関連していた(図2).また最近のEBV再活性化(早期抗原拡散IgG陽性)は,疲労と最も強く関連していた(OR 2.12).HIV感染も認知機能障害と独立して関連していた(2.5).逆に血清学的にCMV感染の既往を認める場合,認知機能障害を呈する可能性は低下した(0.52).以上より,慢性ウイルス重複感染は,その種類によってlong COVIDに及ぼす影響が異なることが示された.
J Clin Invest. 2023 Feb 1;133(3):e163669.(doi.org/10.1172/JCI163669)
◆ヒト剖検脳の検討でSARS-CoV-2ウイルスは延髄と中脳の一部に感染・炎症をきたす.
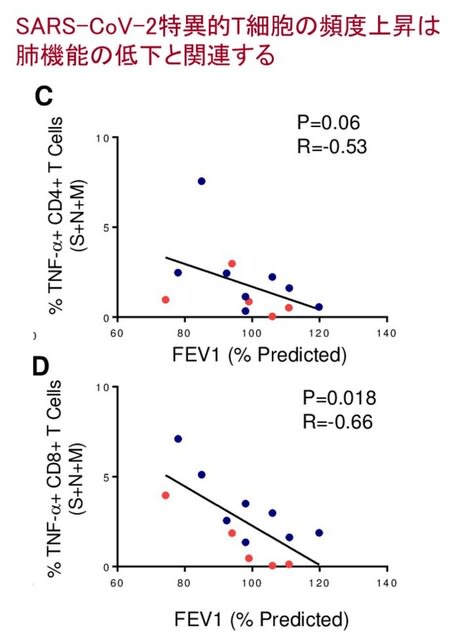
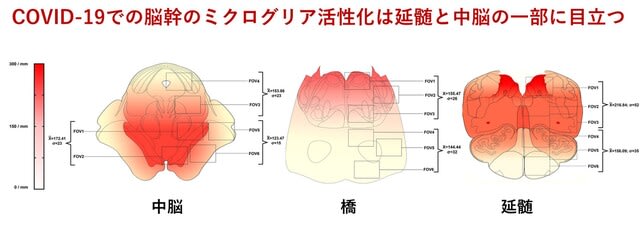
肺炎や呼吸不全で死亡したCOVID-19患者24人と対照18人の神経病理学的変化について検討した研究がイタリアから報告された.広範な神経病理学的変化のほかに,SARS-CoV-2ウイルス免疫反応性ニューロンを延髄背側と黒質に認める5人の患者が存在した.ウイルスRNAもリアルタイムRT-PCRで検出された.つまり頻度は高くないものの,SARS-CoV-2ウイルスが中枢神経系の特定の部位,特に延髄の迷走神経核および中脳の黒質に感染する可能性が示唆された.また活性化ミクログリアの定量化を行いheatmap化すると,脳幹内でも延髄と中脳の一部分でミクログリアの密度が増加していた(図3).以上の結果は,SARS-CoV-2ウイルスの神経への侵襲性を支持するとともに,脳幹の炎症の意義が注目される.とくに黒質における感染所見を重視すると,COVID-19に伴う神経炎症がパーキンソン病を誘発または悪化させる可能性を真剣に検討すべきである.
npj Parkinsons Dis. 9, 25 (2023).(doi.org/10.1038/s41531-023-00467-3)
◆COVID-19は特定の脳機能領域に萎縮を引き起こす.
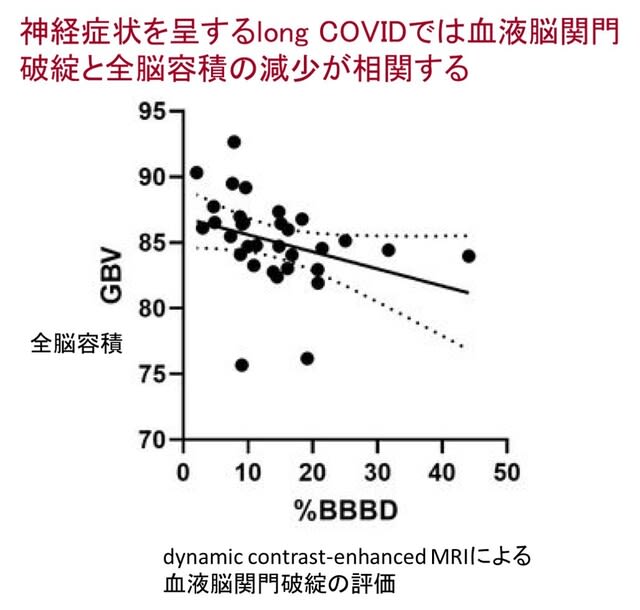
COVID-19が脳に影響を及ぼす部位を,メンデルランダム化解析を用いて検討した研究が中国から報告された.COVID-19の表現型に関するGWASデータ(COVID-19 2万8900人,対照325万1161人)をexposureとし,脳構造に関するGWASデータ(皮質の厚さと表面積5万1665人,皮質下構造体積3万717人)をoutcomeとした.この結果,表現型は尾側中前頭回における皮質厚の減少と関連していた(β = -0.004, p = 0.041)(図4).入院中の表現型は,外側眼窩前頭回(β = -0.005, p = 0.033)および吻側中前頭回(β = -0.002, p = 0.003)の皮質厚の減少と,中側頭回(β = -10.886, p = 0.027)の皮層表面積減少と関連した.これらの因果関係は重症例でも確認された.さらに重症例は楔部の皮質厚の減少(β = -0.002, p = 0.017),pericalcarineの皮質表面積の減少(β = -2.663, p = 0.049), 上頭頂回(β = -5.631, p = 0.041), 海馬傍回(β = -0.147, p = 0.03), および海馬の体積減少(β = -15.913, p = 0.002) であった. COVID-19では特定の脳機能領域に萎縮を引き起こす可能性が示唆された.
Lancet preprint(dx.doi.org/10.2139/ssrn.4356797)

◆SARS-CoV-2ウイルスは脳血管の周皮細胞に感染し虚血性障害を招く.
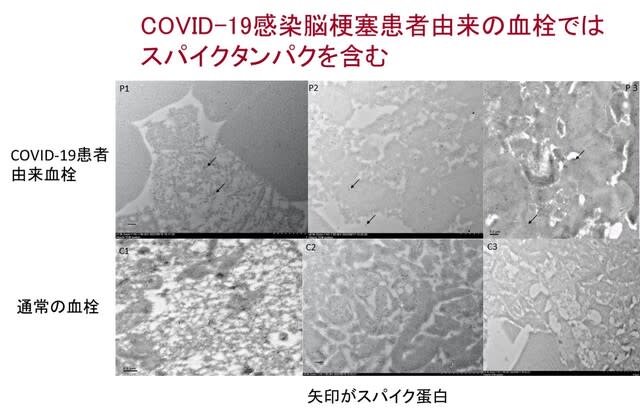
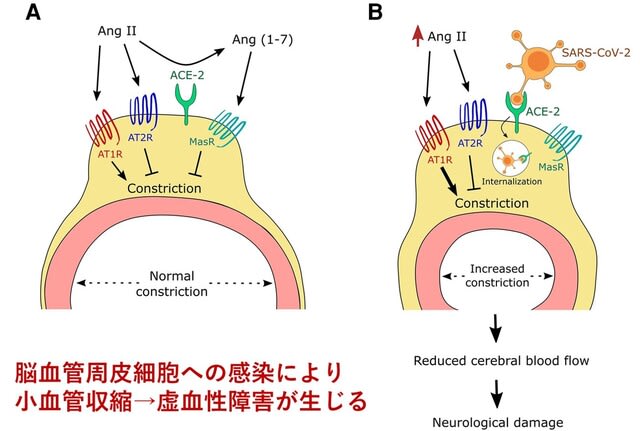
SARS-CoV-2ウイルスの脳血管への影響について分かりやすい図があったので紹介したい.ウイルス受容体ACE-2は,大脳皮質の神経細胞にはほとんど存在せず,小血管径を調節する周皮細胞(ペリサイト)に多く発現している.Ang-IIはAT1Rを介して強力に血管を収縮させるペプチドであるが,同時にAT2RのシグナルとAng-IIからACE-2を介したAng-(1-7)への変換によるMasRシグナルにより制御されている(図5).しかしSARS-CoV-2ウイルスが周皮細胞に感染するとACE-2が内在化し,細胞膜での発現が減少し,小血管の収縮が生じてしまう,このため脳は虚血性障害にさらされる.この変化はAT1R拮抗薬のロサルタンでブロックされる.ただしこれは急性期の研究であり,ウイルスへの曝露が脳血管系に及ぼす長期的な影響.つまり認知症等の一因となる可能性についてはまだ不明である.
Brain. 2023 Feb 13;146(2):418-420.(doi.org/10.1093/brain/awac481)
◆COVID-19を認める虚血性脳卒中では血行再建治療後の頭蓋内出血の合併率が高く臨床転帰が悪い.
COVID-19合併急性虚血性脳卒中(AIS)における血行再建治療の安全性と転帰を評価した後方視的国際研究Global COVID-19 Stroke Registryが報告された.計1万5128人の対象患者のうち,853人(5.6%)がCOVID-19であった.5848人(38.7%)が静脈内血栓溶解療法(IVT)のみ,9280人(61.3%)が血管内治療(EVT)(IVTの有無を問わない)を受けていた.COVID-19患者で治療後,症候性脳出血(SICH)(調整後OR 1.53),症候性くも膜下出血(SSAH)(1.80),SICHとSSAH併発(1.56),24時間死亡率(2.47),3ヶ月死亡率(1.88)であった(図6).3ヵ月後のmodified Rankinスコアも不良であった(1.42).以上よりCOVID-19患者では,血行再建治療後の頭蓋内出血の合併率が高く,転帰も不良である.
Neurology. 2023 Feb 14;100(7):e739-e750.(doi.org/10.1212/WNL.0000000000201537)

Long COVIDとCOVID-19による脳神経障害のメカニズムがどんどん解明されつつあります.驚いたのは,Long COVIDの中核症状のひとつの疲労が,もともと感染していたEBウイルス再活性化と密接な関連があったこと,SARS-CoV-2ウイルスは脳内でも特定の部位(眼窩前頭皮質,延髄,中脳黒質!など)を侵すことが分かってきたこと,そして頭蓋内ではACE-2を発現する周皮細胞が標的となり虚血性障害が生じることです.EBウイルス持続感染と多発性硬化症の関連が話題になっていますが,神経疾患の発症リスク因子としてのCOVID-19持続感染はおそらく今後の重要なテーマになっていくのではないかと思います.
◆Long COVID発症の4大メカニズム.
Long COVIDの原因はウイルスの持続感染,感染によって引き起こされた自己免疫,EBウイルスなどの潜在ウイルスの再活性化,炎症によって引き起こされた組織の機能障害が有力である(図1).ある臓器における局所的な炎症反応は,離れた組織や臓器に持続的な変化を引き起こす可能性が指摘されている.例えばマウスモデルでは感染ウイルスが1週間以内に検出されなくなる呼吸器感染であっても,感染後7週間までミクログリアの活性化やオリゴデンドロサイトの損失,髄鞘の減少など中枢神経における長期の変化を引き起こす.これら以外にも,微小血栓の形成,血小板活性化,コルチゾール減少,ミトコンドリア機能障害などが報告されている.
Lancet Infect Dis. Feb 14, 2023.(doi.org/10.1016/S1473-3099(23)00053-1)

◆COVID罹患後に再活性化するウイルスの種類によりlong COVIDへの影響や症状が異なる.
COVID-19感染歴のある成人280人において,EBウイルス(EBV)とCMウイルス(CMV)の再活性化が及ぼす影響について検討した研究が米国から報告された.最初の診断から4カ月後の疲労や認知機能障害などのlong COVID症状は,最近のEBV再活性化(早期抗原拡散IgG陽性)や高いEBNA IgGレベルと独立して関連していた(図2).また最近のEBV再活性化(早期抗原拡散IgG陽性)は,疲労と最も強く関連していた(OR 2.12).HIV感染も認知機能障害と独立して関連していた(2.5).逆に血清学的にCMV感染の既往を認める場合,認知機能障害を呈する可能性は低下した(0.52).以上より,慢性ウイルス重複感染は,その種類によってlong COVIDに及ぼす影響が異なることが示された.
J Clin Invest. 2023 Feb 1;133(3):e163669.(doi.org/10.1172/JCI163669)

◆ヒト剖検脳の検討でSARS-CoV-2ウイルスは延髄と中脳の一部に感染・炎症をきたす.
肺炎や呼吸不全で死亡したCOVID-19患者24人と対照18人の神経病理学的変化について検討した研究がイタリアから報告された.広範な神経病理学的変化のほかに,SARS-CoV-2ウイルス免疫反応性ニューロンを延髄背側と黒質に認める5人の患者が存在した.ウイルスRNAもリアルタイムRT-PCRで検出された.つまり頻度は高くないものの,SARS-CoV-2ウイルスが中枢神経系の特定の部位,特に延髄の迷走神経核および中脳の黒質に感染する可能性が示唆された.また活性化ミクログリアの定量化を行いheatmap化すると,脳幹内でも延髄と中脳の一部分でミクログリアの密度が増加していた(図3).以上の結果は,SARS-CoV-2ウイルスの神経への侵襲性を支持するとともに,脳幹の炎症の意義が注目される.とくに黒質における感染所見を重視すると,COVID-19に伴う神経炎症がパーキンソン病を誘発または悪化させる可能性を真剣に検討すべきである.
npj Parkinsons Dis. 9, 25 (2023).(doi.org/10.1038/s41531-023-00467-3)

◆COVID-19は特定の脳機能領域に萎縮を引き起こす.
COVID-19が脳に影響を及ぼす部位を,メンデルランダム化解析を用いて検討した研究が中国から報告された.COVID-19の表現型に関するGWASデータ(COVID-19 2万8900人,対照325万1161人)をexposureとし,脳構造に関するGWASデータ(皮質の厚さと表面積5万1665人,皮質下構造体積3万717人)をoutcomeとした.この結果,表現型は尾側中前頭回における皮質厚の減少と関連していた(β = -0.004, p = 0.041)(図4).入院中の表現型は,外側眼窩前頭回(β = -0.005, p = 0.033)および吻側中前頭回(β = -0.002, p = 0.003)の皮質厚の減少と,中側頭回(β = -10.886, p = 0.027)の皮層表面積減少と関連した.これらの因果関係は重症例でも確認された.さらに重症例は楔部の皮質厚の減少(β = -0.002, p = 0.017),pericalcarineの皮質表面積の減少(β = -2.663, p = 0.049), 上頭頂回(β = -5.631, p = 0.041), 海馬傍回(β = -0.147, p = 0.03), および海馬の体積減少(β = -15.913, p = 0.002) であった. COVID-19では特定の脳機能領域に萎縮を引き起こす可能性が示唆された.
Lancet preprint(dx.doi.org/10.2139/ssrn.4356797)

◆SARS-CoV-2ウイルスは脳血管の周皮細胞に感染し虚血性障害を招く.
SARS-CoV-2ウイルスの脳血管への影響について分かりやすい図があったので紹介したい.ウイルス受容体ACE-2は,大脳皮質の神経細胞にはほとんど存在せず,小血管径を調節する周皮細胞(ペリサイト)に多く発現している.Ang-IIはAT1Rを介して強力に血管を収縮させるペプチドであるが,同時にAT2RのシグナルとAng-IIからACE-2を介したAng-(1-7)への変換によるMasRシグナルにより制御されている(図5).しかしSARS-CoV-2ウイルスが周皮細胞に感染するとACE-2が内在化し,細胞膜での発現が減少し,小血管の収縮が生じてしまう,このため脳は虚血性障害にさらされる.この変化はAT1R拮抗薬のロサルタンでブロックされる.ただしこれは急性期の研究であり,ウイルスへの曝露が脳血管系に及ぼす長期的な影響.つまり認知症等の一因となる可能性についてはまだ不明である.
Brain. 2023 Feb 13;146(2):418-420.(doi.org/10.1093/brain/awac481)

◆COVID-19を認める虚血性脳卒中では血行再建治療後の頭蓋内出血の合併率が高く臨床転帰が悪い.
COVID-19合併急性虚血性脳卒中(AIS)における血行再建治療の安全性と転帰を評価した後方視的国際研究Global COVID-19 Stroke Registryが報告された.計1万5128人の対象患者のうち,853人(5.6%)がCOVID-19であった.5848人(38.7%)が静脈内血栓溶解療法(IVT)のみ,9280人(61.3%)が血管内治療(EVT)(IVTの有無を問わない)を受けていた.COVID-19患者で治療後,症候性脳出血(SICH)(調整後OR 1.53),症候性くも膜下出血(SSAH)(1.80),SICHとSSAH併発(1.56),24時間死亡率(2.47),3ヶ月死亡率(1.88)であった(図6).3ヵ月後のmodified Rankinスコアも不良であった(1.42).以上よりCOVID-19患者では,血行再建治療後の頭蓋内出血の合併率が高く,転帰も不良である.
Neurology. 2023 Feb 14;100(7):e739-e750.(doi.org/10.1212/WNL.0000000000201537)