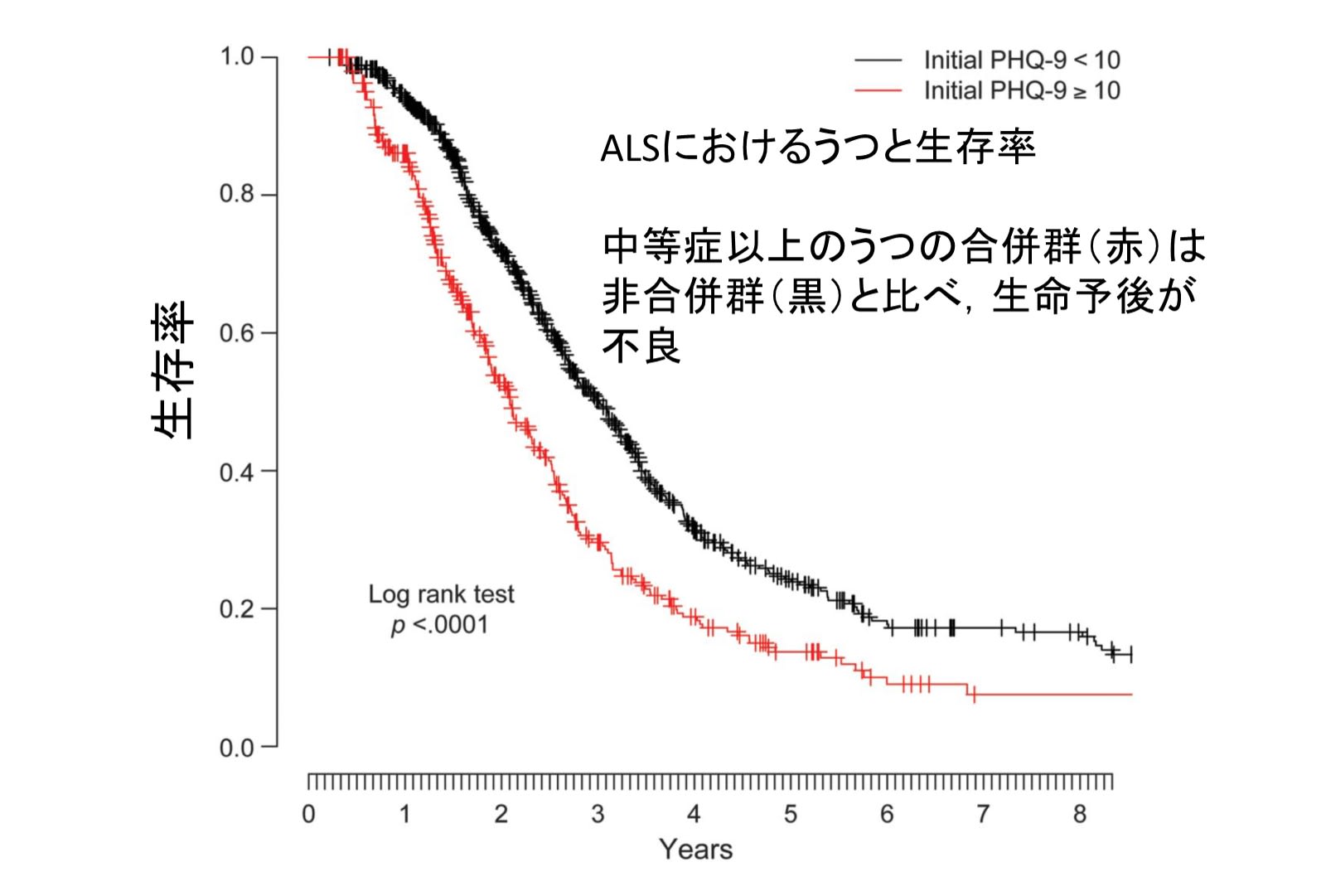
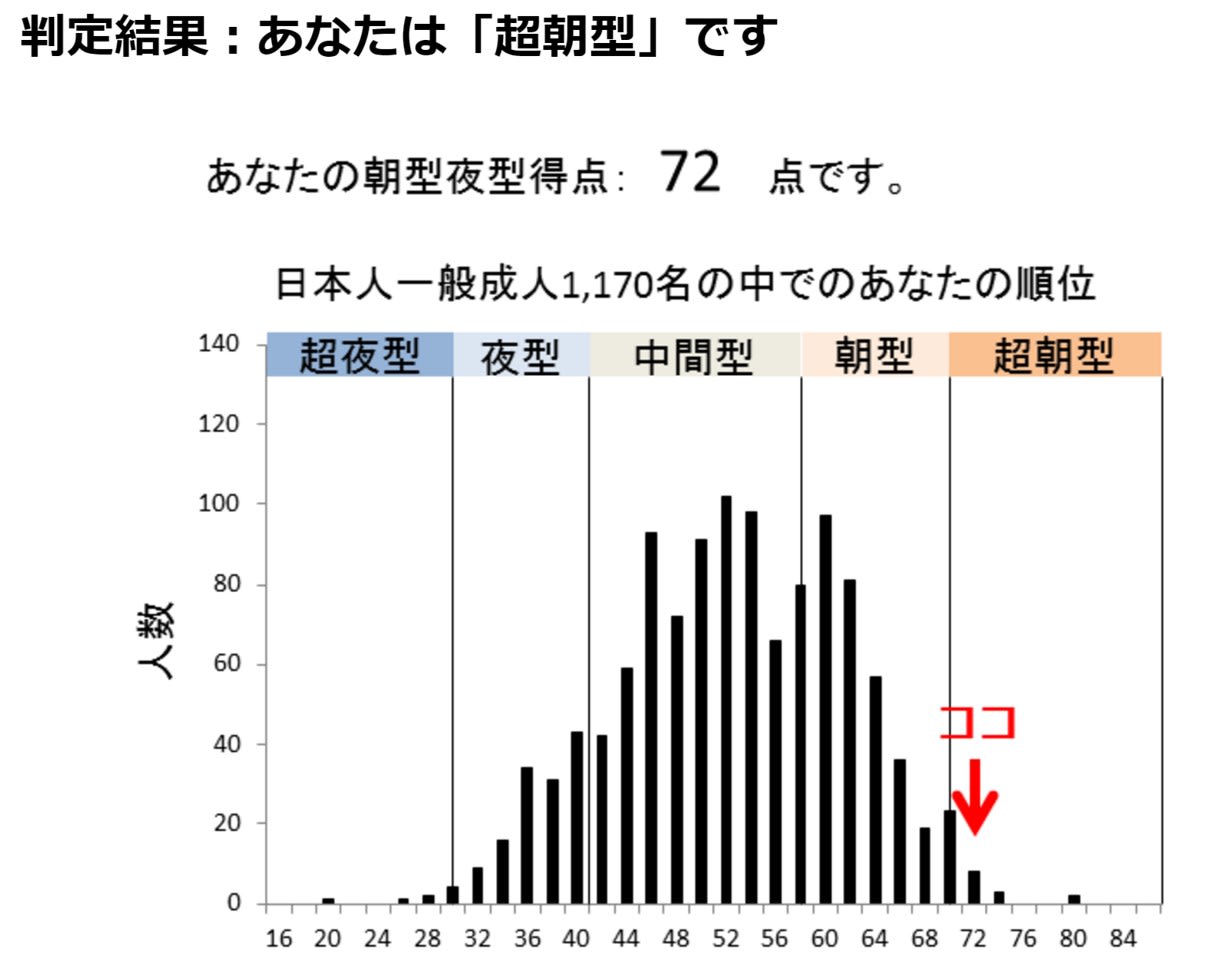
私は朝3時には起きてしまう.夜10時頃にはとても眠く,布団に入ったと同時に眠りに落ち,目覚ましをかけることはほとんどなく,目覚めは爽快である.図は「朝型夜型質問紙」の結果だが,やはり「超朝型人間」の判定である.自分はなぜこんなに早起きなのだろう,ずっと疑問だった(笑).
ビジネス書等で,朝型になる方法とかメリットがよく取り上げられているが,自分の場合,努力したことはない.学生のころはこれほど朝型ではなかったが,医師になってからこの傾向が顕著になった.逆に夜型の人もたくさんいるが,このような朝型・夜型は,睡眠の「概日リズム(約24時間周期で起こるリズム)」の位相がずれた結果,生じると考えられてきた.このリズムは視床下部にある体内時計「視交叉上核」にて形成されている.
この概日リズムは複数の遺伝子(時計遺伝子)により制御されている.最初に線虫で同定されたper,マウスで同定されたCLOCK,ヒトでは家族性睡眠相前進症候群において同定されたPER2などが有名である.また概日リズムは,網膜からの光刺激によっても調節を受けている.ただ,上記のような時計遺伝子群が,朝型・夜型人間の形成に影響しているかについては分かっていなかった.
今回,自分の長年の疑問に答える研究がNature Communicationsに掲載された.米カリフォルニアのDNA解析サービス会社「23andMe」が,8万9283人を対象とした調査を行い,各人に朝型,普通型,夜型人間と申告させた後,全ゲノム関連解析(GWAS)を行い,さらに睡眠や健康の状況などを調査した.結果として,まず朝型は女性に多く,高齢化するほど頻度が高くなることがわかった.GWASの結果,朝型人間に関連する15個の遺伝子座が同定され,そのうち7つは概日リズムとの関連が確立されている遺伝子の近傍にあった(RGS16,VIP,PER2,HCRTR2,RASD1,PER3,FBXL3).例えばRGS16は長い概日リズムに関与,VIPは視交叉上核の重要な神経ペプチドである血管作動性腸管ペプチドをコードし,HCRTR2はナルコレプシーの原因となるヒポクレチン受容体2をコードしている.そしてRASD1やPER3,FBXL3は光感知を制御する遺伝子群である.つまり朝型は概日リズムや光感知を調節する遺伝子により規定されている可能性があるのだ!
さらに朝型人間の特徴が示されている.年齢や性別に関わらず,夜型人間と比較して,(1)不眠症に悩まされたり,8時間以上の睡眠を必要とするケースが少ない(オッズ比それぞれ0.66,0.67).(2)またうつの合併も少なく(オッズ比0.64),(3)BMI(肥満指数)では過度のやせや肥満が少なかった.つまり朝型人間は不眠症やうつ,肥満になりにくく,毎晩8時間以上の睡眠を必要とすることもない(たしかに自分も不眠の心配はなく,8時間眠るなどありえないshort sleeperで,かつノーテンキである).逆に夜型はこれらになりやすい可能性がある.
つまり朝型・普通型・夜型を規定する体内時計は,生まれ持った遺伝子に規定されているもので,トリクルダウン効果(他の現象にも波及するという意味)により,体重や気質などの他の生物学的・心理的プロセスにも影響が生じている可能性がある.ただし,メンデルの無作為化解析では,遺伝子と表現型の因果関係は得られず,著者らはこうした結果は必ずしも因果関係を意味するものではないと述べている.なお,23andMeは体内時計に作用する薬剤を開発しているReset Pharmaceuticalsという会社と契約を結んだそうで,おそらく今回の遺伝子解析データをもとに治療薬開発が行われるのだろう.
それにしても今回のような結果を読むと,ビジネス書で勧められるような朝型への生活スタイルの変更は,そもそも夜型の遺伝子を持っているひとには難しいのかもしれない.
Hu Y et al. GWAS of 89,283 individuals identifies genetic variants associated with self-reporting of being a morning person. Nat Commun. 2016 Feb 2;7:10448.
日本語版朝型-夜型(Morningness-Eveningness)質問紙による調査結果. 心理学研究. 1986; 57: 87-91.
ビジネス書等で,朝型になる方法とかメリットがよく取り上げられているが,自分の場合,努力したことはない.学生のころはこれほど朝型ではなかったが,医師になってからこの傾向が顕著になった.逆に夜型の人もたくさんいるが,このような朝型・夜型は,睡眠の「概日リズム(約24時間周期で起こるリズム)」の位相がずれた結果,生じると考えられてきた.このリズムは視床下部にある体内時計「視交叉上核」にて形成されている.
この概日リズムは複数の遺伝子(時計遺伝子)により制御されている.最初に線虫で同定されたper,マウスで同定されたCLOCK,ヒトでは家族性睡眠相前進症候群において同定されたPER2などが有名である.また概日リズムは,網膜からの光刺激によっても調節を受けている.ただ,上記のような時計遺伝子群が,朝型・夜型人間の形成に影響しているかについては分かっていなかった.
今回,自分の長年の疑問に答える研究がNature Communicationsに掲載された.米カリフォルニアのDNA解析サービス会社「23andMe」が,8万9283人を対象とした調査を行い,各人に朝型,普通型,夜型人間と申告させた後,全ゲノム関連解析(GWAS)を行い,さらに睡眠や健康の状況などを調査した.結果として,まず朝型は女性に多く,高齢化するほど頻度が高くなることがわかった.GWASの結果,朝型人間に関連する15個の遺伝子座が同定され,そのうち7つは概日リズムとの関連が確立されている遺伝子の近傍にあった(RGS16,VIP,PER2,HCRTR2,RASD1,PER3,FBXL3).例えばRGS16は長い概日リズムに関与,VIPは視交叉上核の重要な神経ペプチドである血管作動性腸管ペプチドをコードし,HCRTR2はナルコレプシーの原因となるヒポクレチン受容体2をコードしている.そしてRASD1やPER3,FBXL3は光感知を制御する遺伝子群である.つまり朝型は概日リズムや光感知を調節する遺伝子により規定されている可能性があるのだ!
さらに朝型人間の特徴が示されている.年齢や性別に関わらず,夜型人間と比較して,(1)不眠症に悩まされたり,8時間以上の睡眠を必要とするケースが少ない(オッズ比それぞれ0.66,0.67).(2)またうつの合併も少なく(オッズ比0.64),(3)BMI(肥満指数)では過度のやせや肥満が少なかった.つまり朝型人間は不眠症やうつ,肥満になりにくく,毎晩8時間以上の睡眠を必要とすることもない(たしかに自分も不眠の心配はなく,8時間眠るなどありえないshort sleeperで,かつノーテンキである).逆に夜型はこれらになりやすい可能性がある.
つまり朝型・普通型・夜型を規定する体内時計は,生まれ持った遺伝子に規定されているもので,トリクルダウン効果(他の現象にも波及するという意味)により,体重や気質などの他の生物学的・心理的プロセスにも影響が生じている可能性がある.ただし,メンデルの無作為化解析では,遺伝子と表現型の因果関係は得られず,著者らはこうした結果は必ずしも因果関係を意味するものではないと述べている.なお,23andMeは体内時計に作用する薬剤を開発しているReset Pharmaceuticalsという会社と契約を結んだそうで,おそらく今回の遺伝子解析データをもとに治療薬開発が行われるのだろう.
それにしても今回のような結果を読むと,ビジネス書で勧められるような朝型への生活スタイルの変更は,そもそも夜型の遺伝子を持っているひとには難しいのかもしれない.
Hu Y et al. GWAS of 89,283 individuals identifies genetic variants associated with self-reporting of being a morning person. Nat Commun. 2016 Feb 2;7:10448.
日本語版朝型-夜型(Morningness-Eveningness)質問紙による調査結果. 心理学研究. 1986; 57: 87-91.