標題のテーマはしばしば議論されてきたことであるが,その決定版とも言える論文がドイツからAnnals of Neurology誌に報告された.著者らは,急性期脳梗塞に対する第3相臨床試験を対象として,その前段階に遡って,それぞれの薬剤の早期臨床試験(おもに第2相)と動物実験の3者において,
研究デザインや出版バイアス, 検出力(power), true report probability(TRP)等について統計学的に比較している.その結果,単に動物実験と臨床試験は異なるというだけでなく,
3つの試験それぞれに違いがあることを明確にした.極めてインパクトのある論文だ.
1)対象となった研究
著者らはNXY-059やONO-2506,エダラボン,アルブミン,尿酸などを用いた第3相臨床試験の50試験を対象とし,その前段階で行われた75の早期臨床試験と,209の動物実験を比較した.
2)評価法は3群で大きく異なる
動物実験での主要評価項目は梗塞サイズが100%であるのに対し,早期臨床試験,第3相試験ではともに10%台と稀で,その代わり両者ではほぼ100%
機能障害を確認していた(動物実験では60%未満であった).また評価した個体数(動物数,症例数)は創薬のステージが進むほど,顕著に増加した(P<0.001).
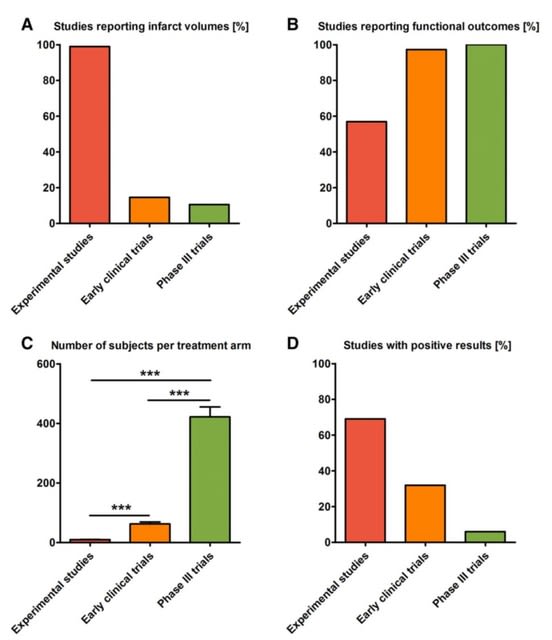
3)治療の成功率は創薬ステージが進むほど低下する
研究が成功した頻度は,動物実験で69%,早期臨床試験で32%,そして第3相試験で6%と,ステージが進むほど低下した.平均治療効果(mean treatment effect)は治療群と対照群の結果の比を示すが,動物実験では0.76 (95%信頼区間0.70~0.83),早期臨床試験では0.87 (0.71~1.06),第3相試験では1.00 (0.95~1.06)とステージが進むにつれて低下した.
4)動物実験と早期臨床試験では出版バイアスが見られる
薬剤の効果が有望である場合,有意差がなくとも論文報告される傾向があるが,逆の結果である場合は,特にサンプルサイズが小さいと,本当にnegative studyなのか分からないこともあり,公表されないことが多い.よって出版された研究結果だけ統合すると,治療が有効と評価されてしまうことが起こり得る.これが「出版バイアス」であり,その有無を評価する方法としてFunnel plotが用いられる.Funnel plotについては
大阪大学腎臓内科のページが詳しいので参照していただきたいが,動物実験のみならず早期臨床試験でにも出版バイアスが見られた.
5)研究デザインが異なる
動物実験では,ランダム化試験や盲検による評価が少なく,さらに高血圧などの共存症を合併する個体を用いた評価が極端に少なかった.

治療介入のタイミングも,動物実験では虚血後3時間以内という急性期が圧倒的に多いが,臨床試験では12時間以降が多かった.

6)動物実験の検出力とtrue report probability(TRP )は低い
検出力(power)は「統計的仮説検定において,帰無仮説が偽であるときに誤らずに帰無仮説を棄却する確率のこと」だが,動物実験での平均検出力はわずか17%しかなかった.またTRP,つまり「統計的に有意な場合に(帰無仮説が棄却される場合に)対立仮説が真である確率=
治療薬が本当に有効である確率」は動物実験ではわずか50%未満であった.
7)なぜ,動物実験で有効な薬剤がヒトの臨床試験で無効なのか?
研究デザインの違い(治療のタイミング,主要評価項目,評価法),出版バイアス,低い検出力が原因と考えられた.主要評価項目の違いは,動物実験では中大脳動脈を閉塞させ,虚血後早期に治療介入を行い,評価も急性期に梗塞体積で行うのに対し,ヒトの臨床試験では様々な脳梗塞のタイプを含み,虚血後遅れて治療介入を行い,評価を慢性期に機能障害で行っている.そして重要なことは,単に動物実験と臨床試験の間に大きな壁(roadblock)があるのではなく,動物実験と早期臨床試験,第3相試験のそれぞれの間にも壁があるということだ.
8)理想的な動物実験はどうあるべきか?
動物実験の個体数を大幅に増加させること,ランダム化,盲検化を徹底し,共存症を持った動物を使用すること,治療介入タイミングを臨床試験に合わせて遅くすること,梗塞サイズではなく,機能障害で評価すること,出版バイアスを減らすため,無効であった論文も投稿することである.この条件で有効な薬剤を見出すことは容易なことではないだろう.しかしそのような薬剤でしか,臨床試験での高い成功率は見込めないということだ.
上記で難しいのは個体数の増加である.単一の研究室では限界があり,少数例で有効であった薬剤に対してはプロトコールを統一し,
多施設共同研究による動物実験を行うことが今後,求められるだろう.その上で動物愛護にも配慮が必要で,必要最低限に抑える必要がある.出版社もnegative studyの論文をさらに積極的に採用することが求められる.
最後に今回の結果は脳梗塞研究に限定されるものではない.他の神経疾患の創薬においても極めて有益な教訓となることは間違いがない.いかに動物実験をヒトの臨床に近づけられるかを念頭に置く必要がある.
Schmidt-Pogoda A et al. Ann Neurol 2020;87,40-51.

















