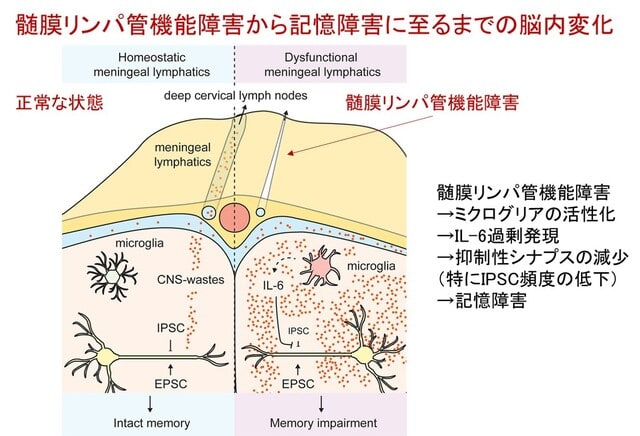
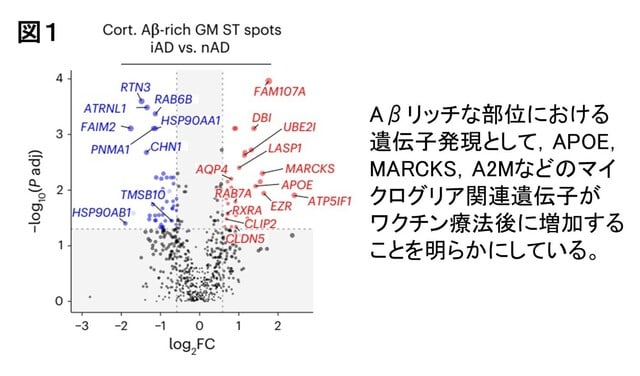
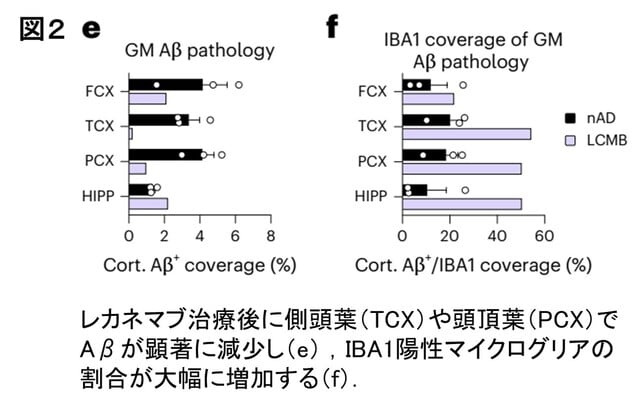
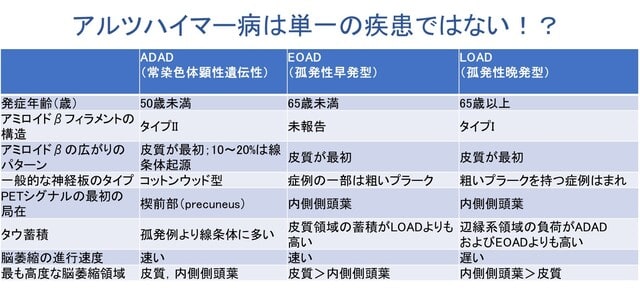
アルツハイマー病(AD)は女性に多く,また病態の進行が速い傾向にあることが知られています.日本人においても女性に多く,認知機能低下の進行も女性で速い傾向が報告されています.久山町研究などの疫学データにより,この性差は単に寿命の長さによるものではなく,生物学的な違いが関与している可能性が指摘されています.また,APOE遺伝子ε4保有による発症リスクは女性でより高いことも知られています.最近,報告された欧米の2つの研究は,ADの性差の根底に「神経炎症・自然免疫応答の性差」が関与していることを示しています.
1つ目の研究は米国Stony Brook大学からのもので,死後脳を用いて,部位ごとの神経炎症の性差を検討しました.海馬,嗅内皮質,および頭頂葉皮質における神経炎症マーカーTSPOの結合密度を定量的オートラジオグラフィーで測定し,さらに炎症性miRNA(miR-146a,miR-34a,miR-125b,miR-155-5p)の発現を定量的PCRで評価しています.その結果,AD女性ではCA1や海馬支脚などの海馬領域においてTSPOの結合が顕著に高く(=神経炎症が強く;図1),さらにTSPOとタウ病理との間に有意な正の相関が認められました.加えて,炎症性miRNAの発現もAD女性でのみ増加しており,性特異的な神経炎症のエピジェネティック制御が示唆されました.

2つ目の研究はノルウェーのオスロ大学病院などによる研究で,285名のコホートを対象に,血漿および脳脊髄液中の9種類の自然免疫マーカーを測定し,性差やアミロイド病理との関連を検討しました.この結果,アミロイド陽性者(A+)の中でも特に軽度認知障害(MCI)段階において,女性はサイトカインMCP-1とIL-6の値が男性よりも有意に低く,またsTREM2(ミクログリア活性化の指標)やclusterin(補体抑制や炎症調節に関わるタンパク質)と神経変性マーカー(タウ,NfL)との相関が男性より強いことが明らかになりました(図2).一見すると炎症性サイトカインが低いことは良い徴候で,1つ目の論文と矛盾しているようにも思えますが,そう単純ではありません.MCP-1やIL-6は炎症の惹起だけでなく,アミロイドβの除去や神経保護にも関与します.つまり,これらのサイトカインが低値であることは,加齢性変化に対して必要な免疫応答が発動せず,防御機構がうまく働いていない可能性を意味します.この結果,女性では神経変性の進行が加速されると推測しています.

2つの研究はアプローチこそ異なりますが,いずれも「女性ではADの前段階から免疫応答や炎症反応に変調が生じ,それが病態進行を促進する」ことを示しています.今後,ADの予防や治療,診断バイオマーカーの解釈において,性差を考慮することが必要と考えられました.臨床試験の設計や集団解析においても,性差を考えることが求められると思います.つまり性差に注目することが,ADの病態の理解や個別化医療の実現に必要になるものと考えられます.
1. Acosta‐Martínez, M. et al. Sex- and region-dependent neuroinflammation in Alzheimer’s disease. Alzheimer’s & Dementia, 2025;21:e14603. DOI: https://doi.org/10.1002/alz.14603
2. Knudtzon, L. et al. Sexual dimorphisms in innate immune activation markers in predementia Alzheimer’s disease. Brain Communications, 2025. DOI: https://doi.org/10.1093/braincomms/fcaf161
1つ目の研究は米国Stony Brook大学からのもので,死後脳を用いて,部位ごとの神経炎症の性差を検討しました.海馬,嗅内皮質,および頭頂葉皮質における神経炎症マーカーTSPOの結合密度を定量的オートラジオグラフィーで測定し,さらに炎症性miRNA(miR-146a,miR-34a,miR-125b,miR-155-5p)の発現を定量的PCRで評価しています.その結果,AD女性ではCA1や海馬支脚などの海馬領域においてTSPOの結合が顕著に高く(=神経炎症が強く;図1),さらにTSPOとタウ病理との間に有意な正の相関が認められました.加えて,炎症性miRNAの発現もAD女性でのみ増加しており,性特異的な神経炎症のエピジェネティック制御が示唆されました.

2つ目の研究はノルウェーのオスロ大学病院などによる研究で,285名のコホートを対象に,血漿および脳脊髄液中の9種類の自然免疫マーカーを測定し,性差やアミロイド病理との関連を検討しました.この結果,アミロイド陽性者(A+)の中でも特に軽度認知障害(MCI)段階において,女性はサイトカインMCP-1とIL-6の値が男性よりも有意に低く,またsTREM2(ミクログリア活性化の指標)やclusterin(補体抑制や炎症調節に関わるタンパク質)と神経変性マーカー(タウ,NfL)との相関が男性より強いことが明らかになりました(図2).一見すると炎症性サイトカインが低いことは良い徴候で,1つ目の論文と矛盾しているようにも思えますが,そう単純ではありません.MCP-1やIL-6は炎症の惹起だけでなく,アミロイドβの除去や神経保護にも関与します.つまり,これらのサイトカインが低値であることは,加齢性変化に対して必要な免疫応答が発動せず,防御機構がうまく働いていない可能性を意味します.この結果,女性では神経変性の進行が加速されると推測しています.

2つの研究はアプローチこそ異なりますが,いずれも「女性ではADの前段階から免疫応答や炎症反応に変調が生じ,それが病態進行を促進する」ことを示しています.今後,ADの予防や治療,診断バイオマーカーの解釈において,性差を考慮することが必要と考えられました.臨床試験の設計や集団解析においても,性差を考えることが求められると思います.つまり性差に注目することが,ADの病態の理解や個別化医療の実現に必要になるものと考えられます.
1. Acosta‐Martínez, M. et al. Sex- and region-dependent neuroinflammation in Alzheimer’s disease. Alzheimer’s & Dementia, 2025;21:e14603. DOI: https://doi.org/10.1002/alz.14603
2. Knudtzon, L. et al. Sexual dimorphisms in innate immune activation markers in predementia Alzheimer’s disease. Brain Communications, 2025. DOI: https://doi.org/10.1093/braincomms/fcaf161