今回のキーワードは,N Engl J Med誌の怒り,ウイルスは皮膚上で9時間生存する,肺を満たすゼリーの正体,無症状感染者を生み出すウイルスの巧妙な企み,神経合併症と転帰,オプソクローヌス・ミオクローヌス症候群,筋障害と影響因子,脳におけるウイルスの証明と脳損傷への影響,脳症患者における髄液高力価抗体,レムデシビル試験最終報告です.
◆アメリカにおける失敗とN Engl J Med誌の怒り.
「Dying in a Leadership Vacuum(リーダーシップの真空状態がもたらす死)」というタイトルの論説は,医学雑誌として前例のないものとなった.冒頭に「COVID-19による危機は,各国のリーダーシップを試すものとなったが,ここ米国では,私たちの指導者は対応を失敗し,危機を悲劇に変えてしまった」と書かれてある.実際に米国の死者数は中国をはるかに上回り,カナダの2倍以上,日本の50倍,ベトナムの2000倍近くとなった.「我々はほとんどすべての対応に失敗した」・・・検査数や個人防護具の不足,検疫や隔離の遅さと一貫性のなさ,感染対策の不徹底,駆逐された疾病対策予防センター(CDC)と政治化された食品医薬品局(FDA)などが列挙される.「政権は専門家を無視・軽蔑し,無知なオピニオンリーダーや,嘘を流布する偽医者に頼った.その結果,不適切な政策のために失われたアメリカ人の命は,第二次世界大戦以降のどの紛争よりも多くなった.また医療従事者の献身的な働きが無駄にされている.しかし,今回の選挙で,我々は判決を下すことができる.現在の指導者たちにこのまま仕事を続けさせ,さらなるアメリカ人の死を招いてはならない」と述べている.
N Engl J Med. Oct 8, 2020(doi.org/10.1056/NEJMe2029812)
◆新型コロナウイルスはヒト皮膚上で9時間生存する.
京都府立医大からの報告.SARS-CoV-2ウイルスのヒト皮膚での生存時間を測定したところ,ウイルスは,インフルエンザAウイルスと比較して有意に長く生存した(9.0時間対1.8時間)(図1).また皮膚や粘液中のウイルスは,80%(w/w)エタノール処理により15秒以内に完全に不活化された.以上より,SARS-CoV-2ウイルスはインフルエンザAウイルスと比べ,接触感染のリスクが高いことが分かる.感染予防には適切な手指衛生が重要である.
Clin Infect Dis. October 3, 2020(doi.org/10.1093/cid/ciaa1517)

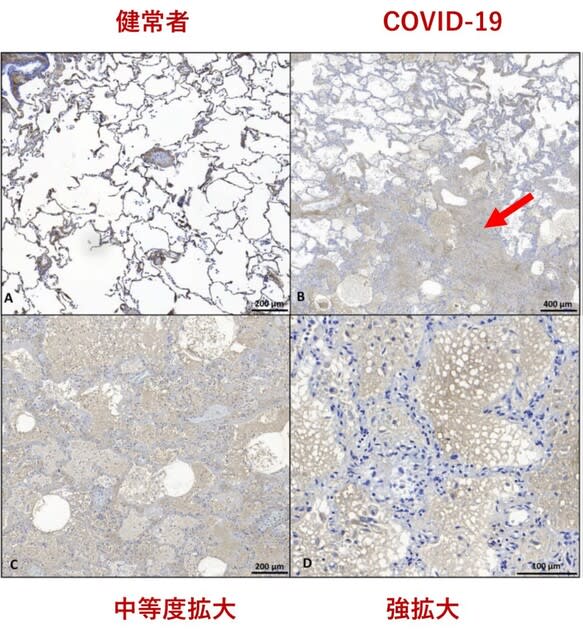
◆肺を満たすゼリー状の液体の正体はヒアルロン酸.
死亡の転帰をたどったCOVID-19症例は,剖検にて肺が透明なゼリー状の液体で満たされていることが知られている.3名の死亡患者から得た肺組織を免疫染色で調べたところ,肺胞腔内の顕著なヒアルロン酸滲出物を確認できた(図2).ヒアルロン酸はムコ多糖で,保水性が高く,水分保持により粘性を持つ性質がある.以上より,呼吸不全の新たな治療標的として,肺におけるヒアルロン酸の産生減少が考えられる.有効性が示されているデキサメタゾンも,ヒアルロン酸を抑制している可能性がある.
J Biol Chem. Sep 25, 2020(doi.org/10.1074/jbc.AC120.015967)
◆ウイルスは痛みを抑制して,無症状感染者を生み出す!?
米国からの報告.ウイルスの侵入経路として,スパイク蛋白質とアンジオテンシン変換酵素 2(ACE2) との結合が有名だが,第2の経路として,ニューロピリン-1 受容体(NRP-1)との結合が指摘されてきた.このNRP-1には,血管内皮増殖因子A(VEGF-A)も結合するため,スパイク蛋白質がVEGF-A/NRP-1シグナル伝達を阻害するかを検討した.結果として,スパイク蛋白質は,VEGF-Aをトリガーとする感覚神経細胞の発火をブロックした.またスパイク蛋白質は,VEGF-Aによる侵害受容(痛覚)促進作用もブロックした.加えて神経障害性疼痛モデルにおいて,アロディニア(通常では疼痛をもたらさない微小刺激が,とても痛く認識される現象)も抑制した.つまりウイルスのスパイク蛋白質はNRP-1に結合し,VEGF-Aによる痛みを消去することで,感染者の咽頭痛などの症状を抑え,さらなる感染伝播をもたらす可能性が示唆される.
Pain. Oct 1, 2020(doi.org/10.1097/j.pain.0000000000002097)
◆COVID-19による死亡リスクはパーキンソン病において有意に高い.
米国から,COVID-19によるパーキンソン病(PD)の症例死亡率が報告された.既報では0~40%の範囲で報告されているが,サンプルサイズが小さく,PDが死亡の独立した危険因子であるかは不明であった.この検討では,COVID-19患者78355名のうち,PDなしの患者は4290名が死亡したのに対し,PDありの患者694名のうち148名が死亡した(PDなし群5.5% vs PDあり群21.3%,p<0.001).年齢,性,人種を共変量としてロジスティック回帰を用いたところ,COVID-19による死亡リスクはPD群で有意に高いことが明らかになった(オッズ比:1.27,p=0.016).
Mov Disord. Sep 21, 2020(doi.org/10.1002/mds.28325)
◆神経合併症と転帰(1)
ニューヨークから,COVID-19患者における神経合併症の有病率と院内死亡率・転帰を前方視的に検討した観察研究が報告された.期間中に入院したCOVID-19患者4,491名のうち,606名(13.5%)が発症から2日以内(中央値)に神経合併症を呈した.多かった順に,中毒性・代謝性脳症(6.8%),けいれん発作(1.6%),脳卒中(1.9%),低酸素/虚血性障害(1.4%)であった.髄膜炎・脳炎,脊髄症・脊髄炎は見られず,検討した18名全例の髄液PCRは陰性であった.神経合併症を呈する患者は,高齢,男性,白人,高血圧,糖尿病,挿管患者が有意に多かった.神経合併症を有する患者は院内死亡のリスクが高く(ハザード比1.38,P<0.001),在宅退院の可能性が低かった(HR 0.72, P<0.001).神経合併症の多くは,重症全身状態に伴う後遺症の可能性が考えられた.
Neurology. Oct 5, 2020(doi.org/10.1212/WNL.0000000000010979)
◆神経合併症と転帰(2)
シカゴから,509名の入院COVID-19患者において,神経合併症の有無による重症度と転帰を比較した研究が報告された.神経合併症は,COVID-189の発症時に215名(42.2%),入院時に319名(62.7%),病期中の任意の時点で419名(82.3%)に認められた.頻度の高かった順に,筋痛(44.8%),頭痛(37.7%),脳症(31.8%),めまい(29.7%),味覚障害(15.9%),無嗅症anosmia(11.4%)であった.脳卒中,運動異常症,運動・感覚障害,運動失調,けいれん発作はまれであった(各0.2~1.4%).人工呼吸を要する重度の呼吸障害は134名(26.3%)に認められた.神経合併症の危険因子は,重症のCOVID-19(OR 4.02;P<0.001)および若年(0.982;P=0.014)であった.つまりより若く,重症患者ほど神経合併症を呈し,またより高齢の患者ほど脳症を呈した.全患者のうち362名(71.1%)は,退院時の転帰が良好であった(modified Rankin scale 0~2).しかし脳症は,呼吸状態の重症度とは無関係に,転帰の悪化(OR 0.22;P < 0.001)および入院後30日以内の死亡率の上昇と関連していた.
Ann Clin Transl Neurol. Oct 5, 2020(doi.org/10.1002/acn3.51210)
◆神経合併症(1)オプソクローヌス・ミオクローヌス症候群.
インドからの症例報告.中年男性が,COVID-19の呼吸器感染の回復から3週間後に,体のふらつきとミオクローヌスを呈した.診察時,オプソクローヌス,皮質性ミオクローヌス,小脳性運動失調を呈していた.他の失調を呈する原因は否定された.ステロイドパルス療法,バルプロ酸,クロナゼパム,レベチラセタムにて1週間後に回復した.
Neurology Oct 1, 2020(doi.org/10.1212/WNL.0000000000010978)
◆神経合併症(2)筋障害の頻度と影響因子.
オーストリアからの報告.COVID-19患者351 名,インフルエンザ患者 258 名における筋合併症の後方視的検討.高CK血症はCOVID-19患者の27%,インフルエンザ患者の28%で認め,同程度の頻度であった.COVID-19において,CKは疾患の重症度,および炎症マーカー(CRP, IL6)と強く相関していた.高CK血症が,ウイルスが引き金となった炎症反応による間接的なものなのか,それとも直接的な筋毒性によるものなのかは不明である.
Eur J Neurol. Sep 30, 2020(doi.org/10.1111/ene.14564)
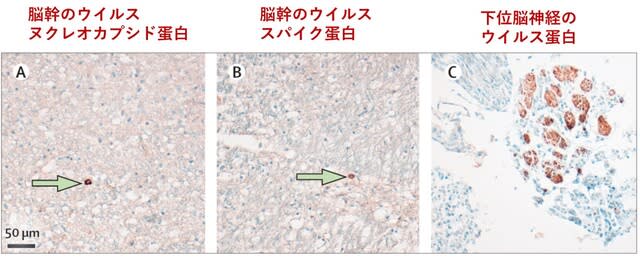
◆神経合併症(3)ウイルスは脳組織に到達するが,直接の損傷は起こさない.
ドイツから,COVID-19で死亡した43名(51~94歳)の患者の脳病理に関する検討が報告された.6 名(14%)で新鮮な虚血病変を認めた.37 名(86%)では,観察したすべての領域にグリオーシスを認めた.ミクログリアの活性化と細胞障害性Tリンパ球の浸潤は,脳幹と小脳で最も顕著であった.髄膜の細胞障害性Tリンパ球の浸潤は34名(79%)で認められた.SARS-CoV-2はPCRにより,40名中21名(53%)の患者脳で検出され,SARS-CoV-2ウイルス蛋白質は脳幹および下部脳幹に由来する脳神経で認められた(図3).中枢神経系におけるSARS-CoV-2の存在は,病理学的変化の重症度とは相関せず,ウイルスに直接起因した損傷とは考えにくく,免疫介在性の機序による損傷の可能性がある.
Lancet Neurol. Oct 5, 2020(doi.org/10.1016/S1474-4422(20)30308-2)
◆神経合併症(4)脳症患者における髄液高力価抗SARS-CoV-2抗体.
ギリシアから脳症を呈した8 名の検討.全患者の髄液に抗SARS-CoV-2抗体が認められ,8名中4名が血清抗体価に匹敵する高力価を示した.1名の患者で,抗SARS-CoV-2 IgGの髄腔内産生が示唆され,他の3名では血液脳関門の障害が認められた.4名の髄液所見で,神経変性マーカーの14-3-3蛋白が高値であった.血液脳関門の破綻は,サイトカインや炎症性メディエーターの中枢神経系への侵入を促進し,神経炎症や神経変性を促進する可能性がある.ちなみにすべての患者の髄液で自己免疫性脳炎に関連する抗体(NMDAr,AMPAr,GABAbr,CASPR2,DPPX,LGI1)は陰性で,PCRによるういSARS-CoV-2も陰性であった.
Neurol Neuroimmunol Neuroinflamm. Sep 25, 2020(doi.org/10.1212/NXI.0000000000000893)
◆レムデシビルは偽薬より回復までの時間を5日間短縮する.
COVID-19で入院し,下気道感染を認めた成人を対象に行われた,抗ウイルス薬レムデシビル静注の二重盲検無作為化プラセボ対照試験の最終結果が報告された.レムデシビルまたは偽薬を10日間投与し,主要アウトカムは回復までの時間であった.541名がレムデシビル群,521名が偽薬群に割り付けられた.リムデシビル群の回復期間(中央値)は10日,偽薬群では15日であった(回復率比1.29;P<0.001)(図4).死亡率は,15日目までにレムデシビル群で6.7%,偽薬群で11.9%,29日目までにレムデシビル投与群で11.4%,偽薬群で15.2%,統計学的な有意差なし(ハザード比0.73;95%CI,0.52~1.03).重篤な有害事象に有意差はなかった.
New Engl J Med. Oct 8, 2020(doi.org/10.1056/NEJMoa2007764)

◆アメリカにおける失敗とN Engl J Med誌の怒り.
「Dying in a Leadership Vacuum(リーダーシップの真空状態がもたらす死)」というタイトルの論説は,医学雑誌として前例のないものとなった.冒頭に「COVID-19による危機は,各国のリーダーシップを試すものとなったが,ここ米国では,私たちの指導者は対応を失敗し,危機を悲劇に変えてしまった」と書かれてある.実際に米国の死者数は中国をはるかに上回り,カナダの2倍以上,日本の50倍,ベトナムの2000倍近くとなった.「我々はほとんどすべての対応に失敗した」・・・検査数や個人防護具の不足,検疫や隔離の遅さと一貫性のなさ,感染対策の不徹底,駆逐された疾病対策予防センター(CDC)と政治化された食品医薬品局(FDA)などが列挙される.「政権は専門家を無視・軽蔑し,無知なオピニオンリーダーや,嘘を流布する偽医者に頼った.その結果,不適切な政策のために失われたアメリカ人の命は,第二次世界大戦以降のどの紛争よりも多くなった.また医療従事者の献身的な働きが無駄にされている.しかし,今回の選挙で,我々は判決を下すことができる.現在の指導者たちにこのまま仕事を続けさせ,さらなるアメリカ人の死を招いてはならない」と述べている.
N Engl J Med. Oct 8, 2020(doi.org/10.1056/NEJMe2029812)
◆新型コロナウイルスはヒト皮膚上で9時間生存する.
京都府立医大からの報告.SARS-CoV-2ウイルスのヒト皮膚での生存時間を測定したところ,ウイルスは,インフルエンザAウイルスと比較して有意に長く生存した(9.0時間対1.8時間)(図1).また皮膚や粘液中のウイルスは,80%(w/w)エタノール処理により15秒以内に完全に不活化された.以上より,SARS-CoV-2ウイルスはインフルエンザAウイルスと比べ,接触感染のリスクが高いことが分かる.感染予防には適切な手指衛生が重要である.
Clin Infect Dis. October 3, 2020(doi.org/10.1093/cid/ciaa1517)

◆肺を満たすゼリー状の液体の正体はヒアルロン酸.
死亡の転帰をたどったCOVID-19症例は,剖検にて肺が透明なゼリー状の液体で満たされていることが知られている.3名の死亡患者から得た肺組織を免疫染色で調べたところ,肺胞腔内の顕著なヒアルロン酸滲出物を確認できた(図2).ヒアルロン酸はムコ多糖で,保水性が高く,水分保持により粘性を持つ性質がある.以上より,呼吸不全の新たな治療標的として,肺におけるヒアルロン酸の産生減少が考えられる.有効性が示されているデキサメタゾンも,ヒアルロン酸を抑制している可能性がある.
J Biol Chem. Sep 25, 2020(doi.org/10.1074/jbc.AC120.015967)

◆ウイルスは痛みを抑制して,無症状感染者を生み出す!?
米国からの報告.ウイルスの侵入経路として,スパイク蛋白質とアンジオテンシン変換酵素 2(ACE2) との結合が有名だが,第2の経路として,ニューロピリン-1 受容体(NRP-1)との結合が指摘されてきた.このNRP-1には,血管内皮増殖因子A(VEGF-A)も結合するため,スパイク蛋白質がVEGF-A/NRP-1シグナル伝達を阻害するかを検討した.結果として,スパイク蛋白質は,VEGF-Aをトリガーとする感覚神経細胞の発火をブロックした.またスパイク蛋白質は,VEGF-Aによる侵害受容(痛覚)促進作用もブロックした.加えて神経障害性疼痛モデルにおいて,アロディニア(通常では疼痛をもたらさない微小刺激が,とても痛く認識される現象)も抑制した.つまりウイルスのスパイク蛋白質はNRP-1に結合し,VEGF-Aによる痛みを消去することで,感染者の咽頭痛などの症状を抑え,さらなる感染伝播をもたらす可能性が示唆される.
Pain. Oct 1, 2020(doi.org/10.1097/j.pain.0000000000002097)
◆COVID-19による死亡リスクはパーキンソン病において有意に高い.
米国から,COVID-19によるパーキンソン病(PD)の症例死亡率が報告された.既報では0~40%の範囲で報告されているが,サンプルサイズが小さく,PDが死亡の独立した危険因子であるかは不明であった.この検討では,COVID-19患者78355名のうち,PDなしの患者は4290名が死亡したのに対し,PDありの患者694名のうち148名が死亡した(PDなし群5.5% vs PDあり群21.3%,p<0.001).年齢,性,人種を共変量としてロジスティック回帰を用いたところ,COVID-19による死亡リスクはPD群で有意に高いことが明らかになった(オッズ比:1.27,p=0.016).
Mov Disord. Sep 21, 2020(doi.org/10.1002/mds.28325)
◆神経合併症と転帰(1)
ニューヨークから,COVID-19患者における神経合併症の有病率と院内死亡率・転帰を前方視的に検討した観察研究が報告された.期間中に入院したCOVID-19患者4,491名のうち,606名(13.5%)が発症から2日以内(中央値)に神経合併症を呈した.多かった順に,中毒性・代謝性脳症(6.8%),けいれん発作(1.6%),脳卒中(1.9%),低酸素/虚血性障害(1.4%)であった.髄膜炎・脳炎,脊髄症・脊髄炎は見られず,検討した18名全例の髄液PCRは陰性であった.神経合併症を呈する患者は,高齢,男性,白人,高血圧,糖尿病,挿管患者が有意に多かった.神経合併症を有する患者は院内死亡のリスクが高く(ハザード比1.38,P<0.001),在宅退院の可能性が低かった(HR 0.72, P<0.001).神経合併症の多くは,重症全身状態に伴う後遺症の可能性が考えられた.
Neurology. Oct 5, 2020(doi.org/10.1212/WNL.0000000000010979)
◆神経合併症と転帰(2)
シカゴから,509名の入院COVID-19患者において,神経合併症の有無による重症度と転帰を比較した研究が報告された.神経合併症は,COVID-189の発症時に215名(42.2%),入院時に319名(62.7%),病期中の任意の時点で419名(82.3%)に認められた.頻度の高かった順に,筋痛(44.8%),頭痛(37.7%),脳症(31.8%),めまい(29.7%),味覚障害(15.9%),無嗅症anosmia(11.4%)であった.脳卒中,運動異常症,運動・感覚障害,運動失調,けいれん発作はまれであった(各0.2~1.4%).人工呼吸を要する重度の呼吸障害は134名(26.3%)に認められた.神経合併症の危険因子は,重症のCOVID-19(OR 4.02;P<0.001)および若年(0.982;P=0.014)であった.つまりより若く,重症患者ほど神経合併症を呈し,またより高齢の患者ほど脳症を呈した.全患者のうち362名(71.1%)は,退院時の転帰が良好であった(modified Rankin scale 0~2).しかし脳症は,呼吸状態の重症度とは無関係に,転帰の悪化(OR 0.22;P < 0.001)および入院後30日以内の死亡率の上昇と関連していた.
Ann Clin Transl Neurol. Oct 5, 2020(doi.org/10.1002/acn3.51210)
◆神経合併症(1)オプソクローヌス・ミオクローヌス症候群.
インドからの症例報告.中年男性が,COVID-19の呼吸器感染の回復から3週間後に,体のふらつきとミオクローヌスを呈した.診察時,オプソクローヌス,皮質性ミオクローヌス,小脳性運動失調を呈していた.他の失調を呈する原因は否定された.ステロイドパルス療法,バルプロ酸,クロナゼパム,レベチラセタムにて1週間後に回復した.
Neurology Oct 1, 2020(doi.org/10.1212/WNL.0000000000010978)
◆神経合併症(2)筋障害の頻度と影響因子.
オーストリアからの報告.COVID-19患者351 名,インフルエンザ患者 258 名における筋合併症の後方視的検討.高CK血症はCOVID-19患者の27%,インフルエンザ患者の28%で認め,同程度の頻度であった.COVID-19において,CKは疾患の重症度,および炎症マーカー(CRP, IL6)と強く相関していた.高CK血症が,ウイルスが引き金となった炎症反応による間接的なものなのか,それとも直接的な筋毒性によるものなのかは不明である.
Eur J Neurol. Sep 30, 2020(doi.org/10.1111/ene.14564)
◆神経合併症(3)ウイルスは脳組織に到達するが,直接の損傷は起こさない.
ドイツから,COVID-19で死亡した43名(51~94歳)の患者の脳病理に関する検討が報告された.6 名(14%)で新鮮な虚血病変を認めた.37 名(86%)では,観察したすべての領域にグリオーシスを認めた.ミクログリアの活性化と細胞障害性Tリンパ球の浸潤は,脳幹と小脳で最も顕著であった.髄膜の細胞障害性Tリンパ球の浸潤は34名(79%)で認められた.SARS-CoV-2はPCRにより,40名中21名(53%)の患者脳で検出され,SARS-CoV-2ウイルス蛋白質は脳幹および下部脳幹に由来する脳神経で認められた(図3).中枢神経系におけるSARS-CoV-2の存在は,病理学的変化の重症度とは相関せず,ウイルスに直接起因した損傷とは考えにくく,免疫介在性の機序による損傷の可能性がある.
Lancet Neurol. Oct 5, 2020(doi.org/10.1016/S1474-4422(20)30308-2)

◆神経合併症(4)脳症患者における髄液高力価抗SARS-CoV-2抗体.
ギリシアから脳症を呈した8 名の検討.全患者の髄液に抗SARS-CoV-2抗体が認められ,8名中4名が血清抗体価に匹敵する高力価を示した.1名の患者で,抗SARS-CoV-2 IgGの髄腔内産生が示唆され,他の3名では血液脳関門の障害が認められた.4名の髄液所見で,神経変性マーカーの14-3-3蛋白が高値であった.血液脳関門の破綻は,サイトカインや炎症性メディエーターの中枢神経系への侵入を促進し,神経炎症や神経変性を促進する可能性がある.ちなみにすべての患者の髄液で自己免疫性脳炎に関連する抗体(NMDAr,AMPAr,GABAbr,CASPR2,DPPX,LGI1)は陰性で,PCRによるういSARS-CoV-2も陰性であった.
Neurol Neuroimmunol Neuroinflamm. Sep 25, 2020(doi.org/10.1212/NXI.0000000000000893)
◆レムデシビルは偽薬より回復までの時間を5日間短縮する.
COVID-19で入院し,下気道感染を認めた成人を対象に行われた,抗ウイルス薬レムデシビル静注の二重盲検無作為化プラセボ対照試験の最終結果が報告された.レムデシビルまたは偽薬を10日間投与し,主要アウトカムは回復までの時間であった.541名がレムデシビル群,521名が偽薬群に割り付けられた.リムデシビル群の回復期間(中央値)は10日,偽薬群では15日であった(回復率比1.29;P<0.001)(図4).死亡率は,15日目までにレムデシビル群で6.7%,偽薬群で11.9%,29日目までにレムデシビル投与群で11.4%,偽薬群で15.2%,統計学的な有意差なし(ハザード比0.73;95%CI,0.52~1.03).重篤な有害事象に有意差はなかった.
New Engl J Med. Oct 8, 2020(doi.org/10.1056/NEJMoa2007764)


























