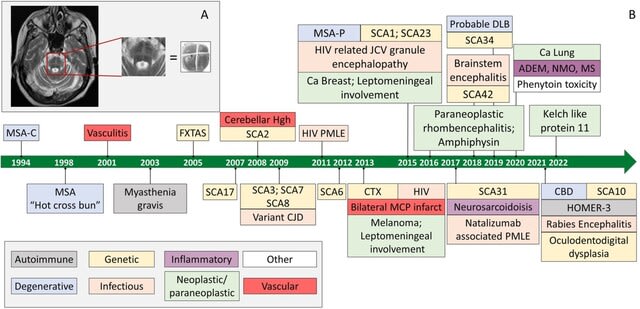
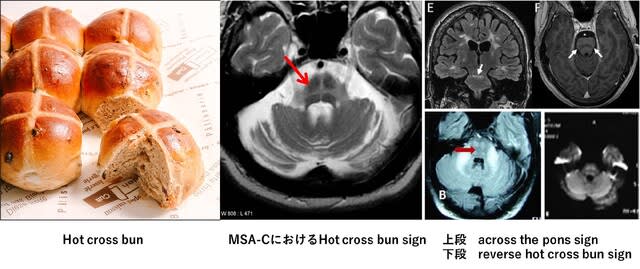
多系統萎縮症(MSA)の疾患感受性遺伝子研究では,COQ2,SNCA,MAPTおよびPRNP遺伝子等が議論されてきました.ただしいずれも説得力のある証明がなされていません.2016年に報告された研究でも,MSA 918例の分析がなされましたが,ゲノムワイドレベルで統計的有意差を示す遺伝子は同定されませんでした.診断が臨床診断でなされ,誤診例が含まれていた可能性が指摘されています.
今回,病理学的に診断を確定したMSA 731名と対照群2898名を検討した多施設国際研究が報告されました.最も強い疾患関連マーカーは,3番染色体のrs16859966,8番染色体のrs7013955,4番染色体のrs116607983で,P値は5×10-6以下でした.3番染色体遺伝子座近傍の遺伝子として約600kb上流のzinc-finger proteins of cerebellum 1 and 4 gene(ZIC1,ZIC4遺伝子)が注目されました.
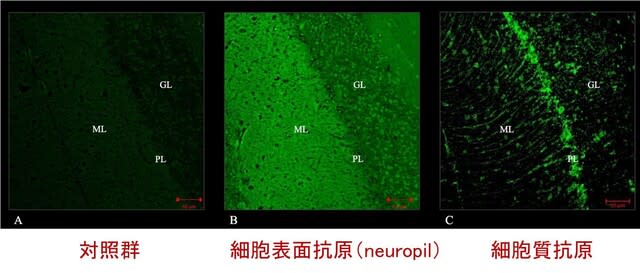
著者らはMSAの病態にZIC1,ZIC4が関与するか検討するため,MSA剖検脳を用いた免疫染色を行いました.検討に適したZIC1抗体を見出だせなかったため,ZIC4抗体による免疫染色を行いました.MSA患者24名(SND 10名+OPCAおよびSND+OPCA混合型 14名),対照5名を対象とし,小脳と前頭葉皮質を染色しました.歯状核ニューロンの総数におけるZIC4陽性ニューロンの割合を計測すると,対照とSNDでは一定の割合で認めたのに対し(33.2%,32.6%),OPCAまたは混合型では,ZIC4陽性ニューロンの割合は有意に低いことが分かりました(15.5%)(図).
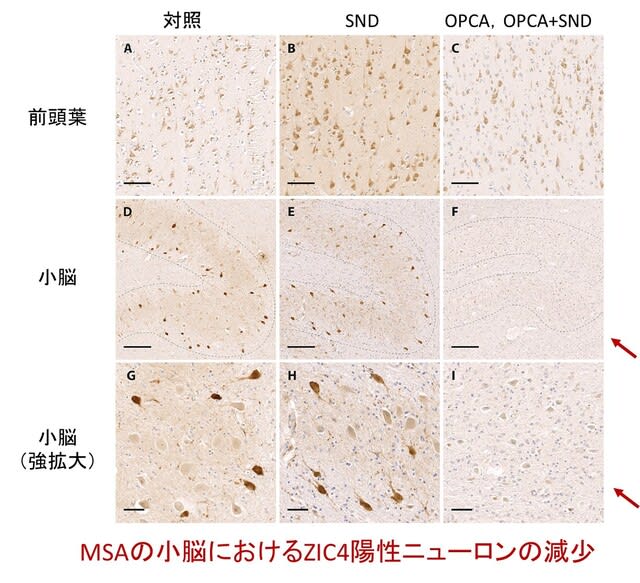
以上より,MSAにおいてZIC4が介在して神経変性が生じる可能性が示唆されました.α-シヌクレインとZIC4の機能的相互作用の可能性については,現在,解析中とのことです.ZIC1と ZIC4は小脳の発生に重要な役割を果たします.これらの遺伝子の変異や欠失は,先天性の小脳欠損を引き起こします(Dandy-Walker 症候群).またMSAの脳組織を用いた最近の2つのエピゲノム研究でも,ZIC4が見出されています.さらに興味深いことに,細胞内抗原であるZIC4に対する自己抗体が,急性~亜急性の小脳性運動失調を呈し,自律神経障害も呈することが知られています(高頻度に肺小細胞癌を認めます).ZIC4が小脳疾患のkey moleculeであることは間違いなく,MSAでどのように関与するのか非常に興味が持たれます.
Hopfner F, et al. Common Variants Near ZIC1 and ZIC4 in Autopsy-Confirmed Multiple System Atrophy. Mov Disord. 2022 Oct;37(10):2110-2121.(doi.org/10.1002/mds.29164)
今回,病理学的に診断を確定したMSA 731名と対照群2898名を検討した多施設国際研究が報告されました.最も強い疾患関連マーカーは,3番染色体のrs16859966,8番染色体のrs7013955,4番染色体のrs116607983で,P値は5×10-6以下でした.3番染色体遺伝子座近傍の遺伝子として約600kb上流のzinc-finger proteins of cerebellum 1 and 4 gene(ZIC1,ZIC4遺伝子)が注目されました.
著者らはMSAの病態にZIC1,ZIC4が関与するか検討するため,MSA剖検脳を用いた免疫染色を行いました.検討に適したZIC1抗体を見出だせなかったため,ZIC4抗体による免疫染色を行いました.MSA患者24名(SND 10名+OPCAおよびSND+OPCA混合型 14名),対照5名を対象とし,小脳と前頭葉皮質を染色しました.歯状核ニューロンの総数におけるZIC4陽性ニューロンの割合を計測すると,対照とSNDでは一定の割合で認めたのに対し(33.2%,32.6%),OPCAまたは混合型では,ZIC4陽性ニューロンの割合は有意に低いことが分かりました(15.5%)(図).

以上より,MSAにおいてZIC4が介在して神経変性が生じる可能性が示唆されました.α-シヌクレインとZIC4の機能的相互作用の可能性については,現在,解析中とのことです.ZIC1と ZIC4は小脳の発生に重要な役割を果たします.これらの遺伝子の変異や欠失は,先天性の小脳欠損を引き起こします(Dandy-Walker 症候群).またMSAの脳組織を用いた最近の2つのエピゲノム研究でも,ZIC4が見出されています.さらに興味深いことに,細胞内抗原であるZIC4に対する自己抗体が,急性~亜急性の小脳性運動失調を呈し,自律神経障害も呈することが知られています(高頻度に肺小細胞癌を認めます).ZIC4が小脳疾患のkey moleculeであることは間違いなく,MSAでどのように関与するのか非常に興味が持たれます.
Hopfner F, et al. Common Variants Near ZIC1 and ZIC4 in Autopsy-Confirmed Multiple System Atrophy. Mov Disord. 2022 Oct;37(10):2110-2121.(doi.org/10.1002/mds.29164)