今回のキーワードは,頭蓋骨から脳内にスパイク蛋白が到達し,持続的な神経細胞障害が生じる,PCR陽性から5日以内のパキロビッドによりlong COVIDは26%減少する,オミクロン株になっても,インフルエンザより入院患者の死亡率は依然として高い,2価ワクチンに変わっても,脳卒中,急性心筋梗塞,肺塞栓症のリスクは増加しない,COVID-19では頭痛に関与する血清CGRPが増加している,です.
Long COVIDの原因として「ウイルスの持続感染説」が有力でしたが,どこにウイルスが存在するのか,どのようにしてブレインフォグや認知症を来すのか(どのようにしてウイルスが脳に影響を及ぼすのか)はよく分かっていませんでした.今回,プレプリント論文ですが,long COVID研究における非常に大きな,そして驚くべき新知見が報告されました.なんとウイルススパイク蛋白の供給源は頭蓋骨のようで(図1),脳に到達したスパイク蛋白が神経細胞障害,脳血管障害,炎症性変化を来すことが示されました!COVID-19以外の原因で死亡した人々の頭蓋骨の29%にもスパイク蛋白は存在しており,軽度の感染でも長期間持続して頭蓋骨に存在することを示唆しています.

◆頭蓋骨から脳内にスパイク蛋白が到達し,持続的な神経細胞障害が生じる.
ドイツからの報告.マウスモデルおよびヒト死後組織を用いて,頭蓋骨骨髄―髄膜―脳実質にスパイク蛋白が集積していることを明らかにした.
図2.まずSARS-CoV-2の標的となる全組織を発見するために,マウスを透明化するクリアリング技術を用い,SARS-CoV-2ウイルス(武漢株,アルファ変異株)のスパイク蛋白,そしてインフルエンザのスパイク蛋白であるハマグルチニン(HA)タンパク質を注射し,標的となる臓器を確認した.この結果,明らかにSARS-CoV-2ウイルスは非常に多くの臓器を標的とすることが示された.

図3.多くの臓器とともに,頭蓋骨骨髄ニッチ(造血幹細胞が存在する特殊な微小環境)や,最近発見された頭蓋骨-髄膜結合(skull-meninges connection;SMC)にスパイク蛋白(緑)の集積が発見され,ウイルスの脳への新しい感染ルートと考えられた.デキストラン(紫)は血管を描出している.

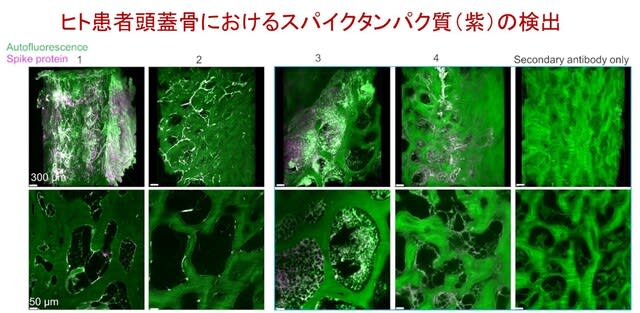
図4.COVID-19による死亡例の頭蓋骨の骨髄ニッチや髄膜にもスパイク蛋白が検出された.

図5.COVID-19患者27例の脳組織はほぼPCR陰性であったが,免疫染色ではスパイクタンパク質は髄膜および大脳皮質に存在し,ウイルス粒子と比較して半減期が長いことが示唆された.

図6.プロテオミクス解析により,COVID-19患者の骨髄,髄膜,脳において,神経変性,好中球細胞外トラップ(NETs),IL18パスウェー,PI3K/AKTシグナル,補体・凝固系カスケードに関わるいくつかの調節異常が認められた.またマウスモデルにSARS-CoV-2スパイクS1蛋白の静脈注射だけで,頭蓋骨骨髄,髄膜,および脳で幅広いプロテオミクス変化を引き起こした(インフルエンザHAタンパク質では生じなかった).これらの変化はCOVID-19に感染したヒトのサンプルで観察したものと同様であった.

図7.スパイク蛋白を頭蓋骨の骨髄に直接注入すると,マウスの大脳皮質組織において急性および長期の神経細胞傷害(アポトーシスやアミロイド前駆蛋白APP発現の増加として観察される)が生じたが,インフルエンザHAは何の変化ももたらさなかった.

図8.驚くべきことに,過去にCOVID-19に罹患し死亡した人の60%に回復後長い時間を経てスパイク蛋白の蓄積が確認された.またCOVID-19以外の原因で死亡した患者では29%に認められた.RT-PCRによるウイルス検出時間を超えて人間の頭蓋骨に確認されたスパイク蛋白は,COVID-19の症状を長期的に発症させる原因である可能性がある.
bioRxiv April 5, 2023.
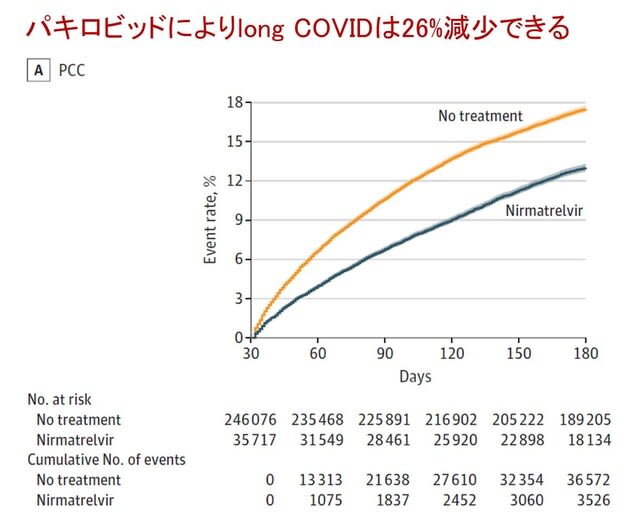
◆PCR陽性から5日以内のパキロビッドによりlong COVIDは26%減少する.
米国からCOVID-19の急性期におけるニルマトルビル(パキロビッド)による治療が,long COVIDリスクを低減させるか検討した研究が報告された.SARS-CoV-2陽性反応後5日以内にニルマトルビルの経口投与を受けた3万5717人と治療を受けなかった24万6076人を比較した.対照群と比較して,ニルマトルビル群はlong COVIDリスクの低減と関連していた(RR, 0.74; ARR, 4.51%)(図9).また急性期以降の死亡(HR, 0.53; ARR, 0.65%) および急性期以降の入院(HR, 0.76; ARR, 1.72%)リスクの低減とも関連していた.
JAMA Intern Med. 2023 Mar 23.(doi.org/10.1001/jamainternmed.2023.0743)
◆オミクロン株になっても,インフルエンザより入院患者の死亡率は依然として高い.
COVID-19はオミクロン株になり弱毒化し「インフルエンザと同じだ」とも言われる.米国から2022-2023年の秋から冬にかけて,COVID-19と季節性インフルエンザで入院した患者の死亡リスクを評価した研究が報告された.COVID-19による入院は8996件,インフルエンザによる入院は2403件であった.30日後の死亡率は,COVID-19で5.97%,インフルエンザで3.75%,超過死亡率は2.23%であった.インフルエンザと比較して,依然,COVID-19は高い死亡リスクと関連していた(ハザード比,1.61).ただしCIVID-19入院患者の死亡率は,パンデミック初期から減少している(2020年17%~21%→今回6%).これはワクチン接種者・既感染者の増加,医療ケアの改善によると考えられる.実際に死亡リスクは,COVID-19ワクチンの接種回数が多いほど減少する(未接種対接種でP = .009,未接種対ブースター接種でP < .001).
JAMA. April 6, 2023.(doi.org/10.1001/jama.2023.5348)
◆2価ワクチンに変わっても,脳卒中,急性心筋梗塞,肺塞栓症のリスクは増加しない.
2023年1月,米国疾病管理予防センターのVaccine Safety Datalinkは,65歳以上の人において2価ワクチン注射後21日以内に虚血性脳卒中のリスクが増加する可能性があることを警告した.1価ワクチン接種後に脳卒中,急性心筋梗塞,肺塞栓症の発生率が増加しないことは報告されているが,2価ブースター接種後に1価ブースターと比較して,これらのイベントのリスクが増加するか検討した研究がフランスから報告された.評価期間中,93万2583人が2価ワクチンを,12万1362人が1価ワクチンを接種した.接種21日後の時点で,2価ワクチン接種者は1価ワクチン接種者と比較して,虚血性疾患イベントのリスク上昇を示すデータは得られなかった.具体的には虚血性脳卒中(ハザード比,0.86),出血性脳卒中(ハザード比,0.86),心筋梗塞(ハザード比,0. 92),肺塞栓症(ハザード比, 0.83),4つのイベントの合計(ハザード比, 0.87)でいずれも有意差なし.2価ワクチンは1価ワクチンと同様に使用できる.
N Engl J Med. 2023 Mar 29.(doi.org/10.1056/NEJMc2302134)
◆COVID-19では頭痛に関与する血清CGRPが増加している.
COVID-19急性期の頭痛のメカニズムは不明であるが,片頭痛に類似した特徴から,三叉神経系の活性化が関与している可能性が指摘されている.スペインからCOVID-19入院患者で頭痛を認める25名と,頭痛を認めない15名,そして健常対照25名の,三叉神経・血管活性化のバイオマーカーである血清α-CGRP値を比較した(朝に測定した).①頭痛ありCOVID-19では55.2±34.3 pg/mL,②頭痛のないCOVID-19では43.3±12.8pg/mL,③対照では33.9±14.0 pg/mLであった.①は③より有意に高値で(p < 0.01),②も③より有意に高値で(p = 0.05),②は①より-28.2%低かったが,有意差はなかった(p = 0.36).→ 著者らはCOVID-19における頭痛にCGRPが関与している可能性があると言っているが,頭痛の有無で有意差がなく,グラフ(図10)を見ても健常対照との比較でもSDのばらつきは大きく,多数例での検討が必要なようである.むしろ頭痛はスパイク蛋白に対する髄膜炎症の為せる技のような気がする.
BMC Neurol. 2023 Mar 17;23(1):109.(doi.org/10.1186/s12883-023-03156-z)

Long COVIDの原因として「ウイルスの持続感染説」が有力でしたが,どこにウイルスが存在するのか,どのようにしてブレインフォグや認知症を来すのか(どのようにしてウイルスが脳に影響を及ぼすのか)はよく分かっていませんでした.今回,プレプリント論文ですが,long COVID研究における非常に大きな,そして驚くべき新知見が報告されました.なんとウイルススパイク蛋白の供給源は頭蓋骨のようで(図1),脳に到達したスパイク蛋白が神経細胞障害,脳血管障害,炎症性変化を来すことが示されました!COVID-19以外の原因で死亡した人々の頭蓋骨の29%にもスパイク蛋白は存在しており,軽度の感染でも長期間持続して頭蓋骨に存在することを示唆しています.

◆頭蓋骨から脳内にスパイク蛋白が到達し,持続的な神経細胞障害が生じる.
ドイツからの報告.マウスモデルおよびヒト死後組織を用いて,頭蓋骨骨髄―髄膜―脳実質にスパイク蛋白が集積していることを明らかにした.
図2.まずSARS-CoV-2の標的となる全組織を発見するために,マウスを透明化するクリアリング技術を用い,SARS-CoV-2ウイルス(武漢株,アルファ変異株)のスパイク蛋白,そしてインフルエンザのスパイク蛋白であるハマグルチニン(HA)タンパク質を注射し,標的となる臓器を確認した.この結果,明らかにSARS-CoV-2ウイルスは非常に多くの臓器を標的とすることが示された.

図3.多くの臓器とともに,頭蓋骨骨髄ニッチ(造血幹細胞が存在する特殊な微小環境)や,最近発見された頭蓋骨-髄膜結合(skull-meninges connection;SMC)にスパイク蛋白(緑)の集積が発見され,ウイルスの脳への新しい感染ルートと考えられた.デキストラン(紫)は血管を描出している.

図4.COVID-19による死亡例の頭蓋骨の骨髄ニッチや髄膜にもスパイク蛋白が検出された.

図5.COVID-19患者27例の脳組織はほぼPCR陰性であったが,免疫染色ではスパイクタンパク質は髄膜および大脳皮質に存在し,ウイルス粒子と比較して半減期が長いことが示唆された.

図6.プロテオミクス解析により,COVID-19患者の骨髄,髄膜,脳において,神経変性,好中球細胞外トラップ(NETs),IL18パスウェー,PI3K/AKTシグナル,補体・凝固系カスケードに関わるいくつかの調節異常が認められた.またマウスモデルにSARS-CoV-2スパイクS1蛋白の静脈注射だけで,頭蓋骨骨髄,髄膜,および脳で幅広いプロテオミクス変化を引き起こした(インフルエンザHAタンパク質では生じなかった).これらの変化はCOVID-19に感染したヒトのサンプルで観察したものと同様であった.

図7.スパイク蛋白を頭蓋骨の骨髄に直接注入すると,マウスの大脳皮質組織において急性および長期の神経細胞傷害(アポトーシスやアミロイド前駆蛋白APP発現の増加として観察される)が生じたが,インフルエンザHAは何の変化ももたらさなかった.

図8.驚くべきことに,過去にCOVID-19に罹患し死亡した人の60%に回復後長い時間を経てスパイク蛋白の蓄積が確認された.またCOVID-19以外の原因で死亡した患者では29%に認められた.RT-PCRによるウイルス検出時間を超えて人間の頭蓋骨に確認されたスパイク蛋白は,COVID-19の症状を長期的に発症させる原因である可能性がある.
bioRxiv April 5, 2023.

◆PCR陽性から5日以内のパキロビッドによりlong COVIDは26%減少する.
米国からCOVID-19の急性期におけるニルマトルビル(パキロビッド)による治療が,long COVIDリスクを低減させるか検討した研究が報告された.SARS-CoV-2陽性反応後5日以内にニルマトルビルの経口投与を受けた3万5717人と治療を受けなかった24万6076人を比較した.対照群と比較して,ニルマトルビル群はlong COVIDリスクの低減と関連していた(RR, 0.74; ARR, 4.51%)(図9).また急性期以降の死亡(HR, 0.53; ARR, 0.65%) および急性期以降の入院(HR, 0.76; ARR, 1.72%)リスクの低減とも関連していた.
JAMA Intern Med. 2023 Mar 23.(doi.org/10.1001/jamainternmed.2023.0743)

◆オミクロン株になっても,インフルエンザより入院患者の死亡率は依然として高い.
COVID-19はオミクロン株になり弱毒化し「インフルエンザと同じだ」とも言われる.米国から2022-2023年の秋から冬にかけて,COVID-19と季節性インフルエンザで入院した患者の死亡リスクを評価した研究が報告された.COVID-19による入院は8996件,インフルエンザによる入院は2403件であった.30日後の死亡率は,COVID-19で5.97%,インフルエンザで3.75%,超過死亡率は2.23%であった.インフルエンザと比較して,依然,COVID-19は高い死亡リスクと関連していた(ハザード比,1.61).ただしCIVID-19入院患者の死亡率は,パンデミック初期から減少している(2020年17%~21%→今回6%).これはワクチン接種者・既感染者の増加,医療ケアの改善によると考えられる.実際に死亡リスクは,COVID-19ワクチンの接種回数が多いほど減少する(未接種対接種でP = .009,未接種対ブースター接種でP < .001).
JAMA. April 6, 2023.(doi.org/10.1001/jama.2023.5348)
◆2価ワクチンに変わっても,脳卒中,急性心筋梗塞,肺塞栓症のリスクは増加しない.
2023年1月,米国疾病管理予防センターのVaccine Safety Datalinkは,65歳以上の人において2価ワクチン注射後21日以内に虚血性脳卒中のリスクが増加する可能性があることを警告した.1価ワクチン接種後に脳卒中,急性心筋梗塞,肺塞栓症の発生率が増加しないことは報告されているが,2価ブースター接種後に1価ブースターと比較して,これらのイベントのリスクが増加するか検討した研究がフランスから報告された.評価期間中,93万2583人が2価ワクチンを,12万1362人が1価ワクチンを接種した.接種21日後の時点で,2価ワクチン接種者は1価ワクチン接種者と比較して,虚血性疾患イベントのリスク上昇を示すデータは得られなかった.具体的には虚血性脳卒中(ハザード比,0.86),出血性脳卒中(ハザード比,0.86),心筋梗塞(ハザード比,0. 92),肺塞栓症(ハザード比, 0.83),4つのイベントの合計(ハザード比, 0.87)でいずれも有意差なし.2価ワクチンは1価ワクチンと同様に使用できる.
N Engl J Med. 2023 Mar 29.(doi.org/10.1056/NEJMc2302134)
◆COVID-19では頭痛に関与する血清CGRPが増加している.
COVID-19急性期の頭痛のメカニズムは不明であるが,片頭痛に類似した特徴から,三叉神経系の活性化が関与している可能性が指摘されている.スペインからCOVID-19入院患者で頭痛を認める25名と,頭痛を認めない15名,そして健常対照25名の,三叉神経・血管活性化のバイオマーカーである血清α-CGRP値を比較した(朝に測定した).①頭痛ありCOVID-19では55.2±34.3 pg/mL,②頭痛のないCOVID-19では43.3±12.8pg/mL,③対照では33.9±14.0 pg/mLであった.①は③より有意に高値で(p < 0.01),②も③より有意に高値で(p = 0.05),②は①より-28.2%低かったが,有意差はなかった(p = 0.36).→ 著者らはCOVID-19における頭痛にCGRPが関与している可能性があると言っているが,頭痛の有無で有意差がなく,グラフ(図10)を見ても健常対照との比較でもSDのばらつきは大きく,多数例での検討が必要なようである.むしろ頭痛はスパイク蛋白に対する髄膜炎症の為せる技のような気がする.
BMC Neurol. 2023 Mar 17;23(1):109.(doi.org/10.1186/s12883-023-03156-z)