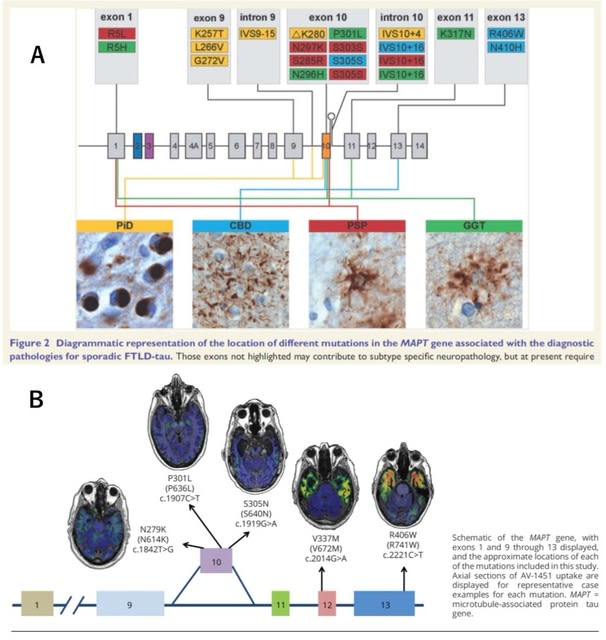
2017年にノーベル化学賞を受賞したクライオ電顕(低温電子顕微鏡法)を用いた,神経変性疾患に大きな進展をもたらす2つの研究がNature誌に報告された.
【大脳皮質基底核変性症(CBD)のタウの構造は,アルツハイマー病,Pickとは異なる】
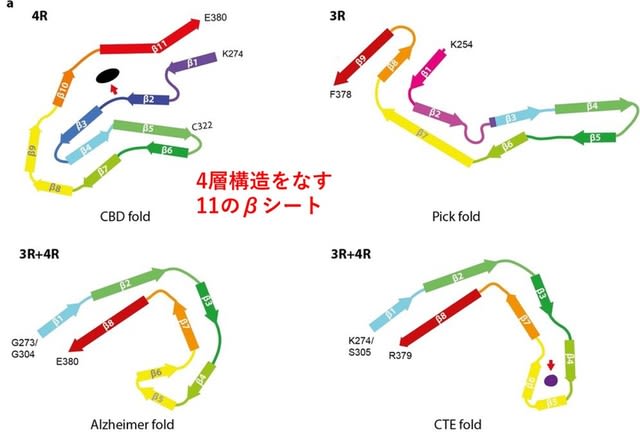
1つ目はCBDの患者脳から分離されたタウ線維の構造(polymorph, conformation)に関する論文である.これまでクライオ電顕を用いた検討で,3リピートタウオパチーであるPick病と,3+4リピートタウオパチーであるアルツハイマー病・慢性外傷性脳症(CTE)では,タウ線維の構造が異なることが報告されていた(strain,つまり株が異なるとも表現される).そして4リピートタウオパチーであるCBDおよび進行性核上性麻痺(PSP)での報告が待ち望まれていた.図1は4つのタウオパチーのタウ線維のコア部分を示すが,CBDは既報のいずれとも異なり,11個のβシートから構成される4層構造をしていた.疾患ごとのタウの構造の違いは,その後の重合や病理変化,疾患の表現型の違いに直結するものと予想される.次の課題は「何がタウにこれらの構造の違いをもたらしているのか?」に移る.
Nature. 2020 Feb 12. doi: 10.1038/s41586-020-2043-0.
【パーキンソン病と多系統萎縮症のαシヌクレインの構造は異なる】
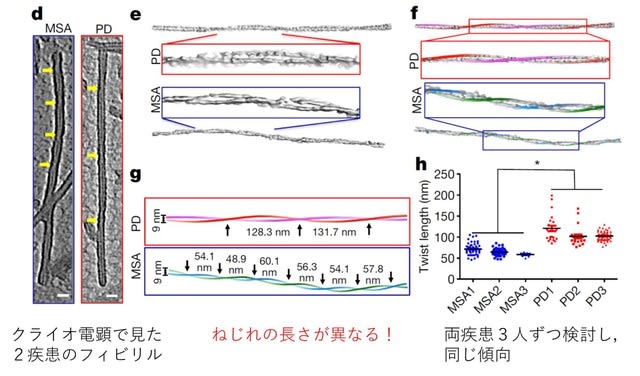
2つ目はパーキンソン病(PD)と多系統萎縮症(MSA)の病因蛋白αシヌクレインの構造に関する論文である.Protein misfolding cyclic amplification(PMCA)増幅法は,2001年に報告されたもので,異常プリオンタンパク(PrPsc)に正常プリオンタンパク(PrPc)を混ぜて超音波処理を行ったのち,撹拌・培養すると,PrPsc を鋳型として,PrPc がPrPscに変化し増幅されるという技術である.この技術を用いて,健常者を含む200名もの髄液中のαシヌクレインを検討したところ,両疾患の髄液に異常αシヌクレインが存在し,PMCA法によって増幅され,さらにそれぞれの疾患のαシヌクレインでは構造が異なっていることが複数の方法で明らかにされたのだ.
具体的にはタンパク分解酵素で分解しにくい分子領域が異なること,タンパクの二次構造解析法である円偏光二色性(CD)の検討で,βシートの割合がMSAでより多いこと,クリオ電顕の観察による線維(protofilament)のねじれの間隔が異なることが示されている(図).そして髄液を検体とするPMCA法により,感度95.4%で,2つの疾患を鑑別できるというのだ!(ただし病初期でも鑑別が可能か,内服薬剤の影響はないかはまだ不明である).そしてもうひとつ重要なことは,αシヌクレインの構造の違いが両疾患の病態に関わっている可能性があるということだ.事実,iPS由来の神経細胞にこれらを添加すると,MSA由来の繊維の方が,細胞毒性が強いことも示されている.つまり両疾患のαシヌクレインは構造のみならず機能的にも異なり,2つの疾患を単にαシヌクレイノパチーと一括りにしてはいけないことを示唆する.
Nature. 2020 Feb;578(7794):273-277
下図はこの論文に関するcommentaryから引用した概念図である.

【One polymorph, One disease 仮説とは?】
2つの論文は,1つの構造(もしくはタンパクのstrain)が,それに対応する1つの疾患を引き起こすというOne polymorph, One disease 仮説を支持するものである.神経変性疾患において構造(polymorph, conformation)がとくに注目された疾患が少なくとも2つある.ひとつはプリオン病で,もう一つがポリグルタミン病である.前者は,正常プリオンタンパクはαヘリックス,異常プリオンタンパクはβシート構造を取る.後者はも正常ポリグルタミン鎖はαヘリックス,伸長ポリグルタミン鎖はミスフォールディングを起こしβシート構造を取る.私は大学院生の頃,ポリグルタミン病研究を行っていたが,当時,conformational diseaseという概念が盛んに議論された.そして今後,あらためてconformational diseaseが議論されていくことになる.「なぜ単一の病因蛋白でありながら,さまざまな臨床・病理像をきたすのか?」という難問になかなか回答を示すことができなかったが,いよいよ次のステージに突入するものと考えられる.
【今後の課題は2つある】
解明すべき課題は2つあり,ひとつは「何がタウやαシヌクレインのconformationを変えるか?」である.ひとつは遺伝子変異であるが,孤発例ではどうか?まずPDとMSAにおいては,神経細胞,グリア細胞といった主に局在する細胞環境の違いが影響している可能性が高い.昨年12月にNature Neuroscience誌に報告された下記論文で,遺伝子変異を有するαシヌクレインを合成し,100 mMの食塩の存在下ないし非存在下に沈殿させると,長さや性質の異なる線維構造(それぞれS線維,NS線維と命名)が形成されることが報告された.そして両者をマウス脳に注射すると,いずれも神経症状を示すが,S線維は鋳型としての能力が高く,結果として,症状の進行が早いこと,神経細胞にのみ蓄積すること,海馬や中脳に限局して蓄積すること,そしてMSA患者脳のαシヌクレイン線維に似た線維ができることが示された(一方のNS線維はパーキンソン病,レビー小体認知症脳のαシヌクレイン線維に似ていた).つまり,αシヌクレインの性質は,単にバッファーの塩濃度によって変わってしまうということは非常に大きな驚きであった.今後さらに研究が進むだろう.
Nat Neurosci 23, 21–31 (2020).
もう一つの課題は「構造の違いが,なぜ固有の病理所見や表現型の違いをもたらすのか?」である.例えば同じ4リピートタウであっても,PSPとCBDではグリア細胞におけるタウ沈着パターンが異なる(tufted astrocyteとastrocytic plaque).このメカニズムまで分かると,疾患の理解は格段に進み,より効果的な治療へ展開するものと思われる.抗タウ抗体もstrainによってより適切なものがあるのかもしれない.いよいよ本当にこれらの神経変性疾患の病態に迫るステージに突入した実感がある.
【大脳皮質基底核変性症(CBD)のタウの構造は,アルツハイマー病,Pickとは異なる】
1つ目はCBDの患者脳から分離されたタウ線維の構造(polymorph, conformation)に関する論文である.これまでクライオ電顕を用いた検討で,3リピートタウオパチーであるPick病と,3+4リピートタウオパチーであるアルツハイマー病・慢性外傷性脳症(CTE)では,タウ線維の構造が異なることが報告されていた(strain,つまり株が異なるとも表現される).そして4リピートタウオパチーであるCBDおよび進行性核上性麻痺(PSP)での報告が待ち望まれていた.図1は4つのタウオパチーのタウ線維のコア部分を示すが,CBDは既報のいずれとも異なり,11個のβシートから構成される4層構造をしていた.疾患ごとのタウの構造の違いは,その後の重合や病理変化,疾患の表現型の違いに直結するものと予想される.次の課題は「何がタウにこれらの構造の違いをもたらしているのか?」に移る.
Nature. 2020 Feb 12. doi: 10.1038/s41586-020-2043-0.

【パーキンソン病と多系統萎縮症のαシヌクレインの構造は異なる】
2つ目はパーキンソン病(PD)と多系統萎縮症(MSA)の病因蛋白αシヌクレインの構造に関する論文である.Protein misfolding cyclic amplification(PMCA)増幅法は,2001年に報告されたもので,異常プリオンタンパク(PrPsc)に正常プリオンタンパク(PrPc)を混ぜて超音波処理を行ったのち,撹拌・培養すると,PrPsc を鋳型として,PrPc がPrPscに変化し増幅されるという技術である.この技術を用いて,健常者を含む200名もの髄液中のαシヌクレインを検討したところ,両疾患の髄液に異常αシヌクレインが存在し,PMCA法によって増幅され,さらにそれぞれの疾患のαシヌクレインでは構造が異なっていることが複数の方法で明らかにされたのだ.
具体的にはタンパク分解酵素で分解しにくい分子領域が異なること,タンパクの二次構造解析法である円偏光二色性(CD)の検討で,βシートの割合がMSAでより多いこと,クリオ電顕の観察による線維(protofilament)のねじれの間隔が異なることが示されている(図).そして髄液を検体とするPMCA法により,感度95.4%で,2つの疾患を鑑別できるというのだ!(ただし病初期でも鑑別が可能か,内服薬剤の影響はないかはまだ不明である).そしてもうひとつ重要なことは,αシヌクレインの構造の違いが両疾患の病態に関わっている可能性があるということだ.事実,iPS由来の神経細胞にこれらを添加すると,MSA由来の繊維の方が,細胞毒性が強いことも示されている.つまり両疾患のαシヌクレインは構造のみならず機能的にも異なり,2つの疾患を単にαシヌクレイノパチーと一括りにしてはいけないことを示唆する.
Nature. 2020 Feb;578(7794):273-277

下図はこの論文に関するcommentaryから引用した概念図である.

【One polymorph, One disease 仮説とは?】
2つの論文は,1つの構造(もしくはタンパクのstrain)が,それに対応する1つの疾患を引き起こすというOne polymorph, One disease 仮説を支持するものである.神経変性疾患において構造(polymorph, conformation)がとくに注目された疾患が少なくとも2つある.ひとつはプリオン病で,もう一つがポリグルタミン病である.前者は,正常プリオンタンパクはαヘリックス,異常プリオンタンパクはβシート構造を取る.後者はも正常ポリグルタミン鎖はαヘリックス,伸長ポリグルタミン鎖はミスフォールディングを起こしβシート構造を取る.私は大学院生の頃,ポリグルタミン病研究を行っていたが,当時,conformational diseaseという概念が盛んに議論された.そして今後,あらためてconformational diseaseが議論されていくことになる.「なぜ単一の病因蛋白でありながら,さまざまな臨床・病理像をきたすのか?」という難問になかなか回答を示すことができなかったが,いよいよ次のステージに突入するものと考えられる.
【今後の課題は2つある】
解明すべき課題は2つあり,ひとつは「何がタウやαシヌクレインのconformationを変えるか?」である.ひとつは遺伝子変異であるが,孤発例ではどうか?まずPDとMSAにおいては,神経細胞,グリア細胞といった主に局在する細胞環境の違いが影響している可能性が高い.昨年12月にNature Neuroscience誌に報告された下記論文で,遺伝子変異を有するαシヌクレインを合成し,100 mMの食塩の存在下ないし非存在下に沈殿させると,長さや性質の異なる線維構造(それぞれS線維,NS線維と命名)が形成されることが報告された.そして両者をマウス脳に注射すると,いずれも神経症状を示すが,S線維は鋳型としての能力が高く,結果として,症状の進行が早いこと,神経細胞にのみ蓄積すること,海馬や中脳に限局して蓄積すること,そしてMSA患者脳のαシヌクレイン線維に似た線維ができることが示された(一方のNS線維はパーキンソン病,レビー小体認知症脳のαシヌクレイン線維に似ていた).つまり,αシヌクレインの性質は,単にバッファーの塩濃度によって変わってしまうということは非常に大きな驚きであった.今後さらに研究が進むだろう.
Nat Neurosci 23, 21–31 (2020).
もう一つの課題は「構造の違いが,なぜ固有の病理所見や表現型の違いをもたらすのか?」である.例えば同じ4リピートタウであっても,PSPとCBDではグリア細胞におけるタウ沈着パターンが異なる(tufted astrocyteとastrocytic plaque).このメカニズムまで分かると,疾患の理解は格段に進み,より効果的な治療へ展開するものと思われる.抗タウ抗体もstrainによってより適切なものがあるのかもしれない.いよいよ本当にこれらの神経変性疾患の病態に迫るステージに突入した実感がある.