まず自律神経系の節前,節後線維における伝達物質についておさらいしたい.交感神経,副交感神経とも,神経節におけるシナプス伝達はアセチルコリン(Ach)によって行なわれている.交感神経の節後線維末端からはノルアドレナリンが支配する臓器に対して分泌されている.副交感神経節後線維の作用はAchにより伝達される(ただし例外として汗腺を支配する交感神経節後線維の伝達物質はAchである).
Mayo ClinicのLowらは先日行われた米国神経学会(AAN)のplenary sessionのひとつで(Frontiers in Clinical Neurscience plenary session),自己免疫性の自律神経節障害autoimmune autonomic ganglionopathy(AAG)について紹介した.この病気はautoimmune autonomic neuropathyとかacute pandysautonomiaとも呼ばれてきた病気だが,日本ではあまり認識されてなかったのではないだろうか.症状としては交感神経系の障害(起立性低血圧OH,無汗症),副交感神経系の障害(脈拍変動異常,口渇,瞳孔収縮の異常),胃腸運動障害などを呈する.急性発症する症例以外にも慢性の経過をたどる症例もあり,この場合,変性疾患(Bannisterが唱えたPAF; pure autonomic failureとか,Shy-Drager症候群との鑑別が必要になる).
AAGでは約半数の症例に自律神経節に存在するneuronal nicotinic acetyl-choline receptor(ganglionic AchR)に対する自己抗体が検出されることが報告されている.最新号のNeurologyではこの自己抗体が本当にAAGの病因であることを証明するin vitro実験が報告されている.ヒト培養細胞であるIMR-32細胞を用いて,パッチクランプ法によりganglionic AchR電流を記録し,AAG患者由来IgGを加えた場合の電流の変化を調べる実験だ.結果としては,7例のAAG患者IgGすべてがこの電流を抑制し,その効果は濃度依存性,かつ温度依存性であった(低温で抑制効果は減弱する).一方,健常者やMG・LEMS患者IgGではこの抑制効果は認められなかった.つまり患者IgGがAAGの原因である可能性が示唆され,ganglionic AchRの機能変化がその病態であると考えられた.
一方,臨床的にはこの自己抗体価の程度によって,臨床像に違いが生じることも分かっている.具体的には以下の4タイプに分けられるそうだ.
① autonomic and paraneoplastic autonomic ganglionopathy(pandyssutonomia)
抗体価が高い場合のタイプ.症候としてAdie pupil,Sicca syndrome,神経因性膀胱,消化器症状,OH,汗腺異常を呈する
② pure automnomic failure
抗体価はさほど高くない場合のタイプ.汗腺異常と神経因性膀胱(軽度)を生じる.
③ chronic idiopathic anhidrosis
中等度の抗体価で,亜急性発症するが汗腺異常のみ.
④ postural orthostatic tachycardia syndrome
低抗体価の場合に生じ,起立性調節障害と頻脈,消化器症状を呈する.
さて治療であるが,まずこれらの疾患では,高血圧を悪化させずにOHを改善させる必要がある.FDAで認められているのはmidodrineのみだが,supine hypertensionを増悪させる点が問題である.みんなが考えるであろうpyridostigmine(コリンエステラーゼ阻害剤)は,経験的には改善効果があるとLow先生は述べていた.現在ランダム化試験中とのことであった.いずれにしても治療できる可能性があることから,自律神経障害を主徴とする症例では鑑別に挙げるべき疾患といえよう.
Neurology 2007; 68; 1917-1921
Mayo ClinicのLowらは先日行われた米国神経学会(AAN)のplenary sessionのひとつで(Frontiers in Clinical Neurscience plenary session),自己免疫性の自律神経節障害autoimmune autonomic ganglionopathy(AAG)について紹介した.この病気はautoimmune autonomic neuropathyとかacute pandysautonomiaとも呼ばれてきた病気だが,日本ではあまり認識されてなかったのではないだろうか.症状としては交感神経系の障害(起立性低血圧OH,無汗症),副交感神経系の障害(脈拍変動異常,口渇,瞳孔収縮の異常),胃腸運動障害などを呈する.急性発症する症例以外にも慢性の経過をたどる症例もあり,この場合,変性疾患(Bannisterが唱えたPAF; pure autonomic failureとか,Shy-Drager症候群との鑑別が必要になる).
AAGでは約半数の症例に自律神経節に存在するneuronal nicotinic acetyl-choline receptor(ganglionic AchR)に対する自己抗体が検出されることが報告されている.最新号のNeurologyではこの自己抗体が本当にAAGの病因であることを証明するin vitro実験が報告されている.ヒト培養細胞であるIMR-32細胞を用いて,パッチクランプ法によりganglionic AchR電流を記録し,AAG患者由来IgGを加えた場合の電流の変化を調べる実験だ.結果としては,7例のAAG患者IgGすべてがこの電流を抑制し,その効果は濃度依存性,かつ温度依存性であった(低温で抑制効果は減弱する).一方,健常者やMG・LEMS患者IgGではこの抑制効果は認められなかった.つまり患者IgGがAAGの原因である可能性が示唆され,ganglionic AchRの機能変化がその病態であると考えられた.
一方,臨床的にはこの自己抗体価の程度によって,臨床像に違いが生じることも分かっている.具体的には以下の4タイプに分けられるそうだ.
① autonomic and paraneoplastic autonomic ganglionopathy(pandyssutonomia)
抗体価が高い場合のタイプ.症候としてAdie pupil,Sicca syndrome,神経因性膀胱,消化器症状,OH,汗腺異常を呈する
② pure automnomic failure
抗体価はさほど高くない場合のタイプ.汗腺異常と神経因性膀胱(軽度)を生じる.
③ chronic idiopathic anhidrosis
中等度の抗体価で,亜急性発症するが汗腺異常のみ.
④ postural orthostatic tachycardia syndrome
低抗体価の場合に生じ,起立性調節障害と頻脈,消化器症状を呈する.
さて治療であるが,まずこれらの疾患では,高血圧を悪化させずにOHを改善させる必要がある.FDAで認められているのはmidodrineのみだが,supine hypertensionを増悪させる点が問題である.みんなが考えるであろうpyridostigmine(コリンエステラーゼ阻害剤)は,経験的には改善効果があるとLow先生は述べていた.現在ランダム化試験中とのことであった.いずれにしても治療できる可能性があることから,自律神経障害を主徴とする症例では鑑別に挙げるべき疾患といえよう.
Neurology 2007; 68; 1917-1921















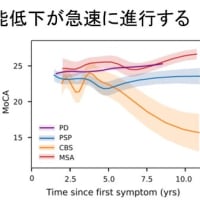
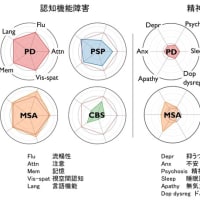



もう3年半以上、消化器症状で苦しんでます。
なぜか、スルピリドしか効かず、
他の胃薬は全く効果がありません。
最近、アセチルコリンが消化器症状に深く関わりがあることを知りました。
そこで、調べたら、スルピリドがアセチルコリンを促進させている、と聞きました。
私の消化器症状はアセチルコリンの分泌異常(少ない)のせいなのでしょうか?