恒例のBritish Medical Journal(BMJ)誌のクリスマス特集号の論文で,ケンブリッジ大学からの報告を紹介したい.アルコールは多くの疾患の危険因子である.イギリスでは近年,アルコール消費量が増加傾向にある.この原因として,製造や流通,ライフスタイルの変化が考えられるが,著者らは環境要因としてワイングラスの大きさが関与している可能性を考えた.この仮説は,食器類のサイズが過去100年で大きくなったことに伴い,摂取カロリーが増加し,肥満に繋がったという既報に基づいている.
研究方法は,ワインを飲むのにワイングラスが使われるようになったのは18世紀初頭とのことであることから,1700年から2017年まで,イギリスで作られたワイングラスを5つの入手先(オックスフォード大学美術館,ロイヤルハウスホールド,eBayオークション,ダーチントン・クリスタル,ジョン・ルイス・オンラインストア)から合計411個を収集し,その容量を測定した.
さて結果であるが,1700年代には66 mLであった容量が,19世紀になってから増加し始め, 2000年代には417 mLにまで増加していた(図).とくに近年,サイズが急速に大きくなり続けて,2016~2017年におけるグラスの容量は449 mLになっていた.年代別のグラスの販売実績データは入手できなかった.
本研究は,経時的なワイングラスのサイズの変化について調査した最初の報告である.ワイングラスが大きくなった要因としては,ワインの販売促進に大きいグラスが良かったり,テイスティングには大きなグラスが適していたり,複数の要因があるだろうと考察されている.研究の限界として,イギリス以外の国において検討できていないことを挙げている.これらの結果から,ワイングラスのサイズを減少することによってアルコール消費量を減少でき,健康被害を防止できる可能性があるのではないかと述べている・・・・
ご存知,これらはクリスマス企画のおふざけ論文である(昨年はポケモンGOの運動効果の論文などでした).でもたぶん個人的な経験で,この仮説は正しいと思う(笑).そのほかの論文としては,満月とバイク事故での死亡率の関係を調べた論文などが掲載されている.
Wine glass size in England from 1700 to 2017: a measure of our time. BMJ 2017;359:j5623
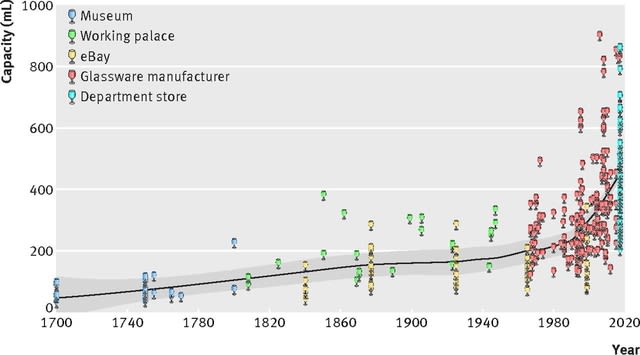
研究方法は,ワインを飲むのにワイングラスが使われるようになったのは18世紀初頭とのことであることから,1700年から2017年まで,イギリスで作られたワイングラスを5つの入手先(オックスフォード大学美術館,ロイヤルハウスホールド,eBayオークション,ダーチントン・クリスタル,ジョン・ルイス・オンラインストア)から合計411個を収集し,その容量を測定した.
さて結果であるが,1700年代には66 mLであった容量が,19世紀になってから増加し始め, 2000年代には417 mLにまで増加していた(図).とくに近年,サイズが急速に大きくなり続けて,2016~2017年におけるグラスの容量は449 mLになっていた.年代別のグラスの販売実績データは入手できなかった.
本研究は,経時的なワイングラスのサイズの変化について調査した最初の報告である.ワイングラスが大きくなった要因としては,ワインの販売促進に大きいグラスが良かったり,テイスティングには大きなグラスが適していたり,複数の要因があるだろうと考察されている.研究の限界として,イギリス以外の国において検討できていないことを挙げている.これらの結果から,ワイングラスのサイズを減少することによってアルコール消費量を減少でき,健康被害を防止できる可能性があるのではないかと述べている・・・・
ご存知,これらはクリスマス企画のおふざけ論文である(昨年はポケモンGOの運動効果の論文などでした).でもたぶん個人的な経験で,この仮説は正しいと思う(笑).そのほかの論文としては,満月とバイク事故での死亡率の関係を調べた論文などが掲載されている.
Wine glass size in England from 1700 to 2017: a measure of our time. BMJ 2017;359:j5623






















