がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
687) 腫瘍関連マクロファージをターゲットにしたがん治療(その1):ジスルフィラムはがん組織内へのマクロファージの動員を阻止する
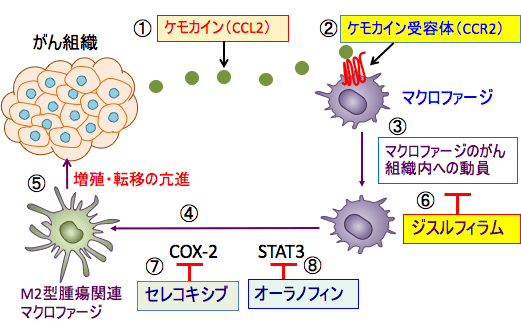
図:がん細胞からケモカインのCCL2が分泌され(①)、マクロファージのケモカイン受容体のCCR2に結合すると(②)、マクロファージはがん組織へと誘引され、腫瘍関連マクロファージとしてがん細胞の増殖を助ける(③)。腫瘍関連マクロファージはシクロオキシゲナーゼ-2(COX-2)から産生されるプロスタグランジンE2や、シグナル伝達兼転写活性化因子3(STAT3)の活性化によってM2型の腫瘍関連マクロファージになり(④)、がん細胞の増殖や転移を促進する(⑤)。アルコール依存症治療薬のジスルフィラムは、CCR2のシグナル伝達を阻止することによって、マクロファージがケモカインを目指して進もうとする反応(走化性)を抑制し、マクロファージのがん組織への動員を阻止する(⑥)。COX-2阻害剤のセレコキシブ(⑦)とSTAT3阻害作用のあるオーラノフィン(⑧)は腫瘍関連マクロファージのM2型への変換を阻止することによって、がん細胞の増殖と転移を抑制する。
687) 腫瘍関連マクロファージをターゲットにしたがん治療(その1):ジスルフィラムはがん組織内へのマクロファージの動員を阻止する
【がん細胞の増殖と転移はがん組織の微小環境に支配されている】
がん細胞だけでは生存も増殖も転移もできません。
がん細胞が生存し増殖していくためには、がん細胞に酸素や栄養を与える血管や、生存や増殖を支持する因子を産生する線維芽細胞や炎症細胞の存在が必要です。転移するためには、ケモカインやケモカイン受容体や増殖因子などの働きが必要です。がん細胞が血管内に侵入するためには、血管周囲マクロファージの手助けが必要です。
がん組織は、がんの実質細胞である「がん細胞」とそのがん細胞を養う「間質組織」の相互作用によって成り立ちます。
間質組織には血管やマクロファージなどの炎症細胞や結合組織を作る線維芽細胞などが存在し、これらの細胞ががん細胞の生存や増殖を維持するために様々な働きを行っています。これが「がんの微小環境」です。(下図)

図:がん組織はがん細胞だけでなく、間質に存在する様々な正常細胞から構成されている。がん細胞の増殖や転移は、がん細胞と間質細胞の相互作用によって決められる。がん細胞だけでは増殖も転移もできない。マクロファージや線維芽細胞や骨髄由来細胞や血管内皮細胞など様々な細胞ががん細胞の増殖や浸潤や転移に関わっている。(参考:Transl Cancer Res. 2013 August 1; 2(4): 309–319のFig1)
がん細胞は様々なケモカインや増殖因子を分泌して、血管内皮細胞や炎症細胞や線維芽細胞などの間質細胞をがん組織に動員しています。一方、動員された線維芽細胞やマクロファージやリンパ球も様々な因子を産生・分泌してがん細胞の増殖や浸潤や転移を促進しています。
がん細胞は正常な間質細胞を自分の都合の良いように操るハッカー(他人のコンピューターに侵入して制御したり破壊する人)だという考え方があります。つまり、がん細胞自身の増殖や生存を維持するために正常細胞を動員してがん細胞の増殖に有利な間質組織(微小環境)を作っています。
本来は宿主のためにがん細胞に立ち向かわなければならないのに、がん細胞に操られて、がん細胞の味方になっていると言えます。正常細胞からの指令もがん細胞からの指令も、間質細胞にとっては同じだと言うことかもしれません。
正常組織は異物や病原菌の侵入を受けると炎症反応を起こして異物や病原菌を排除し、ダメージを修復すると、炎症反応は収束します。
自己免疫疾患(膠原病)の場合は、免疫系の異常によって自己の成分を自分の免疫細胞が攻撃するため、炎症反応が慢性化し、その結果、組織のダメージが持続し、さらに炎症が悪化するという悪循環を形成しています。
がん組織も炎症が起こっています。
がんは「治ることのない創傷」(Tumors are “wounds that do not heal.”)という考えがあります。がん細胞は正常組織を浸潤してダメージを与え、組織修復と炎症反応が持続し、いつまでたっても収束しない状況です。慢性炎症と同様に、炎症が収束せず、永遠に創傷治癒過程(=炎症反応)が続いている状態と同じということです。
つまり、関節リュウマチのような自己免疫疾患と「がん」には慢性炎症という点で共通点があります。
したがって、がん組織の間質における慢性炎症状態を正常化すると、あるいはがん細胞と間質細胞の相互作用を断つと、がん細胞の増殖や生存を阻害できる可能性があります。
これが、慢性関節リュウマチの薬ががん細胞にも効く理由です。逆に抗がん剤が慢性関節リュウマチの治療にも使われています。

図:がん細胞が正常組織に浸潤して組織を破壊し、さらに免疫細胞ががん細胞を攻撃するために免疫細胞や炎症細胞が集まって、がん組織内は慢性炎症状態にある。がん組織中のがん細胞や線維芽細胞などからケモカインや増殖因子が産生される(①)。がん細胞はケモカインや増殖因子に対する受容体が刺激され、増殖が亢進する(②)。ケモカインや増殖因子は骨髄の血管内皮前駆細胞や炎症細胞(マクロファージなど)をがん組織に動員する(③)。その結果、がん組織において血管の新生・増生や炎症性サイトカインの産生、抗腫瘍免疫の抑制が起こる(④)。その結果、がん細胞の増殖が促進され、浸潤や転移が促進される(⑤)。
【がん治療におけるマクロファージ活性化の2面性】
マクロファージは白血球の1種で、細胞内に消化酵素を持ち、細菌、ウイルス、死んだ細胞などの異物を細胞内に取り込んで消化するので、大食細胞や貪食細胞とも呼ばれます。
分解した異物をいくつかの断片にして細胞表面に抗原として提示する(抗原提示という)役割を持ち、リンパ球による免疫反応の最初のシグナルとして重要な働きをします。
さらに、各種のサイトカイン(リンパ球などの免疫細胞の働きを調節するホルモン様蛋白質)を放出してナチュラルキラー細胞やT細胞などを活性化し、感染症やがんに対する生体防御機構において重要な役割を果たします。
がんに効くと宣伝されているサプリメントの多くが、マクロファージを活性化して、がん細胞を排除することを言及しています。つまり、古典的な解釈では、活性化したマクロファージはがん細胞や病原菌を攻撃して排除するので、がん治療に有用と考えられています。
しかし、がん患者においてマクロファージの活性を高めることは、がん細胞の増殖を抑える良い面だけでなく、状況によっては、炎症反応を増悪させ、抗腫瘍免疫を抑制し、組織の破壊やがん細胞の増殖を促進する悪い面の2面性があるので注意が必要です。(下図)

図:炎症性刺激によって活性化されたマクロファージ(①)は、活性酸素や一酸化窒素やシクロオキシゲナーゼー2や炎症性サイトカイン(TNF-αやIL-1など)などを産生する(②)。これらは、がん細胞や病原菌に対する生体防御力を高める(③)。しかし一方、炎症を増悪させて組織障害を増悪し、抗腫瘍免疫を抑制してがん細胞の増殖を促進する場合もある(④)。マクロファージの活性化(炎症反応)には二面性があることに注意する必要がある。
【腫瘍関連マクロファージはがんの悪化を促進する】
以前は、マクロファージが活性化するとがん細胞を攻撃してくれると考えられていたのですが、最近の考え方はむしろ逆で、腫瘍内にマクロファージの数が多いほど予後が悪いことが報告されています。
マクロファージはがん細胞を攻撃することができますが、がん組織の中では、がん細胞に都合の良いように操られるメカニズムが存在するからです。
がん組織に浸潤したマクロファージを腫瘍関連マクロファージ(tumor-associated macrophage:TAM)と言い、血管新生促進、増殖因子産生亢進、免疫抑制、転移促進などのさまざまな作用によりがん細胞の発生と悪性化を促進する働きをしています。
活性化したマクロファージから産生されるプロスタグランジンE2や炎症性サイトカイン(IL-6やTNF-αなど)はがん細胞を悪化させ、抗腫瘍免疫を抑制してがん細胞の増殖を促進し、転移や再発を促進することが明らかになっています。
血中を循環する単球は、皮膚などの末梢組織に入るとマクロファージとよばれる細胞に分化します。表皮のランゲルハンス細胞、脳組織のミクログリア細胞、骨の破骨細胞、肝臓のクッパー細胞などはマクロファージの仲間です。
マクロファージはM1型とM2型に分けられます。
M1型はがん細胞を攻撃する作用がありますが、炎症と組織傷害を進める作用があります。
一方、M2型は炎症を収束させるように働きますが、細胞傷害性T細胞(CTL)活性を抑制して抗腫瘍免疫を阻止する作用を持っています。さらに、M2型はがん細胞の増殖や浸潤や血管新生を促進する作用を持っています。
がんの免疫療法の効果を高めるためにはM1型を亢進し、M2型を抑制することが重要と考えられています。

図:シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)は腫瘍関連マクロファージ(Tumor-associated macrophage: TAM)をM1型からM2型に変換して活性化する(①)。M2型TAMはVEGF, FGF-2, IL-1, IL-8を産生して血管新生を亢進し(②)、EGF, FGF-2, IL-6, TGF-β, PDGFを産生してがん細胞の増殖を亢進する(③)。さらに、がん細胞と融合したり、EGF(上皮細胞増殖因子), IL-6, IL-8を産生して、がん幹細胞の性状をがん細胞に獲得させる(④)。さらにMMPs(matrix metalloproteinase)やEGFの産生を促進してがん細胞の浸潤性を高める(⑤)。このようにして、M2型腫瘍関連マクロファージはがん細胞の増殖、転移、治療抵抗性、再発を促進する(⑥)。(参考:J Zhejiang Univ Sci B. 15(1): 1–15. 2014年, Fig.1)
【血管周囲マクロファージはがん細胞の血管内浸潤を手助けする】
がん細胞が血管内に侵入するとき、それなりのメカニズムが存在します。
血管というのは、血液が漏れないように血管内皮細胞が連続して管を形成しています。その中に入り込むには、血管内皮細胞の隙間を通って入り込むというプロセスが必須です。偶然に入るわけではありません。
まず、がん細胞は移動能を亢進する必要があり、そのため細胞骨格タンパク質などの発現や機能に変化が起こります。その一つがMenaというアクチン制御タンパク質の発現亢進で、このMenaタンパク質を免疫染色で染めれば、多数のがん細胞の中から移動能が亢進して周囲の組織や血管内に浸潤しようとしているがん細胞を見つけることができます。
さらに、血管内皮細胞の接合をこじ開けて、血管壁の透過性を亢進して、がん細胞の血管内侵入を助けるのが、腫瘍組織内のマクロファージ(腫瘍関連マクロファージ)のサブポピュレーションのTie2発現マクロファージです。
血管周囲マクロファージはアンジオポエチン(angiopoietin )の受容体の Tie2を発現しています。
さらに、血管周囲マクロファージは血管内皮細胞増殖因子-A (vascular endothelial growth factor–A :VEGF-A)を分泌して血管透過性を亢進します。
つまり、血管周囲マクロファファージはTie2とVEGFAを高発現(Tie2Hi/VEGFAHi perivascular macrophages)している特徴があります。
がん細胞が血管内に侵入するとき、血管内皮細胞の間の接合部分がこじ開けられて、移動能を増したがん細胞が血管内に入り込むのですが、この時、血管内皮細胞の接合部を解離させてがん細胞の血管内侵入を助けるのが血管周囲のマクロファージで、VEGFAを分泌して一過性に血管透過性を亢進させるという機序が存在するのです。
Menaタンパク質の発現が亢進した(運動能が亢進した)がん細胞と、Tie2発現が亢進している血管周囲マクロファージと血管内皮細胞が一緒になっている部位を3重免疫染色で見つければ、その部位ががん細胞の血管内侵入の部位と同定できます。
この3種類の細胞が一緒にいる部位は転移の腫瘍微小環境(Tumor Microenvironment of Metastasis :TMEM)と呼ばれます。
このTMEMの密度(一定面積内の数)をスコア化して、転移との関連を検討すると、TMEMスコアは血行性転移のリスクと相関を示すことが明らかになっています。(詳しくは587話参照)

図:血管内に侵入しようとしているがん細胞はアクチン制御タンパク質のMenaの発現が亢進している(①)。がん細胞が血管内に侵入する際には、血管新生を促進するアンジオポエチンの受容体のTie2を持つ血管周囲マクロファージ(腫瘍関連マクロファージの1種)の手助けが必要(②)。したがって、がん細胞が血管に侵入している部位には、Mena発現がん細胞とTie2発現マクロファージと血管内皮細胞の3つの細胞が存在する。この部位ががん細胞の血管侵入部位で、Tumor Microenvironment of Metastasis(転移の腫瘍微小環境)、略してTMEMと呼ばれる。
術前補助化学療法を行うと、原発乳がんの化学療法前に比べて、化学療法の後ではTMEM 密度が大きくなっていることが報告されています。つまり、「術前補助化学化学療法ががん転移を誘発する」可能性が指摘されています。したがって、腫瘍関連マクロファージのがん組織への動員や活性化の阻害は、がん細胞の転移の抑制にも有効です。
【白血球やマクロファージの移動はケモカインで制御されている】
免疫や炎症や創傷治癒などの生理機能の制御にはサイトカイン(cytokine)というタンパク質が重要な働きを担っています。
サイトカインはリンパ球や炎症細胞(マクロファージや好中球など)などから分泌され、細胞表面の膜上にある受容体に結合することによって、受容体に特有の細胞内シグナル伝達の引き金となり、極めて低濃度で生理活性を示します。
ケモカイン(chemokine)は細胞遊走活性を主機能とするサイトカインの一群で、様々な細胞の移動や局在を制御に関与している低分子量(8~12 kDa)のタンパク質です。
炎症性疾患や自己免疫疾患やHIV-1感染(エイズ)などの発症や病態に重要な役割を果たし、がん細胞の増殖や転移にも関与しています。
ケモカインがケモカイン受容体に結合すると受容体の種類に応じた細胞内シグナル伝達系が活性化され、細胞の移動や増殖や生存や遺伝子発現などが亢進されます。(下図)

図:ケモカイン受容体はGタンパク質に共役した7回膜貫通型の受容体(Gタンパク質共役受容体)で、これにケモカインが結合することによって細胞内のシグナル伝達系が活性化されて、細胞の移動や増殖の制御に関わる。多数のケモカインとケモカイン受容体が知られており、生体内で多彩な細胞の活動を制御している。
ケモカインはよく保存された4個のシステイン残基の配置からCXC、CC、XC、CX3Cの四つのサブファミリーに分類されます。CXCおよびCX3Cケモカインでは最初と2番目のシステイン残基の間に1個あるいは3個のアミノ酸残基が存在し、CCサブファミリーではそれらは連続しています。
全てのケモカインはGタンパク質共役受容体のケモカイン受容体を活性化して作用します。
現在までに、ケモカインは50種類程度、ケモカイン受容体は約20種類が見つかっており、その機能は極めて多彩で複雑です。
臓器や組織は恒常的あるいは炎症などの刺激によりケモカインを放出し、ケモカイン受容体を発現する細胞(リンパ球やマクロファージなど)はケモカインの濃度勾配や発現部位に従って移動(遊走)します。どのリンパ球がどの臓器に移行するかは,ケモカインと受容体の種類によって厳密に制御されています。
【腫瘍関連マクロファージはケモカインのCCL2で動員される】
ケモカインはサイトカインの一種で、白血球などの遊走を引き起こすタンパク質です。
がん組織からCCL2というケモカインが分泌されています。CCL2は別名を単球走化性タンパク質-1と言い、創傷部位やがん組織にマクロファージや単球を動員する作用があります。
がん組織に動員された腫瘍関連マクロファージはシクロオキシゲナーゼ-2(COX-2)から産生されるプロスタグランジンE2や、シグナル伝達兼転写活性化因子3(STAT3)の活性化によってM2型の腫瘍関連マクロファージになり、がん細胞の増殖や転移を促進します。(下図)

図:がん細胞からケモカインのCCL2が分泌され(①)、マクロファージのケモカイン受容体のCCR2に結合すると(②)、マクロファージはがん組織へと誘引され、腫瘍関連マクロファージとしてがん細胞の増殖を助ける(③)。腫瘍関連マクロファージはシクロオキシゲナーゼ-2(COX-2)から産生されるプロスタグランジンE2や、シグナル伝達兼転写活性化因子3(STAT3)の活性化によって(④)M2型の腫瘍関連マクロファージになり(⑤)、がん細胞の増殖や転移を促進する(⑥)。
【抗がん剤治療は腫瘍関連マクロファージを増やして増殖や転移を促進する】
高用量の抗がん剤治療が転移を誘発することは多くの研究で指摘されています。臨床経験的にも、抗がん剤治療で転移が促進されたのではと思われる例は多数あります。
高用量の抗がん剤投与によってがん組織が強くダメージを受けると、がん細胞やがん組織の間質にいる線維芽細胞(がん関連線維芽細胞)などからダメージを受けたがん組織を修復するため様々な炎症性サイトカインやケモカインや増殖因子などが産生されます。
炎症性サイトカインは免疫細胞や炎症細胞から分泌されるたんぱく質で炎症反応を制御に関わります。ケモカインはサイトカインの一種で、白血球などの遊走を引き起こして炎症反応に関わります。
ダメージを受けたがん組織からCCL2というケモカインが分泌されます。CCL2は別名を単球走化性タンパク質-1と言い、創傷部位やがん組織にマクロファージや単球を動員する作用があります。
CCL2はがん細胞に存在する受容体にも結合してがん細胞の増殖や生存や浸潤を亢進します。
がん組織がダメージを受けるとCXCL12というケモカインの産生も増えます。CXCL12は本来は炎症などにおいてリンパ球や造血幹細胞の移動に関与していますが、骨髄の血管内皮前駆細胞はこのケモカインの受容体を持っているので、ダメージを受けたがん組織から産生されるCXCL12によって血管内皮前駆細胞が骨髄からがん組織に動員されて血管新生が促進されることが報告されています。
がん関連線維芽細胞はCCL2やCXCL12のようなケモカインだけでなく、HGF(Hepatocyte Growth Factor)などの様々な増殖因子や活性酸素を産生することによってがん細胞の増殖や浸潤を促進しています。
このように、抗がん剤治療によって強いダメージを受けると、損傷を受けたがん組織のダメージを修復する目的でケモカインや増殖因子を産生してマクロファージや血管内皮前駆細胞を動員し、その結果、がん細胞の増殖や浸潤は促進され、がんはさらに悪化するという経過を辿ることになります。
これが、高用量の抗がん剤治療がうまくいかない理由の一つです。抗がん剤治療のターゲットはがん細胞だけでなく、間質の細胞(線維芽細胞やマクロファージなど)とがん細胞の相互作用についても十分に考慮することが重要です。
【断酒薬のジスルフィラムはがん組織内へのマクロファージの動員を阻害する】
飲酒するとエチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝されます。アセトアルデヒドは毒性が強く、細胞や組織にダメージを与え、二日酔いや発がんの原因になります。そこで体は、アルデヒド脱水素酵素によってアセトアルデヒドを無害な酢酸に変換しています。つまり、アルデヒド脱水素酵素はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があります。その結果、アセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくします。
アルコール中毒(アルコール依存症)の治療薬として認可され、60年間以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。

図:エチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝され、アセトルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。ジスルフィラムはアルデヒド脱水素酵素を阻害することによって、酒を飲めなくする。
ジスルフィラムはがんの代替医療でも使用頻度の高い薬です。医薬品再利用(Drug RepositioningあるいはDrug Repurposing)によるがん治療薬として代表的な医薬品の一つです。
多くの基礎研究でジスルフィラムの抗がん作用が明らかになっています。
このブロブでも5年前の416話(2014年12月5日)で最初に紹介して以降、ジスルフィラムの抗がん作用については頻回に話題にしています。
このジスルフィラムが腫瘍関連マクロファージのがん組織への動員を阻害することが最近報告されています。以下の論文は東京理科大学の研究グループからの報告です。
Targeting FROUNT with disulfiram suppresses macrophage accumulation and its tumor-promoting properties.(ジスルフィラムによるFROUNTの標的化は、マクロファージの蓄積とその腫瘍促進特性を抑制する)Nat Commun. 2020 Jan 30;11(1):609. doi: 10.1038/s41467-020-14338-5.
【要旨】
腫瘍関連マクロファージは、腫瘍の進行と免疫チェックポイント療法への抵抗に影響する。この研究では、ケモカイン・シグナルの制御因子であるFROUNTが、腫瘍関連マクロファージを制御するための標的になることを明らかにした。
がん患者におけるFROUNT発現の低さは、より良い臨床結果と相関する。
Frount欠損症は腫瘍の進行を著しく低下させ、マクロファージの腫瘍促進活性を低下させる。
FROUNTはマクロファージで高度に発現され、その骨髄特異的欠失は腫瘍の成長を抑制する。さらに、アルコール依存症治療薬のジスルフィラムは、FROUNTを強力に阻害する。
ジスルフィラムは、FROUNTのケモカイン受容体結合ドメインの特定の部位へ直接結合して、FROUNT-ケモカイン受容体の相互作用を妨害し、マクロファージの応答の阻害する。
ジスルフィラムの単独投与は、Frount欠損症の場合と同様に、腫瘍の進行を減少させ、マクロファージによる腫瘍促進活性を減少させる。さらに、ジスルフィラムと免疫チェックポイント抗体との併用治療は、相乗的に腫瘍の成長を阻害する。
したがって、ジスルフィラムによるFROUNTの阻害は、マクロファージを標的としたがん治療の有望な戦略を示唆している。
前述のように、CCL2は受容体CCR2を持つマクロファージをがん組織へと誘引し、誘引されたマクロファージは腫瘍関連マクロファージとしてがん細胞の増殖を助けるようになることが分かっています。
この研究グループは、2005年にマクロファージが体内を移動(遊走)する際に動きを制御する細胞内タンパク質としてFROUNT分子を発見、命名していました。
今回の研究では、このFROUNT分子の生体における機能を明らかにする中で、FROUNTを欠損させたマウスではがん細胞の増殖が弱まっていること、マクロファージの数や活性化も減少していることを見出しました。
ヒトにおいても、FROUNTの発現の低い患者さんでは、発現の高い患者さんと比較して手術後の予後が良いことがわかりました。
そこでFROUNTを標的とした新たな抗がん剤の開発を目指し、およそ13万種類の化合物について創薬スクリーニングを行った結果、既存のアルコール依存症治療薬のジスルフィラムがFROUNT分子内の特定の部位へ結合することで機能を阻害してマクロファージを調節して、がんを治療できることを発見し報告しました。
がん細胞に対するジスルフィラムの直接の抗腫瘍効果のメカニズムに関しては、がん幹細胞で過剰発現しているアルデヒド脱水素酵素を阻害する作用、酸化ストレスを高める作用、プロテアソームを阻害する作用など、多数の報告があります。
この論文では、がん組織において「がん細胞の増殖や転移の促進」や「抗腫瘍免疫の抑制」に関与している腫瘍関連マクロファージに対して、ジスルフィラムが抑制効果を示すという報告です。
この発見は、「新規なメカニズムによるがん治療法」や「安価な既存薬ががん治療に使える」という観点からインパクトはあります。
東京理科大学は1月30日にプレスリリースをしています。そのプレスリリースのタイトルは『アルコール依存症治療薬「ジスルフィラム」が新しい標的タンパク(FROUNT:フロント)を阻害してがんを抑制することを発見 ~世界初:マクロファージを調節する抗がん剤開発への新たな道~』となっています。
このプレスリリースの要旨は以下です。
・マクロファージはがんの悪化に影響するが、マクロファージを調節する抗がん薬はなく、標的分子の発見と制御方法の開発が求められていた。
・マクロファージの動きに関わる細胞内タンパク質FROUNTの働きを阻害することでがん組織へのマクロファージの集積や活性化を抑制し、がんの増殖を抑えられることが明らかになった。
・アルコール依存症治療薬「ジスルフィラム」がFROUNTを阻害し、がんを抑制できることが見出された。また、既存の免疫チェックポイント療法との併用により、同療法の効果が出にくいがん細胞の増殖も抑えられることが明らかになった。
・本研究の成果はNature Communications 2020年1月30日オンライン版に掲載された。
マクロファージはがんを悪化させるので、この腫瘍関連マクロファージをターゲットにすると新規のがん治療薬になるというアイデアです。
マクロファージの動きに関わる細胞内タンパク質FROUNT(フロント)の働きを阻害することで、がん組織へのマクロファージの集積や活性化を抑制し、がんの増殖を抑えられることが確認できたという報告です。
FROUNTの阻害剤として約13万種類の化合物をスクリーニングし、既存薬のジスルフィラムにその阻害作用が見つかったということですので、ジスルフィラムの効果が期待できます。
詳しい内容は東京理科大学のプレスリリースのサイト(https://www.tus.ac.jp/mediarelations/archive/20200130009.html)をご参照ください。
ジスルフィラムは欧米など外国ではがんの代替療法ではかなり使用されています。
私自身、がんの代替療法として5年くらい前からジスルフィラムを100人以上の進行がん患者さんに使用していますが、確かに効いているという手応えは感じています。
飲酒できないという点だけが欠点ですが、飲酒しなければ副作用はほとんど経験しません。
また、パクリタキセルなど、いくつかの点滴の抗がん剤は、溶解するためにエタノールを使用しているものもあるので、点滴の抗がん剤治療ではアルコールを使っていないことを確認する必要があります。
また、M2型の腫瘍関連マクロファージは抗腫瘍免疫を抑制する作用があります。したがって、ジスルフィラムで腫瘍関連マクロファージを減らすとオプジーボなどの免疫チェックポイント阻害剤の効き目を高める効果が期待できます。
免疫チェックポイント阻害剤とジスルフィラムとの併用療法の有効性に関して臨床試験を行っていると報告しています。
このプレスリリースでは「マクロファージを調節する抗がん薬はない」と言っていますが、医薬品の再利用によるがん代替療法の分野では、腫瘍関連マクロファージをターゲットにした薬はいくつか知られています。
例えば、骨転移の治療薬のゾレドロン酸は破骨細胞の働きを阻害して骨を強くする薬ですが、破骨細胞はマクロファージの一種であることから、がん組織中の腫瘍関連マクロファージの抑制によるがん治療にも試みられています。つまり、ゾレドロン酸ががん組織のマクロファージを消滅させて抗腫瘍効果を発揮するという報告があります。
シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)はM1型の腫瘍関連マクロファージをM2型に変換します。
したがって、COX-)阻害剤のcelecoxib(セレコックス)とSTAT3を阻害するオーラノフィンの併用はM2型の腫瘍関連マクロファージの活性抑制に有効です。
【シクロオキシゲナーゼ-2はM2型の腫瘍関連マクロファージを増やして抗腫瘍免疫を抑制する】
活性化したマクロファージとがん細胞はともにシクロオキシゲナーゼ-2(COX-2)の活性が亢進しています。COX-2活性亢進はプロスタグランジンE2(PGE2)の産生を増やします。PGE2はがん細胞におけるPD-L1の発現を亢進して細胞傷害性T細胞(キラーT細胞)の活性を阻害します。
細胞傷害性T細胞は抗原提示細胞(樹状細胞やマクロファージ)から抗原を提示されると活性化されて、敵(病原菌やがん細胞など)を攻撃します。
細胞傷害性T細胞にはPD-1という受容体が存在します。PD-1はプログラム細胞死1(programmed death-1)の略です。
PD-1にリガンド(受容体に結合して作用する物質)となるPD-L1を抗原提示細胞が持つことによって細胞傷害性T細胞の働きを抑制しています。
つまり、PD-1受容体がPD-L1によって刺激されると、T細胞の増殖が停止し細胞死を来すことになります。このようにして細胞傷害性T細胞の過剰な応答を制御しています。
細胞傷害性T細胞の働きを阻害するPD-L1はがん細胞にも発現しています。つまり、がん細胞は免疫系の制御システムを利用して、がん組織内の細胞傷害性T細胞の働きを阻止しています。プロスタグランジンE2はがん細胞におけるPD-L1の発現を亢進することによって細胞傷害性T細胞の働きを阻害します。(下図)

図:抗原提示細胞上にはMHCクラスII(MHC-II)といわれる分子があり、抗原を介してT細胞上のTCR(T細胞受容体)と反応して細胞傷害性T細胞を活性化する(①)。PD-1(Programmed death-1)は抗原提示細胞のPD-L1と結合することによって抑制型の免疫調節シグナルを活性化させる(②)。がん細胞もPD-L1が発現しており、細胞傷害性T細胞の働きを抑制している(③)。プロスタグランジンE2(PGE2)はがん細胞のPD-L1の発現を亢進して細胞傷害性T細胞の働きを抑制する(④)。
また、PGE2はT細胞を動員するケモカインのCXCL9の働きを阻害することによってT細胞の腫瘍内への動員を阻止しています。
また、PGE2はM1型マクロファージを阻害し、M2型マクロファージの活性を亢進します。その結果、CTL(細胞傷害性T細胞)の活性は抑制され、抗腫瘍免疫は低下します。したがって、COX-2阻害剤のcelecoxib(商品名:セレコックス)は抗腫瘍免疫を高める効果が期待できます。

図:がん組織内のマクロファージやがん細胞はシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進し、プロスタグランジンE2(PGE2)の産生が増えている。PGE2によってM2型に誘導されたマクロファージ(M2)は細胞傷害性T細胞(CTL)の活性を抑制する(①)。M1型マクロファージはヘルパーT細胞タイプ1(Th1)を活性化してCTLの働きを亢進する(②)。しかし、PGE2はマクロファージのM1型への移行を阻害するので、PGE2はM1型マクロファージとTh1の阻害を介してCTLを抑制する(③)。PGE2はcolony stimulating factor-1受容体(CSF-1R)の発現を亢進してマクロファージのがん組織への集積を促進する(④)。がん細胞ではPGE2がPD-L1(Programmed Death-1 ligand)の発現を亢進する(⑤)。PD-L1はCTLのPD-1(Programmed Death-1)に作用してCTLの活性を抑制する(⑥)。PGE2は局所にT細胞を動員するケモカインのCXCL9の発現を抑制することによって、がん組織へのT細胞の移動・集積を阻害する(⑦)。PGE2はナチュラルキラー(NK)細胞の活性を阻止する(⑧)。以上のような様々なメカニズムでCOX-2は抗腫瘍免疫を抑制している。COX-2阻害剤のcelecoxib(セレコックス)はCOX-2活性を阻害することによって抗腫瘍免疫を亢進する効果がある(⑨)。(参考:Oncoimmunology. 2014 Jun 30;3:e29287. eCollection 2014.)
【オーラノフィンはSTAT3を阻害する】
STAT3は、STAT (Signal Tranducer and Activator of Transcription:シグナル伝達兼転写活性化因子) ファミリーに属する蛋白質で、その名の通り、「シグナル伝達」と「遺伝子転写活性化」の両方において働きます。
STAT3は非活性化状態においては細胞質に存在しますが、ヤーヌスキナーゼ(Janus Kinase; JAK)が活性化されることによってリン酸化を受け、核内へ移行して目的遺伝子を活性化する転写因子として機能します。
JAKはサイトカイン受容体のサブユニットとして存在し、チロシンをリン酸化する酵素(チロシンキナーゼ)の一種です。
IL-6ファミリーのサイトカインあるいは上皮成長因子(EGF)等の成長因子がそれらの受容体に結合することによりヤーヌスキナーゼ(JAK)が活性化されると、活性化されたJAKがSTAT3のチロシン705をリン酸化します。
チロシン705がリン酸化されたSTAT3二分子のSH2ドメインがそれぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行し、核内に移行したSTAT3二量体は標的となるDNAに結合する事で転写を活性化します。これをJAK-STAT経路と言います。
STAT3のリン酸化はJAKを介する以外に、増殖因子や成長因子の受容体が直接リン酸化する場合や、Srcなどの非受容体性チロシン・キナーゼによっても起こります。つまり、様々な細胞刺激に応答してSTAT3がリン酸化されて、増殖や生存を促進する作用を発揮します(下図)。

図:JAK(Janus Kinase;ヤーヌスキナーゼ)はサイトカイン受容体のサブユニットとして存在し、チロシンをリン酸化するチロシンキナーゼ活性を持つ。IL-6や上皮成長因子(EGF)などの受容体が刺激されるとJAKが活性化されてSTAT3がリン酸化される。STAT3のリン酸化は受容体性チロシンキナーゼや非受容体性チロシンキナーゼ(Srcなど)でも起こる。STAT3は不活性な状態では細胞質に存在し、JAK(ヤーヌスキナーゼ)などでチロシン705がリン酸化されると、STAT3二分子のSH2ドメインが、それぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行する。核内に移行したSTAT3二量体は、標的となるDNAに結合する事で転写を活性化する。STAT3は細胞をアポトーシス抵抗性にするBcl-2やBcl-XL、細胞周期を促進するサイクリンD1(Cyclin D1)などの遺伝子発現を誘導することによってがん細胞の増殖や転移を促進する。
オーラノフィン(Auranofin)は、関節リュウマチの治療に使われる経口金製剤です。通常、非ステロイド抗炎症剤を使用しても効果がないときに使われます。
最近、オーラノフィンの抗腫瘍効果が注目されており、米国ではがん治療へのオーラノフィンの効果を検討する第2相臨床試験の実施がFDA(食品医薬品局)から承認されています。
オーラノフィンの抗腫瘍作用のメカニズムとして様々な作用が報告されていますが、特にチオレドキシン還元酵素の阻害による抗がん剤作用が注目されています。これに関しては424話で解説しています。
オーラノフィンがSTAT3の活性化を阻害する作用が報告されています。つまり、オーラノフィンの抗炎症作用と抗がん作用の共通の作用メカニズムとしてSTAT3の阻害作用が提唱されています。以下のような報告があります。
Auranofin blocks interleukin-6 signalling by inhibiting phosphorylation of JAK1 and STAT3.(オーラノフィンはJAK1とSTAT3のリン酸化を阻害することによってインターロイキン-6シグナル伝達系を阻害する)Immunology. 122(4):607-14.2007年
【要旨】
オーラノフィンはイオウ含有の金製剤で、抗炎症作用と免疫抑制作用を有し、関節リュウマチの治療薬として広く使用されている。しかしながら、その作用機序については十分に解明されていない。オーラノフィンの抗炎症作用の作用メカニズムを解明する目的で、インターロイキン-6(IL-6)に対する細胞応答に対するオーラノフィンの作用を検討した。
ヒト肝臓がん細胞HepG2を用いた実験で、オーラノフィンはIL-6によるヤーヌスキナーゼ1(JAK1)とSTAT3のリン酸化と、STAT3の核への移行を阻害した。
この実験結果と一致して、オーラノフィンはIL-6で産生が誘導されるハプトグロビン、フィビリノーゲン、補体C3、α1-酸性糖タンパク質などの急性期タンパク質(炎症の急性期に肝臓から産生されるタンパク質)の産生、および血管内皮細胞増殖因子の遺伝子発現を抑制した。これらの遺伝子の転写活性はSTAT3によって活性化されることが知られている。
関節リュウマチ患者の滑膜細胞、ヒトの𦜝帯静脈の血管内皮細胞、ラットのアストロサイトを使った実験でも、オーラノフィンによるSTAT3のリン酸化の阻害作用が確認された。
オーラノフィンによるSTAT3リン酸化の阻害作用は、チオール基をもつ抗酸化剤を添加することによって減弱した。
これらの結果は、オーラノフィンの抗炎症作用にはJAK1/STAT3シグナル伝達系の阻害作用が関与していることを示唆している。この作用にはチオール基反応性のタンパク質がJAK1/STAT3リン酸化に関与していることを示唆している。
オーラノフィンはチオレドキシン還元酵素を阻害する作用があります。
チオレドキシン(Thioredoxin: Trx)は、分子内に酸化還元活性を有するSH基(チオール基)を持つ抗酸化酵素です。
還元型チオレドキシンは、酸化された標的タンパク質に結合し、標的タンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身の チオール基は酸化されます。酸化型チオレドキシンは、NADPHの存在下でチオレドキシン還元酵素の作用により還元され、 再び還元型に戻ります(下図)。

図:チオレドキシンは-Cys-Gly-Pro-Cys-という大腸菌から哺乳類までよく保存された活性部位を持ち、この活性部位の2つのシステイン基の間でジスルフィド(S-S)結合を作る酸化型とジチオール(-SH-SH)を作る還元型が存在する。還元型チオレドキシンは、酸化された標的タンパク質に結合して標的タンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身のチオール基(-SH)は酸化されてジスルフィド(S-S)になる。酸化型チオレドキシンは、NADPHの存在下でチオレドキシン還元酵素の作用により還元され、再び還元型に戻る。NADPHはペントースリン酸回路で産生される。オーラノフィンはチオレドキシン還元酵素を阻害する。
つまり、チオール基(-SH)をもつタンパク質がJAK/STAT3の活性化に関与しており、オーラノフィンのJAK/STAT3活性化阻害作用はチオレドキシン還元酵素阻害作用が関与していることを示しています。これはチオール基をもつ抗酸化剤(N-アセチルシステインやグルタチオン)を添加するとオーラノフィンのJAK1/STAT3活性化阻害作用が阻止されたことから示されています。

図:STAT3(シグナル伝達兼転写活性化因子-3)は不活性な状態では細胞質に存在する。IL-6や成長因子(EGFなど)などの受容体が刺激されたり、非受容体性チロシンキナーゼの活性化によってSTAT3がリン酸化されると、STAT3は二量体を形成して核内に移行する。核内に移行したSTAT3二量体は、標的となるDNAに結合する事で標的遺伝子の転写を活性化する。STAT3は細胞をアポトーシス抵抗性にするBcl-2やBcl-XL、細胞周期を促進するサイクリンD1(Cyclin D1)などの遺伝子発現を誘導することによってがん細胞の増殖や転移を促進する。関節リュウマチの治療薬である有機金化合物のオーラノフィンはSTAT3の活性化や炎症細胞の活性化を阻害する作用があり、がん細胞の増殖や転移を予防する効果が報告されている。
オーラノフィンのSTAT3阻害作用の詳細については427話で解説しています。
以上の観点から、がん治療以外で使用されている既存薬のジスルフィラムとcelecoxib(セレコックス)とオーラノフィンの3種類の組み合わせは、腫瘍関連マクロファージの動員や活性を阻害することによって、がん細胞の増殖や転移を抑制し、さらに抗腫瘍免疫を増強して、がん治療に役立つ可能性が高いと言えます。
| « 686)メトホル... | 688) 腫瘍関連... » |



