がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
416) 再開発医薬品の組合せによる「体にやさしいがん治療」
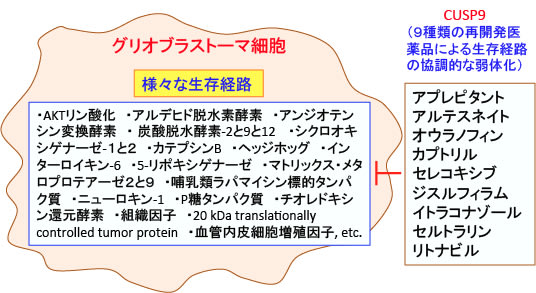
図:グリオブラストーマ(神経膠芽腫)で活性化されている様々な生存経路(増殖シグナル伝達系や因子)の阻害作用がある9種類の既存の医薬品(再開発医薬品)を用いた治療がCUSP9(Coordinated Undermining of Survival Paths with Nine repurposed drugs)という名称で報告されている。このCUSP9は「9種類の再開発医薬品による生存経路の協調的な弱体化」という意味であり、個々の薬の抗腫瘍効果は弱くても、グリオブラストーマ細胞の生存に必須の増殖シグナル伝達系や因子を阻害する医薬品(がん以外の治療で使用されている医薬品)を組み合せることによって抗腫瘍効果を得ることができる可能性が示唆されている。このような副作用の少ない再開発医薬品の組合せによる治療は「体に優しいがん治療」として期待できる。
416) 再開発医薬品の組合せによる「体にやさしいがん治療」
【抗がん剤治療の副作用は年々増強している?】
データがあるわけでもなく実際はどうなのか判りませんが、私の経験では、抗がん剤の副作用で苦しんでいる人が増えているように感じます。
抗がん剤治療では、がん組織の縮小効果を高めるためには副作用が強くなっても仕方ないと考えています。患者さんが死なない範囲で、がん細胞に最大限のダメージを与えるのが、がん治療として最も効果があると考えています。
そのため、より抗がん作用(がん縮小効果)の強い薬剤の開発や、複数の抗がん剤を組み合わせるプロトコールが行われています。がん縮小効果を高めるために、抗がん剤治療の攻撃力を高める方向で年々エスカレートしているように思います。
副作用が強くても、延命効果があれば治療法として認められます。しかし、これは副作用で苦しむ期間が延びることも意味します。
以前は数ヶ月程度の延命効果しかなかったのが、最近ではがんの種類によっては数年間の延命効果が期待できるように抗がん剤治療も進歩しています。生存期間が延びることは良いことですが、副作用に対する有効な治療法は乏しいため、副作用で苦しむ人が増えることになります。
抗がん剤が少なかった頃は数ヶ月で効かなくなって治療が終了していたのが、現在では効かなくなれば他の抗がん剤に切り替え、使える抗がん剤が増えたため数年間にわたって治療が継続され、副作用で苦しむ人が増えるという結果になります。
抗がん剤による末梢神経障害に対する治療を希望する患者さんの数は以前に比べてかなり増えています。抗がん剤による末梢神経障害に対する有効な治療法はないのですが、症状を軽減したり、回復を促進する漢方薬やサプリメントの相談は多くなっています。
また、「あの副作用は二度と経験したくないので抗がん剤は拒否している」というように、抗がん剤治療を経験した人が、再発などで再度抗がん剤治療を提案されたとき、以前の副作用の苦痛があまりに強かったので、抗がん剤だけは受けたくないというという理由で、代替医療の相談に来られる患者さんが増えています。
以前は、抗がん剤治療が効かなくなって主治医から匙を投げられたから「何か方法はないか」というのが代替医療を相談に来られる患者さんの理由として多かったのですが、最近は「抗がん剤治療は受けたくないから」という理由が増えています。
【副作用の少ない抗がん剤治療の開発が困難な理由】
従来の抗がん剤は細胞分裂している細胞をターゲットにしているため、がん細胞と同時に細胞分裂している正常細胞(骨髄細胞や消化管粘膜細胞など)も死滅し、白血球減少や体力・食欲の低下、胃腸障害などの副作用が避けられませんでした。
最近は、がん細胞で異常を起こしている増殖因子や増殖シグナルの伝達系をターゲットにした分子標的薬が開発されていますが、これらの分子標的薬もがん細胞に完全に特異的ではないため、がん細胞に効く量を投与すれば、正常細胞の機能にも影響してかなりの副作用がでます。
このように副作用の強い抗がん剤しか開発されないのは、抗がん剤の開発や認可の仕組みに起因すると思います。
抗菌薬や抗ウイルス薬の開発では、人間と細菌やウイルスは細胞の構造や細胞を増やすメカニズムがかなり異なるため、人間には全く作用せず、細菌やウイルスの増殖を止めたり死滅させる薬を開発することは比較的容易です。
しかし、がん細胞は正常細胞が遺伝子異常の蓄積などで細胞分裂や細胞死の制御に異常を起こして生じた細胞であるため、細胞の成分やエネルギー産生や物質代謝や細胞分裂の仕組みは基本的に正常細胞と同じです。ただ、その制御に異常を起こっているだけなので、がん細胞と正常細胞の根本的な違いは極めてわずかです。
つまり、正常細胞とがん細胞の違いがわずかなので、がん細胞の特異性の高い抗がん剤の開発は難しいということになります。
しかし、抗がんとして認可されるためには、その薬単独で抗腫瘍効果(腫瘍縮小効果)を証明する必要があります。
将来的に、複数の抗がん剤と組み合わせて使われることが主体になる薬でも、最初に抗がん剤として認可されるためには、単独で腫瘍縮小効果を証明する必要があります。
がん細胞と正常細胞の違いはわずかであるため、がん細胞の増殖や生存を抑制する効果を証明できる薬は、多くの場合、正常細胞に対しても毒性を示すものになってしまいます。
そのため、抗がん剤治療の目的で開発された抗がん剤の多くは副作用が強いものしか認可されず、保険診療で認可されている抗がん剤を使えば、必然的に副作用で苦しむことは避けられないということになっています。
【日本はメリットの少ない抗がん剤の使用が多い?】
日本では、国民皆保険制度や高額療養費制度などによって、1ヶ月に何百万円もする抗がん剤治療でも自己負担は数万円ですむので、気兼ねなく高額な新薬が使用されています。
医者も、新しく開発された高額な薬をどんどん使うのが患者のためだと考え、高額な抗がん剤を多く使うのが最先端だと考えています。
製薬産業の言いなりになって、高額な医薬品を何の躊躇もなく使う傾向が強いのが日本のがん治療の現状です。
抗がん剤に関しては「効く、効かない」という議論が最も重要ですが、「費用対効果」の観点からの議論も重要です。苦しい副作用を伴った数ヶ月の延命のために何十万円、何百万円の医療費を使うことが本当に意味があるのか疑問です。
既存の医薬品から抗がん剤をスクリーニングする「医薬品再開発(Drug Repositioning):400話参照」や、安価な抗がん剤を使って有効性を高める「メトロノミック・ケモテラピー(397話参照)」は、医療費を減らす目的で多くの国で研究が行われていますが、日本ではほとんど注目されていません。そのような研究を行う理由もインセンティブもないからです。高価な新薬を多く使う方が患者さんのためだと考えているからです。
医療の費用対効果を評価する指標にQALY(質調整生存率、Quality-adjusted Life Year)があります。これは「生活の質を調整した生存年」のことで「生活の質 x 生存年数」で決められます。生活の質についてはEQ-5Dという5項目からなる患者さんへのアンケート結果を数値化したものを使います。
生活の質を低下させずに1年間延命すれば1QALYになります。生活の質が半分になっても2年間延命すれば1QALYになります。
英国の保険制度では、QALY(生活の質を落とさずに1年間延命)あたり2万~3万ポンド(今日の為替レートで380~570万円程度)を目安にして、それ以上の高額な(費用対効果が悪い)医薬品は保険で償還しないというルールがあります。
例えば、副作用の多い最大耐用量を投与する抗がん治療で、生活の質が半分になって6ヶ月の延命効果がある薬の場合、QALYは0.25であるため、この治療での6ヶ月間の薬剤費が7500ポンド(約140万円)を超えると保険で償還されないことになります。
このようなルールは患者さんが新薬の恩恵を得られないという問題がありますが、医療費高騰を避けるためには、仕方ないという考えです。
そのため、日本で普通に使われているような分子標的薬が、英国ではかなりの数が保険償還が承認されていません。
日本では医療費の高騰が問題になっていますが、国民皆保険制度と高額療養費制度があるために、日本では治療の費用対効果について医者も患者さんも真剣に考えないことが一番の原因のように思います。
【副作用の少ない安価な薬の組合せによるがん治療】
単独での抗腫瘍効果は弱くても、組み合わせることによって強い抗腫瘍効果を発揮できる薬もありますが、このような薬は抗がん剤としては認可されることはありません。
しかし最近、このような効果の弱いが抗腫瘍効果が期待できる医薬品やサプリメントを組み合わせてがん治療を行う研究が多く報告されるようになりました。
その理由の一つは、抗がん剤の新薬があまりに高額なわりに、延命効果も少なく、副作用も強いためです。例えば、次のような論文があります。
A conceptually new treatment approach for relapsed glioblastoma: coordinated undermining of survival paths with nine repurposed drugs (CUSP9) by the International Initiative for Accelerated Improvement of Glioblastoma Care.(再発したグリオブラストーマに対する概念的に新規の治療アプローチ:グリオブラストーマの治療成績の改善を促進するための国際的取組みによる9種類の再開発医薬品による生存経路の協調的な弱体化)Oncotarget 4(4):502-30, 2013
「repurposed drugs」というのは医薬品再開発によって新たな薬効(この場合は抗腫瘍効果)が見つかった薬です。
例えば、がん治療以外の目的で開発された何千種類という既存の薬から、抗がん作用を有する物質を探索する研究が行われており、そのような研究を医薬品再開発(Drug Repositioning あるいはDrug Repurposing)と言います。(400話参照)
グリオブラストーマ(神経膠芽腫)は極めて治療が困難で予後不良の悪性腫瘍です。再発するとほとんどが余命1年以内です。再発したグリオブラストーマの治療成績を高める目的で再開発医薬品の組合せの効果が検討されているという話です。米国のバーモント大学の研究者を中心とした国際的な取組みが行われているようです。
「coordinated undermining of survival paths(生存経路の協調的な弱体化)」というのは、がん細胞の生存のための様々なシグナル伝達系や因子(生存経路)を、9種類の再開発医薬品を組み合せて用いることによって阻害することを意味しています。
以下にこの論文の要旨を記載します。
【要旨】
再発したグリオブラストーマにおける治療成績を改善するために、従来の細胞毒性のある抗がん剤の組合せに基づく治療法でなく、他の病気の治療薬として使用されていて安全性が高く使用経験の長い既存の医薬品を組み合わせる治療法の確立を目指した。
この治療法で使用する医薬品は、a)薬理学的に十分に研究されている、b)正常細胞に対する毒性が少なく患者に投与して副作用が起こりにくい、c)グリオブラストーマの増殖を促進する良く知られている経路や因子に対して阻害作用を示す根拠がある、d)組み合わせることによってグリオブラストーマの増殖を阻害する効果が相乗的に高まる可能性がある、という4つ基準を満たすものを用いた。
これらの基準に合致する9種類の医薬品を見つけ、再発したグリオブラストーマに標準治療であるStuppプロトコール(Stupp Protocol:放射線治療と低用量のテモゾロマイドの連日服用の組合せの治療法)で治療を行ったあとに、さらにテモゾロマイドの低用量連日投与に加えて、これらの医薬品を併用する治療法を提案した。
この9種類の医薬品の組合せはCUSP9(Coordinated Undermining of Survival Paths;「生存経路の協調的弱体化」)と名付けられ、アプレピタント(aprepitant)、アルテスネイト(artesunate)、オウラノフィン(auranofin)、カプトリル(captopril)、 グルコン酸銅(copper gluconate)、ジスルフィラム(disulfiram)、ケトコナゾール(ketoconazole)、 ネルフィナビル(nelfinavir)、セルトラリン(sertraline)が、低用量のテモゾロマイドの連日投与の治療に追加された。
この論文では、個々の薬がどのようにグリオブラストーマの増殖を抑制し、テモゾロマイドによる治療に対してグリオブラストーマ細胞が抵抗するメカニズムをこれらの薬がどのように阻止するかを考察した。
これらの薬の相互作用のリスクと、これらの薬の組合せが生活の質(QOL)と全生存率の両方を高めることができるかを解説した。
この論文で報告された医薬品はがん治療以外で使用されてますが、がん細胞の増殖を抑制する作用が報告されています。そして多くは比較的安価です。
アプレピタント(aprepitant)はニューロキニン-1(NK-1)受容体拮抗薬で、制吐剤として、抗がん剤に伴う悪心・嘔吐の治療に用いられています(商品名:イメンド)
アルテスネイト(Artesunate)は抗マラリア薬で、がん細胞の多く含まれる鉄と反応して活性酸素を産生してがん細胞の酸化ストレスを高めてがん細胞を死滅させます。(251話参照)
オウラノフィン(auranofin)は慢性関節リュウマチの治療に使われる金製剤(商品名:リドーラ)です。チオレドキシン還元酵素(thioredoxin reductase)を阻害してがん細胞の酸化ストレスを高める作用によってジスルフィラムの抗腫瘍効果を増強します。
カプトリル(captopril)はアンジオテンシン変換酵素阻害薬(ACE阻害薬)と呼ばれる降圧剤です。
ジスルフィラム(disulfiram)はアルデヒドデヒドロゲナーゼを阻害する作用によって断酒薬として使用されています。がん幹細胞はアルデヒドデヒドロゲナーゼの発現と活性が亢進していることが知られており、その阻害剤の抗腫瘍効果が注目されています。
ケトコナゾール(ketoconazole)はイミダゾール系抗真菌剤で、真菌の細胞膜合成を阻害することにより、抗真菌作用を示します。
ネルフィナビル(nelfinavir)はプロテアーゼ阻害剤でHIV感染症(エイズ)の治療薬です。
セルトラリン(sertraline)は選択的セロトニン再取込阻害薬とよばれる薬で抗うつ作用や抗不安作用があります。
この論文の発表のあと、欧州ではケトコナゾールとネルフィナビルが製造中止になったので、新しいプロトコールではケトコナゾールの代わりにイトラコナゾール(itraconazole)、ナルフィナビルの代わりにリトナビル(ritonavir)が入っています。
ジスルフィラムと銅がキレート(結合)したものが抗腫瘍効果を発揮するという報告から、ジスルフィラムの抗腫瘍効果を高める目的でグルコン酸銅(copper gluconate)が加えられていますが、その後の研究で、胃内でジスルフィラムは銅とキレートすることが報告されたので、新しいプロトコールではグルコン酸銅は省かれています。その代わりにCOX-2阻害剤のcelecoxibが新しく加わっています。
この論文に続いて次のような論文(同じ研究グループからの報告)が今年出ています。
CUSP9* treatment protocol for recurrent glioblastoma: aprepitant, artesunate, auranofin, captopril, celecoxib, disulfiram, itraconazole, ritonavir, sertraline augmenting continuous low dose temozolomide.(再発グリオブラストーマに対するCUSP9治療プロトコール:持続低用量テモゾロマイド治療の効果を高めるアプレピタント、アルテスネイト、オウラノフィン、カプトリル、 セレコキシブ、ジスルフィラム、イトラコナゾール、 リトナビル、セルトラリンの組合せ)Oncotarget. 5(18):8052-82.2014年
米国のバーモント大学とドイツのウルム大学の研究グループからの報告です。
【要旨】
再発グリオブラストーマに対するCUSP9治療プロトコールを1年前に報告した。今回、このプロトコールに少しの修正を加え、CUSP9*と命名した。
CUSP9*はアプレピタント(aprepitant)、アルテスネイト(artesunate)、オウラノフィン(auranofin)、カプトリル(captopril)、 セレコキシブ(celecoxib)、ジスルフィラム(disulfiram)、イトラコナゾール(itraconazole)、 セルトラリン(sertraline)、リトナビル(ritonavir)の9種類の薬の組合せで、これらは全て国で認可されており、がん以外の治療目的で広く使用されている。
個々の薬は、グリオブラストーマの生存や増殖を促進する経路の一つあるいは幾つかを阻害する作用がある。このような生存のために経路を阻害することによって、グリオブラストーマに対する標準的な抗がん剤治療の効果を高めることができる。
一度に9種類もの多くの薬を使うことに抵抗があるかもしれないが、CUSP9*のオリジナルの組合せ(CUSP9)での経験から、副作用が少なく十分に使用可能である。
これらの薬の組合せは、AKTリン酸化、アルデヒド脱水素酵素、アンジオテンシン変換酵素、 炭酸脱水酵素-2と9と12、 シクロオキシゲナーゼ-1と2、カテプシンB、ヘッジホッグ、インターロイキン-6、5-リポキシゲナーゼ、マトリックス・メタロプロテアーゼ2と9、哺乳類ラパマイシン標的タンパク質、にゅーろきん-1、P糖タンパク質、チオレドキシン還元酵素、組織因子、20 kDa translationally controlled tumor protein、血管内皮細胞増殖因子のシグナル伝達経路や活性を阻害する
グリオブラストーマは再発すると予後が極めて悪いので、CUSP9*の臨床試験を実施する価値がある。
つまり、それぞれ単独では抗腫瘍効果が弱くても複数の薬を組み合せることによって、グリオブラストーマの生存や増殖に働いている複数の経路や因子を阻害して、治療に役立てることが可能かもしれないという話です。
この論文で報告されている再開発医薬品はがんの補完・代替医療では既に利用されており、有効性や安全性に関する論文も増えています。
再開発医薬品の研究結果は「体にやさしいがん治療」の実践に役立ちます。
(詳しくはこちらへ)
新刊紹介:膠芽腫(グリオブラストーマ)の根治を目指す補完・代替医療
本書はプリント・オン・デマンド(Print on Demand)という出版形式で書店では販売していません。アマゾンからの購入になります。
アマゾンからの購入はこちらへ:
| « 415)VDAC-1とヘキソキナ... | 417)がん細胞... » |





