がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
894)がん細胞のフェロトーシス誘導(その1):アルテスネイト

図:がん細胞はトランスフェリン受容体の発現が多く、細胞内に鉄を多く取り込んでいる(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し、これは鉄イオンやヘムと反応して(②)、活性酸素を発生する(③)。鉄イオンを介してがん細胞内で多量に発生した活性酸素は、細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、細胞死(フェロトーシス)を誘導する(④)。正常細胞は鉄の含有量が少ないのでアルテスネイトによる酸化傷害を受けない(⑤)。
894)がん細胞のフェロトーシス誘導(その1):アルテスネイト
【アルテスネイトの抗がん作用は1990年代から注目されていた】
アルテスネイト(Artesunate)はマラリアの治療薬です。この薬ががん細胞を死滅するという基礎研究は1990年代から報告され、人間でも効果を認めた症例が報告されていました。
がん細胞は鉄を多く含み、鉄とアルテスネイトが反応してフリーラジカルを産生してがん細胞を死滅します。正常細胞は鉄の含有量が少ないので傷害を受けず、がん細胞が選択的に死滅します。鉄介在性のフリーラジカル産生によって細胞死を誘導するのです。
2012年に米国のコロンビア大学の研究グループが鉄依存性の細胞死に対してフェロトーシス(Ferroptosis)という用語を提唱しました。フェロトーシスは、細胞内で鉄介在性に活性酸素やフリーラジカルが発生し、細胞膜の脂質の過酸化が生じて細胞膜が破綻して誘導される細胞死です。
アルテスネイトの抗腫瘍効果はフェロトーシスという特殊な細胞死の誘導であることが明らかになりました。アルテスネイト単独では抗がん作用に限界がありますが、細胞内の抗酸化システムを阻害する方法や、がん細胞内に活性酸素の産生を増やす方法を併用することによってアルテスネイトのフェロトーシス誘導作用を強化できることが明らかになりました。
がん治療におけるフェロトーシス誘導剤に関しては多くのがん研究者が注目しています。多くの製薬企業がフェロトーシス誘導作用のある新薬の開発を行っています。製薬企業にとっては特許の取れる新規の物質でないと利益が得られません。しかし、すでに使用できる安価な医薬品やサプリメントなどを組み合わせることによって、がん細胞に選択的にフェロトーシスを誘導することができます。
この治療法の有効性と安全性は多くの症例で確認しています。大きな腫瘍塊となった乳がんの患者さんにこの治療法を使って、がん組織が崩壊するように縮小した例もあります。
【活性酸素を増やすとがん細胞は死滅する】
細胞のエネルギーであるATP(アデノシン3リン酸)は細胞質の解糖系とミトコンドリアでの呼吸鎖(酸化的リン酸化)によって産生されます。
解糖系では酸素を使わずに、グルコース1分子当たり2分子のATPを産生します。ミトコンドリアの酸化的リン酸化では酸素を使ってグルコース1分子当たり32分子のATPを産生できます。
正常細胞においては、ミトコンドリアにおける物質代謝やエネルギー産生過程は整然とコントロールされており、活性酸素の発生は最小限に抑えられています。
一方、がん細胞ではミトコンドリアに様々な異常が起こっています。ATPを産生する呼吸鎖にも異常が起こっており、酸素を使ったエネルギー産生過程で大量の活性酸素が産生されやすくなっています。これは、排気ガス処理装置が壊れた自動車が排気ガスをまき散らすのと同じ状態です。
つまり、がん細胞ではミトコンドリアでの酸素消費を増やせば活性酸素の産生が増えて、酸化ストレスによって細胞が強いダメージを受け、自滅するリスクが高くなります。
がん細胞では酸化ストレスの増加を防ぐために、酸素を使わない解糖系でのエネルギー産生を増やしています。酸素が十分に利用できる条件でも解糖系でのATP産生を増やし、酸素を使ったミトコンドリアでのATP産生を抑制している理由の一つは、酸化ストレスを高めたくないからです。
ミトコンドリアでのエネルギー産生を抑制するため、効率の悪い解糖系でエネルギー産生を行う必要があるために、グルコースの取込みと解糖系の亢進が起こっているということになります。
またグルコース-6-リン酸からのペントース・リン酸経路での代謝も亢進しており、この系で産生されるNADPHが細胞内の酸化ストレスを軽減するために利用されます。つまり、がん細胞はミトコンドリアでの酸素呼吸を抑制することによって活性酸素の発生を防ぐ必要があるため、必然的に酸素を使わない解糖系の活性が亢進しているのです。(図)

図:がん細胞はミトコンドリアの呼吸鎖の異常によって酸素を使ってATPを産生すると活性酸素の産生量が増える(①)。がん細胞は解糖系(②)が亢進し乳酸(③)の産生が増えている。また、ペントースリン酸経路(④)が亢進し、この経路でできるNADPH(⑤)はグルタチオンやチオレドキシンを還元して活性酸素を消去する(⑥)。
【ジェームズ・ワトソンが提唱するがんの酸化治療】
ジェームズ・ワトソン(James Watson)は、1953年(25歳)にフランシス・クリックらとDNAの分子構造を解明し、1962年(34歳)にノーベル生理学・医学賞を受賞しています。分子生物学研究のトップレベルの研究施設であるコールド・スプリング・ハーバー研究所に所長や会長として長く君臨し、国立衛生研究所(NIH)の国立ヒトゲノム研究センター初代所長を勤め、大統領自由勲章やアメリカ国家科学賞も受けています。
このような分子生物学やがん研究の領域で卓越した業績を残しているジェームズ・ワトソン博士が、「がん細胞の無制限の増殖の結果として必然的に生じる酸化ストレスに対するがん細胞の脆弱性をターゲットにしたがん治療」の重要性を主張しています。
がん細胞は恒常的な増殖活性を示すために、グルコースの取込みと解糖系の亢進という特徴を持ちます。さらに、抗酸化システムを増強して酸化ストレスに対する抵抗性を高めて細胞死を防いでいます。
そのため、がん細胞はグルコースの取込みや解糖系の阻害や、抗酸化システムの阻害で死滅するという特徴があります。ミトコンドリアでの酸化的リン酸化を亢進すると活性酸素の産生が増えて酸化ストレスが増大し、細胞死を誘導できます。細胞内の酸化還元バランスを破綻させてがん細胞を死滅させる治療法をワトソン博士は主張しています。(図)

図:ミトコンドリアで酸素を使ってATP産生を行うときに活性酸素が発生し、炎症があると炎症細胞から活性酸素が発生する(①)。活性酸素は細胞に酸化傷害を引き起こすが、細胞内には活性酸素を消去する抗酸化物質や抗酸化酵素による抗酸化力が存在する(②)。活性酸素種の量と抗酸化力の差が酸化ストレスとなる。細胞内には酸化ストレスの増大に応じて、抗酸化酵素の発現や活性を亢進することによって抗酸化力を高めるメカニズムが存在し、酸化還元のバランスを維持することによって酸化傷害の発生を防いでいる(③)。しかし、細胞内の活性酸素の産生量が増えたり、活性酸素消去能(抗酸化力)が低下すると、酸化還元バランスが破綻して(④)、酸化ストレスが亢進する(⑤)。酸化ストレスが亢進すると細胞の増殖が抑制され、細胞死が誘導される(⑥)。
【中途半端では逆効果になる】
がん細胞内では活性酸素の産生量が増えており、抗酸化システムを亢進して酸化傷害を防いでいます。がん細胞は酸化ストレスを軽減するために余分のエネルギーを使うことになるので、酸化ストレスは増殖や転移を抑制する作用があります。
したがって、がん細胞のミトコンドリアでの酸化的代謝を亢進すると増殖や転移を抑制できます。がん細胞に高度に酸化ストレスを高めることができれば、死滅させることができます。
しかし、中途半端な酸化ストレスだと逆に増殖や転移を促進することになります。それは、中等度の酸化ストレスは逆にがん細胞の活動性を高める作用があるからです。(図)

図:がん細胞は酸素を使わない解糖系でグルコースを代謝し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されている。がん細胞で酸化的リン酸化によるエネルギー産生を増やすと、活性酸素の産生が増え、酸化ストレスが高まる。中等度の酸化ストレス亢進はがん細胞の活動性を亢進し、増殖シグナルや血管新生を亢進する。高度の酸化ストレスの場合は酸化傷害によるダメージを受け、増殖が抑制され、細胞死が誘導されて自滅する。がん細胞の酸化ストレスを高める治療では、徹底した酸化ストレスの亢進を目標にしなければならない。
【抗酸化システムを利用して放射線や抗がん剤に抵抗性になる】
細胞内で活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンなどの抗酸化物質の合成を高めて、活性酸素の害を軽減しようとします。
放射線治療も抗がん剤治療も活性酸素の産生を高め、細胞を死滅します。しかし、がん細胞は細胞に備わった抗酸化システムを利用して酸化ストレスを軽減し、細胞死から免れようとします。(図)

図:抗がん剤や放射線は活性酸素の産生を高め(①)、細胞の酸化傷害を引き起こして、細胞増殖を抑制し、細胞死を誘導する(②)。がん細胞は、スーパーオキシド・ディスムターゼやカタラーゼやグルタチオン・ペルオキシダーゼなどの活性酸素消去酵素やグルタチオンやチオレドキシンなどの抗酸化物質の産生を高めて、活性酸素による害(酸化ストレス)を軽減している(③)。この抗酸化システムの亢進によって、がん細胞は抗がん剤や放射線治療に抵抗性になる。
そこで、ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進するジクロロ酢酸ナトリウム、細胞内で活性酸素の産生を高める薬剤(アルテスネイト、メトホルミン、高濃度ビタミンC点滴など)を使って細胞内の活性酸素の産生量を高め、同時に活性酸素を消去する細胞内の抗酸化システムを抑制すると、細胞内の酸化ストレスが高度に亢進し、酸化傷害によってがん細胞を死滅できます。
「がんの酸化治療」は下図に示すようにがん細胞内の酸化ストレスを高めて、活性酸素でがん細胞を死滅する治療法です。

図:放射線と抗がん剤治療は活性酸素の産生を高めて細胞を死滅させる(①)。ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進するジクロロ酢酸ナトリウム(②)、細胞内で活性酸素の産生を高める薬剤(アルテスネイト、高濃度ビタミンC点滴、メトホルミン)も活性酸素の産生を増やす(③)。活性酸素の産生量が増えると、活性酸素を消去する抗酸化物質や抗酸化酵素による抗酸化力を高めて酸化還元バランスを維持しようとする。ジスルフィラム、2-デオキシ-D-グルコースは抗酸化システムを阻害する(④)。がん細胞内の活性酸素の産生量を増やし、同時に活性酸素消去能(抗酸化力)を阻害すると、酸化還元バランスが破綻して強い酸化ストレスを引き起こし、がん細胞を死滅できる(⑤)。
【正常細胞とがん細胞の違いががん治療のターゲットになる】
様々ながん治療法は、がん細胞と正常細胞の違いをターゲットにしています。がん細胞は正常細胞に比べて細胞増殖が亢進しているので、DNAの合成や複製の過程、細胞分裂のメカニズム(微小管の働きなど)、増殖シグナル伝達系を阻害すると、がん細胞の増殖を抑え細胞死を誘導できます。
しかし、正常細胞でも骨髄細胞や消化管粘膜上皮細胞や免疫組織(リンパ球)や毛根細胞も盛んに細胞分裂を行っているので、細胞増殖を阻害する抗がん剤は、骨髄抑制(白血球減少、血小板減少、貧血)や消化管障害(食欲低下、吐き気、嘔吐、便通障害など)や免疫力低下(リンパ球減少)や脱毛などの副作用が出てきます。
エネルギー代謝と物質合成においても、がん細胞ではグルコース(ブドウ糖)の取り込みが増え、解糖系と乳酸産生が亢進し、がん組織は酸性化しています。がん組織の酸性化は、がん細胞の増殖や転移や血管新生を促進し、免疫細胞の働きを抑制し、抗がん剤が効きにくくなります。したがって、解糖系の阻害と乳酸産生の抑制は、がん細胞の増殖抑制と細胞死誘導に役立ちます。
増殖活性の高いがん細胞は細胞内の鉄の含有量が正常細胞に比べて極めて多いという特徴があり、細胞内の鉄を利用してがん細胞を死滅させる治療法が注目されています。
【がん細胞は鉄を多く取込んでいる】
私たちの体内には、体重60kgで平均4g程度(2~6gくらい)の鉄が存在します。鉄は全て食事から体内に摂取しています。鉄は酸素などの小さな分子と強く特異的に結合する性質があります。体内の鉄の60%くらいはヘモグロビンのヘムとして存在し、酸素を運搬する働きを担っています。
鉄はイオンの価数が変化する遷移金属で、簡単に二価イオン(Fe2+)と三価イオン(Fe3+)の両方の型を行き来するので、電子の移動を伴う生体反応に利用できます。
例えば、NADPHオキシダーゼ、キサンチンオキシダーゼ、リポキシゲナーゼ、チトクロームP450酵素など活性酸素を産生させるような酵素の活性に必要です。ATPを生産するミトコンドリアの電子伝達系のタンパク質など電子を輸送する様々なタンパク質にも使われています。ペルオキシソームで過酸化水素(H2O2)を分解するカタラーゼの活性にも鉄が必須です。
このように、鉄イオンは細胞の呼吸、核酸合成、増殖などに必須な補助因子として重要な役割を果たしています。したがって、細胞増殖が亢進したがん細胞は鉄の需要が増え、鉄の取込みが増えています。
血液中では鉄イオンはトランスフェリンに結合して細胞まで運ばれます。1つのトランスフェリンに2つの3価鉄(Fe3+)が結合します。トランスフェリンは細胞膜にあるトランスフェリン受容体と結合して細胞内に取り込まれ、リソソーム内の酸性の環境で鉄イオンが解離し2価の鉄(Fe2+)になります。
フリーの2価鉄イオンは細胞質鉄プールとして蓄積され、DNA合成、細胞周期の制御、ミトコンドリアでのATP産生などに必須の働きを担っています。(図)
増殖活性の高いがん細胞は、細胞膜のトランスフェリン受容体の発現量が増え、正常細胞に比べて鉄の取込みが増えています。さらに、細胞内の鉄イオンの調節に破綻をきたし、酸化還元活性のあるフリーの2価鉄(Fe2+)が過剰に存在する状況になっています。

図:1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる(①)。 細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体は細胞内に取り込まれる(②)。エンドソーム内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。2価の鉄イオンは細胞質に移行し、細胞内の鉄プールに入る(④)。鉄イオンはDNA合成と修復、細胞周期、エネルギー産生、ヘム合成、鉄-イオウ(Fe-S)クラスター合成など様々な生理機能に利用される(⑤)。余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に貯蔵される(⑥)。細胞質の2価鉄イオンは過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシラジカル(・OH)を発生させ、細胞傷害を引き起こす(⑦)。
【2価鉄イオン(Fe2+)はフリーラジカルを発生して細胞を傷害する】
2価のフリーの鉄は過酸化水素(H2O2)と反応してより有毒なヒドロキシルラジカルを生じ、DNA障害、脂質酸化、細胞死などを引き起こします。
鉄は電子の授受を容易に行いうることから種々の酵素の活性中心として働いており、地球上のほぼ全ての生物にとって必須の元素です。しかし一方で、二価鉄(Fe2+)が過剰に存在すると、その高い反応性ゆえにフリーラジカルの産生を促進し細胞に対する傷害性をもたらします。
慢性炎症組織やがん組織では、鉄イオンの調節に破綻をきたし、フリーの2価鉄(Fe2+)が過剰に存在する状況になっています。がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を選択的に死滅させる治療が注目されています。
すなわち、がん細胞および腫瘍組織には2価鉄イオン(Fe2+)が大量に蓄積しているので、この鉄イオンと反応して活性酸素を発生させる方法は、がん細胞への毒性を選択的に高めることができ、新規のがん治療法になります。
【アルテミシニン誘導体は抗マラリア薬として開発された】
青蒿(セイコウ:Artemisia annua)というキク科の薬草は中国伝統医学でマラリアなど様々な感染症や炎症性疾患の治療に古くから使用されていました。抗マラリア作用の活性成分がアルテミシニン(Artemisinin)で、その効果を高めたアルテスネイト(Artesunate)とアルテメーター(Artemether)という2種類の誘導体が合成されています。これらは現在、マラリアの治療薬として世界中で使用されています(図)。

図:アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)は、マラリアの治療薬として使用されている。抗がん作用があることから、がんの代替医療にも使用されている。
青蒿からアルテミシニンを発見して抗マラリア薬を開発した中国の女性科学者の屠呦呦(Tu Youyou)博士は、2015年のノーベル生理学・医学賞を受賞しています。
マラリアは熱帯・亜熱帯地域に広く分布し、全世界で年間2億人以上が発症し、死者は100~150万人と言われる感染症です。その治療薬のアルテミシニン誘導体の開発は、「伝統薬から開発された医薬品としては20世紀後半における最大の業績」という表現がなされているほど、医学において重要な成果だと言われています。
青蒿(セイコウ)という生薬は強力な解熱作用があり、中国医学でマラリアなど様々な感染症や炎症性性疾患の治療に古くから使用されていました。1972年に中国の湖南省長沙市の郊外で発掘された馬王堆漢墓は2100年以上前に作られた墓(古墳)ですが、その中から見つかった「五十二病方」という医書の中に青蒿が記載されています。
青蒿はartemisia annuaという植物です。artemisiaとはヨモギのことで、青蒿はキク科ヨモギ属の植物です。
ベトナム戦争中に南ベトナムで組織された南ベトナム解放民族戦線(通称ベトコン)を援助するために中国軍がベトナム戦争に従軍しましたが、密林でマラリアに感染して病死する兵士が多く、そこで毛沢東の命令でマラリヤの治療薬の開発が国家プロジェクトとして1967年に開始されました。その指揮を取ったのが、当時37歳の屠博士でした。
屠博士は1970年代に、その薬効成分のアルテミシニンを分離し、アルテミシニンやその誘導体のアルテスネイトやアルテメーターの抗マラリア薬としての有効性を確認しました。そして近年、このアルテミシニン誘導体が抗がん物質として注目を集めています。
【アルテミシニン誘導体は副作用が少なく、がん細胞を死滅する】
アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)はマラリアの治療薬として使用されていますが、がんの研究分野でも注目されています。
培養がん細胞を使った実験でアルテミシニンやアルテスネイトががん細胞を死滅させる作用や、がん細胞を移植した動物実験でがんを縮小させる効果が報告されています。抗腫瘍作用を示す投与量で、正常細胞に対する毒性が低く、副作用が少ない特徴を持っています。
アルテミシニン誘導体は多彩な作用メカニズムで抗腫瘍効果を発揮することが報告されています。がん細胞内でフリーラジカルを産生して酸化ストレスを高める作用、血管新生阻害作用、DNAトポイソメラーゼIIa阻害作用、細胞増殖や細胞死のシグナル伝達系に影響する作用などが報告されています。臨床試験での有効性も報告されています。
アルテスネイトは水溶性で、抗マラリア作用や抗がん作用はアルテミシン誘導体の中で最も高いと考えられています。毒性が極めて低いので副作用がほとんど無いのが特徴です。しかし、体内での半減期が比較的短いという短所もあります。
アルテメーターは脂溶性で、アルテスネトより体内の半減期は長く、血液脳関門を容易に通過するので、脳マラリアや脳腫瘍にも効果があります。しかし、高用量を使用すると神経毒性が現れるという副作用があります。
アルテミシニンは、アルテスネイトとアルテメーターの2つの中間的な半減期をもち、血液脳関門も通過します。
【アルテスネイトはがん細胞内の鉄イオンと反応して細胞死を誘導する】
アルテスネイトは分子の中に鉄イオンと反応してフリーラジカルを産生するエンドペルオキシド・ブリッジ(endoperoxide bridge) を持っており、がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています(図)。

図:がん細胞は細胞内に鉄を多く含む(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持つ(②)。このエンドペルオキシド・ブリッジは細胞内の鉄と反応してフリーラジカルを産生し、フェロトーシスの機序で細胞死を誘導する(③)。一方、正常細胞は鉄の含有が少ないので、アルテスネイトによる細胞傷害を受けない(④)。
鉄は細胞増殖に必要なため、がん細胞はトランスフェリン受容体の発現量を増やして鉄を多く取り込んでいます。細胞分裂の早いがん細胞ほど鉄を多く取り込んでいると言われています。したがって、がん細胞内の鉄と反応してフリーラジカルを発生するアルテスネイトは、正常細胞を傷つけずにがん細胞に選択的に傷害を与えることができます。
アルテスネイトによってがんや肉腫が縮小した臨床報告があり、人間における腫瘍に対しても有効であることが報告されています。進行した肺がんの抗がん剤治療にアルテスネイトを併用すると抗腫瘍効果が高まることが、中国で行われたランダム化比較試験で報告されています。その他、乳がんや大腸がんや悪性黒色腫などでも、臨床試験での有効性が報告されています。
【アルテスネイトはフェロトーシスを誘導する】
細胞死のメカニズムとしてアポトーシスやネクローシスなどがあります。
アポトーシス(Apoptosis)は正常細胞が老化して新しい細胞に置き換わるような、生体の細胞回転(細胞の交代)で使われる細胞死のパターンです。免疫細胞や炎症細胞が反応しないような死に方をします。
一方、脳梗塞や心筋梗塞のような虚血や、火傷や毒物による細胞傷害では、壊死(ネクローシス)という細胞死を起こして、細胞が崩壊して炎症反応が引き起こされます。ネクローシスの場合は組織の傷害を生体に知らせて、防御と修復を起こす必要があるからです。
フェロトーシス(Ferroptosis)という細胞死が2012年に提唱されています。「フェロ(Ferro)」は鉄という意味で、「ptosis」は「下垂する」という意味で、枯れ葉が枝から落ちる様から細胞の死を意味します。
フェロトーシスでは、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。細胞内の鉄に依存する機構であり、他の金属類には依存しません。(図)
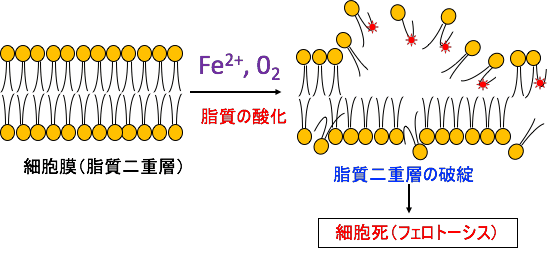
図:二価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で、脂質の酸化が強く起こり、脂質二重層の破綻によって誘導される細胞死をフェロトーシスという。
アルテスネイト服用の数時間前に鉄剤を服用するとアルテスネイトの抗腫瘍作用が増強することが報告されています。服用した鉄の多くががん細胞に取り込まれるためです。がん細胞では鉄の取込みが亢進しており、この細胞内の鉄にアルテスネイトが反応して細胞内で活性酸素を産生させ、脂質過酸化によって細胞傷害を引き起こすと考えられています。
2015年頃から、「アルテミシニン誘導体は腫瘍細胞に鉄依存性細胞死(フェロトーシス)を誘導する」 という内容の研究結果が多数報告されています。
正常細胞は鉄の含有量が少なく、がん細胞では鉄の含有量が多いので、アルテスネイトはがん細胞に選択的にフェロトーシスによる細胞死を誘導することが示されています。
この場合、抗酸化剤を投与すると細胞死が阻止されます。つまり、がん細胞内に多く含まれる鉄イオンとアルテスネイトが反応して活性酸素が産生されることが細胞死のメカニズムだからです。
| « 893)ザクロ種... | 895)がん細胞... » |



