がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
587)乳がんの術前補助化学療法で転移が促進される?
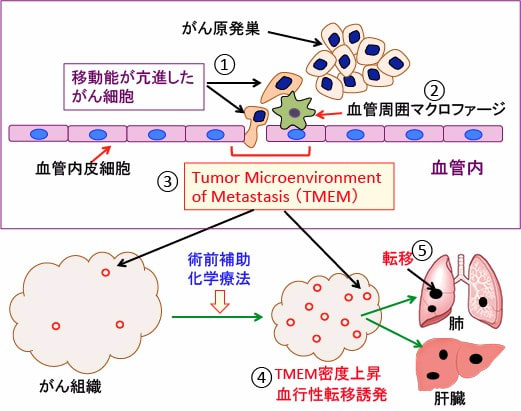
図:(上)がん原発巣から運動能(移動能)が亢進したがん細胞が遊走して、血管に侵入するために血管内皮細胞と接触する(①)。がん細胞が血管内に侵入する際には、血管新生を促進するアンジオポエチンの受容体のTie2と血管内皮細胞増殖因子A(VEGFA)を高発現する血管周囲マクロファージ(腫瘍関連マクロファージの1種)が手助けする(②)。このがん細胞とマクロファージと血管内皮細胞の3者が密に接した部分はがん細胞が血管内に侵入する部位で、Tumor Microenvironment of Metastasis(転移の腫瘍微小環境)、略してTMEMと呼ばれる(③)。
(下)がん組織の中のTMEM部位を赤い◯で示している。術前補助化学療法によって原発巣のがん組織は縮小するが、TMEM(転移の腫瘍微小環境)の密度は増加し、がん細胞の血行性転移が誘発される(④)。その結果、術前補助化学療法によって肺や肝臓などへの血行性転移は促進される(⑤)。
587)乳がんの術前補助化学療法で転移が促進される?
【乳がんの術前補助化学はがん細胞の転移を誘発する】
術前補助化学療法(NeoAdjuvant Chemotherapy)は、手術前に抗がん剤を投与して、がんを小さくさせることで、がんの切除を可能にしたり、臓器の機能を温存させる目的で行います。目にみえない小さな転移を根絶させることも目的としています。
一般的には、術前補助化学療法と手術を組み合わせることで治療効果を高めることができ、再発率を低下できると考えられています。しかし、高用量の抗がん剤治療が転移を誘発することは多くの研究で指摘されています。臨床経験的にも、抗がん剤治療で転移が促進されたのではと思われる例は多数あります。
乳がんの術前補助化学療法でがんの転移が促進することが報告されています。例えば、以下のような報告があります。
Neoadjuvant chemotherapy induces breast cancer metastasis through a TMEM-mediated mechanism(術前補助化学療法は、TMEM介在性機序によって乳がんの転移を誘発する)Sci Transl Med. 2017 Jul 5; 9(397): eaan0026.
【要旨】
乳がん細胞は、転移の腫瘍微小環境(Tumor Microenvironment of Metastasis :TMEM)と呼ばれるTIE2 / MENACalc / MENAINV依存性のがん細胞の血管内侵入部位を介して広がり、このTMEMは乳がん患者の転移の予後マーカーとして臨床的に立証されている。
PyMTマウスモデルおよび患者由来異種移植片の固定組織および生体内画像化を用いて、化学療法がTMEM部位およびMena発現の密度および活性を増加させ、遠隔転移を促進することを示す。
さらに、ドキソルビシン+シクロホスファミド投与後にパクリタキセルの術前投与を受けた患者の残存乳がんにおいて、TMEMスコアおよびTMEMのメカニズムと関連するMENAINVアイソフォーム発現パターンは両方とも増加し、腫瘍サイズの減少にもかかわらず化学療法は転移播種のリスクを増加させる。
化学療法によって誘発されたTMEMの活性化およびがん細胞播種は、TIE2阻害剤リバスチニブ(rebastinib)の投与またはMENA遺伝子のノックダウンのいずれかによって阻止された。
我々の結果は、術前化学療法によって、乳がん組織のTMEMスコア(密度)が上昇し、がん細胞のMENAアイソフォームの発現パターンが変化することを示している。TMEMスコアは化学療法によって引き起こされる転移誘発性の変化を予測するのに使用できることを示す。
さらに、TMEM機能の阻害剤は、術前補助化学療法または転移性乳がんにおける化学療法の臨床利益を向上することができる。
医学論文を読む時、それがどこの国、あるいはどの研究グループから発表されたものかは常に気にします。雑誌のレベルも気にします。国全体としていい加減な論文が多い国もあり、データの操作や捏造が疑われる研究室もあるからです。その意味で、この論文の結果の信頼性は高いと思います。
この論文の著者は16人で、米国のニューヨーク州のアルバート・アインシュタイン医科大学(Albert Einstein College of Medicine)の解剖学、外科、放射線科、病理、疫学、腫瘍学などの専門家の共著になっています。
この雑誌(Science Translational Medicine)の2016年のインパクトファクターは16.796です。
超一流雑誌のNature やSienceのインパクトファクターは40前後ですが、Cancer Research(2014年のインパクトファクターは9.329)やPNAS (Proceedings of the National Academy of Sciences of the United States of America) が10前後ですので、この学術雑誌のレベルはかなり高いと言えます。
この研究グループは以前から、乳がんをモデルに、血行性転移のリスクを病理学的に評価する方法としてTMEMスコアを提唱しています。
TMEMはTumor Microenvironment of Metastasisの略で、日本語では「転移の腫瘍微小環境」という意味です。この論文を理解するにはTMEMを知る必要があります。詳細は後述しましが、簡単に要点だけ説明しておきます。
がん細胞が血行性に他の臓器に転移するためには、がん細胞が血管内に侵入する必要があります。このとき、がん細胞は移動性を高めるために、細胞骨格のアクチンを制御するMenaというタンパク質の発現を亢進しています。
さらに、血管壁に侵入するときにTie2を発現したマクロファージの存在が必要です。Tie2は血管新生を促進するアンジオポエチンの受容体で、血管内皮細胞に発現していますが、血管周囲にこのTie2を発現しているマクロファージが存在し、このTie2発現陽性のマクロファージががん細胞の血管内侵入を手助けしています。このTie2高発現の血管周囲マクロファージは血管新生や血管透過性に関与する血管内皮細胞増殖因子-A (vascular endothelial growth factor–A :VEGF-A)も高発現しています。
したがって、Menaタンパク質の発現が亢進した(運動能が亢進した)がん細胞と、Tie2発現が亢進している血管周囲マクロファージと血管内皮細胞が一緒になっている部位を3重免疫染色で見つければ、その部位ががん細胞の血管内侵入の部位と同定できます。
この3種類の細胞が一緒にいる部位がTMEM(転移の腫瘍微小環境)となります。
このTMEMの密度(一定面積内の数)をスコア化して、転移との関連を検討すると、TMEMスコアは血行性転移のリスクと相関を示すことが明らかになっています(後述)。

図:血管内に侵入しようとしているがん細胞はアクチン制御タンパク質のMenaの発現が亢進している(①)。がん細胞が血管内に侵入する際には、血管新生を促進するアンジオポエチンの受容体のTie2を持つ血管周囲マクロファージ(腫瘍関連マクロファージの1種)の手助けが必要(②)。したがって、がん細胞が血管に侵入している部位には、Mena発現がん細胞とTie2発現マクロファージと血管内皮細胞の3つの細胞が存在する。この部位ががん細胞の血管侵入部位で、Tumor Microenvironment of Metastasis(転移の腫瘍微小環境)、略してTMEMと呼ばれる。
このTMEMは、がん組織の中でMena発現がん細胞と血管周囲マクロファージと血管内皮細胞の3つの細胞を免疫染色で染めることによって、病理組織で検出することができます。
免疫染色で、マクロファージ特異的なCD68と、血管内皮細胞に特異的なCD31、移動能の亢進を示唆するMena陽性がん細胞を、3種類の抗体を使って、3重免疫染色を行えば、TMEMの部位を同定できます。(以下の図)

図:3重免疫染色で血管周囲マクロファージ(M)は褐色(抗CD68抗体で検出)、血管内皮細胞(EC)は青(抗CD31抗体で検出)、Mena発現がん細胞(TC)は赤で染め分けて(抗Mena抗体で検出)、TMEM(転移の腫瘍微小環境)の部位を検出できる。この3つの細胞の間にはコラーゲン線維が無いことから3つの細胞が密接していることを示している。
腫瘍組織の病理標本で、400倍の強拡大で20視野をカウントして、20視野中のTMEMの総数(TMEMスコア)で比較しています。
この研究グループはTMEM(転移の腫瘍微小環境)の密度と血行性転移のリスクが関連することを、転移のない乳がん組織と転移のある乳がん組織のTMEM密度を比較することを明らかにしています。
30例の血行性転移のある乳がん症例と、それぞれに予後因子を一致させた30例の血行性転移のない乳がん症例(対照)を比較する症例対照試験で、血行性転移のある乳がんの原発腫瘍のTMEM密度が血行性転移のない乳がん組織よりTMEM密度が高いことを報告しています。(この論文については後述します)
そこで、このTMEMスコアで乳がん組織を検討すると、ドキソルビシン+シクロホスファミド投与後にパクリタキセルの術前投与を受けた患者の残存乳がんにおいて、TMEMスコアおよび浸潤性がん細胞(MENAINVアイソフォーム発現陽性がん細胞)は増加し、腫瘍サイズの減少にもかかわらず化学療法は転移播種のリスクを増加させるという結論です。
つまり、術前補助化学療法を行うと、原発乳がんの化学療法前に比べて、化学療法の後ではTMEM 密度が大きくなっていることを明らかにし、「術前補助化学化学療法ががん転移を誘発する」という結論に達しています。

図:がん組織の中のTMEM(Tumor Microenvironment of Metastasis)部位は赤い◯で示している。術前補助化学療法によって原発巣のがん組織は縮小するが、TMEM(転移の腫瘍微小環境)の密度は増加(TMEMスコア上昇)し、がん細胞の血行性転移が誘発される。その結果、術前補助化学療法によって肺や肝臓などへの血行性転移は促進される。
【がん細胞の転移が成立するには多くのプロセスが必要】
がんができた元の場所を原発巣といいます。がん細胞は原発巣から血液やリンパ液の流れに乗って別の場所にもがん細胞の塊を形成しながら全身に広がる性質を持っており、これを転移といいます。転移によって他の場所にできたがん細胞の集まりを転移巣といいます。
がん細胞は周囲組織に浸潤し、リンパ管に入ってリンパ節に転移したり、血管に入って遠隔の臓器や組織に転移します。また、腹部のがんであれば腹膜に播種し、胸部のがんは胸膜に播種する場合もあります。胃がんの場合を例にしてがん細胞の広がるルートを下図に示しています。

図。胃がんを例にとってがんが広がるルートを示している。胃にできたがん細胞は胃壁に沿って浸潤性に増殖し、膵臓や腹膜など隣接した組織にも広がっていく(①)。リンパ管に入ると周囲のリンパ節に転移し(②)、血管に入ると肝臓や肺など離れた臓器に転移する(③)。手術で原発巣を切除しても、がんの取り残しや、離れた臓器に転移(遠隔転移)があると再発する。
がん死のほとんどは、がんが転移して全身に広がることによって起こります。つまり、がん細胞の周囲組織への浸潤や遠隔臓器への転移を防げれば、がん死を防ぐことができます。がん細胞の転移は偶然に起こる現象ではありません。がん細胞が転移を成立させるためには何段階ものプロセスを経る必要があり、それぞれのステップで数多くの因子が関与しています。
例えば、がん細胞の運動を活発にし、がん細胞の移動を制限している結合組織などの細胞外マトリックスを分解する酵素を産生し、血管壁の内皮細胞の間から血管内に侵入し、血液に運ばれて他の臓器や組織に定着し、原発の部位とは異なる微小環境の中で細胞を増やすという過程が必要で、このどれが阻止されても転移は成立しません。(下図)

図:原発巣のがん細胞が血流を介して全身の組織や臓器に転移巣を作るためには、図の①から⑥に示すような多くのステップを経なければならない。③のがん細胞が血管内に入り込む部位(TMEM)は、移動能を亢進したMena発現がん細胞と、がん細胞の血管内侵入を助けるTie2を発現する血管周囲マクロファージと血管内皮細胞の3つの細胞が密接に接している。これらの3種類の細胞を同時に免疫染色することによってTMEM(転移の腫瘍微小環境)を検出でき、原発がん組織でのTMEMの密度を測定することによって血行性転移のリスクを評価できる。
【血行性転移のリスクを評価できると無駄な補助化学療法が減らせる】
乳がんの予後は血行性転移の有無にかかっています。
手術時にすでに転移していた場合、多くは3年以内に再発しますが、10年以上経過して再発が見つかることもあります。
転移による再発を防ぐ(あるいは遅らせる)目的で乳がん患者の80%程度が手術後に補助化学療法を受けているという報告があります。
診断時の年齢によりますが、術後補助化学療法によって15年生存率では3%から15%くらいの生存率上昇の臨床的有益性があると報告されています。
しかし、再発したり転移するのは、乳がん患者の40%もいないので、6割以上の患者は無駄に抗がん剤治療を受け、有害作用を受けていることになります。
通常行われている腫瘍の大きさや核異型度(グレード)や細胞分裂(Ki-67)などで予後(再発の可能性)を推測していますが、これらは全身性の血行性転移の可能性とはあまり相関していないことが明らかになっています。
手術後の病理検査での、リンパ節転移の程度や、血管やリンパ管への侵襲の度合いなどでは血行性転移のリスクは評価できないと考えられています。
リンパ節転移と血行性転移はメカニズムが異なるため、リンパ節転移の程度では、血行性転移のリスクは評価できないと言われています。
血行性転移のリスクを正しく評価できれば、補助化学療法の必要な乳がん患者を絞れることができ、無駄な抗がん剤治療(補助化学療法)が減らせることになります。
【TMEM(転移の腫瘍微小循環)密度は血行性転移のリスクを評価する】
乳がんの血行性転移のリスクを評価する方法として、アルバート・アインシュタイン医科大学の研究グループはTMEM(転移の腫瘍微小循環)の有用性を報告しています。先ほどの論文もこの研究グループからです。
TMEMは以下の論文で最初に報告されています。
Tumor Microenvironment of Metastasis in Human Breast Carcinoma: A Potential Prognostic Marker Linked to Hematogenous Dissemination(ヒト乳がんにおける転移のがん微小環境:血行性転移と関連した潜在的な予後マーカー)Clin Cancer Res. 2009 Apr 1; 15(7): 2433–2441.
【要旨】
目的:多光子画像法に基づく生体内イメージング検査は、マウスおよびラットの乳腺腫瘍において、がん細胞が血管内に侵入するとき、血管周囲マクロファージと接触することを明らかにした。これは転移における腫瘍微小環境(tumor microenvironment of metastasis;TMEM)の存在を示唆している。
我々は、このTMEM(転移の腫瘍微小環境)を浸潤性がん細胞とマクロファージと血管内皮細胞の3者構成として定義する。
この研究の目的は、ヒト乳がん病理組織検査サンプル中のTMEM密度が、血行性の転移の発生を予測するかどうかを決定することである。
実験計画:転移性乳がんの30人の患者および転移を有しない30人の乳がん患者の症例対照研究を行った。症例と対照は、現在使用されている予後判定基準を一致させるように選択した。パラフィン包埋された原発性乳がん試料を、がん細胞、マクロファージおよび血管内皮細胞の同時同定を可能にする三重免疫組織化学的方法を用いて染色した。 転移の有無に関して情報を与えられていない2人の病理学者は、強拡大の20視野当たりのTMEMの数を測定した。
結果:腫瘍のサイズ、グレード、リンパ節転移、リンパ管や血管への浸潤、またはホルモン受容体の状態とTMEM密度との関連は見られなかった。全身性転移のある乳がん患者の原発がん組織のTMEM密度は、転移のない乳がん原発組織に比較してより高かった(中央値は105対50、P = 0.00006)。 TMEM密度の10単位増加ごとに、全身転移のオッズ比は1.9(95%信頼区間、1.1〜3.4)であった。
結論:TMEM密度は、全身性の血行性の転移の発生を予測した。遠隔転移を予測するTMEMの能力は、リンパ節転移の状態および現在使用されている他の予後予測指標とは無関係であった。 TMEMの定量は、乳がん患者にとって有用な新しい予後マーカーとなりうる。
転移の腫瘍微小環境(tumor microenvironment of metastasis;TMEM)は、浸潤性の性質を持ったがん細胞(Mena発現)と、がん細胞を手助けする血管周囲マクロファージと、血管内皮細胞の3者が密に接している状態を意味します。このTMEMの存在部位は、これらの3種類の細胞を免疫染色で染めることによって検出できます。
そこで、血行性転移のある乳がんと血行性転移の無い乳がんの原発部位の組織でTMEM密度を比較しています。
その結果、血行性転移の無い乳がんの原発腫瘍に比べて、血行性転移のある乳がん組織の方がTMEM密度(TMEMスコア)が高いことを明らかにしています。つまり、原発部位のTMEM密度は、血行性転移の確率のマーカーとなるという結果です。

図: TMEM(Tumor Microenvironment of Metastasis;転移の腫瘍微小環境)の部位を病理組織中の◯で示している。血行性転移のない乳がん原発腫瘍ではTMEM密度が低く、血行性転移のある乳がん原発腫瘍ではTMEM密度が高い。
【TMEMはがん細胞と血管周囲マクロファージと血管内皮細胞の3つから構成される】
血行性転移の成立に必要ながん細胞の血管内侵入にはがん組織中の微小環境が関与しています。
がん組織内では、様々な炎症細胞や線維芽細胞などから増殖因子やサイトカインやケモカインが分泌され、パラクリン機序(近くの細胞に作用すること)によってがん細胞の増殖や移動や浸潤が亢進されます。
その結果、がん組織の中では、移動能が亢進したがん細胞が血管の方向に極性を向け、血管の方向に移動し、血管壁に侵入しようとします。このように、がん細胞の極性、移動の亢進、血管壁への侵入という過程においては、細胞骨格タンパク質の変化が伴います。
アクチンは、すべての真核細胞に存在し、かつ多量に発現しているタンパク質です。
アクチン分子は重合して連なり、繊維状のアクチン・フィラメントとなって細胞の骨格を形成しています。アクチン・フィラメントは、遊走、接着、移動といった細胞運動において中心的な役割を担います。

図:(左)緑色がアクチン・タンパク質で、アクチンが重合して繊維状になって細胞内に分布し、細胞骨格を形成している。
(右)細胞が増殖因子やケモカインなどの刺激(シグナル)を受けると、シグナル伝達系を介して、細胞骨格を制御する因子の発現や機能が変化し、細胞骨格の再構成などの変化が起こり、その結果として細胞形態の変化や、細胞の移動(遊走)などの機能の変化として現れる。
移動能や浸潤能が亢進し血管内に侵入しようするがん細胞はアクチン制御タンパク質のMenaというタンパク質の発現が亢進しています。つまり、Menaを発現しているがん細胞は移動したり、血管内に侵入しようとしているがん細胞と言えます。Menaタンパク質を免疫染色で染めれば、移動能が高まったがん細胞を同定することができます。
さらに、がん細胞が移動能を増しただけでは血管内に侵入することはできません。特殊な任務(性質)を持ったマクロファージの手助けが必要です。
血中を循環する単球は、皮膚などの末梢組織に入るとマクロファージとよばれる細胞に分化します。
がん組織に浸潤したマクロファージを腫瘍関連マクロファージ(tumor-associated macrophage;TAM)と言い、血管新生、増殖因子産生、免疫抑制、転移促進などのさまざまな機能により発がん・悪性化を促進する働きをしています。
腫瘍組織内には特殊に分化したマクロファージが何種類も存在します。その中には、がん細胞の増殖を抑える働きをするものや、反対にがん細胞の増殖や転移を促進するものもあります(後述)。
がん組織の血管周囲にはTie2というアンジオポエチン受容体を持ったマクロファージが存在します。アンジオポエチン(Angiopoietin)は、血管内皮細胞に発現するTie2受容体を介して,血管構造の安定化と血管新生の相反する機能を制御しています。このTie2発現マクロファージががん細胞の血管内侵入を手助けしています。
したがって、この3種類の細胞がコラーゲン線維などが介在せずに密接している部位が「転移の腫瘍微小環境(Tumor Microenvironment of Metastasis: 略してTMEM)」として検出することができます。この特徴ある細胞を免疫染色で染めれば、TMEM が容易に検出でき、病理組織検査でTMEMの密度を測定してスコア化すれば、血行性転移の可能性を数値化できます。

図:血管に侵入しようとしている移動能の亢進したがん細胞はアクチン制御タンパク質のMenaの発現が亢進している。がん細胞が血管内に侵入する際には、血管新生を促進するアンジオポエチンの受容体のTie2を持つ血管周囲マクロファージ(腫瘍関連マクロファージの1種)の手助けが必要。したがって、がん細胞が血管に侵入している部位には、Mena発現がん細胞とTie2発現マクロファージと血管内皮細胞の3つの細胞が存在する。この部位ががん細胞の血管侵入部位で、Tumor Microenvironment of Metastasis(転移の腫瘍微小環境)、略してTMEMと呼ばれる。
【がん細胞の血管内侵入にはマクロファージの手助けが必要】
がん細胞が血管壁に侵入して血管内に入り込むには、がん細胞単独では実行できないようです。血管周囲のマクロファージの手助けが必須です。したがって、抗がん剤治療中の血行性転移を防ぐためには、腫瘍内マクロファージが重要なターゲットになります。このマクロファージは血管内皮細胞増殖因子A(VEGFA)を発現して血管内皮細胞の接合を解離させるようです。以下の報告も前述2つの論文と同じ研究グループからの論文です。
Real-time imaging reveals local, transient vascular permeability and tumor cell intravasation stimulated by Tie2Hi macrophage-derived VEGFA(リアルタイムの画像化は、Tie2高発現のマクロファージ由来の血管内皮細胞増殖因子Aによって刺激された局所的、一時的な血管透過性腫瘍細胞の血管内侵入を明らかにする)Cancer Discov. 2015 Sep; 5(9): 932–943.
【要旨】
がん細胞の集団からがん細胞が遊離する過程は転移の成立過程で必須のステップである。
マクロファージとMena過剰発現腫瘍細胞と血管内皮細胞の3つの細胞の直接的な接触 (転移腫瘍微小環境:TMEM)は、乳がん患者における転移と関連する。
ここでは、生体内高分解能2光子顕微鏡法を用いて、一過性の血管透過性とがん細胞の血管内侵入が同時にかつTMEM(転移の腫瘍微小環境)においてのみ起こることを示す。
腫瘍血管の透過性亢進の性質は、空間的および時間的に様々であることが明らかになっている。
リアルタイムの画像検査を用いて、血管透過性が一時的であり、TMEMに限定され、腫瘍細胞の転移に必須であることを観察した。
TMEMにおけるTie2高発現のマクロファージから分泌される血管内皮増殖因子A(VEGFA)によるシグナル伝達は、血管内皮細胞間の接合を局所的に解離させ、一過性の血管透過性亢進とがん細胞の血管内侵入を引き起こす。これは原発乳がん組織におけるTMEMの役割を実証する。
これらのデータは、乳がんにおける腫瘍細胞の血管内侵入および血管透過性のメカニズムを説明し、乳がん患者における遠隔転移の予測因子としてのTMEM密度の有用性を示唆している。
リアルタイム・イメージングは生細胞の動きなどを可視化する技術です。この特殊な画像化で、がん細胞が血管内に侵入するときにマクロファージの助けが必須であることを証明しています。この論文の画像の抜粋を以下のまとめています。

図:①と②:赤が血管、青が血管周囲マクロファージ(M)、緑ががん細胞(TC)を示す。がん細胞(TC)が血管内に入り込むときマクロファージ(M)が血管内皮細胞とがん細胞と接している。③四角の枠の中がTMEM(転移の腫瘍微小環境)でがん細胞(T1)が血管内皮細胞(EC)に侵入する際、マクロファージ(M1)が密接して血管内侵入を手助けしている。④血管周囲マクロファージはEGF(上皮細胞増殖因子)やCSF-1(コロニー刺激因子-1)を分泌してパラクリン機序(近くの細胞に作用)でがん細胞やマクロファージを血管周囲に集め、VEGF(血管内皮細胞増殖因子)を分泌して血管透過性を一過性に亢進して、移動能の亢進したがん細胞の血管内侵入を助ける。つまり、血管周囲マクロファージから分泌される因子のがん細胞と血管内皮細胞に対するパラクリン機序での働きかけがないと、がん細胞は血管内に侵入できない。
【血管周囲マクロファージはTie2とVEGFAの発現が高い】
がん細胞が血管内に侵入するとき、それなりのメカニズムが存在します。
血管というのは、血液が漏れないように血管内皮細胞が連続して管を形成しています。その中に入り込むには、血管内皮細胞の隙間を通って入り込むというプロセスが必須です。偶然に入るわけではありません。
まず、がん細胞は移動能を亢進する必要があり、そのため細胞骨格タンパク質などの発現や機能に変化が起こります。その一つがMenaというアクチン制御タンパク質の発現亢進で、このMenaタンパク質を免疫染色で染めれば、多数のがん細胞の中から移動能が亢進して周囲の組織や血管内に浸潤しようとしているがん細胞を見つけることができます。
さらに、血管内皮細胞の接合をこじ開けて、血管壁の透過性を亢進して、がん細胞の血管内侵入を助けるのが、腫瘍組織内のマクロファージ(腫瘍関連マクロファージ)のサブポピュレーションのTie2発現マクロファージです。
血中を循環する単球は、皮膚などの末梢組織に入るとマクロファージとよばれる細胞に分化します。
がん組織に浸潤したマクロファージを腫瘍関連マクロファージ(tumor-associated macrophage;TAM)と言い、血管新生、増殖因子産生、免疫抑制、転移促進などのさまざまな機能により発がん・悪性化を促進する働きをしています。
以前は、マクロファージが活性化するとがん細胞を攻撃してくれると考えられていたのですが、むしろ逆で、腫瘍内にマクロファージの数が多いほど予後が悪いことが報告されています。
活性化したマクロファージから産生されるプロスタグランジンE2や炎症性サイトカインはがん細胞を悪化させ、抗腫瘍免疫を抑制してがん細胞の増殖を促進し、転移や再発を促進することが明らかになっています。
血管周囲マクロファージはアンジオポエチン(angiopoietin )の受容体の Tie2を発現しています。
さらに、血管周囲マクロファージは血管内皮細胞増殖因子-A (vascular endothelial growth factor–A :VEGF-A)を分泌して血管透過性を亢進します。
つまり、TMEM(転移の腫瘍微小環境)を構成する血管周囲マクロファファージははTie2とVEGFAを高発現(Tie2Hi/VEGFAHi perivascular macrophages)している特徴があります。
がん細胞が血管内に侵入するとき、血管内皮細胞の間の接合部分がこじ開けられて、移動能を増したがん細胞が血管内に入り込むのですが、この時、血管内皮細胞の接合部を解離させてがん細胞の血管内侵入を助けるのが血管周囲のマクロファージで、VEGFAを分泌して一過性に血管透過性を亢進させるという機序が存在するということです。
【「抗がん剤治療が転移を促進する機序」を阻止する治療】
術前補助化学療法にパクリタキセルを加えると、病理学的完全奏功の率が上昇するが、全生存期間が改善しないことが報告されています。
また、タキサン系抗がん剤をベースにした化学療法は血管新生を誘導して腫瘍の再増殖を促進する事が報告されています。
抗がん剤治療が血行性転移を促進する可能性が多くの研究で指摘されています。
前述のよに、乳がんの術前補助化学療法(neoadjuvant chemotherapy)や術後の補助化学療法(adjuvant chemotherapy)で使用されるパクリタキセルやシクロフォスファミドやドキソルビシンは、動物(マウスやラット)の腫瘍ウイルスで誘発した自然発生乳がんの実験モデルや移植腫瘍の実験系で、血行性転移を促進することが報告されています。
転移を促進するメカニズムは、抗がん剤治療によって腫瘍組織内にマクロファージが動員され、血管周囲のマクロファージは血管内皮細胞増殖因子A(VEGFA)とTie2を高発現して、血管透過性を高めてがん細胞の血管内侵入を促進するからです。
VEGFAは血管形成や血管新生を促進し、Tie2は血管新生を促進するアンジオポエチンの受容体です。
血管周囲に存在してTie2とVEGFAを高発現しているマクロファージは血管内皮細胞間の細胞接合を解離させて、移動能の亢進した(Mena高発現の)がん細胞の血管内侵入を手助けしています。
このメカニズムは動物実験だけでなく、人間の乳がん組織で証明されています。つまり、術前補助化学療法を受けた乳がん患者を対象に、補助化学療法の前と後でTMEMを比較すると、TMEMの密度が亢進していることや、血行性転移の存在する乳がんの原発巣のがん組織では、血行性転移のない乳がん組織よりもTMEM密度が高いことが明らかになっています。
抗がん剤治療が非常に良く効いて病理学的完全奏功になった場合は、術前補助化学療法は生存率を高めることは多くの臨床試験で確かめられています。
しかし、抗がん剤であまり縮小しなかった場合は、むしろ血行性転移を促進して、再発を促進する可能性があることも指摘されています。
つまり、術前補助化学療法を受けるときは、病理学的完全奏功を目指すか、血行性転移を防ぐか、どちらかあるいは両方の手段を併用することが有用と言えます。
病理学的完全奏功を達成するためには、がん細胞(特にがん幹細胞)の抗がん剤感受性を高める方法として、2-デオキシ-D-グルコース、メトホルミン、ジクロロ酢酸ナトリウム、ジスルフィラムなどが有用です(583話、584話参照)
血行性転移を防ぐ方法としては、マクロファージや血管内皮細胞前駆細胞の腫瘍組織への動員や活性化を防ぐ方法が考えられます。
シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)はマクロファージをM1型からM2型に変換して活性化します。
したがって、COX-2阻害剤のセレコックス(celecoxib)とSTAT3活性を阻害するオーラノフィン(427話)やジインドリルメタン(428話)が有効です。
術前補助化学療法は、効かなければ(腫瘍が縮小しなければ、あるいは消滅しなければ)、転移や再発を促進する可能性があります。これらの補完療法を併用する価値はかなり高いと言えます。
実際に、ワールブルグ効果をターゲットにした治療を抗がん剤治療と併用すると、奏功率がかなり上がることを多数経験しています。
しかし、この治療に使用される薬が保険適応外使用(糖尿病治療薬のメトホルミン、断酒薬のジスルフィラム、リュウマチ治療薬のオーラノフィンなど)のものか、サプリメント(ジインドリルメタン、アルテスネイトなど)か、古くから知られていて特許が取れない物質(2-デオキシ-D-グルコース、ジクロロ酢酸など)であるため、標準治療で使用されることは永久に無いと言えます。
| « 586)抗がん剤... | 588)酸素ナノ... » |



