がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
686)メトホルミンは塩化物細胞内チャネル1(CLIC1)活性を阻害して膠芽腫細胞の増殖を抑制する
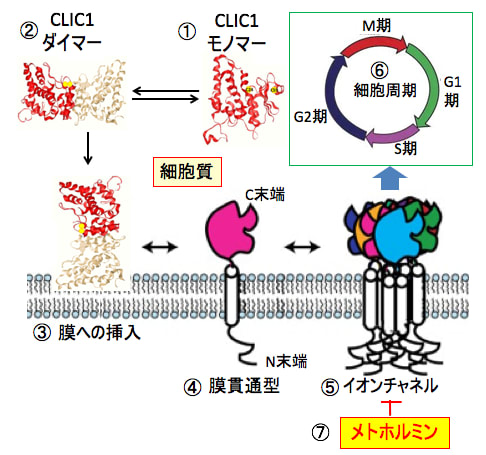
図:塩化物細胞内チャネル1(Chloride Intracellular Channel 1:CLIC1)は細胞質内にモノマー(単量体)として存在し(①)、様々な刺激やシグナルでダイマー(二量体)を形成したのち(②)、細胞膜に挿入される(③)。膜に挿入されたCLIC1は膜貫通型になり(④)、多量体を形成して陰イオンを通過させるイオンチャネルになる(⑤)。イオンチャネルを形成するCLIC1は細胞周期の進行に必要な働きを担っている(⑥)。メトホルミンはイオンチャネルになったCLIC1に結合して陰イオンを通過させるチャネル機能を阻害する(⑦)。がん細胞はCLIC1が過剰発現しており、細胞分裂が亢進している。メトホルミンによるがん細胞増殖抑制作用の機序の一つとして、CLIC1阻害作用が報告されている。
686)メトホルミンは塩化物細胞内チャネル1(CLIC1)活性を阻害して膠芽腫細胞の増殖を抑制する
【体内には50種類以上のミネラルが存在する】
ミネラルとは元素のことです。元素というのは物質を構成する最小の単位で、この世の全ての物質は全て元素からできており、私達の体も元素の寄せ集めです。
地球上には100種類以上の元素が知られていますが、このうち私達の体からは50種類以上の元素が見つかっています。
酸素(O)・炭素(C)・水素(H)・窒素(N)の4種類の非金属元素が約96.6%を占め、次のカルシウム(Ca)、リン(P)、硫黄(S)、カリウム(K)、ナトリウム(Na)、塩素(Cl)、マグネシウム(Mg)、ケイ素(Si)の8つの主要な微量ミネラルを合わせて約3.3%、残りのわずか0.1%以下の中に40種類以上の微量ミネラルが含まれています。微量ミネラルの中には、鉄(Fe)、フッ素(F)、亜鉛(Zn)、ルビジウム(Rb),ストロンチウム(Sr)、臭素(Br)、銅(Cu)、セレン(Se)などがあります。
太古の昔、生き物は海から発生しました。その海には多くのミネラルが豊富に存在し、生物が進化する過程で、必然的にこれらのミネラルを複雑な生命機能の働きに利用するようになったのです。
体の骨格を作るためにカルシウムやリンを利用し、酸素や二酸化炭素を運ぶために鉄や銅が利用され、細胞の活動性を調節するためにナトリウムやカリウムが利用されています。
【細胞の外と内では電解質の組成が大きく異なる】
体液や細胞内に存在する電解質はプラスかマイナスの電荷を持っています。プラス電荷を持つ電解質を陽イオン(Cation)といい、ナトリウム(Na+)、カリウム(K+)、カルシウム(Ca2+)、マグネシウム(Mg2+)などがあります。
マイナスの電荷を持つ電解質を陰イオン(Anion)といい、塩素(Cl-)、リン酸塩(HPO42-)、重炭酸塩(HCO3-)などがあります。
この電解質の組成は細胞の外と内では大きな違いがあります。
体液中(血漿や間質液)における主たる電解質は 塩化ナトリウム(NaCl) であり、体重の 60~66% を占める水に溶け、大部分はナトリウムイオン(Na+)と塩素イオン(Cl−)とに解離して存在しています。
血漿中および間質液中の Cl− は、総陰イオン(アニオン)濃度の約 65% および 70% を占めています。これらの細胞外液と海水の電解質組成を比較すると、海水の方が濃度は約3.5倍濃いのですが、組成比率は相似しています。つまり、生物は原始海水において生まれ、現在の海水は原始海水からかなり濃縮されたことが推定されています。
一方、細胞内液では。陽イオンはK+とMg2+が主体で、陰イオンはリン酸イオン(HPO42-)や硫酸イオン(SO42-)やタンパク質が主体になります。(下図)

図:細胞外液にはNa+とCl-が多く存在し、細胞内液にはK+、Mg2+、HPO42-、SO42-が多く存在する。
【細胞内の塩素イオンは多彩な生理機能の制御に関与している】
多くのイオンが体内で様々な働きを担っていますが、ここでは塩素イオン(クロライドイオン)に絞ってその体内での分布と働きを解説します。最近の研究で、細胞内の塩素イオンの制御ががん治療薬の開発のターゲットになっています。
クロライドイオンは血液中に存在する陰イオンで一番多い成分です。血液中で2番目に多い陰イオンは重炭酸イオン(HCO3-)です。
クロライドイオンは細胞内にも存在して、重要な働きを担っていますが、その濃度は細胞外液(血漿)の30分の1程度です(下表)。

表:細胞外と細胞内の主要な電解質の濃度。塩素イオン(Cl-)は細胞外で最も多い陰イオンで、細胞内の濃度は低い。
電解質は細胞膜の通路(チャネル)を通って濃度勾配によって移動します。濃度勾配に逆らって移動する場合は、ATPのエネルギーを使ったポンプによって移動します。
塩素イオン(クロライドイオン)の細胞内の分布や濃度を制御するクロライドイオン(Cl-)チャネルが広く全身の細胞膜に分布しています。
その役割は、静止電位の形成や変化、興奮性の抑制や亢進、Cl-や水の輸送、細胞容積の調節などがあります。
さらに、細胞分裂や増殖、細胞死の制御など多様な細胞機能にも深く関与しています。
塩素イオンチャネルには多数の種類の存在が知られていますが、未だに同定されていない塩素イオンチャネル分子も存在します。
一般に、Na+、K+、Ca2+といった陽イオンの細胞内濃度変化は、神経興奮、神経伝達物質の放出、筋の興奮・収縮など様々な細胞機能に重要な役割を果たしていることが知られています。
一方、陰イオンの細胞内における生理的な役割については、ほとんど着目されていませんでした。しかし、細胞内のCl-は生理的な条件下でも変化していることが明らかになっており、様々な細胞機能制御に関与している事が明らかになっています。
【細胞内の塩素イオン・チャネルががん治療のターゲットになっている】
細胞内の塩素イオンの変化が、がん細胞の増殖、細胞接着や細胞運動能に影響することが明らかになり、塩素イオンチャネルががん治療のターゲットとして注目されています。
イオンチャネルは、細胞表面や細胞内小器官を覆う膜に存在し、細孔を形成する膜タンパク質です。
細胞のコンパートメント間でのイオンの通過を制御し、細胞の増殖や運動や生存の調節に重要な働きを担っています。
イオンチャネルの構造や機能の異常は、がんを含むいくつかのヒト疾患を引き起こします。
特に、イオンチャネル活性の変化は、細胞のがん化に関連し、細胞増殖の亢進、アポトーシス抵抗性、運動や浸潤能の亢進を引き起こします。
細胞膜のイオンチャネルの役割は広く研究されていますが、細胞内イオンチャネルについてはあまり知られていません。
細胞質で不活性なこれらの分子は、膜に自動挿入され、イオンチャネルとして働き、細胞周期、アポトーシス、細胞接着および運動性を調節することが認められています。
そのため、細胞内イオンチャネルの薬理学的制御は、革新的な治療法となる可能性を持っています。
様々なイオンチャネルががん細胞の発生や増殖に関連していますが、塩化物細胞内チャネル(Chloride Intracellular Channel Protein :CLIC)ファミリーが最近特に注目を集めています。
CLICグループの6つのメンバー(CLIC1-6)は、可溶性および膜結合型の両方で存在し、哺乳類組織で細胞特異的発現および生物学的機能を示し、従来の塩化物チャネルとして機能するのではなく、それぞれの異なる細胞で特有の生理学的役割を有します。
CLIC1はこのファミリータンパク質の中で最も広く発現しており、最も研究されています。CLIC1は正常細胞の生理機能や、脳機能やがん細胞増殖を含む病的状態において、重要な働きを担っています。
【塩化物細胞内チャネル(CLIC)は可溶性と膜貫通型が存在する】
塩化物細胞内チャネル1(CLIC1)は、細胞質内において可溶性で存在する状態から膜貫通型に切り替えることができるタンパク質です。
したがって、CLIC1は3つの異なる状態で存在します。すなわち、単量体の可溶性の形態、酸化された可溶性の二量体の中間体の形態、および完全な膜貫通型の形態です(下図)。

図:塩化物細胞内チャネル1(Chloride Intracellular Channel 1:CLIC1)は細胞質内でモノマー(単量体)として存在し(①)、様々な刺激やシグナルでダイマー(二量体)を形成したのち(②)、細胞膜に挿入される(③)。膜に挿入されたCLIC1は膜貫通型になり(④)、多量体を形成して陰イオンを通過させるイオンチャネルになる(⑤)。
二量体の形成は、2つの保存されたシステイン残基、Cys-24とCys-59をつなぐジスルフィド結合を介して安定化されます。Cys-24あるいはCys-59の変異によりチャネル形成が妨げられます。
Cys-24残基は、タンパク質の酸化還元調節のために必要とされており、CLIC1の膜挿入は活性酸素種によって制御されていると考えられています。膜結合は、オリゴマーCLIC1複合体の形成を意味します。

図:塩化物細胞内チャネル1(CLIC1)は細胞質内でモノマー(単量体)の状態で存在し、酸化条件下でダイマー(二量体)を形成する。二量体の形成は、2つのシステイン残基(Cys-24とCys-59)をつなぐジスルフィド結合を介して安定化される。モノマーとダイマーの変換は可逆的で、酸化還元状態によって相互に移行する。
【CLIC1の過剰発現しているがんは予後が悪い】
過去数年間で、がん細胞の発生と進行における重要な因子としての塩化物細胞内チャネル1(CLIC1)の役割が明らかになりつつあります。
塩化物チャネルとして機能するCLIC1は、腫瘍形成において重要な役割を果たしており、細胞体積の調節、細胞遊走と浸潤、および血管新生の制御に関連しています。
細胞分裂過程において、特に細胞周期進行のG1/S期移行の調節に関与します。
つまり、CLIC1活性は、細胞周期の進行と細胞分裂を促進します。正常細胞ではこの機能的発現はG1 / S期の移行中に一時的に発生しますが、がん細胞では恒常的に活性化しており、増殖速度の加速につながります。
CLIC1は、周囲の正常組織と比較して、乳がんや卵巣がんや膀胱がんなどいくつかのヒト固形腫瘍で過剰発現していることが報告されています。
さらに、大腸がん、胃癌、肝細胞がん、胆嚢がん、膵臓がん、肺がん、および肉腫においてCLIC1の発現亢進が予後不良と関連していることが報告されています。
多くの種類のがん細胞において、遺伝子変異による異常は少なく、腫瘍形成におけるCLIC1の役割は変異よりも膜局在および活性に関連していることが明らかになっています。
【メトホルミンはCLIC1活性を阻害して膠芽細胞腫の増殖を抑える】
糖尿病治療薬のメトホルミンが塩化物細胞内チャネルの活性を阻害することが報告されています。以下のような報告があります。
Repurposed Biguanide Drugs in Glioblastoma Exert Antiproliferative Effects via the Inhibition of Intracellular Chloride Channel 1 Activity.(膠芽腫における再目的化されたビグアナイド薬は、細胞内塩化物チャネル1活性の阻害を介して抗増殖効果を発揮する)Front Oncol. 2019 Mar 13;9:135.
【要旨】
神経膠芽腫の発生と進行に関する分子メカニズムは不明な点も多く、血液脳関門を通過する薬剤も少ないため、神経膠芽腫に対する新規かつ有効な薬物の発見は困難な状況にある。 神経膠芽腫の増殖を制御する因子の中で、塩化物細胞内チャネル1(chloride intracellular channel 1:CLIC1)は、有望な治療標的であると同時に、予後を予測するバイオマーカーとしても注目されている。
CLIC1は、細胞質に存在するものと、細胞膜に存在するものとがあり、細胞膜に存在するCLIC1は塩化物選択的イオンチャネルとして機能する。
CLIC1はいくつかの生理学的な細胞機能に関与しており、その異常な発現はがん細胞の発生を引き起こし、がん細胞の増殖、浸潤、転移を促進する。
CLIC1の過剰発現は、神経膠芽腫を含むさまざまなヒト固形腫瘍の浸潤的な性質と関連しており、その発現レベルは予後不良と相関している。
さらに、ミクログリアにおけるイオンチャネル活性の変化、特にCLIC1活性の変化は、様々な神経疾患や脳腫瘍の発生に寄与することを示す証拠が増えている。
興味深いことに、CLIC1はがん幹細胞において恒常的に活性化されているが、非がん幹細胞亜集団の生存や正常細胞の機能との関連性は低い。
がん幹細胞は神経膠芽腫瘍の増殖と進行を引き起こし、幹細胞様特性(自己再生と分化)は治療に抵抗し、増殖を促進し、腫瘍の再発を引き起こす。
CLIC1の発現抑制により、in vitroおよびin vivoで神経膠芽腫の幹細胞の増殖が大幅に抑制される。これは、CLIC1の活性の制御が革新的な薬理学的標的になる可能性を示唆している。
最近の研究で、メトホルミンなどのビグアナイドに属する薬物が、がん幹細胞のCLIC1活性を選択的に阻害して、その生存率と侵襲性を低下させるが、正常細胞の幹細胞には影響しないことが報告されている。これは安全性の高い新規のがん治療薬となりうることを示唆している。
以上のような観点から、神経膠芽腫に対する選択的薬理学的ターゲットとしてのCLIC1の生物学的役割に関して考察する。さらに、古くからある薬あるいは新薬から、CLIC1活性を機能的に標的とすることができる薬を探索し、CLIC1標的療法の課題と開発について議論する。
神経膠芽腫では、いくつかのイオンチャネルの発現と機能の異常が見つかっており、特にCLIC1遺伝子の発現亢進が高頻度に見つかっています。つまり、CLIC1のmRNAとタンパク質のレベルは、正常な脳実質と比較して神経膠芽腫で増大しています。
特に、悪性度の高い膠芽腫ほどCLIC1の発現レベルが亢進していることが報告されています。膠芽腫のがん幹細胞でCLIC1の発現が亢進していることが明らかになっています。
糖尿病治療薬のメトホルミンが、CLIC1活性を阻害することによって膠芽腫のがん幹細胞の増殖を阻害し、細胞死(アポトーシス)を誘導するということです。
メトホルミンが神経膠芽腫のがん幹細胞をターゲットにして抗がん剤治療の効果を増強することは2012年頃から知られています。
膠芽腫(グリオブラストーマ)のがん幹細胞の抗がん剤感受性を高める方法として、国立がんセンターと山形大学医学部の研究グループは、FoxO3aという転写因子の活性化が有効であることを示し、FoxO3aを活性化する薬として経口糖尿病薬のメトホルミンの有効性を2012年頃に報告しています。
この研究の内容に関しては当時のニュースでも紹介されて話題になりました。
2012/11/16 (日本経済新聞)
http://www.nikkei.com/article/DGXNASDG15056_W2A111C1CR0000/
糖尿病薬、がん治療に効果 山形大と国立がん研究センター:
山形大医学部と国立がん研究センターの共同研究チームは、糖尿病の治療薬「メトホルミン」が、がん治療に効果があることを発見したと発表した。既に治療に使われている薬のため、新薬を開発するよりも短期間での実用化が期待できるという。研究成果は15日付の米科学誌電子版に掲載。
共同研究チームによると、がん治療では腫瘍の再発が課題で、新しい腫瘍をつくる「がん幹細胞」の働きを変えることが重要とされている。
チームのこれまでの研究で、悪性脳腫瘍のがん幹細胞の中にある「FoxO3」という分子が活性化すると、がん幹細胞が再発不可能な細胞に変化することが分かっていた。
今回、研究チームはメトホルミンにFoxO3を活性化させる作用があることを発見。腫瘍細胞を植えたマウスに、10日間メトホルミンを投与したところ、新たな脳腫瘍が形成されることなく、がん幹細胞が消失する効果などが確認できたという。
記者会見した山形大医学部の北中千史教授(分子腫瘍学)は「メトホルミンは全ての人に使える薬ではないが、ほかのがんにも応用できる可能性が示された」と話した。〔共同〕
関連論文:Glioma-initiating cell elimination by metformin activation of FOXO3 via AMPK.(メトホルミンによるAMPKを介したFOXO3の活性化によるグリオーマ始原細胞の排除)Stem Cells Transl Med. 1(11):811-24. 2012年
こはは、7年前の報告です。
メトホルミンがFoxO3を活性化して膠芽腫のがん幹細胞を死滅するという内容です。
増殖シグナルの伝達系であるPI3K(phosphoinositide-3-kinase)/Akt/mTOR(mammalian target of rapamycin)経路とMEK(mitogen-activated protein/extracellular signal-related kinase kinase)/ERK(extracellular signal-regulated kinase)経路の両方を阻害するとグリオブラストーマ幹細胞の分化を誘導し、腫瘍形成能を抑制し、抗がん剤や放射線治療の感受性を高めることができることが報告されています。
これらのシグナル伝達系を阻害するとFoxO3aという転写因子が活性化され、このFoxO3aの活性化がグリオブラストーマ幹細胞の分化誘導や腫瘍形成能抑制に関与していることを、これらの研究グループが明らかにしたという内容です。
つまり、膠芽腫幹細胞のFoxO3aを活性化すれば、増殖の能力の無いがん細胞に変化し、再発を予防する効果が高まるという内容です。
そして、経口糖尿病薬のメトホルミンがFoxO3aを活性化する作用をもっているので、膠芽腫細胞の治療にメトホルミンが役に立つということです。
メトホルミンがAMP活性化プロテインキナーゼ(AMPK)を活性化し、AMPKがFoxO3aを活性化すること、メトホルミンがAMPKを活性化することは、この報告以前の他の論文にもすでに発表されています。
前述の論文では、メトホルミンによる膠芽腫細胞のがん幹細胞を死滅する作用が、CLIC1の活性を阻害する作用も関連することを指摘しています。
膠芽腫細胞以外でも、メトホルミンががん幹細胞の抗がん剤感受性を高めることが報告されていますので、多くのがんの抗がん剤治療においてメトホルミンの併用は有用だと思います。
非糖尿病患者を含めて、メトホルミンが多くのがん患者の生存率を改善すること、抗がん剤治療の有効性を高めることを前回(685話)解説しました。
塩化物細胞内チャネル1(CLIC1)の阻害作用もメトホルミンの抗腫瘍効果のメカニズムとして提唱されています。
いずれにしても、膠芽腫(グリオブラストーマ)を含め、多くのがんの治療においてメトホルミンを使用する根拠は大きいと思います。
【コレステロールはCLIC1の膜挿入を促進する】
コレステロールとCLICは結合する部分があり、CLICが膜に挿入されてイオンチャネルとして機能するには膜のコレステロールが必要という報告があります。
X-ray and Neutron Reflectivity Study Shows That CLIC1 Undergoes Cholesterol-Dependent Structural Reorganization in Lipid Monolayers
Langmuir ( IF 3.683 ) Pub Date : 2017-10-20 , DOI: 10.1021/acs.langmuir.7b02872
前述のように、CLIC1は単量体の形で細胞質に存在し、二量体になったCLIC1は膜に結合して挿入されてからイオンチャネルを形成するように構造が変化します。
このCLIC1の膜挿入には膜を構成する脂質の状態によって制御されており、特にコレステロールの存在が、CLIC1の膜挿入とイオンチャネル形成を促進するという研究結果です。
この報告では、コレステロールを欠損させた細胞膜にはCLIC1は挿入できないという実験結果を示しています。
コレステロールはCLIC1の膜への結合を促進するだけでなく、脂質を貫通して膜に挿入される過程もコレステロールの存在で促進されるという結果です。(下図)

図:細胞膜にコレステロールがないと、塩化物細胞内イオンチャネル1(CLIC1)は膜のリン脂質層を貫通できないので、イオンチャネル形成が阻害される。
この研究結果は、コレステロールの産生を阻害するスタチンがCLIC1のイオンチャネル活性を阻害する可能性を示唆しています。
がん治療において、メトホルミンとスタチン(特に脂溶性のシンバスタチンとアトルバスタチン)の併用が、相乗的な抗腫瘍活性を発揮することが数多く報告されています。
塩化物細胞内イオンチャネルの活性においても、メトホルミンとスタチンは異なるメカニズムで阻害作用を有するので、メトホルミンとスタチンの抗腫瘍効果における相乗作用のメカニズムとして塩化物細胞内イオンチャネルの阻害作用も関連する可能性があるかもしれません。
| « 685)メトホル... | 687) 腫瘍関連... » |



