がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
688) 腫瘍関連マクロファージをターゲットにしたがん治療(その2):メトホルミンと2-デオキシ-D-グルコースはマクロファージのM2型をM1型に誘導する
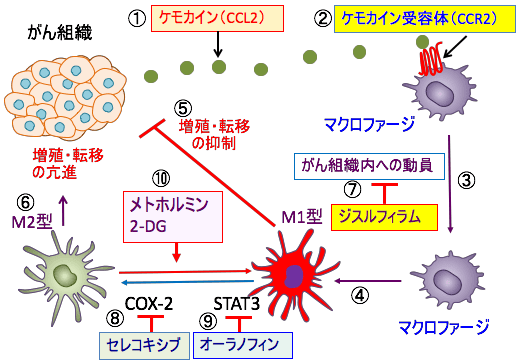
図:がん細胞からケモカインのCCL2が分泌され(①)、マクロファージのケモカイン受容体のCCR2に結合すると(②)、マクロファージはがん組織へと誘引される(③)。がん組織内では腫瘍関連マクロファージとなり、M1型とM2型に分極する(④)。M1型のマクロファージはがん細胞の増殖や転移を抑制する(⑤)。腫瘍関連マクロファージはシクロオキシゲナーゼ-2(COX-2)から産生されるプロスタグランジンE2や、シグナル伝達兼転写活性化因子3(STAT3)の活性化によってM2型の腫瘍関連マクロファージになり、がん細胞の増殖や転移を促進する(⑥)。アルコール依存症治療薬のジスルフィラムは、CCR2のシグナル伝達を阻止することによって、マクロファージがケモカインを目指して進もうとする反応(走化性)を抑制し、マクロファージのがん組織への動員を阻止する(⑦)。COX-2阻害剤のセレコキシブ(⑧)とSTAT3阻害作用のあるオーラノフィン(⑨)は腫瘍関連マクロファージのM2型への変換を阻止することによって、がん細胞の増殖と転移を抑制する。メトホルミンと2-デオキシ-D-グルコース(2-DG)は腫瘍関連マクロファージをM2型からM1型に誘導することによって抗腫瘍効果を発揮する(⑩)。これらの薬を組み合わせると、がん組織内のM2型腫瘍関連マクロファージを枯渇して、がん細胞の増殖・転移を抑制できる。
688) 腫瘍関連マクロファージをターゲットにしたがん治療(その2):メトホルミンと2-デオキシ-D-グルコースはマクロファージのM2型をM1型に誘導する
【炎症反応や免疫応答は様々なメディエーターで制御されている】
生体は、相反する作用を示す2つあるいは複数の制御機構のバランスで体の病的状態(バランスの偏位)を是正し、正常状態に回復し、恒常性を維持しています。
例えば、心拍数は交感神経によって早まり、副交感神経によって減少するという制御機構によって、体の状況に応じて心拍数を制御しています。
尿量は、利尿作用のあるホルモンと、抗利尿作用のあるホルモンのバランスによって決められ、脱水状態や浮腫みなどの病的状態を是正します。
このように、全ての生理機能は、相反する生理作用が相互にバランスをとって調節しています。
免疫応答や炎症反応も多数のサイトカインやケモカインによる複雑なネットワークと、相反する働きをもった細胞のバランスで、様々な異常状態を是正し、病気を治します。
外傷や感染などに反応して炎症細胞や線維芽細胞が動員され、急性炎症反応が起こります。異物の排除が完了すると炎症反応は速やかに消散し、組織の修復過程に移行します。炎症反応が終了することを「炎症の収束(resolution of inflammation)」と言います。
炎症の収束は、これまで起炎反応(炎症を引き起こす反応)の減弱化によると考えられてきましたが、最近の研究で、受動的なものではなく、能動的な機構であることが明らかになっています。つまり、積極的に炎症を抑制するメカニズムが存在します。
急性炎症の特徴は白血球の組織への浸潤に伴う浮腫、発赤、発熱、痛みなどで、これらの反応にはアラキドン酸から生成されるプロスタグランジンやロイコトリエンなどの脂質メディエーターが関与します。
これらの物質によって好中球の浸潤や活性化、血管透過性の亢進などの炎症反応が起こります。
炎症の収束過程においては炎症性サイトカインの産生が抑制され、血管透過性が正常に戻り、好中球の遊走阻止や浸出液中のリンパ球の除去や、マクロファージによる死滅した細胞の除去などが起こります。
この炎症の収束過程には、炎症を抑制する抗炎症性メディエーターや抗炎症性の細胞が積極的に関与します。
【マクロファージは自然免疫と獲得免疫を活性化する】
血中を循環する単球は、皮膚などの末梢組織に入るとマクロファージとよばれる細胞に分化します。表皮のランゲルハンス細胞、脳組織のミクログリア細胞、骨の破骨細胞、肝臓のクッパー細胞などは組織に常在するマクロファージの仲間です。
マクロファージ(macrophage)は「macros(大きい)」と「phagein(食べる)」というギリシャ語を起源に命名された白血球の一種です。日本語では貪食細胞や大食細胞とも訳されます。
生体内をアメーバ様運動する遊走性の食細胞で、死んだ細胞やその破片、体内に生じた変性物質や侵入した細菌などの異物を捕食して消化し、清掃屋の役割を果たします。外傷や炎症の際に中心的な役割を担っています。がん細胞に対する免疫応答(免疫監視機構)においても重要な役割を担っています。
免疫システムは病原体やがん細胞から生体を守る働きを担っています。この免疫システムは自然免疫と獲得免疫に分けられます。
自然免疫は先天的に備わった免疫で、微生物などに特有の分子パターンを認識して異物を攻撃します。マクロファージや好中球には細菌などの病原体に共通した情報を認識できる受容体を細胞表面に持っていて、病原体を認識して貪食します。
さらにマクロファージはナチュラルキラー細胞を活性化します。
ナチュラルキラー(natural killer)細胞(略してNK細胞)は、ターゲットの細胞を殺すのにT細胞と異なり事前に感作させておく必要が無いことから、生まれつき(natural)の細胞傷害性細胞(killer cell)という意味で名付けられました。
「感作」というのは、前もって抗原に対する認識能を高めておくことで、感作させておく必要がないというのは、初めて出あった細胞でも、直ちにその異常細胞を認識して攻撃できるということです。
ナチュラルキラー細胞(NK細胞)は、MHCクラスI分子が喪失した細胞(自己性を喪失した異常な細胞)を認識して攻撃します。
NK細胞の細胞質にはパーフォリンやグランザイムといった細胞傷害性のタンパク質をもち、これらを放出してターゲットの細胞を死滅させます。
がん細胞を見つけると直ちに攻撃するため、がんに対する第一次防衛機構として、特に発がん過程の初期段階でのがん細胞の排除において重要な役割を果たしています。
一方、獲得免疫は,後天的に外来異物の刺激に応じて形成される免疫です。高度な抗原特異性と免疫記憶を特徴とします。
マクロファージや樹状細胞が、がん細胞からがん抗原ペプチドと呼ばれる小さな蛋白質を捕足し、その情報がヘルパーT細胞に伝えられ、その情報に従って特定のがん抗原に対する免疫応答が引き起こされるのが獲得免疫です。
T細胞は、がん抗原で活性化されて初めて細胞傷害活性を持つようになります。すなわち、細胞傷害活性を持たないT細胞が抗原提示細胞から抗原ペプチド(がん抗原)を提示されて活性化してはじめてがん細胞に対して特異的な細胞傷害活性を持つ細胞傷害性T細胞(キラーT細胞)となり、がん細胞を攻撃するようになります。
細胞傷害性T細胞(CTL)は細胞傷害物質であるパーフォリン、グランザイム、 TNF(tumor necrosis factor)などを放出したり、ターゲット細胞のFasを刺激してアポトーシスに陥らせることでがん細胞やウイルス感染細胞を死滅させます。
細胞傷害性T細胞の一部はメモリーT細胞となって、異物に対する細胞傷害活性を持ったまま宿主内に記憶され、次に同じ異物(抗原)に暴露された場合に対応できるよう備えます。

図:活性化したマクロファージはナチュラルキラー細胞(NK細胞)を活性化する(①)。活性化されたマクロファージやNK細胞などががん細胞を攻撃してがん細胞の破壊が起こる(②)。破壊されたがん細胞から放出されたがん抗原が樹状細胞に取込まれる(③)。抗原による感作の必要のないがん細胞に対する第一次防衛機構が「自然免疫」となる。がん抗原を貪食した樹状細胞はがん抗原の情報をT細胞やB細胞に渡して活性化する(④)。がん抗原特異的な免疫応答によるがん細胞の攻撃が「獲得免疫」となる(⑤)。
【マクロファージはT細胞を活性化してがん細胞を攻撃する】
最近はオプジーボやヤーボイなどの免疫チョックポイント阻害剤を使った治療の有効性が数多く報告されています。
免疫チェックポイント阻害剤はT細胞によるがん細胞への攻撃を活性化します。しかし、がん組織は酸性化や栄養枯渇などの要因で、T細胞が働きにくい環境にあります。がん組織にはT細胞の働きを阻害する細胞も集まっています。
このような免疫抑制性の微小環境の存在が免疫チェックポイント阻害剤の効き目を阻害しています。
したがって、免疫チョックポイント阻害剤などの免疫療法の効き目を高めるためには、免疫抑制性の微小環境を改善することが重要です。
がん細胞に対する免疫細胞の攻撃の機序と、T細胞の働きを阻害するがん組織の微小環境とその改善の仕方を理解することはがん治療において重要です。
リンパ球にはB細胞・T細胞・ナチュラルキラー細胞などがあります。
B細胞は抗体を使って細菌やウイルスを攻撃するもので、これを「液性免疫」といいます。
一方、ウイルス感染細胞やがん細胞など自分の細胞に隠れている異常を発見して、Tリンパ球などが直接攻撃する免疫の仕組みを「細胞性免疫」といいます。
この液性免疫と細胞性免疫の制御は2種類のヘルパーT細胞 (Th) のバランスによって決まります。
ヘルパーT細胞は、B細胞やT細胞の増殖や働きを調節するタンパク質(サイトカイン)を分泌して、液性免疫と細胞性免疫のバランスを調節しており、そのサイトカインの産生パターンから、Th1(1型ヘルパーT) 細胞とTh2(2型ヘルパーT) 細胞に分類されます。
Th1細胞はインターフェロン・ガンマ(IFN-γ)や インターロイキン-2(IL-2)を分泌して細胞性免疫に関与し、Th2細胞はIL-4, IL-5, IL-6, IL-10などを分泌して液性免疫に関与します。
ヘルパーT前駆細胞(Th0)がTh1細胞になるためにはマクロファージや樹状細胞から分泌されるIL-12が必要であり、一方、Th2細胞となるためにはT細胞から分泌されるIL-4が必要とされています。

図:ヘルパーT前駆細胞(Th0)は1型ヘルパーT細胞(Th1)と2型ヘルパーT細胞(Th2)に分化誘導される(①)。 Th1細胞はインターフェロン・ガンマ(IFN-γ)や インターロイキン-2(IL-2)を分泌して細胞性免疫に関与し(②)、Th2細胞はIL-4, IL-5, IL-6, IL-10などを分泌して液性免疫に関与する(③)。ヘルパーT前駆細胞(Th0)がTh1細胞になるためにはマクロファージや樹状細胞から分泌されるIL-12が必要であり(④)、一方、Th2細胞となるためにはT細胞から分泌されるIL-4が必要とされている(⑤)。Th1細胞はナチュラルキラー(NK)細胞(⑥)やキラーT細胞(⑦)を活性化してがん細胞を攻撃する。
【がん組織内のマクロファージはがん細胞の増殖や転移を促進している】
さて、前述の説明から論理的に導かれる結論は「がん組織内のマクロファージはがん細胞を攻撃(排除)するために働いている」ということになります。
マクロファージはがん細胞を排除する自然免疫と獲得免疫の中心で働いているはずなので、マクロファージが多いほど、がん細胞への攻撃が強いと思われます。
しかし、多くの場合、事実はその逆です。
「腫瘍組織内にマクロファージの数が多いほど予後が悪い」ことが報告されています。
マクロファージはがん細胞を攻撃することができますが、がん組織の中では、がん細胞に都合の良いように操られているからです。つまり、がん組織内のマクロファージは、がん細胞を攻撃するのではなく、がん細胞の増殖や転移を促進するように作用して、がんを悪化させるように働いているのです。
がんの生物学において、比較的長い間、マクロファージはホストを守るために活動していると考えられてきました。
伝統的に、マクロファージはがん細胞や病原菌を貪食して排除することによって、正常組織を病原菌やがん細胞の攻撃から守る働きを担っていると考えられてきました。
がん組織内にはマクロファージが多数存在します。マクロファージに特異的に発現するタンパク質マーカーで免疫染色すると、がん組織内にマクロファージが多数存在することが簡単にわかります。(下図)

図:マクロファージのマーカー(CD68)に対する抗体を用いた免疫染色でマクロファージが黒褐色に染められている。他の細胞はがん細胞で、がん組織内に多数のマクロファージが存在している状態を示している。
このようながん組織内のマクロファージはがん細胞を排除するために集まっていると考えられていましたが、そうとは限らないようです。
がん組織に浸潤したマクロファージを腫瘍関連マクロファージ(tumor-associated macrophage:TAM)と言い、血管新生促進、増殖因子産生亢進、免疫抑制、転移促進などのさまざまな作用によりがん細胞の発生と悪性化を促進する働きをしています。
活性化したマクロファージから産生されるプロスタグランジンE2や炎症性サイトカイン(IL-6やTNF-αなど)はがん細胞を悪化させ、抗腫瘍免疫を抑制してがん細胞の増殖を促進し、転移や再発を促進することが明らかになっています。
マクロファージは、炎症を促進する働きのM1型と、炎症を抑制し収束させる働きのM2型があり、そのバランスで、炎症や免疫が制御されています。
M1型はがん細胞を攻撃する作用がありますが、炎症と組織傷害を進める作用があります。
一方、M2型は炎症を収束させるように働きますが、細胞傷害性T細胞(CTL)活性を抑制して抗腫瘍免疫を阻止する作用を持っています。さらに、M2型はがん細胞の増殖や浸潤や血管新生を促進する作用を持っています。
がんの免疫療法の効果を高めるためにはM1型を亢進し、M2型を抑制することが重要と考えられています。

図:マクロファージの古典的な活性化(classical activation of macrophages)は組織傷害や病原体の感染によって引き起こされ、リポポリサッカライド(LPS)、インターフェロン-ガンマ(INF-γ)、tumor necrosis factor-α (TNF-α)などによって活性化され、炎症を促進するサイトカイン(TNF-α, IL-1, IL-6, IL-12など)や活性酸素や一酸化窒素を産生し、炎症促進、殺菌、抗がん、Th1応答、抗原提示、組織傷害などに関与する。
一方、M2型マクロファージは、IL-4、IL-10、IL13などで誘導され、炎症を収束させ、組織の修復を促進する抗炎症性のサイトカイン(IL-10, IL-4, TGF-βなど)やアルギナーゼ-1を産生し、これらはがん細胞の増殖や血管新生を促進し、がん細胞や病原体に対する免疫反応を低下させる。(参考:Oncotarget. 2018; 9:17937-17950)
IFN-γはマクロファージをM1型(classically activated macrophage)に分化させ、炎症を促進します。
Th2細胞から産生されるIL-4はマクロファージをM2型(alternatively activated macrophage) に誘導し、炎症を抑制します。
M1マクロファージは炎症を促進する炎症性サイトカインやケモカインを産生し、がん細胞を死滅する作用を発揮し、抗原提示に関与してがん細胞や病原体に対する免疫応答に関与します。M1マクロファージが産生する主な炎症性サイトカインはIL-6、IL-12とTNF-αです。
M2マクロファージはArginase-I, IL-10、 TGF-βやその他の抗炎症性のサイトカインを産生し、炎症を抑制し、創傷治癒や組織修復に重要な働きを担っていますが、がん細胞の増殖を促進し、免疫応答を抑制します。
つまり、腫瘍組織内のマクロファージは「両刃の剣(double-edged sword)」であり、がん細胞の増殖を抑制する作用と、増殖や転移を促進する作用の2面性があるのです。
そして、多くの場合、腫瘍関連マクロファージはM2型になって、がんを悪化させる働きを行なっているのが問題なのです。

図:シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)は腫瘍関連マクロファージ(Tumor-associated macrophage: TAM)をM1型からM2型に変換して活性化する(①)。M2型TAMはVEGF, FGF-2, IL-1, IL-8を産生して血管新生を亢進し(②)、EGF, FGF-2, IL-6, TGF-β, PDGFを産生してがん細胞の増殖を亢進する(③)。さらに、がん細胞と融合したり、EGF(上皮細胞増殖因子), IL-6, IL-8を産生して、がん幹細胞の性状をがん細胞に獲得させる(④)。さらにMMPs(matrix metalloproteinase)やEGFの産生を促進してがん細胞の浸潤性を高める(⑤)。このようにして、M2型腫瘍関連マクロファージはがん細胞の増殖、転移、治療抵抗性、再発を促進する(⑥)。(参考:J Zhejiang Univ Sci B. 15(1): 1–15. 2014年, Fig.1)
【腫瘍関連マクロファージはがん治療のターゲットになる】
以下のような総説論文があります
The role of tumor-associated macrophage in breast cancer biology.(乳がん生物学における腫瘍関連マクロファージの役割)Histol Histopathol. 2018 Feb;33(2):133-145.
【要旨】
乳がんは世界中の女性において最も一般的に診断される悪性腫瘍であり、女性のがん関連死亡の主な原因となっている。したがって、新規で効果的な治療標的の発見が望まれている。
乳がん組織における腫瘍微小環境は、がん細胞とがん組織に動員された宿主の正常細胞から構成され、腫瘍の進行に関与し、がん治療のターゲットとして認識されている。
腫瘍微小環境は、免疫細胞(マクロファージやリンパ球など)、血管を構成する細胞、線維芽細胞、筋線維芽細胞、間葉系幹細胞、脂肪細胞、細胞外マトリックス(ECM)などが含まれる。
これらの細胞の中で、腫瘍関連マクロファージは、乳癌における腫瘍微小環境の主要なコンポーネントである。
マクロファージは、さまざまな外部刺激に応答して高い可塑性を示し、自然免疫および獲得免疫応答に関与し、腫瘍微小環境の多数の因子を制御する。
腫瘍微小環境における刺激に応じて、マクロファージは2つの異なる表現型(M1とM2型マクロファージ)に分化する。
腫瘍関連マクロファージは、主にM2型の性状を示す。
臨床病理学的研究は、腫瘍における腫瘍関連マクロファージの蓄積が、悪い臨床結果と相関することを示唆している。ヒト乳がんでは、腫瘍関連マクロファージの密度が高いと予後不良と相関する。
腫瘍関連マクロファージは血管新生を誘導し、腫瘍細胞外マトリックスを変化してがん細胞の浸潤を手助けし、乳がん細胞を宿主免疫系から回避させ、免疫抑制性白血球を腫瘍微小環境に動員する。これらの機能とともに、乳がん幹細胞の活性化における腫瘍関連マクロファージの潜在的な役割も明らかになっている。
乳がんの腫瘍関連マクロファージは、細胞外マトリクスを分解することによりがん細胞の浸潤を促進し、腫瘍の血管新生を促進し、細胞傷害性T細胞による抗腫瘍免疫機能を抑制し、患者の予後不良をもたらす。
これらの観察により、腫瘍関連マクロファージはその機能のさまざまな側面をターゲットにすることで、治療的介入の魅力的なターゲットになる。
このレビューでは、腫瘍関連マクロファージの腫瘍組織内への動員に関与するメカニズムについて説明し、腫瘍血管新生、浸潤、転移、免疫抑制、および化学療法抵抗性の調節における腫瘍関連マクロファージの役割を解説する。最後に、有望な新規戦略としての腫瘍関連マクロファージをターゲットとする治療法の可能性についても考察する。
つまり、がん治療のターゲットとして、がん細胞自身だけでなく、がん組織の微小環境における腫瘍関連マクロファージは重要なターゲットになるということです。
【糖尿病治療薬のメトホルミンがM2マクロファージを減らす】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
メトホルミンの血糖降下作用は1960年代から知られていますが、2005年ころから臨床レベルでメトホルミンのがん予防効果や抗がん作用が報告され、それ以降、メトホルミンの抗がん作用のメカニズムに注目が集まっています。
メトホルミンは直接的および間接的な多彩なメカニズムで抗腫瘍作用を示します。
メトホルミンは肝臓における糖新生を阻害し、血液中のグルコースとインスリンの量を低下し、がん細胞の増殖を抑制します。
さらにメトホルミンは、ミトコンドリアの呼吸酵素複合体Iの阻害によるATP産生抑制、AMP活性化プロテインキナーゼ(AMPK)活性化、mTORシグナル伝達系の抑制、低酸素誘導因子-1(HIF-1)活性の抑制などのメカニズムで直接的な抗腫瘍効果を示します。
さらに、がん細胞のミトコンドリアでのグルコースとグルタミンの利用を阻害し、物質合成を阻害す効果も報告されています。
抗がん剤やホルモン療法や免疫チェックポイント阻害剤などと併用してこれらの治療による抗腫瘍効果を増強することが報告されています。
その結果、これらの総合作用によってがん患者のメトホルミン服用は生存率を高める効果が期待できると考えられています。(詳しくは685話参照)
さらに、メトホルミンががん組織の腫瘍関連マクロファージの分極(polarization)に作用するメカニズムで抗腫瘍効果を発揮する可能性が報告されています。以下のような報告があります。
Metformin's antitumour and anti-angiogenic activities are mediated by skewing macrophage polarization.(メトホルミンの抗腫瘍および血管新生阻害活性は、マクロファージの分極を変化させる事によって引き起こされる)J Cell Mol Med. 2018 May 4. doi: 10.1111/jcmm.13655. [Epub ahead of print]
【要旨】
がんの発生率と死亡率に対するメトホルミンの有益な効果は、疫学および臨床研究によって証明されており、その抗腫瘍効果のメカニズムの解明に研究の関心を集めている。
最近、腫瘍関連マクロファージがメトホルミンの抗腫瘍活性に関与している可能性が指摘されている。しかし、メトホルミンがどのようなメカニズムで腫瘍関連マクロファージによる腫瘍の進行を阻害するかは、明らかになっていない。
この論文では、メトホルミンによる抗腫瘍作用および血管新生阻害作用は、がん細胞や血管内皮細胞の機能の直接的な阻害によって引き起こされる可能性は低いことを明らかにした。
腫瘍関連マクロファージの分化(表現型)をM2型からM1型に変更させることにより、メトホルミンは腫瘍の成長と血管新生の両方を阻害した。
クロドロネートリポソームによる腫瘍関連マクロファージの枯渇は、M2型腫瘍関連マクロファージが誘導する血管新生促進を阻止し、M1型マクロアージによる血管新生阻害作用も阻止し、メトホルミンを投与したマウスの腫瘍における血管新生を促進する。
腫瘍関連マクロファージを培養した後の培養液を使った実験あるいは共培養システムを使用した実験が行われ、M2型に分極させたRAW264.7マクロファージによって誘導される内皮細胞出芽および腫瘍細胞増殖に対して、メトホルミンは阻害効果を示した。
これらの結果は、腫瘍の増殖と血管新生に対するメトホルミンの抑制作用は、がん組織の微小環境での腫瘍関連マクロファージの分極の変化によって引き起こされる可能性を示しており、がん治療におけるメトホルミンの有用性を示唆している。
つまり、メトホルミンはM2型腫瘍関連マクロファージをM1型に誘導することによって、がん細胞の増殖や血管新生を阻害するという結果です。
以下のような総説もあります。
The multifaceted effects of metformin on tumor microenvironment.(腫瘍微小環境に対するメトホルミンの多面的な効果)Semin Cell Dev Biol. 2020 Feb;98:90-97.
【要旨】
糖尿病治療薬メトホルミンの服用とがん発生率低下の関連が多くの疫学的研究で証明されているため、がん治療におけるメトホルミンの有効性が広く検討されている。
腫瘍は複雑なシステムであり、がん細胞はいくつかの異なる種類の非悪性細胞と共存し、相互作用している。
したがって、抗がん剤ががん細胞だけでなく、腫瘍微小環境の細胞の働きにも影響を及ぼすことは十分に考えられる。
近年、メトホルミンやその他の呼吸酵素複合体I阻害剤が、腫瘍内の非がん細胞の機能に作用することにより、がんの進行に様々な影響を及ぼすことが多く報告されている。 このレビューでは、血管新生、がん関連線維芽細胞、腫瘍関連マクロファージ、および抗腫瘍免疫抑制に対するメトホルミンの効果に特に焦点を当てて解説する。
メトホルミンの抗腫瘍効果は、がん細胞に対する直接作用だけでなく、腫瘍微小環境に対する効果も重要という意見です。つまり、メトホルミンの抗腫瘍効果は以下の図のようにまとめられます。

図:メトホルミンは肝臓における糖新生を阻害し(①)、血液中のグルコースとインスリンの量を低下し、がん細胞の増殖を抑制する(②)。さらにメトホルミンは、ミトコンドリアの呼吸酵素複合体Iの阻害によるATP産生抑制、AMP活性化プロテインキナーゼ(AMPK)活性化、mTORシグナル伝達系の抑制、低酸素誘導因子-1(HIF-1)活性の抑制などのメカニズムで直接的な抗腫瘍効果を示す(③)。さらに、がん細胞のミトコンドリアでのグルコースとグルタミンの利用を阻害し、物質合成を阻害す効果も報告されている(④)。腫瘍微小環境のマクロファージや線維芽細胞、制御性T細胞、骨髄由来抑制細胞などは血管新生を促進し、抗腫瘍免疫を抑制し、がん細胞の増殖を促進する(⑤)。このような腫瘍微小環境による腫瘍促進に関与するメカニズムをメトホルミンは阻害する(⑥)。これらの総合効果によって、メトホルミンは抗腫瘍作用を発揮する。
【2-デオキシ-D-グルコースはM2型腫瘍関連マクロファージを減らす】
2-デオキシ-D-グルコース(2-Deoxy-D-Glucose:2-DG)はグルコース(ブドウ糖)の2位のOHがHに変わっているグルコース類縁物質です(下図)。

2-DGはグルコースと同じトランスポーター(輸送担体)で取り込まれるので、グルコースの取り込みが亢進しているがん細胞に多く取り込まれます。
細胞内では、ヘキソキナーゼによってリン酸化されて、2-デオキシグルコース-6リン酸(2-DG-6リン酸)に変換されますが、この2-DG-6リン酸は解糖系の先の代謝系には進めない(ヘキソキナーゼの先の解糖系酵素で代謝できない)ので、ATP産生量が減ります。
さらに、蓄積した2-DG-6リン酸はヘキソキナーゼを阻害する作用もあるので、正常なグルコースの代謝も阻害されます。
つまり、2-DGはがん細胞の増殖を直接抑制する作用があります。
さらに、2-DGがM2型マクロファージ分極を抑制することが報告されています。
以下のような報告があります。
2-Deoxy-d-Glucose Treatment Decreases Anti-inflammatory M2 Macrophage Polarization in Mice with Tumor and Allergic Airway Inflammation.(2-デオキシ-d-グルコース治療は、腫瘍およびアレルギー性気道炎症を有するマウスの抗炎症性M2マクロファージ分極を減少させる)Front Immunol. 2017; 8: 637.
【要旨】
炎症における重要なエフェクター細胞であるマクロファージは、周囲の状況に応じて、炎症促進性のM1型または抗炎症性のM2型のいずれかに機能的に分極することができる。
M1マクロファージへの分極における解糖の重要な役割は十分に明らかになっている。しかし、解糖系とM2分極マクロファージの関係はまだよくわかっていない。
ここでは、解糖系の阻害剤である2-デオキシ-d-グルコース(2-DG)が、マクロファージをインターロイキン4で刺激したときに発現するM2マクロファージのマーカーであるArg、Ym-1、Fizz1、およびCD206分子の発現を著しく阻害したことを報告する。
2-DGによる影響を受けたM2マクロファージの分極は、細胞死によるものではなく、解糖系の障害によって引き起こされた。
分子メカニズムの研究により、M2分極マクロファージに対する2-DGの効果はAMPK-Hif-1α依存性経路に依存していることが示された。
重要なことに、2-DG治療は、キチン投与、腫瘍、およびアレルギー性気道炎症を伴う一連のマウスモデルにおいて、抗炎症性M2マクロファージの分極を大幅に減少させ、疾患の進行を防ぐ。
したがって、M2マクロファージ分極における解糖の主な役割の特定は、M2マクロファージ媒介疾患の潜在的な分子標的を提供する。
2-DG療法は、M2マクロファージの極性化に対する負の調節により、腫瘍またはアレルギー性気道炎症の患者に有益な効果をもたらす可能性がある。
Th2細胞とIL-4で誘導されるM2マクロファージはがん細胞の増殖と気管支喘息の悪化を促進します。
2-DGは解糖を阻害し、AMPK-Hif-1α依存性経路を介してM2マクロファージを減らすことによって、M2マクロファージによるがんとアレルギー疾患の増悪を抑制するという結果です、

図:2-デオキシ-D-グルコースはマクロファージの解糖を阻害し、ATPの産生を阻害してAMP依存性プロテインキナーゼ(AMPK)をリン酸化して活性化し、低酸素誘導性因子-1α(Hif-1α)を阻害し、M2マクロファージの遺伝子発現を抑制して、M2型への分極を阻害する。その結果、腫瘍細胞の増殖やアレルギー性炎症を抑制する。
以上の最近の研究結果から、ジスルフィラム、セレコキシブ、オーラノフィン、2-デオキシ-D-グルコース、メトホルミンを併用してM2マクロファージを枯渇できると、がん細胞の増殖や転移が抑制され、免疫療法の効き目を高めることができると思います。(トップの図参照)
| « 687) 腫瘍関連... | 689)骨髄由来... » |



