がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
885)ヒストンアセチル化を亢進するボリノスタット+α
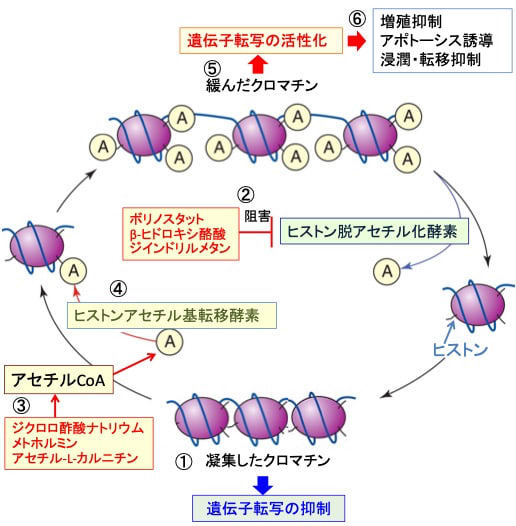
図:ヒストン脱アセチル化酵素によってヒストンのアセチル化が低下するとクロマチンが凝集して遺伝子転写活性は抑制される(①)。ボリノスタット、β-ヒドロキシ酪酸(ケトン食や絶食で体内で産生される)、ジインドリルメタンはヒストン脱アセチル化酵素を阻害してヒストン・アセチル化を亢進する(②)。アセチルCoAはグルコースや脂肪酸の分解で産生される。ジクロロ酢酸ナトリウムとメトホルミンは細胞内のアセチルCoAの濃度を高め、アセチル-L-カルニチンはアセチル基を供給する(③)。アセチルCoAのアセチル基はヒストンアセチル基転移酵素によってヒストンのアセチル化に使用される(④)。ヒストン・アセチル化によってクロマチンが緩むと遺伝子転写活性が亢進する(⑤)。その結果、がん抑制遺伝子の発現亢進などによってがん細胞の増殖抑制、アポトーシス誘導、浸潤・転移の抑制が起こる(⑥)。
885)ヒストンアセチル化を亢進するボリノスタット+α
【遺伝子(DNA)はヒストンに巻き付いている】
人間の1個の細胞の核には、約30億対のヌクレオチドからなるDNA(デオキシリボ核酸)が格納されています。このDNAが遺伝子の本体です。
細胞核内では、DNAはヒストンという球状のタンパク質複合体に巻き付くような状態で存在します。
ヒストンはリシン(リジン)やアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。
ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。ヒストンによる遺伝子発現の調節は複雑ですが、簡単にまとめると、「ヒストンとDNAの結合は転写に阻害的に働く」ということです。
遺伝子がmRNAに転写されるためには、転写因子やRNAポリメラーゼなどの他のタンパク質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。
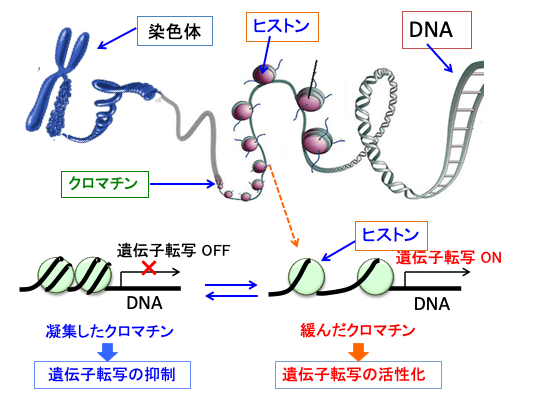
図:細胞核内でDNAとタンパク質(ヒストンなど)の複合体をクロマチンという。クロマチンが凝集している部分はDNAが強く折り畳まれており遺伝子転写が抑制されている。一方、クロマチンが緩んでいる部分は、遺伝子の転写が活発になっている。
【ヒストンアセチル化は遺伝子発現を亢進する】
DNAとヒストンの結合を緩くする機序として「ヒストンのアセチル化」という現象があります。アセチル化というのはアセチル(CH3CO)基が結合することです。
ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。

図:ヒストン・アセチル基転移酵素によってヒストン・タンパク質のリシン(リジンとも言う)のアミノ基(-NH2)にアセチル(CH3CO)基が結合するとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになる。その結果、遺伝子の転写が起こりやすくなる。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進(正に制御)し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制(負に制御)されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素(=ヒストンアセチルトランスフェラーゼ)」と「ヒストン脱アセチル化酵素(=ヒストンデアセチラーゼ)」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています。アセチル基はグルコースや脂肪酸の分解によって産生されるアセチルCoAが使われます(下図)。

図:ヒストンアセチル基転移酵素はヒストンをアセチル化することによってクロマチン構造を緩めて遺伝子転写を活性化する。一方、ヒストン脱アセチル化酵素はヒストンのアセチル化を減らすことによってクロマチン(DNAとヒストンの複合体)を凝集して遺伝子転写を抑制する。アセチル基はグルコースや脂肪酸が分解して産生されるアセチルCoAから供給される。
このように、ヒストンのアセチル化などによって遺伝子発現を調節する現象を「エピジェネティクス(epigenetics)」と言います。
がん発症の原因は,がん遺伝子やがん抑制遺伝子の変異,すなわち塩基配列上の変化が蓄積し,細胞増殖,接着,細胞死などの制御が異常になることによると考えられています。さらに、遺伝子の塩基配列の変化を伴わない遺伝子の発現異常,すなわちエピジェネティクスの機序による遺伝子発現異常も発がんに大きく寄与していることが近年明らかになってきました。
このようながん細胞における遺伝子発現の変化の中で、遺伝子発現の活性を調節するヒストンアセチル化は重要な役割を果たすと考えられています。
例えば、p21cip1は細胞周期の進行を担うサイクリン依存性キナーゼ(CDK)の活性を抑制するインヒビター(阻害剤)の一つで、細胞増殖の停止、分化や老化に関わっており、がん抑制因子として捉えられています。ヒストン脱アセチル化酵素(histone deacetylase)の阻害は、p21cip1のような細胞周期の進展を阻害する遺伝子の発現を高めることによってがん細胞の増殖を抑える作用が報告されており、ヒストン脱アセチル化酵素阻害剤はがんの治療薬として注目されています。

図:細胞が分裂して数を増やしていくとき、細胞周期は4 つの段階に分けられる。すなわち、DNA複製前のG1(Gap1) 期、DNA複製期(S期)、細胞分裂前のG2(Gap2)期、および最後の細胞分裂期(M) 期に分けられる。増殖を休止した状態の細胞はG0期にあると定義される(①)。増殖刺激は、サイクリン(Cyc)というタンパク質で活性化されるサイクリン依存性キナーゼ(CDK)を活性化してRbタンパク質をリン酸化する(②)。Rbタンパク質は転写因子のE2Fと結合してE2Fの活性を阻害しているが、Rbがリン酸化されるとE2Fと結合できなくなってE2Fがフリーになる(③)。フリーになったE2Fは増殖関連遺伝子の転写を促進することによって細胞周期をG1からS期に移行させて細胞周期を回す(④)。サイクリン依存性キナーゼ阻害因子(CDK阻害因子)のp21cip1は、サイクリン依存性キナーゼ(CDK)を阻害して細胞周期をG1期で停止した状態に維持する(⑤)。ヒストン脱アセチル化酵素はヒストンの脱アセチル化を促進してp21cip1の発現を抑制する(⑥)。したがって、ヒストン脱アセチル化酵素阻害剤はp21cip1の発現を亢進して細胞増殖を停止できる(⑦)。
【ヒストン以外のタンパク質の働きもアセチル化で制御される】
タンパク質のアセチル化は、ヒストンだけでなく、非ヒストンタンパク質にも起こります。アセチル化を受けるタンパク質には、p53, nuclear factor-κB (NF-κB), p65, CBP, p300, STAT3, tubulin, PC4, GATA factors, nuclear receptors, c-Myc, hypoxia-inducible factor (HIF)-1α, FoxO1, heat-shock protein (Hsp)-90, HMG, E2F, MyoD, Bcr–Abl, the FLT3 kinase, c-Raf kinaseなど多数が知られており、これらの非ヒストンタンパク質のアセチル化は、タンパク質の安定性や局在や他のタンパク質やDNAとの相互作用などに影響して、がん細胞の発生や増殖や転移などに関与しています。
アセチル化されるタンパク質はヒストンだけでないので、最近は、ヒストンアセチル基転移酵素はリシンアセチル基転移酵素(lysine acetyltransferases)、ヒストン脱アセチル化酵素はリシン脱アセチル化酵素(lysine deacetylases)と呼ばれるようになっています。
通常、ヒストンや非ヒストンタンパク質のアセチル化はがん細胞の増殖を抑制する方向で働くため、このような作用をもった物質はがんの治療に役立つと考えられています。
すなわち、ヒストン脱アセチル化酵素の阻害剤ががん治療薬として注目され、実際に既に使用されている薬もあります。
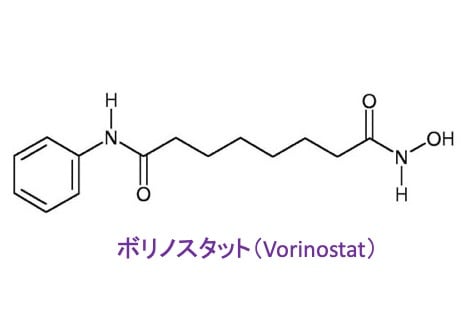
ヒストン脱アセチル化酵素阻害薬としてボリノスタットという薬があります。皮膚などに生じる悪性リンパ腫の皮膚T細胞性リンパ腫に使用されています。
【がん細胞はヒストン脱アセチル化酵素の活性が亢進している】
近年、プロテオーム解析(Proteomic analysis)の手法によって、細胞に発現している全てのタンパク質の構造や機能が解析できるようになりました。抗アセチル化リシン抗体や質量分析法やアミノ酸のアイソトープ標識などの方法を組み合わせて細胞内のアセチル化したタンパク質を解析した研究も報告されるようになりました。
ヒストンや非ヒストンタンパク質のアセチル化はヒストン・アセチル基転移酵素とヒストン脱アセチル化酵素のバランスによって動的に制御されています。
細胞のがん化の過程で、ヒストンや非ヒストンタンパク質の脱アセチル化が進むことが明らかになっています。そして、がん細胞ではヒストン・アセチル基転移酵素の発現や活性が低下し、逆にヒストン脱アセチル化酵素の発現と活性が亢進していることが明らかになっています。

図:ヒストンや非ヒストンタンパク質のアセチル化の状況はヒストン・アセチル基転移酵素(HAT)とヒストン・脱アセチル化酵素(HDAC)のバランスで決まる。がん細胞ではヒストン・アセチル基転移酵素(HAT)の発現や活性が低下し、ヒストン・脱アセチル化酵素(HDAC)の発現や活性が亢進して、タンパク質の脱アセチル化が亢進している。
ヒストン脱アセチル化酵素の活性亢進は様々なヒストンアセチル化によって遺伝子発現に影響し、さらに非ヒストン・タンパク質の働きに影響し、これらの作用によって、がん細胞の脱分化、細胞増殖、浸潤・転移、細胞接着低下、アポトーシス抵抗性、血管新生を亢進し、がんの発生や悪性進展を促進する方向で作用しています。したがって、ヒストン脱アセチル化酵素を阻害することはがん治療の有力な方法になります。
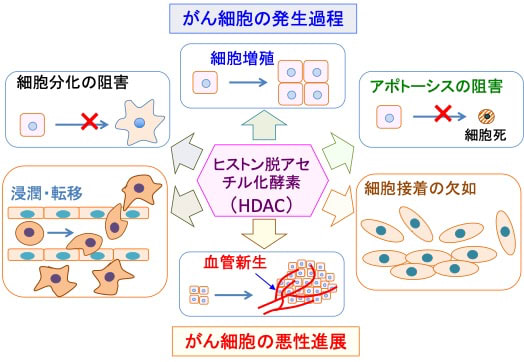
図:ヒストン脱アセチル化酵素(Histone Deacetylase:HDAC)によるヒストン・アセチル化はがん細胞の発生過程と悪性進展過程の両方に関わる遺伝子の発現に影響する。がん細胞の発生過程においては、ヒストン脱アセチル化酵素(HDAC)は、無制限の細胞増殖や細胞分化の阻害(脱分化)やアポトーシス阻害に関わる遺伝子発現を亢進する。がん細胞の悪性進展においては、HDACは細胞接着の欠如や浸潤・転移や血管新生に関わる遺伝子の発現を亢進する。 (参考:J Histochem Cytochem 62:11–33, 2014のFig.5)
ヒストン脱アセチル化酵素阻害剤としてボリノスタット(Vorinostat)という薬があります。これは成人T細胞リンパ腫に使用されています。
臨床試験では、ボリノスタットは患者が十分耐えられる用量で血液がんおよび固形がんに対して抗腫瘍活性が認められています。
ヒストン脱アセチル化酵素の阻害を目標にした代替療法として、β-ヒドロキシ酪酸(ケトン食で体内で産生される内因性のヒストン脱アセチル化酵素阻害剤)とジインドリルメタンなどがあります。
アセチル基を供給するアセチルCoAを増やす方法として、ピルビン酸からアセチルCoAを変換するピルビン酸脱水素酵素を活性化するジクロロ酢酸ナトリウム、脂肪酸合成やメバロン酸経路を阻害してアセチルCoAの消費を抑えるメトホルミン、アセチル基の核内への運搬を担うアセチル-L-カルニチンなどがあります(トップの図)。
【ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害する】
βヒドロキシ酪酸はケトン体の一種です。ケトン体は絶食などで糖質が枯渇した状態で脂肪酸の燃焼(β酸化)が亢進したときに肝臓で産生され、グルコース(ブドウ糖)が枯渇した時の代替エネルギーになります。絶食時などで日常的に産生されています。
ケトン体としてアセト酢酸、βヒドロキシ酪酸、アセトンの3種が作られますが、アセトンは呼気となって排泄され、アセト酢酸とβヒドロキシ酪酸はエネルギー源になります。
グルコースのもとになる糖質の摂取をできるだけ減らし、がん細胞の増殖抑制効果があるω3系不飽和脂肪酸(αリノレン酸、エイコサペンタエン酸、ドコサヘキサエン酸)やオリーブオイルやケトン体を出しやすくする中鎖脂肪酸トリグリセリドのような脂肪を多く摂取するケトン食という食事療法が進行がんの治療に有効であることが報告されています。
ケトン食は、がん細胞にエネルギー源のグルコースの供給を減らし、がん細胞の増殖を刺激するインスリンの分泌を抑制する効果など、複数の作用機序でがん細胞の増殖を抑制します。
ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素を阻害し、ヒストンのアセチル化を促進し、遺伝子発現を調節する作用があります
Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor.(内因性ヒストン脱アセチル化酵素阻害剤のβヒドロキシ酪酸による酸化ストレスの抑制) Science. 2013 Jan 11;339(6116):211-4.
この論文において、筆者らは、ケトン体の一種のβヒドロキシ酪酸がクラスIヒストン脱アセチル化酵素を特異的に阻害することを明らかにしました。βヒドロキシ酪酸をマウスへ投与するとヒストンのアセチル化のレベルが上昇したのにくわえ、βヒドロキシ酪酸が蓄積する飢餓状態あるいはカロリーを制限したマウスの組織においてもヒストンのアセチル化のレベルは上昇していました。そして、ヒストン脱アセチル化酵素の阻害が遺伝子の転写状態の変化をもたらすことを示しています(下図)。

図:絶食やケトン食で体内で増加するケトン体の一種のβヒドロキシ酪酸は、ヒストン脱アセチル化酵素を阻害することによってヒストンのアセチル化を促進して、遺伝子発現状態に変化を及ぼす。その遺伝子発現の変化は寿命延長や抗がん作用と関連している。
ヒストン脱アセチル化酵素が阻害されてヒストンのアセチル化が増えると、いくつかの遺伝子の発現がオン(on)になり、細胞の機能に変化が起こります。
ヒストン脱アセチル化酵素の阻害剤として単鎖脂肪酸の酪酸が有名です。酪酸は、食物繊維を腸内細菌が嫌気性発酵させてできます。脂肪酸の分解過程で生合成されるほか、バターやチーズや皮脂にも含まれています。銀杏や足の悪臭の原因にもなっています。
培養したがん細胞に酪酸を添加すると、増殖抑制や分化誘導が起こり、その作用機序は酪酸によるヒストン脱アセチル化酵素の阻害作用によるものです。
さて、絶食や飢餓状態やケトン食で産生されるケトン体のβヒドロキシ酪酸は酪酸のHがOHに変わっただけで化学構造が似ています。

βヒドロキシ酪酸は長期的な飢餓状態では6〜8mMにも達するので、飢餓状態などで産生されるβヒドロキシ酪酸がヒストンのアセチル化を介して遺伝子発現に作用して、細胞機能に影響するのではないかという仮説のもとに、βヒドロキシ酪酸にヒストン脱アセチル化酵素阻害作用があるかどうか検証する目的で本研究が行われています。
そして、研究の結果、培養細胞やマウスの動物実験でβヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素を阻害することが示され、さらに、飢餓や直接βヒドロキシ酪酸を投与する方法でマウスの血中のβヒドロキシ酪酸の濃度(0.6〜1.5mM)を上昇させると、腎臓など複数の臓器においてヒストンのアセチル化が増えていることが確認されています。
ヒストン脱アセチル化酵素の阻害が、寿命の延長やがん細胞の分化誘導や増殖抑制に効果があることも多くの研究で明らかになっています。つまり、絶食やケトン食による健康作用や寿命延長作用や抗がん作用の一部は、βヒドロキシ酪酸によるヒストン脱アセチル化酵素の阻害作用が関与している可能性を示唆しています。
【ジクロロ酢酸とメトホルミンはアセチルCoAを増やす】
コエンザイムA(CoA)は補酵素Aとも呼ばれ、生物にとって極めて重要な補酵素で、様々な化合物を結合することによって糖質や脂質やアミノ酸などの代謝反応に関わります。
補酵素Aはパントテン酸とアデノシン二リン酸、および 2-メルカプトエチルアミンから構成されており、末端にあるチオール基に様々な化合物のアシル基がチオエステル結合することによってクエン酸回路やβ酸化などの代謝反応に関わります。例えばアセチル基が結合したものがアセチルCoAです。

図:コエンザイムA(Coenzyme A; CoA)は補酵素Aとも言う。CoAにアセチル基が結合したものがアセチルCoAになる。
グルコース代謝の場合は、グルコース(ブドウ糖)が解糖系で作られたピルビン酸がミトコンドリア内に取り込まれてピルビン酸脱水素酵素複合体の作用で二酸化炭素(CO2)が除去されてアセチル基になり、このアセチル基にコエンザイムA(CoA)が結合してアセチルCoAに変換され、アセチルCoAはクエン酸に変換されてTCA回路と電子伝達系によってさらにATPの産生が行われます。
脂肪酸はミトコンドリアにおけるβ酸化によってアセチルCoAを産生し、同様にTCA回路と電子伝達系によってさらにATPの産生が行われます。
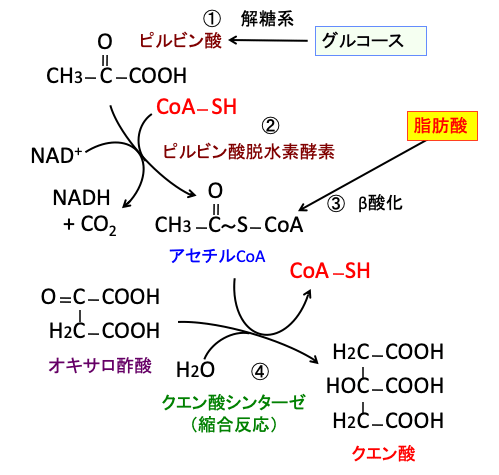
図:グルコースは解糖系でピルビン酸に変換され(①)、ピルビン酸はミトコンドリアに入ってピルビン酸脱水素酵素によって二酸化炭素(CO2)が除去されてアセチル基になり、このアセチル基にコエンザイムA(CoA)が結合してアセチルCoAに変換される(②)。脂肪酸はβ酸化によってアセチルCoAを産生する(③)。アセチルCoAとオキサロ酢酸からクエン酸が生成される反応がTCA回路の最初のステップになる(④)。TCA(Tricarboxylic acid)というのは3つのカルボキシル酸基(COOH)を持つクエン酸のことで、TCA回路はクエン酸回路とも言う。
脂肪酸合成が必要なときは、TCA回路で産生されたクエン酸の一部が細胞質に移行して、ATPクエン酸リアーゼによってアセチルCoAに変換され、脂肪酸合成に使われます。アセチルCoAは細胞膜を通過できないので、ミトコンドリアでできたクエン酸が細胞質に移行してアセチルCoAの合成に使われます。

図:TCA回路で産生されたクエン酸の一部は細胞質でATPクエン酸リアーゼによってアセチルCoAに変換され、さらにマロニルCoAから脂肪酸が合成される。がん細胞は細胞の数を増やすために脂肪合成が亢進しており、これら脂肪酸合成に関与する酵素の活性が亢進している。
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。さらに、メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素を阻害することも報告されています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。
活性化したAMPKは、細胞内のATP量を増やすために異化を亢進し、同化を抑制します。
「異化」と言うのは高分子の物質を分解してエネルギー(ATP)を産生することで、「同化」はより低分子の化合物から高分子の生体成分を作り出すことです。つまり、メトホルミンはAMPKを活性化してタンパク質やグリコーゲンや糖質や脂肪酸やコレステロールの合成を阻害します。
AMPKは脂肪酸合成を促進するアセチルCoAカルボキシラーゼと脂肪酸合成酵素の活性を阻害します。
AMPKを活性化して脂肪酸の合成を阻害すると、細胞質のクエン酸とアセチルCoAが増えます。クエン酸はがん細胞の解糖系を阻害する効果によって抗腫瘍効果を発揮します。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAの変換を亢進します。
メトホルミンとジクロロ酢酸は細胞内のアセチルCoAを増やします。アセチルCoAが増えると、核内タンパク質のヒストンや多くのタンパク質のアセチル化を引き起こして、がん細胞の増殖を抑える効果があります。

図: ジクロロ酢酸はピルビン酸脱水素酵素の活性を亢進してミトコンドリア内のアセチルCoAを増やす(①)。ミトコンドリアのTCA回路で生成されたクエン酸は、ミトコンドリアから細胞質に移行し(②)、ATPクエン酸リアーゼによってアセチルCoAに変換され(③)、アセチルCoAカルボキシラーゼによってマロニルCoAに変換され(④)、脂肪酸合成酵素によって脂肪酸が合成される(⑤)。メトホルミンはミトコンドリアの呼吸酵素を阻害する機序(⑥)でATP産生を阻害してAMP/ATP比を上昇させ(⑦)、AMP活性化プロテインキナーゼ(AMPK)を活性化する(⑧)。活性化したAMPKはアセチルCoAカルボキシラーゼ(⑨)と脂肪酸合成酵素を阻害する(⑩)。その結果、がん細胞の増殖を抑制する。
【ジインドリルメタンはヒスト脱アセチル化酵素を阻害する】
ジインドリルメタンはアブラナ科の植物に含まれるインドール化合物で、欧米ではサプリメントとして販売されています。
ジインドリルメタンがヒスト脱アセチル化酵素を阻害する作用が報告されています。以下のような論文があります。
Chemopreventive agent 3,3'-diindolylmethane selectively induces proteasomal degradation of class I histone deacetylases.(がん化学予防物質ジインドリルメタンはクラスIヒストン脱アセチル化酵素のプロテアソームでの分解を選択的に誘導する。)Cancer Res. 2010 Jan 15;70(2):646-54.
【要旨】
ジインドリルメタン(3,3'-Diindolylmethane :DIM)は抗がん作用をもつ物質で、細胞周期の停止やアポトーシス誘導を引き起こすが、そのメカニズムは解明されていない。この論文では、DIMは、クラスIIのヒストン脱アセチル化酵素(HDAC)は阻害せず、クラスIのヒストン脱アセチル化酵素(HDAC1, HDAC2, HDAC3,HDAC8)を選択的に、プロテアソームを介するタンパク分解を誘導することを報告する。
ヒト大腸がん細胞を用いたin vitroの実験と、移植腫瘍を用いたin vivoの実験系において、DIMはクラスIHDACの発現量を減少させた。
ヒストン脱アセチル化酵素(HDAC)によって阻害されたサイクリン依存性キナーゼ阻害因子のp21WAF1とp27KIP2の転写は、HDACを枯渇させることによって発現量が増え、その結果、細胞周期のG2期で停止した。さらに、HDACの枯渇はDNAのダメージを誘導し、アポトーシスを引き起こす。これらの結果は、DIMがクラスIのHDACの分解を選択的にターゲットにしていることを示している。
次のような報告もあります。
3,3'-Diindolylmethane, but not indole-3-carbinol, inhibits histone deacetylase activity in prostate cancer cells.(3,3’-ジインドリルメタンは前立腺がん細胞におけるヒストン脱アセチル化酵素を阻害するがインドール-3-カルビノールは阻害しない)Toxicol Appl Pharmacol. 2012 Sep 15;263(3):345-51.
ブロッコリーやケールなどのアブラナ科の植物や野菜には抗がん作用のある成分が多く含まれていますが、その代表的な成分がGlucobrassicin(グルコブラシシン)です。
グルコブラシシンは加水分解してインドール-3-カルビノール(Indole-3-carbinol)になり、さらに胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタン(3,3'-diindolylmethane, DIM)になります(下図)。
ジインドリルメタンはヒストン脱アセチル化酵素を阻害し、細胞周期を停止させるp21の発現を亢進して、前立腺がんの増殖を抑制することが報告されています。

図:アブラナ科の植物や野菜に含まれるGlucobrassicin(グルコブラシシン)は加水分解してインドール-3-カルビノール(Indole-3-carbinol, I3C)になり、さらに胃の中の酸性の条件下でI3Cが2個重合したジインドリルメタン(3,3‘-diindolylmethane, DIM)になる。I3CとDIMは、がん細胞の増殖抑制、アポトーシス誘導などの抗がん作用を有する。ジインドリルメタンはAkt/NF-κBシグナル伝達系やIL-6/JAK/STAT3経路やHIF-1(低酸素誘導因子-1)の活性を抑制する作用やヒストン脱アセチル化酵素阻害など様々なメカニズムで抗腫瘍活性を示す。
その他に、アセチル-L-カルニチンのアセチル基が、細胞核のヒストンのアセチル化に使われることが報告されています。(Epigenetics 4(6):399-403, 2009
)
アセチル-L-カルニチンは欧米ではサプリメントとして販売されています。
細胞核におけるヒストンのアセチル化では、アセチル-CoAのアセチル基が使われます。アセチル-CoAはミトコンドリアでグルコース(ブドウ糖)や脂肪酸の分解で生成されます。しかしアセチル-CoAは細胞膜を通れないので、ヒストンアセチル化に必要なアセチル基の供給源としてアセチルCoAを細胞核に運搬するのに、細胞膜を通過できるL-カルニチンとアセチル-L-カルニチンが利用されているというメカニズムです。この経路をまとめると図のようになります。
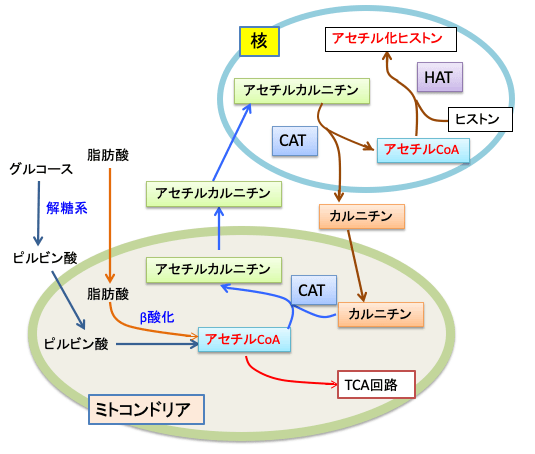
図:グルコースや脂肪酸の分解によってミトコンドリアで生成されたアセチルCoAのアセチル基がL-カルニチンに渡されてアセチル-L-カルニチンになる。アセチル-L-カルニチンは細胞核に運ばれ、核でアセチルCoAに変換され、ヒストンのアセチル化のアセチル基の供給源となる。アセチルCoAは細胞膜を通過できないので、L-カルニチンとアセチル-L-カルニチンが利用されている。
治療法の無くなった進行がんの治療に、ヒストンのアセチル化を増やすボリノスタット、ケトン食、ジインドリルメタン、ジクロロ酢酸ナトリウム、メトホルミン、アセチル-L-カルニチンの組み合わせは、試してみる価値があります。
| « 884)トコトリ... | 886)進行乳が... » |



