がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
887)低酸素はがん患者の予後を悪くする
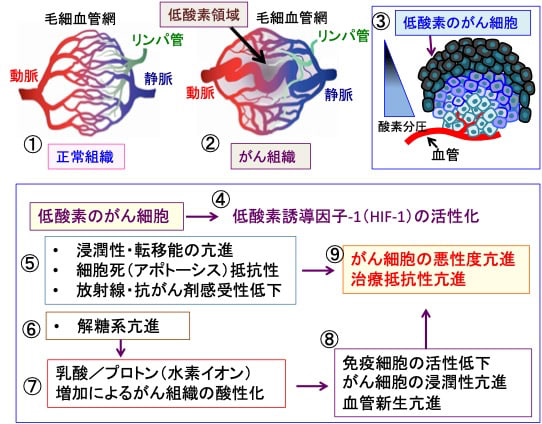
図:正常組織は整然とした血管網で栄養と酸素供給が行われている(①)。一方、がん組織では血管網が不完全で、血液が十分に行き渡らないところが多く、低酸素領域が多く存在する(②)。酸素は血液から拡散によって組織に広がるので、血管から離れた領域のがん細胞は低酸素になっている(③)。低酸素のがん細胞は浸潤性や転移能を亢進し、細胞死(アポトーシス)に抵抗性になり、放射線や抗がん剤に対する感受性が低下する。その結果、低酸素のがん細胞の悪性度と治療抵抗性が亢進する(④)。さらに、解糖系亢進が亢進する結果(⑤)、乳酸とプロトン(水素イオン)の産生増加によってがん組織の酸性化が起こる(⑥)。組織の酸性化は免疫細胞の働きを阻害し、がん細胞の浸潤性と血管新生を亢進する(⑦)。これらの総合作用によって、低酸素はがん細胞の悪性度を亢進し、治療抵抗性を亢進する(⑧)。
887)低酸素はがん患者の予後を悪くする
【がん組織は低酸素になりやすい】
正常な組織では、血液の供給が不足して低酸素や低栄養の領域ができないように整然とした血管網が構築されています。一方、がん組織では、血管網の整備が細胞の増殖に追いつかないので、血液供給が途絶えた低酸素の領域が至る所に存在します。
がん細胞が増殖し、がん組織が大きくなるためには腫瘍組織を養う血管の新生が必要です。しかし、血管内皮細胞の増殖速度はがん細胞の増殖に追いつかないので、不完全な血管網が形成されます。血管壁構造は不完全(血管周皮細胞や基底膜がない、血管平滑筋が不完全、細胞の受容体が無いなど)で、血管のネットワークも不規則でいびつです。血管抵抗が高く、血流も滞りやすく、血管自体がもろく、漏れ易い状況です。リンパ管の発達も不完全で、がん組織では組織液の圧が高くなっています。
酸素と栄養素は血管から拡散によって細胞に到達するので、血管から離れたがん細胞は低酸素と低栄養状態に陥っています(図)。

図:正常組織は整然とした血管網で栄養と酸素供給が行われている(①)。一方、がん組織では、血管網が不完全で、血液が十分に行き渡らないところが多く、至るところで低酸素領域が存在する(②)。酸素が毛細血管から拡散して到達する距離は1〜2mm程度であるため、血管から離れた領域のがん細胞は低酸素になっている(③)
【低酸素のがん細胞はHIF-1活性が亢進してがん治療に抵抗性になる】
酸素と栄養素は血管から拡散によって細胞に到達するので、血管から離れたがん細胞は低酸素と低栄養状態に陥っています。酸素や栄養素が不足すれば、がん細胞の増殖が低下し、死滅することが期待できるので、それは治療にメリットがあるように考えることもできます。つまり、がん組織の兵糧攻めという戦略では、腫瘍血管からの栄養と酸素の供給を阻止することを目標にしています。
しかし実際は、がん組織の低酸素化は低酸素誘導因子-1(HIF-1)を活性化し、低酸素状態に適応したがん細胞は、より浸潤性と転移性を高める事が明らかになっています。細胞死(アポトーシス)に対しても抵抗性になります。
酸素を使わない解糖系での代謝が亢進すると、がん組織はさらに酸性化します。このがん組織の酸性化は、血管新生を誘導し、浸潤や転移を促進し、生体の免疫細胞からの攻撃を阻害します。
つまり、がん組織における低酸素という微小環境は、がん細胞の悪性度を高め、治療効果を弱めることにつながります。がん組織の低酸素が放射線治療の効果を弱めることは、すでに1950年代に報告されています。
低酸素はヒト遺伝子の1〜2%ほどの遺伝子の発現を調節しており、これはHIF-1が行っています。HIF-1は低酸素で活性化される転写因子です。
がん組織の低酸素状態はHIF-1の発現と活性を亢進して、がん細胞はアポトーシスに抵抗性になり、放射線治療や抗がん剤治療に抵抗性になります。がん組織の低酸素状態を改善すると、放射線治療や抗がん剤治療の効果が高くなることが明らかになっています(下図)。

図:酸素や栄養素が拡散で到達できるのは数百μm程度であるため、血管から1〜2mm離れたがん細胞は高度な低酸素状態になっている。がん組織は血管網が不完全であるため、毛細血管から離れて低酸素に陥っているがん細胞が多く存在する。低酸素のがん細胞では低酸素誘導因子-1(HIF-1)の発現と活性が亢進している。HIF-1の活性亢進はがん細胞の浸潤性・転移能を亢進し、細胞死(アポトーシス)に抵抗性になり、放射線治療や抗がん剤治療に対する感受性が低下する。
【低酸素誘導因子-1は低酸素になると活性化される】
2019年のノーベル医学生理学賞は、「細胞の低酸素応答の仕組みの解明」に貢献した米英の3人の科学者が受賞しました。低酸素は低酸素誘導因子-1(Hypoxia Inducible Factor-1: HIF-1)という転写因子を活性化します。このHIF-1は何百という遺伝子の発現を亢進し、細胞は低酸素に適応できるようになります。このHIF-1の発見とその活性化の機序を解明した功績です。
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1)とプロリル・ヒドロキシラーゼ(prolyl hydroxylase)と呼ばれるタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。(HIFのαサブユニットにはHIF-1α, -2,α-3α、βサブユニットにはHIF-1β, -2β, -3βのそれぞれ3種類が知られていますが、低酸素誘導因子として中心になっているのはHIF-1αとHIF-1βであるため、HIF-1をHIFの同義語として使用しています。)
HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリルヒドロキシラーゼ(prolyl hydroxylase)により水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
プロリル・ヒドロキシラーゼ(prolyl hydroxylase)は酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリル・ヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。
安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮増殖因子(VEGF)、造血因子エリスロポイエチンなど、多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(図)。

図:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
【がん細胞では低酸素でなくてもHIF-1が恒常的に活性化している】
がん細胞の代謝の特徴は、酸素が十分に利用できる状況でも、酸素を使わない解糖系が亢進し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されていることです。つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。
このような代謝の特徴の根本的なメカニズムは、がん細胞では酸素濃度とは関係なく、恒常的にHIF-1が活性化しているためです。つまり、がん細胞では恒常的に低酸素シグナルがオンになっているということです。その理由は、がん細胞で活性化されているmTORC1やSTAT3がHIF-1の産生を促進するからです。
がん細胞の増殖シグナル伝達系であるPI-3キナーゼ/Akt/mTORC1シグナル伝達系においてmTORC1はHIF-1のタンパク質の産生(mRNAからタンパク質の翻訳)を促進します。また、増殖因子やサイトカインで活性化されるSTAT3という転写因子はHIF-1遺伝子の転写を亢進します。
mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によってタンパク質合成を促進し、HIF-1タンパク質の産生を増やします。
一方、STAT(signal transducer and activator of transcription;シグナル伝達兼転写活性化因子)は、様々な増殖因子やサイトカインを中心とする細胞外からの刺激によって活性化されたJAKなどのチロシンキナーゼによってリン酸化を受けると2量体を形成し、核内に移行してさまざまな遺伝子の発現を誘導します。STAT転写ファミリーには7種類が存在しますが、特にSTAT3はほとんどすべての固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっています。
STAT3はHIF-1の遺伝子発現(転写)を促進することが知られています。つまり、がん細胞で活性が亢進しているmTORC1とSTAT3はHIF-1タンパク質の産生量を相乗的に高めることが報告されています(図)。
HIF-1αタンパク質の発現量が増えても、HIF-1αの分解に関与するプロリル・ヒドロキシラーゼやVHLタンパク質が正常に働けばHIF-1の活性亢進を抑制できますが、がん細胞ではプロリル・ヒドロキシラーゼやVHLの発現低下や遺伝子変異によってHIF-1αの分解過程に異常を起こしていることも多いことが報告されています。

図:増殖刺激や遺伝子変異などによってがん細胞で恒常的に活性が亢進しているSTAT3(シグナル伝達兼転写活性化因子)はHIF-1遺伝子の転写(mRNAの産生)を促進し、mTORC1はリボソームの生合成を促進するS6Kを活性化してHIF-1タンパク質の合成を促進する。
【HIF-1活性が高いがん細胞は浸潤・転移しやすい】
急速に増大するがん組織の中で、がん細胞は常に低酸素や低栄養による細胞死の危険にさらされています。そこで、低酸素や低栄養による細胞死を起こさないようにするメカニズムとしてがん細胞はHIF-1活性を高めています。これは、HIF-1活性が亢進しているほど、がん細胞は低酸素や低栄養で生存できる(死ににくい)ということを意味しています。
HIF-1はピルビンン酸脱水素酵素キナーゼ(PDK)の発現を促進してピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへの変換)の活性を低下させ、さらにピルビン酸から乳酸への嫌気性解糖系に働く乳酸脱水素酵素(LDH)の発現を促進する作用があります。
つまり、HIF-1はピルビン酸からアセチルCoAへの変換を阻害してTCA回路と酸化的リン酸化での代謝を抑制し、嫌気性解糖系(ピルビン酸から乳酸の変換)を亢進します。さらに、HIF-1は腫瘍特異的なピルビン酸キナーゼ-M2の発現を促進し、解糖系の途中におけるグルコース代謝産物から核酸や脂肪酸やアミノ酸の合成を促進する作用(ペントースリン酸経路の亢進)もあります。
また、HIF-1はがん幹細胞の幹細胞として能力を維持させる作用、上皮-間葉移行(上皮細胞が線維芽細胞のような間葉系細胞の性質を獲得して周囲組織への浸潤性が高まること)や、VEGF(血管内皮細胞増殖因子)を介する血管新生によりがん細胞の遠隔転移を促進する作用なども知られています。
HIF-1はNANOGという遺伝子の発現を亢進しますが、このNANOG遺伝子は幹細胞の多能性を安定化させる因子として働きます。
つまり、HIF-1活性が亢進するとグルコースの取込みと解糖系とペントースリン酸経路が亢進し、ミトコンドリアでの酸化的リン酸化の活性が抑制され、さらに血管新生が促進され、乳酸の産生が増えると免疫細胞が抑制され、結合組織の分解も促進されて転移や浸潤が起こりやすくなるので、HIF-1活性が高いがんほど予後が悪いと言えます。(図)

図:低酸素誘導因子(HIF-1)によって発現誘導や活性亢進される因子を図中の囲み(黄色地に赤字)で示している。HIF-1はグルコース・トランスポーター(GLUT)の量を増やしてグルコースの取込みを増やす。ヘキソキナーゼ(HK)の量を増やして解糖系を亢進しグルコース-6-リン酸脱水素酵素(G6PD)を増やしてペントース・リン酸経路を活性化する。乳酸脱水素酵素(LDH)の量を増やしてピルビン酸から乳酸への変換を促進し、ピルビン酸脱水素酵素キナーゼ(PDK)を誘導してピルビン酸脱水素酵素を阻害して、ピルビン酸からアセチルCoAへの変換を阻害してミトコンドリアでの酸化的リン酸化を抑制する。乳酸を細胞外に排出するモノカルボン酸トランスポーター-4(MCT4)や血管新生を促進する血管内皮細胞増殖因子(VEGF)の発現を誘導する作用もある。これらの作用によって、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化を抑制され、血管新生や免疫抑制や結合組織の分解などによって、増殖や浸潤や転移が促進される。
HIF-1はグルコースを取り込むグルコース輸送体(GLUT-1)の発現を亢進し、解糖系酵素の発現を亢進します。一方、ピルビン酸脱水素酵素キナーゼの発現を亢進してピルビン酸脱水素酵素の活性を阻害し、ミトコンドリアの酸化的リン酸化を抑制します。つまり、HIF-1の活性亢進がワールブルグ効果を引き起こしていると言えます。
がん細胞に取り込まれたグルコースの多くは解糖系で代謝され、物質合成に必要な中間代謝産物を多く作り出しています。
ミトコンドリアの呼吸鎖での酸素を使ったATP産生は必然的に活性酸素の産生を増やします。酸化ストレスは、増殖や転移を抑制するので、がん細胞は増殖や転移を促進するために、ミトコンドリアでの呼吸を抑えていると考えられています。
HIF-1(低酸素誘導因子-1)は解糖系を亢進し、ミトコンドリアでの酸化的代謝を抑制するので、がん細胞の増殖や転移を促進するというメカニズムです。したがって、HIF-1の発現や活性化を抑制する方法はがん細胞の代謝異常の特徴であるワールブルグ効果を阻止するのに役立ちます。(図)

図:酸素分圧(pO2)が低下して低酸素になると(①)、低酸素誘導因子-1(HIF-1)の発現が亢進する(②)。HIF-1はグルコースを取り込むGLUT-1(③)と解糖系酵素(④)と乳酸を排出するMCT4(⑤)の発現を亢進する。HIF-1は血管内皮細胞増殖因子(VEGF)の産生を増やし(⑥)、血管新生を亢進する(⑦)。ペントース・リン酸経路を亢進し(⑧)、NADPHと核酸の合成を促進する(⑨)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進してピルビン酸脱水素酵素の活性を阻害し(⑩)、アセチルCoAの産生を低下させ、ミトコンドリアでの代謝を抑制する(⑪)。
【肺機能が低下したがん患者は予後が悪い】
がん組織の微小環境における低酸素は、がん細胞の悪性度を高め、患者の予後を悪くする要因となっています。高圧酸素療法や酸素吸入などによってがん組織の低酸素状態を軽減すると、生存期間が延びるという動物実験の報告もあります。人間でも、呼吸器機能ががん患者の予後と関連することが報告されています。
高圧酸素療法が肝細胞がん患者の予後を改善し、合併症を軽減することが複数の臨床試験で示されています。そこで、肺機能が肝細胞がんの予後に影響を与えるかどうかが検討されました。その結果、肺機能障害が肝切除後の肝細胞がん患者の不良予後と関連することが明らかになりました。
肺機能の低下は、患者の生存期間の短縮および肝細胞がんの再発の増加と独立に関連していました。これは、肺機能を改善することで、肝細胞がん患者の存期間が向上する可能性を示唆しています。呼吸機能の改善はがん組織の低酸素状態を軽減することによって、がん細胞の増殖や悪性進展を抑制するためと考えられています。
Pulmonary function impairment predicted poor prognosis of patients with hepatocellular carcinoma after hepatectomy.(肺機能障害は、肝切除後の肝細胞がん患者の不良予後を予測した)Oncotarget. 2017 Sep 12;8(43):75326-75335.
低酸素ががん患者の予後を悪くすることは肝臓がんだけでなく、他の多くのがんで当てはまります。
低酸素は固形がんでは一般的な特徴です。低酸素状態はがん細胞の増殖や浸潤や転移を促進し、抗がん剤や放射線治療に対する抵抗性を亢進し、患者の予後を悪くする要因となっています。さらに、低酸素は解糖系を亢進して乳酸の産生を増やし、ミトコンドリアでの酸素呼吸を抑制して活性酸素の産生を低下させ、アポトーシスを起こしにくくします。
乳酸産生の亢進はがん組織における水素イオンの量を増やして、がん組織を酸性化します。がん組織の酸性化は、がん細胞の浸潤や転移を促進し、血管新生を亢進し、免疫細胞の働きを阻害します。貧血も、がん組織の低酸素状態を悪化させ、がん細胞の悪性度を高める可能性があります。
体内に取込む酸素の量を増やし、がん組織の低酸素状態を改善することが、がん細胞の悪性度を低下させ、増殖や浸潤や転移を抑制する手段として有効と言えます。 (図)

図:低酸素のがん細胞は浸潤性や転移能を亢進し、細胞死(アポトーシス)に抵抗性になり、放射線や抗がん剤に対する感受性が低下する。その結果、低酸素のがん細胞の悪性度と治療抵抗性が亢進する(①)。さらに、解糖系亢進が亢進する結果(②)、乳酸とプロトン(水素イオン)の産生増加によってがん組織の酸性化が起こる(③)。組織の酸性化は免疫細胞の働きを阻害し、がん細胞の浸潤性と血管新生を亢進する(④)。これらの総合作用によって、低酸素はがん細胞の悪性度を亢進し、治療抵抗性を亢進する(⑤)。
【がん幹細胞ががん組織を増大する】
組織の細胞には幹細胞(stem cell)と成熟した体細胞が存在します。組織の幹細胞とは、組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる細胞です。組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出しています。
組織幹細胞は、分裂して自分と同じ細胞を作り出すことができ(自己複製能)、いろいろな細胞に分化できる(多分化能)という二つの重要な性質を持ち、この性質により、限られた寿命のある体細胞を絶えず供給し、傷ついた組織を修復することができるのです。
がん組織においても正常組織における幹細胞システムに類似した階層性が存在し、その中にがん幹細胞 (cancer stem cells)と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成していることが明らかになっています。
すなわち、無限に自己複製を行うがん幹細胞ががん組織中に少数存在し、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっているのです。多くの場合、このがん幹細胞の起源は通常の組織幹細胞と考えられています。(図)
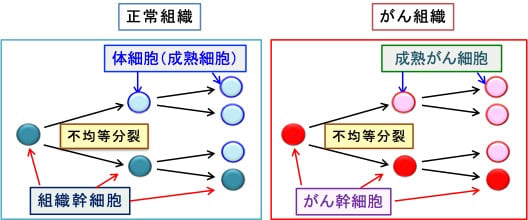
図:(左)正常組織の細胞には幹細胞と成熟した体細胞が存在する。幹細胞は組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる。組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出している。
(右)がん組織にはがん幹細胞 (cancer stem cells)と呼ばれる細胞が存在して、通常のがん細胞(成熟がん細胞)を供給しながらがん組織を構成している。がん幹細胞は自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっている。
がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境中に存在し、周りの細胞から分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
生体内で幹細胞がその性質を維持するために必要な微小環境を幹細胞ニッチ (stem cell niche)と言います。ニッチ(niche)とは、もともと西洋建築で彫像などを置くために設けられた窪みの部分を指し「隙間」を意味します。経済分野で使われる「ニッチ産業」は「隙間産業」とも呼ばれ、他の企業が進出していない小さな分野や市場に対して使われていますが、このニッチ(niche)と同じ用語です。
幹細胞を単離して培養すると、幹細胞の自己複製能や未分化性が次第に無くなって来ます。つまり、幹細胞がその性質を維持するためには適切な環境が必要であると考えられており、この環境のことを幹細胞ニッチと言います。
【低酸素はがん幹細胞を増やす】
がん組織を構成するがん細胞をばらばらに単離して、それを同じ種類の動物に植えても、多くのがん細胞は腫瘍を形成できません。腫瘍を形成するのは、がん幹細胞と言われる一部のがん細胞です。
腫瘍を形成するがん細胞は分化度が低く、無限に増殖する能力を持っています。低酸素は細胞分化を阻止します。がん細胞を低酸素状態(1% O2)で培養すると、脱分化の遺伝子の発現が増え、分化の遺伝子の発現は抑制されます。つまり、低酸素で培養するとがん細胞は悪性度が高まります、
腫瘍組織の低酸素は、患者の予後不良と関連する独立した予後決定因子であることが多くの研究で明らかになっています。腫瘍微小環境における低酸素状態が、腫瘍細胞におけるがん幹細胞様性状を誘導し、この性状の選択および維持を促進することによって、がん細胞の悪性進展および治療抵抗性を促進することが示唆されています。
乳がん細胞をマウスに移植する実験で、腫瘍組織の微小環境における低酸素が、がん幹細胞の性状を持ったがん細胞の数を増やすことが報告されています。低酸素の腫瘍組織から採取したがん細胞は、分化度が低く、がん幹細胞の性状に関連した遺伝子の発現が亢進していました。つまり、「がん細胞は低酸素になると分化度が低下し、がん幹細胞の性状を発現し、悪性度が亢進する」ということです。
低酸素の領域のがん細胞は増殖促進シグナル経路のPI3K/AKT 経路が強度に亢進し、これはがん幹細胞の性状を維持するために必要と言っています。つまり、がん組織の低酸素の改善と同時に、増殖シグナル経路(PI3K/AKT 経路)の阻害を併用することが、がん幹細胞の維持を阻止する手段として重要だと言えます。
The hypoxic tumor microenvironment in vivo selects the cancer stem cell fate of breast cancer cells(生体内での低酸素腫瘍微小環境は、乳がん細胞のがん幹細胞の性状を選択する)Breast Cancer Res. 2018; 20: 16.
このように、低酸素はがん細胞の分化度や幹細胞性(stemness)といったがん細胞の性状に影響を及ぼすことが明らかになっています。通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。がん幹細胞が生き残れば、がんはいずれ再燃・再発するので、がん幹細胞の放射線感受性や抗がん剤感受性を高める方法の開発が重要と考えられています。(図)

図:成熟がん細胞(白い細胞)は抗がん剤や放射線で死滅しやすいが、がん幹細胞(黒い細胞)は死滅しにくいので抗がん剤治療や放射線治療で生き残る(①)。がん幹細胞は腫瘍形成能を持つので、生き残ったがん幹細胞が増殖して再発や再燃が起こる(②)。治療を繰り返すと治療抵抗性のがん幹細胞が増え、治療抵抗性が亢進する(③)。
【有酸素運動でがん組織の酸素供給を増やすとがん治療の効果が高まる】
有酸素運動はがん組織の低酸素を除去する方法の一つとなります。
がんと運動の関係においては、発がん予防や再発予防やがんサバイバーの症状の改善などが中心に研究されていますが、がん治療における効果についてはあまり検討されていません。しかし、多くの研究結果をまとめると、 「運動はがん組織の血液循環を良くし、低酸素状態を改善することによって治療効果を高める」というのが現在のコンセンサスのようです。
つまり、がん患者さんが有酸素運動を積極的に行うことは、いろんなメカニズムで、がん治療や再発予防に役立つと言えます。
ラットの前立腺がんの実験モデルを使って、トレッドミルによる運動をさせた群と運動をさせなかった群で、腫瘍組織の低酸素状態を比較した研究が行われています。以下のような報告があります。
Effects of exercise training on tumor hypoxia and vascular function in the rodent preclinical orthotopic prostate cancer model.(齧歯類における前臨床試験としての同所性前立腺がんモデルにおける腫瘍低酸素および血管機能に対する運動訓練の効果)J Appl Physiol (1985). 2013 Dec;115(12):1846-54.
運動はがん組織の微小環境における血液循環を良くして低酸素状態を改善し、その結果がん細胞の浸潤性や悪性度が低下し、生存率を良くすることを報告しています。
がん細胞は酸素を嫌う嫌気的な生き物で、酸素が少ない方が生存に有利な細胞です。したがって、運動によってがん組織の血液循環と酸素供給を増やすことは、がん細胞の増殖抑制に有効と言えます。
また、抗がん剤治療に高圧酸素療法を併用して抗腫瘍効果を高める治療法も報告されています。がん組織の低酸素化を改善して酸素が十分に行き渡ると、抗がん剤や放射線治療の効き目を高めることがあきらかになっています。高気圧酸素療法は放射線療法や抗がん剤治療との併用が保険適用されています。
サリドマイドや血管内皮細胞増殖因子(VEGF)の阻害剤は血管新生を阻害する作用によって抗腫瘍効果を発揮すると一般には考えられていますが、がん組織内の血管(腫瘍血管)を正常化して、がん組織内の血液循環を良くして、抗がん剤や放射線治療の効果を高めるというメカニズムも指摘されています。
前述のように、固形がんでは、腫瘍細胞の増殖に血管の増生や構築が間に合わなく、異常な血管が作られ、不十分な血管網を構築し、がん組織の至る所で低酸素状態に陥っています。低酸素になると、がん細胞は様々な適応応答を発動し、その結果、抗がん剤や放射線による細胞死(アポトーシス)に抵抗性になります。
また、放射線治療は活性酸素を産生してがん細胞を死滅させますが、この効果は酸素が無い状態では阻害されます。抗がん剤の多くも、最終的に細胞死を引き起こすときに活性酸素が関与しており、酸素が乏しい条件では、細胞死が起こりにくいことが明らかになっています。
「がん細胞のミトコンドリアを活性化して活性酸素の産生を高めて、がん細胞を自滅させる」というがんの酸化治療においても、低酸素の条件ではがん細胞のミトコンドリアでの活性酸素の発生が低下するので、がん細胞を死滅させることができません。免疫療法も、酸素の無い場所では、リンパ球などの免疫細胞も働けません。
つまり、多くのがん治療において、がん組織の低酸素状態は、治療効果を妨げていることになるのです。したがって、がん組織の酸素濃度を高めることががん治療の効果を高める重要な因子になります。
| « 886)進行乳が... | 888)グルタチ... » |



