がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
672) 2-デオキシ-D-グルコースとメトホルミンとケトン食の相乗的抗がん作用
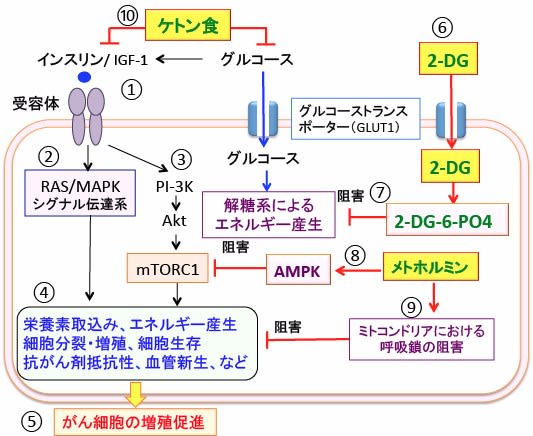
図:糖質の多い食事は血糖を高め、インスリン/インスリン様成長因子-1(IGF-1)受容体のチロシンキナーゼ・ドメインのチロシン残基のリン酸化を介して(①)、RAS/MAPKシグナル伝達系(②)およびPI3キナーゼ(PI-3K)/Akt/ mTORC1シグナル伝達系(③)を活性化し、栄養素取込みやエネルギー産生、細胞分裂・増殖、細胞生存、抗がん剤抵抗性、血管新生などを亢進して(④)、がん細胞の増殖を促進する(⑤)。2-デオキシ-D-グルコース(2-DG;⑥)が細胞内でリン酸化されてできる2-DG-6-リン酸(2-DG-6-PO4)は解糖系を阻害してエネルギー産生を低下させる(⑦)。メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化し、AMPKは哺乳類ラパマイシン標的蛋白質複合体1(mTORC1)の活性を阻害して、がん細胞の増殖を抑制する(⑧)。さらに、メトホルミンはミトコンドリアにおける呼吸鎖(電子伝達系)を阻害してATPの産生を低下させ、がん細胞の増殖を抑制する(⑨)。超低糖質/高脂肪食のケトン食は血糖上昇とインスリン/IGF-1シグナル伝達系を阻害することによって、がん細胞の増殖と生存を阻止する(⑩)。
672) 2-デオキシ-D-グルコースとメトホルミンとケトン食の相乗的抗がん作用
【グルコースの取込みが多いがん細胞は増殖活性が高く、治療に抵抗性を示す】
一般的にグルコース(ブドウ糖)の取込みの多いがん細胞ほど増殖が早く、悪性度が高く、予後が悪いと言えます。取り込まれたグルコースがエネルギー産生と細胞を構成する成分の合成に使われるからで、グルコースの取込みが多いことは増殖活性が高いことを意味します。
したがって、がん細胞におけるグルコースの取込みや解糖系での代謝を阻害すると、がん細胞の増殖活性を低下させることができます。
また、抗がん剤治療や放射線治療にグルコースの取込みや解糖系を阻害する治療を併用すると、抗がん剤や放射線治療の効き目を高めることができます。
がん細胞が抗がん剤や放射線でダメージを受けても、エネルギー(=ATP)と細胞成分を作る材料、すなわちグルコースが十分に供給されておれば、ダメージを修復して増殖を続けることができます。しかし、がん細胞におけるグルコースの取込みや利用を阻害すれば、ダメージを修復することができません。
グルコースの取込みやエネルギー産生過程を阻害する方法は、抗がん剤や放射線に対するがん細胞の感受性を高める効果が期待でき、がん治療の重要なターゲットになっています。(下図)

図:(上)がん細胞はグルコースの取込みと代謝(解糖系とペントース・リン酸経路)が亢進してATP産生と細胞を構成する物質(細胞膜や核酸など)の合成が亢進している。抗がん剤や放射線照射によって細胞がダメージを受けても、グルコースの取込みと代謝(エネルギー産生と物質合成)の亢進によって、ダメージを修復して増殖活性を維持できる。
(下)グルコースの取込みや代謝が阻害されると、ダメージの修復に必要なATPも物質合成も行えなくなる。そうなると抗がん剤や放射線で受けたダメージを修復できないので、細胞死をきたすことになる。
【高血糖はがんを促進する】
高血糖はがん細胞の増殖を促進します。以下のような論文があります。
Impact of glycemia on survival of glioblastoma patients treated with radiation and temozolomide.(放射線およびテモゾロミドで治療された膠芽腫患者の生存に対する血糖の影響)J Neurooncol. 2015; 124(1): 119–126.
【要旨】
高血糖が膠芽腫患者の転帰を悪くすることを示す研究結果が報告されている。
この研究は、新たに膠芽腫と診断された患者の放射線療法およびテモゾロミド治療中の血糖と全生存との関連を確認することを目的としている。
この後向き研究には、2004年から2011年にかけて放射線療法およびテモゾロミドで治療された膠芽腫患者が含まれた。
時間加重平均血糖値とデキサメタゾンの用量は、放射線治療の開始から放射線治療の終了の4週間後まで収集された。時間加重平均グルコース値およびその他の予後因子と全生存との関連を単変量および多変数解析で検討した。
合計で393人の患者が対象となり、追跡期間の中央値は14ヶ月であった。全生存期間の中央値は15か月で、時間加重平均血糖値の中央値は6.3 mmol / Lであった。
全生存期間の中央値は、時間加重平均血糖値が6.3 mmol / L未満の群では16ヶ月で、6.3 mmol / Lを超える患者では13か月であった(p = 0.03)。
単変量解析では、時間加重平均血糖値、時間加重平均デキサメタゾン、年齢、手術の範囲、およびパフォーマンスステータスは全生存期間と関連していた。
多変量解析では、時間加重平均血糖値は、時間加重平均デキサメタゾン、年齢、および手術の範囲とともに、全生存期間の独立した予測因子のままであった(p = 0.03)。
この研究は、血糖値が放射線療法およびテモゾロミドで治療された膠芽腫患者の生存の独立した予測因子であることを示している。
がん細胞がグルコースを多く取り込むことはよく知られています。がん細胞が数を増やしていくには、莫大なエネルギー(ATP)の産生と、細胞を構成する成分(核酸や細胞膜など)の合成が必要です。エネルギー産生と細胞構成成分の合成の主な材料がグルコースなのです。
がんの検査法でPET(Positron Emission Tomography:陽電子放射断層撮影)というのがあります。これはフッ素の同位体で標識したグルコース(18F-fluorodeoxy glucose:フルオロデオキシグルコース)を注射して、この薬剤ががん組織に集まるところを画像化することで、がんの有無や位置を調べる検査法です。正常細胞に比べてグルコースの取り込みが非常に高いがん細胞の特性を利用した検査法です。
がん細胞がグルコースを多く取り込むことが最初に報告されたのは1921年です。糖尿病患者ががんを発症すると尿糖が減ること、グルコースの入った培養液にがん組織や正常組織を入れて培養する実験で、正常の筋肉組織や肝臓組織に比べてがん組織ではグルコースの消費量が高いことが報告されています。(Braunstein A: Wratschebnaje obosrnije. 7:291. 1921年)
翌年の1922年には、がん組織には乳酸が大量に蓄積していることが報告されています。(Bierich R: Virchows Archiv f Pathol Anatom und Physiol. 23:1-19.1922年)
そして、1923年からオットー・ワールブルグ博士のグループが、「がん組織では、ミトコンドリアでの酸化的リン酸化が低下し、酸素がある状態でも嫌気性解糖系でのエネルギー産生が主体である」という現象について一連の論文を発表しています。
オットー・ワールブルグ(Otto Warburg:1883年~1970年)博士は呼吸酵素(チトクローム)の発見で1931年にノーベル生理学・医学賞を受賞したドイツの生化学者です。細胞生物学や生化学の領域で重大な基礎的発見を次々に成し遂げ、呼吸酵素以外の研究でも何回もノーベル賞候補になった偉大な科学者です。
ワールブルグ博士は、がん細胞ではグルコースから大量の乳酸を作っていること、がん細胞は酸素が無い状態でもエネルギーを産生できること、さらに、がん細胞は酸素が十分に存在する状態でも、酸素を使わない方法(嫌気性解糖系)でエネルギーを産生していることを見つけています。現在ではこの現象はワールブルグ効果(Warburg effect)と呼ばれ、がん研究の重要なテーマになっています。
がん細胞はグルコースをエネルギー源として大量に取り込んでいるため、高血糖はがん細胞の増殖に有利になります。
逆に、血糖を低下させたり、グルコースの取り込みや解糖系を阻害すれば、がん細胞の増殖を抑えることができます。
これが、血糖を上げない糖質制限食あるいはケトン食と、血糖を低下させるメトホルミンと解糖系を阻害する2-デオキシ-D-グルコースが相乗的に抗がん作用を発揮する、最も簡単な説明になります。
【2-デオキシ-D-グルコースはグルコース(ブドウ糖)の誘導体】
2-デオキシ-D-グルコース(2-Deoxy-D-glucose)は、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換された物質(グルコース誘導体)です。2-デオキシグルコース(2-DG)はグルコースと同じようにグルコース輸送体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれます。
グルコースと2-DGは細胞内に入るとヘキソキナーゼ(Hexokinase)によってリン酸化され、グルコース-6-リン酸あるいは2-デオキシ-D-グルコース-6-リン酸(2-DG-6-リン酸)に変換されます。リン酸化されるとグルコース・トランスポーター(GLUT1)を通過できないため細胞外へ出れなくなります。このヘキソキナーゼによる6位のリン酸化は解糖系によるグルコースの代謝の最初のステップで、細胞内に取込んだグルコースを細胞内にとどめておく目的があります。
リン酸化反応後は、グルコース-6-リン酸はさらに解糖系で代謝されてエネルギー産生に使われ、ペントース・リン酸経路で核酸などの物質合成の材料としても利用されます。
しかし、2-DG-6-リン酸は、解糖系酵素で代謝できないため、細胞内に蓄積します。グルコース-6-リン酸や2-DG-6-リン酸を脱リン酸化するフォスファターゼが糖新生を行う肝臓や腎臓の細胞にはありますが、多くのがん細胞はフォスファターゼの活性が低いので、一旦入った2DGは2DG-6-リン酸に変換されたあとは細胞外に出ることができず、さらにそれ以上代謝されることもできないので、2-DG-6-リン酸の状態でどんどん蓄積します。
2-DGによってエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーターの発現がさらに増え、2-DGの取り込みをさらに増やすことにもなります。したがって、がん細胞は正常細胞に比べてより2-DGの取込みが増えます。
細胞内で蓄積した2-DG-6-リン酸はヘキソキナーゼとヘキソース・フォスフェート・イソメラーゼを阻害します(拮抗阻害)。したがって、2-DGを経口摂取すると、がん細胞に多く取り込まれ、がん細胞の解糖系を阻害するので、グルコースの代謝によるエネルギー産生と物質合成を阻害することになります。
さらに2-DGがタンパク質のN-グリコシル化を阻害して小胞体ストレスを引き起こす作用もあります。(下図)
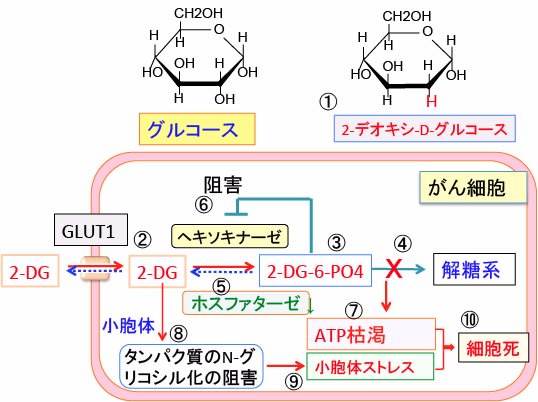
図:2-デオキシ-D-グルコース(2-DG)はグルコースの2位の水酸基(OH)が水素原子(H)に置換されたグルコース誘導体(①)で、グルコースと同様にグルコース・トランスポーター(GLUT1)によって細胞内に取り込まれる(②)。がん細胞はGLUT1の発現量が増え、グルコースと同時に2-DGも多く取り込む。2-DGはヘキソキナーゼで2-DG-6リン酸に変換されるが(③)、それ以上代謝されない(④)。がん細胞はフォスファターゼの活性が低いので(⑤)、2-DG-6-リン酸ががん細胞内に蓄積する。蓄積した2-DG-6-リン酸はヘキソキナーゼをフィードバック阻害する(⑥)ので、 2-DG-6-リン酸を取り込んだがん細胞はグルコースの解糖系での代謝が阻害される。その結果、がん細胞のエネルギー産生と物質合成は阻害され、ATPが枯渇する(⑦)。さらに、タンパク質のN-グリコシル化を阻害して(⑧)タンパク質の折り畳みの異常による小胞体ストレスを引き起こす(⑨)。ATP枯渇と物質合成阻害と小胞体ストレスはがん細胞の細胞死を誘導する(⑩)。
【2-デオキシ-D-グルコースはがん細胞の増殖を抑える】
2-デオキシ-D-グルコース(2-DG)ががん細胞の増殖を抑制する効果が最初に指摘されたのは1950年代です。「がん細胞のエネルギー源であるグルコースの誘導体を取り込ませれば、がん細胞の増殖を抑制できる」というアイデアは、もう60年以上も前に研究されており、グルコースの誘導体の抗腫瘍活性が検討され、2-DGに強い抗腫瘍効果があることが証明されています。
しかし、2-DGを使ったがん治療は、その後あまり注目されなかったようです。その理由の一つは、がんの治療においては、「強い毒性をもった化合物を使ってがん細胞を一掃するような治療法」が1950年代以降は主流になっていたからだと思われます。 そのため、「エネルギー産生経路を阻害してがん細胞の増殖を低下させる」というようなアイデアは注目されなかったのかもしれません。
しかし、ワールブルグ効果が再評価されるようになり、がん細胞のエネルギー産生と物質合成を阻害する方法として、2-DGにも注目が集まるようになり、多くの動物実験で抗腫瘍効果が証明され、人間での臨床試験も実施されるようになったということです。
例えば、以下のような報告があります。
Chronic Dietary Administration of the Glycolytic Inhibitor 2-Deoxy-D-Glucose (2-DG) Inhibits the Growth of Implanted Ehrlich’s Ascites Tumor in Mice(解糖系阻害剤2-デオキシ-D-グルコースの慢性食餌投与は、マウスに移植されたエールリッヒ腹水腫瘍の成長を阻害する)PLoS One. 2015; 10(7): e0132089.
【要旨の抜粋】
背景:カロリー制限食は、強力な抗がん戦略として確立されている。しかし、人間においてカロリー制限を長期間実施することは、現実的に困難なことも多い。したがって、食事からのカロリー摂取を減らさずに、カロリー制限と同様な効果を発揮できる医薬品の開発が望まれている。
解糖阻害剤の2-デオキシ-D-グルコース(2-DG)は、カロリー制限模倣剤としての可能性を持っていることが示されている。本研究では、マウス腫瘍モデルを用いて、食事性に投与した2DGの抗腫瘍効果を検討し、2DGの抗腫瘍効果のメカニズムを検討した。
方法と主要な結果:スイスのアルビノ系統「A」マウスに、エールリッヒ腹水がんを移植する3ヶ月前から飲料水中に0.2%および0.4% w/v の濃度で2-DGを混入して2-DGを飲水から投与し、実験が終了するまで投与を継続した。2-DGの投与は動物の一般的な生理機能や成長には悪影響は認めなかった。
食事性の2-DG投与は、腫瘍の発生率を有意に低下させ、腫瘍の発症を遅らせ、腫瘍の増大を抑制し、生存率を向上した。
2-DG給餌マウスでは、血中グルコースおよび血清インスリンレベルの低下と、移植腫瘍のがん細胞の増殖活性の低下が観察された。また、2-DG摂食マウスの腫瘍では、ホスファチジルイノシトール3-キナーゼ(PI3K)、リン酸化Akt、低酸素誘導因子1アルファ(HIF-1α)などのがん細胞の増殖を促進するタンパク質のレベルの低下も認められた。
さらに、2-DG給餌マウスではCD4 + / CD8 +比の減少と制御性T細胞の減少を認めた。これは、抗腫瘍免疫とT細胞エフェクター機能の増強を示唆した。
結論と意義:これらの結果は、ヒトで容易に達成可能な用量でのマウスへの食餌2-DG投与が、カロリー制限と同様なメカニズムで、腫瘍形成を阻害することを示している。カロリー制限模倣薬ががん予防薬として有用である可能性を示唆している。
ネズミと人間は体重当たりの代謝率が異なり、小さい動物ほど体重当たりの飲水やエサの摂取量は多くなります。
標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。体表面積ではほぼ同じになります。これについては293話で解説しています。
しかし、面倒な計算をしなくても、代謝量は食餌摂取量や水分摂取量と比例すると考えると、食事中の濃度や飲料水中の濃度が同じで計算できます。
つまり、マウスの食餌や水分の摂取量は体重換算で人間の7倍くらいです。体表面積当たりであれば、同じです。
さて、この論文では飲料水に2-DGを0.2%と0.4%の濃度で溶かしています。1リットル当たり2gか4gです。
人間は食事や飲料から1日に2Lくらいの水分を摂取していますが、飲料水からは1.2L程度です。したがって、このマウスの実験結果から人間成人の場合1日に2gから4g程度の2-DGの摂取が目安になります。
米国で行われている臨床試験では2-DGは1日に体重1kg当たり40から60mg程度です。これは60kgで2.4gから3,6gに相当します。マウスの実験とほぼ同じレベルです。
つまり、抗腫瘍効果が期待できる2-DGの摂取量として1日に体重1kg当たり40から60mgが妥当と言えます。2-DGの投与量については以下の論文も参考になります。
A phase I dose-escalation trial of 2-deoxy-D-glucose alone or combined with docetaxel in patients with advanced solid tumors.(進行した固形がんの患者における2-デオキシ-D-グルコースの単独およびドセタキセル併用の第1相用量増加試験) Cancer Chemother Pharmacol. 71(2):523-30, 2013年
【論文内容の要約】
この第1相試験は、進行した固形がんの患者34人を対象にして、解糖系阻害剤の2-デオキシ-D-グルコース(2-DG)の単独およびドセタキセルを併用した場合の、安全性と薬物動態と最大耐用量(患者が耐えられる最大投与量)を評価する目的で実施された。
最大耐用量の基準に相当する用量制限性毒性は認めなかった。 最も多い副作用は倦怠感、発汗、めまい、吐き気であり、2-DG投与で予想される低血糖の症状と類似していた。
63mg/kgを臨床的耐用量と決定した。63-88 mg/kgの投与でみられた最も重要な副作用は高血糖(100%)、消化管出血(6%)、可逆性のグレード3の心電図上のQTc延長(22%)であった。 12例(32%)は病状安定(stable disease)、1例(3%)は部分奏功、22例(66%)は病状進行であった。2DGとドセタキセルの薬物動態において相互作用は認めなかった。
結論:週1回のドセタキセル投与との併用療法における2GDの推奨投与量は63mg/kg/day であった。
2-DGを抗がん剤治療と併用する場合の2-DG投与量の一つの目安として、1日に体重1kg当たり63mgという報告です。2-DGはグルコースと競合的に取込まれるため、糖質の摂取が少ない条件では、2-DGの服用量を減らしても抗腫瘍効果が期待できます。つまり、糖質制限食やケトン食を行えば、2-DGの摂取量をかなり減らせます。
2-DGとの併用で効果増強が報告されている抗がん剤として、上記のドセタキセル以外に、ドキソルビシン、5-フルオロウラシル、トラスツズマブ(Trastuzumab;商品名はハーセプチン)、シクロフォスファミドなどもあります。いずれも、それぞれの抗がん剤単独の場合より、2-DGを併用すると抗腫瘍効果が増強することが報告されています。
また、放射線治療との併用においても、2-DGが放射線治療の効果を増強することが報告されています。
多くの臨床試験の結果から、2-DGは1日に体重1kg当たり40〜60mgを服用するのが妥当です。糖質制限やケトン食を実践しているときは1日に体重1kg当たり20〜30mg(体重50kgで1日1〜1.5g)の服用で抗腫瘍効果が期待できます。
最も多い副作用は高血糖です。2-DGは細胞内のグルコースの濃度を低下させます。脳の視床下部の神経細胞が細胞内グルコースの低下を感知すると、低血糖状態と勘違いして、脳下垂体のホルモン分泌を制御して血糖を高めるホルモンや伝達物質を出すようになるため高血糖になるようです。食事からの糖質摂取を減らすケトン食や肝臓の糖新生を阻害するメトホルミンを併用すると高血糖を避けることができます。
一方、服用量が多いと低血糖のような症状(倦怠感や脱力)を感じます。がん細胞の多く取込まれるため、低血糖症状が起こらないレベルで服用量を調節することが重要です。
【カロリー制限と類似の作用を示す2-デオキシ-D-グルコース】
カロリー制限による寿命延長の研究を行っている米国国立老化研究所(National Institute on Aging)のジョージ・ロス(George Roth)博士の研究グループは、カロリー制限と同じ効果を真似る薬の開発において、2-デオキシ-D-グルコース(2-DG)の可能性を研究していました。
カロリー制限と同じ効果(抗老化や寿命延長効果)を示す薬をCalorie restriction mimetics (CRM:カロリー制限模倣化合物)と言います。
CRMには抗糖尿病薬のメトホルミン、赤ワインに含まれるレスベラトロール、ポリアミンの一種のスペルミジンなども知られていますが、2-DGはカロリー制限模倣化合物)として最初に研究された物質です。現在でも抗老化の観点からの研究は行われています。
グルコース代謝が阻害されてATP量が減少するとAMP活性化プロテイン・キナーゼ(AMPK)が活性化され、活性化されたAMPK はmTORC1(哺乳類ラパマイシン標的タンパク質)を抑制します。mTORC1は老化と発がん過程の両方を促進する働きがあるので、mTORC1の抑制は抗老化と抗がんの両方の効果になります。
線虫の実験では、2-DGが寿命を顕著に延長する結果が得られています。
しかし、ラットの実験では2-DGを大量に長期間投与すると心筋細胞の空砲化と死亡率の上昇などの毒性が確認されています。(Toxicol Appl Pharmacol 243(3): 332-9, 2010年)
つまり、動物にとっては老化予防や寿命延長の目的では2−DGは現実的とは言えないようです。
ただし、てんかんやがんの治療目的においては、臨床効果の方が毒性より上回っていると考えられ、人間での臨床試験が行われています。
2-デオキシ-D-グルコースがケトン体の産生を高めて神経細胞におけるミトコンドリアでのエネルギー産生を高めることによってアルツハイマー病を改善する作用が動物実験で確認されています。
いろんな研究結果からがん治療において2-デオキシ-D-グルコースとケトン食は相乗効果が期待できるようです。
例えば、以下のような報告があります。
Drug/diet synergy for managing malignant astrocytoma in mice: 2-deoxy-D-glucose and the restricted ketogenic diet.(マウスの悪性星細胞腫を制御するための薬物と食事の相乗効果:2-デオキシ-D-グルコースとカロリー制限されたケトン食)Nutr Metab (Lond). 2008 Nov 25;5:33. doi: 10.1186/1743-7075-5-33.
【要旨】
背景:星状細胞腫は、成長と生存のための生体エネルギー要求を満たすために、解糖に大きく依存している。したがって、解糖を阻害する治療法は、星状細胞腫の成長と進行を抑制できる可能性がある。高脂肪/低糖質のケトン食は、マウスおよびヒト星状細胞腫に対して、解糖を抑制し、増殖を抑制する。
細胞で代謝できないグルコース類似体の2-デオキシ-D-グルコース(2-DG)は、in vitroおよびin vivoの両方でカロリー制限の効果を模倣することができる強力な解糖系阻害剤である。しかし、200 mg / kgより多い用量で投与すると有害作用を引き起こす可能性がある。この研究の目標は、低用量の2-DGがケトン食と相乗的に作用してCT-2A悪性マウス星状細胞腫の成長をより有効に抑制できるかどうかを検討することである。
方法:同所性に移植したCT-2A悪性星状細胞腫を有する成体C57BL / 6Jマウスにおいて、ケトン食に低用量の2-DG(25 mg / kg)の投与を併用した場合の治療効果を検討した。
腫瘍移植後の最初の3日間はマウスに標準食を自由摂取で与えた。その後、カロリー制限しない標準食とカロリー制限したケトン食群にわけ、さらにそれぞれの群で、2-DGの投与を受けた群と受けなかった群にわけ、計4つの群に分けて飼育した。
カロリー制限されたケトン食は、体重を約20%減らすようにカロリーを制限した。 2-DGは腫瘍移植の6日後に開始され、7日間続けられた。脳腫瘍を切除し、重量を量った。
結果:エネルギー摂取量、体重、およびCT-2A腫瘍重量は、カロリー制限なしの普通食において、2-DGの併用の有無と関係なく同様の結果であった。
腫瘍重量は、普通食群よりもカロリー制限ケトン食群では約48%の減少、カロリー制限ケトン食+ 2-DG群で約80%の減少を認めた。マウスの健康と活力は、カロリー制限ケトン食+ 2-DG群よりもカロリー制限ケトン食群の方が優っていた。
結論:星状細胞腫の成長は、カロリー制限ケトン食または2-DGのみの投与を受けたマウス群よりも2-DGを併用したカロリー制限ケトン食群でより抑制され、薬物と食事の相乗的相互作用が示唆された。これらの結果は、悪性星細胞腫の治療にケトン食を使用する場合、解糖を阻害する薬物と組み合わせると、抗腫瘍効果を強化できることを示唆している。
つまり、ケトン食と2-デオキシ-D-グルコースの併用は相乗効果が期待できるということです。
【2-DGは正常細胞を抗がん剤や放射線のダメージから保護する】
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害するので、がん細胞の増殖速度を低下させる効果があります。
がん細胞のエネルギー産生や物質合成の経路を阻害すると、抗がん剤や放射線に対するがん細胞の感受性が高まります。
2-デオキシ-D-グルコース(2-DG)は抗がん剤や放射線に対するがん細胞の感受性を高めるだけでなく、抗がん剤や放射線による正常細胞のダメージを軽減する効果があるという報告があります。以下のような報告があります。
Protection of normal cells and tissues during radio- and chemosensitization of tumors by 2-deoxy-D-glucose. (2-デオキシ-D-グルコースはがん組織の放射線感受性と抗がん剤感受性を高め、正常細胞と組織のダメージを軽減する)J Cancer Res Ther. 2009 Sep;5 Suppl 1:S32-5.
【要旨】
正常組織への毒性はがん治療における重要な制限因子の一つである。正常組織や重要臓器に対するダメージが大きくなるため、抗がん剤や放射線照射の用量を増やすことができない。そのため治療効果も弱くなる。
グルコース類縁体の2-デオキシ-D-グルコース(2-DG)は、解糖系を阻害してATP産生を阻害する作用があり、がん細胞に対する抗がん剤や放射線治療の感受性を高めることが、多くのがん細胞種において認められている。さらに、正常細胞に対しては、放射線や抗がん剤からのダメージを軽減することが報告されている。この総説では、正常細胞や正常組織を抗がん剤や放射線から保護する2-DGの作用機序を考察し、このグルコース類縁体ががん治療において有用な補助療法である根拠を示す。
がん細胞は正常細胞に比べてグルコース(ブドウ糖)の取込みが多く、ATP産生や細胞分裂するための物質合成に大量のグルコースを必要としています。したがって、グルコースの取込みや利用を妨げれば、ATP産生や物質合成が低下し、抗がん剤や放射線治療の効き目が高くなります。
がん細胞はグルコーストランスポーターを多く発現しているので、2-DGの取込みも多く、2-DGによるグルコース代謝の阻害作用が著明に現れます。
培養細胞を使った実験や動物にがん細胞を移植した動物実験で、2-DGを投与すると抗がん剤や放射線治療の治療効果が高まることが多くの実験系で確認されています。
さらに動物実験で、2-DGが脳や心臓に対する抗がん剤や放射線のダメージを軽減する作用が認められています。その作用機序についてはまだ十分に解明されていませんが、AMP活性化プロテインキナーゼ(AMPK)の活性化やオートファジーの阻害など複数のメカニズムが示唆されています。以下のような論文があります。
Caloric restriction mimetic 2-deoxyglucose antagonizes doxorubicin-induced cardiomyocyte death by multiple mechanisms.(カロリー制限と同様の作用がある2-デオキシグルコースはドキソルビシンによる心筋細胞死を複数のメカニズムで阻止する)J Biol Chem. 2011 Jun 24;286(25):21993-2006.
【要旨】
食事からのカロリー摂取を減らすカロリー制限が心血管系の健康状態を良くすることが知られている。グルコース類縁物質の2-デオキシ-D-グルコースはカロリー制限と同様の作用を示すことが複数の動物実験で報告されている。しかしながら、2-DGが心機能に有益な作用を示すかどうかはまだ不明である。
この研究では、抗がん剤で副作用として心筋障害を引き起こすドキソルビシンの投与で引き起こされる心筋細胞死に対して2-DGが抑制作用を示すかどうかを検討した。
新生児ラットの心筋細胞を0.5mMの2-DGで処理すると、ドキソルビシンで誘導される心筋細胞のダメージや細胞死を顕著に抑制した。
2-DGは細胞内ATP量を17.9%低下させたが、ドキソルビシンによって引き起こされる著明なATP枯渇は阻止し、これが2-DGによる心筋細胞死の抑制に寄与していると考えられた。
さらに、2-DGはAMP活性化プロテインキナーゼ(AMPK)の活性を高めた。
AMPKシグナルの阻害剤(compound Cまたは干渉RNA)を投与すると、2-DGの心筋細胞保護作用は阻止された。
逆に、薬や遺伝子的方法でAMPK活性を増強すると、ドキソルビシンの心筋細胞障害は抑制された。2-DGとAMPK活性化剤を併用すると相加効果は認めなかった(注:両方とも同じ機序でドキソルビシンによる心筋障害を抑制するので、併用しても相加や相乗効果は得られないということ)
さらに2-DGはオートファジー(自食作用)を誘導するが、このオートファジーは細胞内タンパク質の分解であり、その活性化は細胞の状況によって良い場合(細胞障害から保護する)と悪い場合(細胞障害を悪化する)がある。
2-DGはオートファジーを活性化するが、ドキソルビシンによって引き起こされる細胞障害性のオートファジーは阻止した。
以上のことから、カロリー制限と同様な作用を示す2-DGはドキソルビシンで誘導される心筋細胞のダメージや細胞死を阻止することが明らかになり、その作用機序としては、ATP量の維持、AMPKの活性化、ドキソルビシンによって誘導されるオートファジーの阻害など複数のメカニズムが関与していることが示唆された。
このように、2-DGはがん細胞の抗がん剤感受性や放射線感受性を高め、正常細胞に対しては抗がん剤や放射線のダメージから守る作用があります。
【メトホルミンの抗腫瘍活性はグルコース摂取を減らすと増強できる】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
ビグアナイド剤は、中東原産のマメ科のガレガ(Galega officinalis)から1920年代に見つかったグアニジン誘導体から開発された薬です。ガレガは古くから、糖尿病と思われる病気(口渇や多尿)の治療に経験的に使われ有効性が認められており、その関係でこのガレガから血糖降下作用のあるビグアナイドが発見されました。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。最近の研究では、メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素(mitochondrial glycerol-phosphate dehydrogenase: mGDP)を阻害することも報告されています(下図)。

図:メトホルミンは有機カチオン輸送体1(organic cation transporter 1 :OCT1)によって細胞内に入り、ミトコンドリアに集積する(①)。ミトコンドリアでは呼吸酵素複合体IとmGDP(ミトコンドリア・グリセロールリン酸脱水素酵素)を阻害してNADH酸化を阻害する(②)。呼吸鎖活性の低下はミトコンドリアでのATP産生を低下し(③)、AMP活性化プロテインキナーゼ(AMP)シグナル伝達系を亢進する。(参考:BMC Biol. 2014; 12: 82.)
このメトホルミンの呼吸酵素阻害作用は、がん細胞において活性酸素の産生を増やす目的でがん治療への応用が検討されています。
つまり、がん細胞の酸化ストレスを高めるジクロロ酢酸と2-デオキシグルコースとケトン食の組み合せにメトホルミンを併用すると抗腫瘍効果を高めることができますが、その機序としてミトコンドリアでの活性酸素を増やす作用が指摘されています。
メトホルミンがミトコンドリアでのグルコースとグルタミンの利用を阻害して物質合成を阻害し、がん細胞の増殖を抑制する効果が報告されています。(490話参照)
メトホルミンの抗腫瘍作用の最も重要なメカニズムはミトコンドリアの酸素呼吸を阻害してATP産生を低下させることです。しかし、ミトコンドリアでのATP産生を抑制しても、グルコースの取込みが十分にあれば、がん細胞は解糖系だけでATPを賄うことができます。がん細胞は解糖系で細胞が必要とするATPを産生できます。
つまり、がん細胞にメトホルミンを投与しても、グルコースが十分に供給されていれば、抗腫瘍効果は期待できません。メトホルミンの抗腫瘍効果はグルコースの利用を阻止すると増強することが明らかになっています。以下のような論文があります。
Mechanisms by which low glucose enhances the cytotoxicity of metformin to cancer cells both in vitro and in vivo.(培養細胞および生体内におけるがん細胞に対するメトホルミンの細胞毒性が低グルコースによって増強されるメカニズム)PLoS One. 2014 Sep 25;9(9):e108444. doi: 10.1371/journal.pone.0108444. eCollection 2014.
【要旨の抜粋】
がん細胞に対するメトホルミンの毒性は細胞の種類によって感受性が異なる。その一つの理由は、細胞を培養するときの培養液に高濃度のグルコースが添加されているためであり、グルコースの濃度が低い条件では、多くのがん細胞に対してメトホルミンの細胞毒性は増強されることが最近の研究で明らかになっている。
0から5mMの低グルコース濃度の条件では、メトホルミンは乳がん細胞株のMCF7とMDAMB231とSKBR3、卵巣がん細胞株のOVCAR3とPA-1に対して細胞毒性を示した。
高濃度のグルコースを含有する通常の培養液での検討では、MDAMB231とSKBR3細胞はメトホルミンの細胞毒性に抵抗性を示す。培養液のグルコース濃度を10mM以上にすると、全ての培養細胞株はメトホルミンの細胞毒性に対して抵抗性になった。
培養液の糖の濃度が低グルコース(2.5mM)の条件では、メトホルミンの添加によってATP産生は顕著に減少した。しかし高グルコース(25mM)の培養液ではATP産生の減少は認めなかった。
4T1乳がん細胞をマウスに移植するin vivoの動物実験系を使った研究で、低糖質のケトン食を与えて血中グルコースのレベルを低下させると、メトホルミンによる腫瘍増殖の抑制効果は増強された。
以上の結果は、グルコースの利用を抑制する条件下ではメトホルミンのATP産生抑制と生存シグナル伝達系の阻害効果画が増強することを示している。
25mMというのは450mg/dLです。正常な血糖のレベルは4~6mM(72–108 mg/dL)です。
高血糖という条件だけで、がん細胞の増殖経路は活性化されます。
メトホルミンでミトコンドリアでのATP産生を阻害すると、がん細胞の解糖系が亢進して、解糖系でのATP産生が増えて代償しようとします。したがって、グルコースの取込みや解糖系を阻害する方法を併用するとメトホルミンの抗腫瘍活性を増強できます。
がん細胞のグルコース取り込みや利用を阻止する方法として、ケトン食や2-デオキシ-D-グルコースが有効です。つまり、2-デオキシ-D-グルコースとメトホルミンとケトン食は抗がん作用において相乗効果が期待できます。
【2-デオキシ-D-グルコースとメトホルミンの相乗効果】
がん細胞のエネルギー産生経路を2-デオキシ-D-グルコースとメトホルミンで二重阻害すると抗腫瘍効果が増強することがマウスを使った移植腫瘍の実験で示されています。以下のような報告があります。
Dual inhibition of Tumor Energy Pathway by 2-deoxy glucose and metformin Is Effective Against a Broad Spectrum of Preclinical Cancer Models(2-デオキシグルコースとメトホルミンによる腫瘍細胞のエネルギー産生経路の2重の阻害は、多くの前臨床の動物実験モデルにおいて効果がある) Mol Cancer Ther. 10(12): 2350-2362, 2011年
この論文では、様々な種類のがん細胞をマウスに移植した実験モデルを用いて、2-デオキシグルコース(2-DG)とメトホルミンを同時に投与すると、抗腫瘍効果が相乗的に高まることを報告しています。
2-DGとメトホルミンはそれぞれ単独では抗腫瘍効果は強くはありませんが、併用すると強い抗腫瘍効果が得られるという結果です。
培養がん細胞を用いた実験では、2-DGで解糖系を阻害しても、がん細胞を死滅させるだけの効果はありませんが、メトホルミンを同時に投与すると、がん細胞は死滅しました。
マウスの移植腫瘍の実験系でも、2-DGとメトホルミンを同時に投与すると、がん組織が著明に縮小しました。
メトホルミンはミトコンドリアの呼吸鎖(電子伝達系)を阻害してATP産生を阻害する作用がありますが、さらにAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を阻害します。
一方、2-DGはグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。
すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。以下のような報告があります。
Co-treatment of breast cancer cells with pharmacologic doses of 2-deoxy-D-glucose and metformin: Starving tumors.(薬理学的用量の2-デオキシ-D-グルコースとメトホルミンによる乳がん細胞の併用治療:がん細胞の飢餓)Oncol Rep. 2017 Apr;37(4):2418-2424.
【要旨】
がん細胞のエネルギー産生の特徴は、好気性解糖である。従って、解糖の阻害は、がん細胞に選択的な治療法となる。
解糖系を阻害する2-デオキシ-D-グルコース(2DG)は、多くのがん細胞においてアポトーシス(細胞死)を誘導することが示されている。さらに、糖尿病治療薬のメトホルミンの抗腫瘍活性が実証されている。
本研究では、2DGとメトホルミンの薬理学的用量の組み合わせが抗腫瘍効果を高めるかどうかを確認することを目的とした。
トリプルネガティブ乳がん(TNBC)細胞のMDA-MB-231およびHCC1806細胞を用いて、2DGとメトホルミンのそれぞれ単独の投与と併用投与の場合の細胞生存率を測定した。
アポトーシスの誘導は、ミトコンドリア膜電位の低下およびPARP(ポリADPリボースポリメラーゼ)の切断の測定によって定量した。
2DGまたはメトホルミンによる乳がん細胞の治療は、細胞生存率の有意な低下およびアポトーシスの増加をもたらした。
2DGとメトホルミンを同時に投与すると、それぞれ単一で投与した場合と比較して、細胞生存率が有意に低下した。この細胞生存率の低下は、アポトーシスの誘導によるものであった。
さらに、アポトーシス誘導に関しては、単剤で投与した場合と比較して、併用投与はより強い誘導効果を示した。
ヒト乳がん細胞の解糖系亢進は、治療のターゲットになりうる。解糖系阻害剤の2DGおよび糖尿病治療薬のメトホルミンの併用投与は副作用が少なく、乳がんに対する適切な治療法になるかもしれない。
トリプルネガティブ乳がんに対してメトホルミンと2-デオキシ-D-グルコースの併用が抗腫瘍効果を高めることは他にも多数の論文があり、最近増えています。がん細胞では解糖系が亢進しているので、メトホルミンだけでは抗腫瘍効果が十分に得られないことが分ってきたからです。
メトホルミンをがん治療に使うときには、がん細胞の解糖系を阻害する方法を併用することが重要と言えます。
【ケトン食+2-デオキシグルコース+メトホルミン+ジクロロ酢酸の相乗効果】
がん細胞におけるワールブルグ効果を抑制し、エネルギー代謝を正常に是正すれば、がん細胞の増殖を抑制し、細胞死を誘導できます。絶食はがん細胞のワールブルグ効果を是正してがん細胞を死滅させる効果が期待できます。しかし、長期間の絶食は体力や栄養状態を低下させる欠点があります。体力や栄養状態を低下させないで絶食と同じような効果が期待できる方法としてケトン食があります。
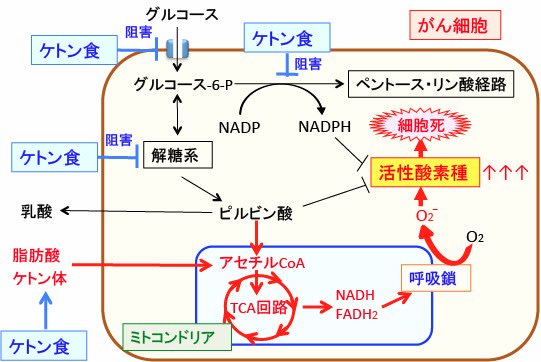
図:糖質摂取を極力減らし、脂肪の摂取を増やしてケトン体の産生を増やすケトン食は、グルコースの取込みや解糖系を抑制(=正常化)し、NADPHの産生を低下させ、がん細胞内の活性酸素消去能を低下させる。さらに、ケトン食の主要なエネルギー源となる脂肪酸とケトン体はミトコンドリアでアセチルCoAに変換されて代謝されるため、これらをエネルギー源として利用すると活性酸素の産生が亢進してダメージを受けることになる。つまり、ケトン食はがん細胞に対してエネルギー産生を抑制し、活性酸素の産生を高めて酸化ストレスを亢進する2つの機序によってがん細胞を自滅させることができる。(参考:Redox Biology 2: 963-970, 2014年)
2-デオキシ-D-グルコース(2-DG)は解糖系を阻害することによって乳酸とATPの産生を阻害します。
経口糖尿病薬のメトホルミンはミトコンドリアの呼吸酵素を阻害してATPの産生を阻害する作用があります。最近の研究では、メトホルミンが2-DGと同様に解糖系酵素のヘキソキナーゼの活性を阻害する作用も明らかになっています。
したがって、2-DGとメトホルミンを併用すると、がん細胞のエネルギー産生を阻害する効果を高めることができます。2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。
メトホルミンには乳酸アシドーシスを引き起こす副作用があります。乳酸が増えて、血液が酸性になる状態です。大きながん組織があると乳酸の産生が増えています。乳酸アシドーシスを防ぐために、肝臓では乳酸をブドウ糖に変換する糖新生が亢進します。メトホルミンは糖新生を阻害する効果があるので、乳酸産生の増加した状態でメトホルミンを服用すると乳酸アシドーシスを起こしやすくなります。
この場合、がん細胞の解糖系を抑制し、ミトコンドリアでの酸素呼吸を増やす2-デオキシグルコースやジクロロ酢酸ナトリウムやケトン食を併用するとメトホルミンによる乳酸アシドーシスの発生を防ぐことができます。特にジクロロ酢酸ナトリウムは乳酸アシドーシスの治療に古くから使用されています。

図: がん細胞は解糖系が亢進して乳酸の産生が増えている(①)。乳酸によるアシドーシス(酸性血症)を防ぐため、肝臓で乳酸をグルコースに変換する。これをコリ回路という(②)。メトホルミンは糖新生を阻害するので、乳酸アシドーシスの副作用を起こしやすい(③)。ケトン食はグルコースの利用を阻害し、脂肪酸とケトン体はミトコンドリアの酸素呼吸(酸化的リン酸化)を亢進する(④)。2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害し(⑤)、ジクロロ酢酸ナトリウム(DCA)はピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進する(⑥)。その結果、2-DGとDCAはメトホルミンによる乳酸アシドーシスを防ぎ、活性酸素の産生を高めて酸化ストレスを亢進する(⑦)。これらは相乗効果で、がん細胞の増殖を抑制できる。
ケトン食だけでは抗腫瘍効果は弱いのですが、2-デオキシグルコース(2-DG)とメトホルミンとジクロロ酢酸ナトリウムを併用すると、がん細胞の増殖を抑制できます。さらに抗酸化システムを阻害するジスルフィラムやオーラノフィンを併用すると、がん細胞を酸化ストレスで自滅できます。(510話参照)
以上、いろんな研究を総合すると、2-デオキシ-D-グルコースとメトホルミンとケトン食の併用は、がん治療において効果が期待できるエビデンスが高いと言えます。特に抗がん剤治療を行なっているときは、抗がん剤の抗腫瘍効果を高め、副作用を軽減する効果が期待できます。
追加:2-DGとジクロロ酢酸ナトリウム(+ビタミンB1+R体アルファリポ酸)とメトホルミンを併用したがん治療の有効性のメカニズム:

① グルコースが解糖系で代謝されてピルビン酸に変換された後、ピルビン酸脱水素酵素によってミトコンドリア内でアセチルCoAに変換される。
② アセチルCoAはミトコンドリア内でTCA回路と呼吸酵素複合体における酸化的リン酸化によってATPが産生される。
③ R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の活性に必要な補因子。
④ ピルビン酸脱水素酵素はピルビン酸脱水素酵素キナーゼによってリン酸化されることによって活性が阻害されている。
⑤ ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する作用があり、その結果ピルビン酸脱水素酵素を活性化する。
⑥ メトホルミンは呼吸酵素複合体Iを阻害してミトコンドリアでの活性酸素の産生を増やす。
⑦ 2-デオキシ-D-グルコース(2-DG)は解答系を阻害してATP産生と物質合成を阻害する。
⑧ 抗がん剤や放射線治療が最終的にがん細胞を死滅するときに活性酸素によって細胞死が誘導される。
したがって、抗がん剤治療や放射線治療を行うときに、2-DG(2-デオキシ-D-グルコース)、ジクロロ酢酸ナトリウム、R体αリポ酸、ビタミンB1、メトホルミンを併用すると、抗腫瘍効果を増強できる。
| « 671)断酒薬ジ... | 673)イベルメ... » |



