がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
510)代謝をターゲットにしたがん治療(その5):ケトン食はがん細胞の酸化ストレスを高める
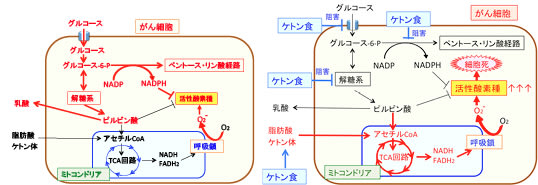
図:上図で赤の矢印と文字は活性化あるいは増えていることを示している。
(左図)がん細胞ではミトコンドリアの呼吸鎖の異常などによって酸素を使ってATPを産生すると活性酸素の産生量が増える状況にある。そこでがん細胞ではミトコンドリアでのATP産生(酸化的リン酸化)を抑制して酸化ストレスの増大を防いでいる。そのため、酸素を使わない解糖系が亢進していて乳酸の産生が増えている。また、ペントース・リン酸経路が亢進し、この経路でできるNADPHは活性酸素の消去に使われる。がん細胞ではミトコンドリアでの代謝を抑えているので、ミトコンドリアで代謝される脂肪酸やケトン体をエネルギー源として利用することができない。
(右図)糖質摂取を極力減らし、脂肪の摂取を増やしてケトン体の産生を増やすケトン食は、グルコースの取込みや解糖系を抑制(=正常化)し、NADPHの産生を低下させ、がん細胞内の活性酸素消去能を低下させる。さらに、ケトン食の主要なエネルギー源となる脂肪酸とケトン体はミトコンドリアでアセチルCoAに変換されて代謝されるため、これらをエネルギー源として利用すると活性酸素の産生が亢進してダメージを受けることになる。つまり、ケトン食はがん細胞に対してエネルギー産生を抑制し、活性酸素の産生を高めて酸化ストレスを亢進する2つの機序によってがん細胞を自滅させることができる。(参考:Redox Biology 2: 963-970, 2014年)
510)代謝をターゲットにしたがん治療(その5):ケトン食はがん細胞の酸化ストレスを高める
【カメは無酸素でも長く生きられる】
人間を含めて全ての哺乳動物は無酸素の環境では長くは生存できません。しかし、少し下等な生物では無酸素でも長く生きられるものが存在します。
淡水にすむカメ(亀)は無酸素で長く生きることができます。生物における低酸素や無酸素に対する生体応答の研究にカメがよく使われています。以下のような論文があります。
Living without oxygen: lessons from the freshwater turtle.(酸素の無い生活:淡水産カメからの知見)
Comp Biochem Physiol A Mol Integr Physiol. 2000 Mar;125(3):299-315.
【要旨】
淡水産カメ、特にニシキガメ(Chrysemys picta)は、空気を呼吸する脊椎動物の中で、最も長く無酸素に耐えることができる。このカメは3℃の無酸素状態の水中で5ヶ月間生存できることが実験で明らかになっている。
この顕著な能力の基礎には、2つの適応応答が関与している。一つはエネルギー代謝の減少で、同じ温度で通常の酸素濃度の環境に比べて、エネルギー産生を10%程度に減少させている。これは、細胞のATP産生系とATP消費系の両方を減少させて達成される。
第2の適応応答は、嫌気性解糖で産生される乳酸による顕著なアシドーシス(酸性血症)に対する防衛機序である。この防衛システムの中心をなすのが、カメの特徴的な骨格である甲羅の中で、アシドーシスを緩衝する物質を貯蔵してアシドーシスを防御するシステムを進化させている。
炭酸塩(carbonate)がカメの骨や甲羅から放出され、乳酸が増えてアシドーシスになった体液を緩衝している。乳酸は骨や甲羅の部位に移行し炭酸塩で緩衝されて貯蔵される。
このように、代謝の低下と乳酸の緩衝能の増強の2つが、カメが嫌気的な環境で長期に生存できる能力のメカニズムとなっている。
脊椎動物(Vertebrate)は脊椎を持つ動物で、魚類、鳥類、両生類、爬虫類、哺乳類の5類から構成されます。カメは爬虫類の一種です。
ニシキガメ(Chrysemys picta)は米国でよく見られる淡水産のカメで、頭頂部に鮮やかな黄色の斑紋や背甲の縁に赤い模様があります。
カメの骨格の特徴は甲羅です。甲羅の内部は脊椎骨、肩胛骨、肋骨、胸骨などが互いに密着して箱のような構造をしています。嫌気性解糖で産生された乳酸を甲羅の内部で貯蔵して、炭酸塩で緩衝させるメカニズムが進化して、乳酸蓄積の有害性を軽減できるので、カメは無酸素の状態で長く生きられるという話です。
カメの寿命が100年以上と長いのは酸素を使わないからだという意見もあります。
一般に動物は、単位体重当たりの酸素消費と寿命は反比例すると言われています。つまり、酸素消費が少ないほど長生きできます。
ミトコンドリアでグルコースや脂肪酸の分解(代謝)で産生されたアセチルCoAがTCA回路で代謝され、TCA回路で産生された電子がNADPHやFADH2の形で捕捉され、この電子が最終的に酸素に渡される過程(酸化的リン酸化)でATPが産生されます。つまり、酸素が電子の受け手(acceptor)となってATPを効率的に産生するのが酸素呼吸です。
酸素が電子を受け取るときに、正しく渡されないとそれが不対電子になって、フリーラジカル(活性酸素)になり、細胞構成成分を酸化してダメージを与えることになります。したがって、酸素を使わない代謝は酸化傷害を軽減し、寿命を延ばすことになります。
【がん細胞は嫌気的な生き物である】
細胞にとって酸素を使うことは、エネルギー産生の効率は高めることはできますが、活性酸素による酸化ストレスを高めるデメリットがあります。
がん細胞は、酸素が十分に存在しても、ミトコンドリアでの酸素を使う酸素呼吸(=酸化的リン酸化)を抑制して、酸素を使わない解糖系でエネルギーを産生する理由の一つは酸化ストレスを高めたくないからです。
最近の研究では、酸化ストレスががん細胞の増殖や転移を抑制する方向で作用することが明らかになっています。(506話参照)
がん細胞は活性酸素のダメージによってアポトーシス(細胞死)を起こさないために、ミトコンドリアの活性、すなわち酸化的リン酸化を抑制する必要があると考えられています。酸素を使わない生き方を選ぶ方が、がん細胞にとっては生存に有利になるというわけです。
ワールブルグ博士の言葉では「がんとは嫌気的な生き物」ということです。
太古の地球で嫌気的な環境で生存してきた生き物が地球上に酸素が増えて絶滅していったのと同じ理由で、がん細胞も酸素を使った代謝が増えると死滅するという弱点を持っています。
したがって、がん細胞はますます酸素を使わない代謝に頼るようになり、グルコースの取込みがさらに増え、グルコースへの依存度がどんどん高くなっていきます。がん細胞はグルコース(ブドウ糖)中毒に陥っていると言っても過言ではありません。
この考えにたつと、解糖系を阻害し、がん細胞にミトコンドリアでの酸素呼吸を亢進させ、がん細胞の酸化的ストレスを高めてがん細胞を死滅させるという治療法(酸化治療)の根拠が理解できます。酸化治療はDNAの構造解明でノーベル賞を受賞したジェームズ・ワトソンが提唱し推奨しています。(356話、357話参照)
中鎖脂肪ケトン食でがん細胞のグルコースの利用を妨げると同時に、2-デオキシグルコースで解糖系を阻害し、ジクロロ酢酸ナトリウムでミトコンドリアでの代謝を亢進し、メトホルミンで活性酸素の産生を高め、抗酸化システムを阻害するオーラノフィンやジスルフィラムの併用の根拠が理解できます。(508話)
【ジクロロ酢酸ナトリウムとメトホルミンの相乗効果】
解糖系によって生成されるピルビン酸はミトコンドリア内でピルビン酸脱水素酵素複合体によってアセチルCoAに変換されます。
ピルビン酸脱水素酵素はピルビン酸脱水素酵素キナーゼによって不活性化されますが、がん細胞ではこのピルビン酸脱水素酵素キナーゼの活性が亢進しています。それは、がん細胞で発現が亢進している低酸素誘導因子-1(HIF-1)がピルビン酸脱水素酵素キナーゼの発現を亢進するからです。(364話参照)
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから使用されています。
ジクロロ酢酸ナトリウムを使ってがん細胞におけるミトコンドリア内での酸化的リン酸化を活性化すると、がん細胞のアポトーシス(細胞死)が起こりやすくなることが報告されています。がん細胞の抗がん剤感受性を高める効果も報告されています。
その理由は、がん細胞のミトコンドリアでの代謝を亢進させると、活性酸素が多く産生されて細胞にダメージが起こるからです。
ジクロロ酢酸単独では抗腫瘍効果に限界がありますが、呼吸鎖を阻害して活性酸素の産生を高めるメトホルミンを併用すると抗腫瘍効果を高めることができます。
ミトコンドリアの呼吸酵素複合体をメトホルミンで阻害した状態で、ジクロロ酢酸でがん細胞のミトコンドリアの代謝を亢進すれば、がん細胞に比較的特異的に酸化ストレスを高めることができるからです。
ジクロロ酢酸とメトホルミンの相乗効果が報告されています。次のような論文があります。
Dichloroacetate enhances apoptotic cell death via oxidative damage and attenuates lactate production in metformin-treated breast cancer cells.(メトホルミンを投与した乳がん細胞において、ジクロロ酢酸は酸化傷害によるアポトーシスを亢進し、乳酸の産生を抑制する)Breast Cancer Res Treat. 147(3):539-50. 2014年
メトホルミンはミトコンドリアの呼吸酵素複合体Iの働きを阻害して活性酸素の産生を増やし、酸化傷害によって細胞死を誘導します。
呼吸酵素複合体Iの阻害は解糖系の亢進によって乳酸産生を増やすことになりますが、がん細胞においては解糖系の亢進によって乳酸産生がもともと亢進した状態にあり、乳酸産生が高いほど予後が悪いことが知られています。
メトホルミンはがん治療に効果が期待できますが、乳酸産生を抑制する方法を組み合わせると、メトホルミンの抗がん作用を効率的に高めることができる可能性が示唆されます。
ジクロロ酢酸は、ピルビン酸脱水素酵素キナーゼの活性を阻害することによってミトコンドリアでの代謝を促進する作用によって、乳酸アシドーシスの治療薬として使用されています。
そこで、この論文では、乳がん細胞株を用い、メトホルミンとジクロロ酢酸を投与し、細胞死の程度や代謝の変化を解析ています。
実験の結果、ジクロロ酢酸とメトホルミンを同時に添加すると、乳がん細胞のアポトーシスは相乗的に増加することが明らかになりました。
メトホルミンによって誘導される酸化傷害はジクロロ酢酸によって促進され、ジクロロ酢酸によるピルビン酸脱水素酵素キナーゼ活性の阻害はメトホルミンによって引き起こされる乳酸産生亢進を抑制しました。
つまり、ジクロロ酢酸とメトホルミンを同時投与すると、酸化傷害を介するカスパーゼ依存性のアポトーシスの誘導を相乗的に亢進し、さらにメトホルミンによる乳酸産生を抑制することが明らかになったという報告です。
この論文の結論は、「メトホルミンとジクロロ酢酸の併用は、乳がんの治療効果を高めることが期待できる革新的な治療法となる可能性がある」となっています。この論文の結果をまとめると以下の図のようになります。
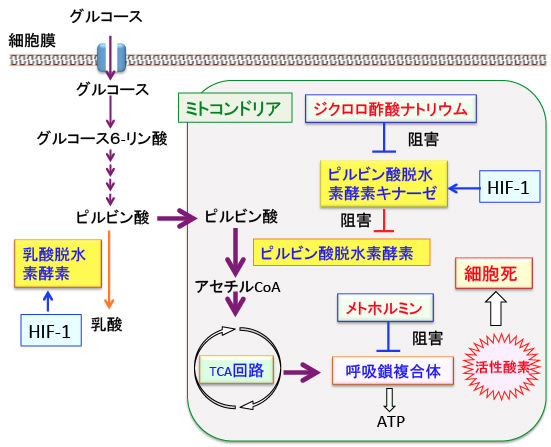
図:がん細胞では、HIF-1(低酸素誘導因子-1)の作用によって乳酸脱水素酵素やピルビン酸脱水素酵素キナーゼ(ピルビン酸脱水素酵素をリン酸化して阻害する酵素)の活性が亢進しているため、ミトコンドリアでの酸素呼吸は低下し、解糖系が亢進して乳酸の産生が増えている。 メトホルミンはミトコンドリアの呼吸酵素複合体1を阻害するため、ATP産生が阻害され、同時に活性酸素の発生が増える。活性酸素が増えるとミトコンドリアが破綻して細胞のアポトーシスが起こる。 メトホルミンでミトコンドリアでのATP産生が低下すると、それを代償するために解糖系が亢進するので乳酸の産生が増える(メトホルミンに乳酸アシドーシスの副作用があるのはこのため)。乳酸の増加はがん細胞を悪化させる。ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害する作用によってピルビン酸脱水素酵素を活性化してミトコンドリアでのTCA回路を回す。その結果、メトホルミンによって生じる乳酸の産生増加が阻止され、ミトコンドリアでの活性酸素の産生が増えて、アポトーシスが亢進される。 また、乳酸の産生が減れば、がん組織の酸性化が軽減され、がん細胞の増殖が抑制できる。つまり、この2つの薬を併用するとがん細胞のアポトーシス誘導が増強できる。
別の研究グループから同様な報告があります。
Sensitization of metformin-cytotoxicity by dichloroacetate via reprogramming glucose metabolism in cancer cells.(がん細胞におけるグルコース代謝の再プログラム化を介するジクロロ酢酸によるメトホルミンの細胞毒性の増強)Cancer Lett. 346(2): 300-308, 2014
【要旨】
がん細胞に対するメトホルミンの細胞毒性を高める目的で、ピルビン酸脱水素酵素キナーゼの阻害剤であるジクロロ酢酸の作用を検討した。
メトホルミンの細胞毒性は主にグルコース利用性と、ペントース・リン酸経路で産生される還元力(NADPH)に依存していた。
一方、ジクロロ酢酸は、ピルビン酸脱水素酵素キナーゼを阻害しミトコンドリアでの呼吸(酸化的リン酸化)を亢進してグルコース代謝を再プログラム化(=正常化)することによってメトホルミンの細胞毒性を増強した。
グルコースとグルタチオンの濃度が高い条件下でも、ジクロロ酢酸とメトホルミンの併用投与は、がん細胞を死滅させた。
ジクロロ酢酸はがん細胞のグルコース代謝を好気的解糖主体の代謝からミトコンドリアでの酸化的リン酸化主体の代謝に再プログラム化することによって、メトホルミンの細胞毒性の感受性を高めることが明らかになった。
グルコース代謝の再プログラミング(reprogramming)というのは、がん細胞の特徴であるワールブルグ効果(酸素があっても解糖系でのグルコース代謝が亢進し、ミトコンドリアでの代謝が低下している)を正常化(初期化)するということです。
ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高めることによってミトコンドリアでの呼吸(酸素を使ったATP産生)が活性化され、解糖系でのATP産生は抑制されることになります。
一方、メトホルミンはミトコンドリアの呼吸酵素複合体1の働きを阻害するので、ATP産生は阻害され、活性酸素の発生が増加します。
がん細胞ではもともとミトコンドリアでの酸素を使った代謝が低下しているので、メトホルミン単独では細胞を死滅させる作用が弱いのですが、ジクロロ酢酸でミトコンドリアにおける酸素利用を高めれば、がん細胞は酸化傷害によって死滅するというストーリーです。
つまり、メトホルミンの抗がん作用を利用するときは、解糖系の阻害とミトコンドリアの活性化(ピルビン酸脱水素酵素の活性化やミトコンドリア新生の亢進など)を併用することが重要だと言えます。ケトン食は解糖系の阻害とミトコンドリアの活性化の両方の作用があります。
ジクロロ酢酸とメトホルミンのがん細胞における作用をまとめると以下のようになります。

図:がん細胞ではミトコンドリアでの呼吸鎖での活性酸素の産生率が高いので、メトホルミンで呼吸酵素複合体Iが阻害されると、ATPの産生障害と活性酸素の産生増加が起こる。そうなると解糖系が亢進してATP産生を増やそうとするが、ジクロロ酢酸を用いてピルビン酸脱水素酵素を活性化してミトコンドリアでの代謝を活性化すると、乳酸産生は減少し、ミトコンドリアでの活性酸素の産生量はさらに増える。ミトコンドリアでの代謝が亢進するとペントース・リン酸経路での代謝が抑制されてNADPH産生による抗酸化力も低下し、酸化ストレスが亢進してがん細胞は死滅する。脂肪酸やケトン体を増やすとさらにミトコンドリアからの活性酸素の産生量は増加する。
(赤で示した矢印や文字は発現や活性を亢進していることを示す)
さらに、低酸素誘導因子-1(HIF-1)の活性を阻害する方法を併用すると、ジクロロ酢酸とメトホルミンの抗腫瘍効果を高めることができます。HIF-1の活性阻害にはシリマリンやジインドリルメタンが報告されています。(267話、270話、364話参照)
【がん細胞ではミトコンドリアでのピルビン酸取り込みに異常がある】
ジクロロ酢酸ナトリウムでがん細胞のミトコンドリアの活性が高まることは、全てのがん細胞に当てはまるわけではありません。
がん細胞ではピルビン酸のミトコンドリアへの取込みに異常があって、ピルビン酸がミトコンドリアに取り込まれにくくなっていることが報告されています。
ピルビン酸はミトコンドリアの外膜と内膜で別々のトランスポーターを使って取り込まれます。
外膜では、非選択的なチャネルであるポリン(porin)によって受動拡散で簡単に通過できます。
ポリンはVDAC(voltage-dependent anion channel)と呼ばれる膜貫通たんぱく質で大きな孔(pore)を持ち、受動的拡散(passive diffusion)によって糖やイオンやアミノ酸のような小さな物質の膜通過に関与しています。
一方、内膜では、より選択的なトランスポーターであるMitochondrial Pyruvate Carrier(MPC)を使って移動します。
がん細胞では、このMPCの発現が低下していることが報告されています。ピルビン酸はミトコンドリアに取り込まれて、アセチルCoAとオキサロ酢酸に変換されてTCA回路で代謝されます。
したがって、ジクロロ酢酸ナトリウムだけでは、がん細胞のミトコンドリアを十分に活性化できない場合も多いのです。ピルビン酸をミトコンドリアに入れるキャリアたんぱくの発現が抑制されていると、ピルビン酸はミトコンドリアに入れないのです。

図:グルコースは解糖によってピルビン酸に変換され、酸素が無い嫌気性状況やがん細胞では乳酸脱水素酵素(LDH)によってピルビン酸は乳酸に変換される。ピルビン酸と乳酸はモノカルボン酸トランスポーター(MCT)によって細胞外に移行する。酸素がある状況ではピルビン酸はミトコンドリアに入ってTCA回路で代謝される。ピルビン酸はミトコンドリア外膜ではポリンという孔たんぱく質を通って受動拡散で移行するが、内膜ではピルビン酸に選択的なミトコンドリア・ピルビン酸キャリアー(MPC)を通ってミトコンドリアマトリックスに入る。マトリックス内では、ピルビン酸はピルビン酸脱水素酵素複合体によってアセチルCoAに、ピルビン酸カルボキシラーゼでオキサロ酢酸に変換され、アセチルCoAとオキサロ酢酸からクエン酸が合成されてTCA回路で代謝され、TCAの代謝産物からアミノ酸や脂肪酸が合成される。オキサロ酢酸は糖新生にも利用される。TCAでNADHやFADH2の形で捕捉された電子は、酸素をアクセプターとする酸化的リン酸化反応でATPが生成される。がん細胞ではミトコンドリア・ピルビン酸キャリアー(MPC)の発現が低下して、ピルビン酸のミトコンドリア移行が抑制されている。
【ケトン体はがん細胞のミトコンドリアの酸化的リン酸化を活性化する】
がん細胞はケトン体や脂肪酸をエネルギー源として利用しにくい状態にあります。それは、がん細胞は酸素を使ったエネルギー産生を行いたくない理由があるからです。
したがって、酸素を使わない解糖系を亢進し、ミトコンドリアの酸素呼吸をできるだけ抑制します。
脂肪酸もケトン体もミトコンドリアでしか代謝できないので、ミトコンドリアの代謝が抑制されているがん細胞では脂肪酸もケトン体も利用できない(利用したくない)状況にあります。
しかし、がん細胞でもミトコンドリアの機能は維持されています。したがって、解糖系を阻害すると、ミトコンドリアでのエネルギー産生を高めるしかありません。実際、がん細胞もケトン体や脂肪酸を分解してエネルギー産生はできます。ただ、したくないだけです。
そこで、ケトン体や脂肪酸をエネルギー源としてがん細胞に使用させるように仕向けると、がん細胞の酸化ストレスを高めて、死滅できます。
つまり、がん細胞がエネルギー産生のためにケトン体や脂肪酸を使用させて、自滅させるように仕掛けるのです。以下のような報告があります。
Embryonic Lethality of Mitochondrial Pyruvate Carrier 1 Deficient Mouse Can Be Rescued by a Ketogenic Diet.(ミトコンドリアピルビン酸キャリア1欠損マウスの胚致死はケトン食によって救助できる)PLoS Genet. 2016 May 13;12(5):e1006056. doi: 10.1371/journal.pgen.1006056. eCollection 2016.
遺伝的にミトコンドリアのピルビン酸キャリアが欠損しているマウスでは、グルコースの解糖系でできたピルビン酸がミトコンドリアに入れないので、ミトコンドリアでの物質合成とエネルギー産生ができないので、胎生期に死亡して育ちません。
しかし、妊娠しているマウスにケトン食を与えるとは胎児が育つという結果です。
ケトン体はミトコンドリアに入ってアセチルCoAに変換されてTCA回路に入るので、ピルビン酸がミトコンドリアに入れなくても、ケトン体がミトコンドリアの物質合成とエネルギー産生に使われるからです。
ケトン体はモノカルボン酸トランスポーター(monocarboxylate transporters)の MCT1と2を使って、細胞質とミトコンドリアに入ることができます。
ケトン食はがん細胞の解糖系を阻害し、酸化的リン酸化を亢進する結果、ワールブルグ効果を是正して抗腫瘍効果を発揮します。
しかし、がん細胞はグルタミンの取込みを増やしてTCAでの物質代謝(脂肪酸合成など)を維持し、ケトン体もエネルギー源として利用しようとします。したがって、ケトン食単独では、抗腫瘍効果に限界があり、場合によってはがん細胞を助けることにもなります。
がん細胞がミトコンドリアでの酸化的リン酸化を亢進するときには、活性酸素の産生を高めるメトホルミンやレスベラトロール、抗酸化システムを阻害するジスルフィラムやオーラノフィン、解糖系を阻害する2-デオキシグルコースなどの併用が重要になります。
つまり、がん細胞の酸化ストレスを徹底的に高めることが重要です。中途半端では逆効果になる(がん細胞の増殖を促進する)ので、注意が必要です。
【ケトン食はがん性悪液質を改善する】
以下のような論文があります。
Metabolic reprogramming induced by ketone bodies diminishes pancreatic cancer cachexia. (ケトン体によって誘導される代謝の再プログラム化は膵臓がんの悪液質を軽減する)Cancer & Metabolism. 2014;2:18. doi:10.1186/2049-3002-2-18.
【要旨】
背景:エネルギー代謝の異常はがん細胞の最大の特徴である。がん細胞は増大するエネルギー要求を満たすために、サイトカインや様々な因子を分泌し、筋肉や脂肪の分解を促進し、これががん性悪液質と言われる状況である。
がん関連死の20%程度が悪液質によると考えられている。しかし、がん性悪液質のメカニズムやその治療法に関しては十分に解明されていない。
高脂肪・低糖質食のケトン食では、ケトン体(アセト酢酸、βヒドロキシ酪酸、アセトン)の血中濃度が増加し、代替エネルギー源となる。さらに、ケトン食は全身的な代謝の変化を引き起こす。
がんでは代謝の異常が重要な役割を果たしている点を踏まえ、ケトン食はがん細胞におけるグルコース取り込みを減らし、悪液質状態を軽減し、有効な治療法になる可能性がある。
結果:複数の膵臓がん細胞を用いた実験で、培養がん細胞にケトン体を投与すると、がん細胞のグルコースとグルタミンの取込みと総ATP量を減少させ、細胞死を誘導した。
代謝の制御に重要な働きをしているがん遺伝子のc-Mycの細胞内量と、解糖系酵素の遺伝子のプロモーター領域へのc-Mycの結合が減少し、これががん細胞における代謝の変化と関連していることが示唆された。
このようなケトン体によって誘導された膵臓がん細胞内の代謝の再構成は、がん細胞を用いた実験モデルでがん性悪液質を顕著に軽減することが示された。すなわち、マウスに膵臓がん細胞を移植した実験モデルにおいて、ケトン食が腫瘍の増殖と悪液質を抑制する効果があることが確認された。
結論:以上の結果から、がん性悪液質はがん細胞における特有の代謝異常によって引き起こされ、このがん細胞における代謝異常はケトン食によって是正でき、その結果、がん細胞の増殖を抑制し、筋肉と体重の減少を阻止した。
膵臓がん患者の83%ががん性悪液質の状態になり、膵臓がん関連の死亡の主要な原因となっていると報告されています。がん性悪液質では、脂肪だけでなく筋肉も減少します。膵臓がんの治療では、がん細胞の増殖と悪液質の進展を阻止する有効な治療手段が必要です。この目的にケトン食は有効だという報告です。
以下のような報告もあります。
Silibinin-mediated metabolic reprogramming attenuates pancreatic cancer-induced cachexia and tumor growth(シリビニンによる代謝の再プログラム化は膵臓がんの悪液質とがん細胞増殖を低減する)Oncotarget. 2015 Dec 1; 6(38): 41146–41161.
シリビニン(silibinin)はミルクシスル(マリアアザミ)に含まれるシリマリンの一種です。シリマリンはミルクシスルというキク科の植物の種子に含まれるフラボノリグナン(flavonolignan)の総称です。シリマリンには、シリビニン(silibinin), シリジアニン(silydianin), イソシリビン(isosilybin), シリクリスチン(silychristin)などがあります。シリビニンは最も抗腫瘍活性の高いシリマリンです。
シリマリンは低酸素誘導性因子-1(HIF-1)活性の阻害や、解糖系の阻害など複数の作用メカニズムでがん細胞のワールブルグ効果を是正(正常化)する作用があります。(267話、270話参照)
この論文では、膵臓がん細胞を使った動物実験で、シリビニンが膵臓がん細胞の解糖系を阻害し、代謝系の再プログラム化(正常化)によって、がん細胞の増殖を抑え、体重や筋肉の減少(=がん性悪液質)を阻止することを報告しています。
したがって、膵臓がんの治療にケトン食とシリマリンの併用は有効かもしれません。さらにジインドリルメタンの併用も有効です。(364話参照)
【がん細胞に酸化ストレスを高める治療とケトン食の併用効果について】
高圧酸素療法とケトン食の併用の抗がん作用については346話(後半部分)で紹介しています。また、ケトン食ががん細胞の抗酸化力を減弱する理由も説明しています。
がん細胞に酸化ストレスを与えると細胞はダメージを受けます。このとき、グルコースが十分にあれば、解糖系で産生されるエネルギーとペントース・リン酸経路で生成されるNADPHによって酸化傷害に対して抵抗性と回復力を高めることができます。
NADPH(ニコチンアミドアデニンジヌクレオチドリン酸) は、細胞内の過酸化水素や過酸化脂質の消去に必要なグルタチオンの還元に必要です。つまり、がん細胞のグルコース供給が不十分でペントース・リン酸経路でのNADPHの生成が不足すると、還元型グルタチオンの量が不足して、酸化傷害で死にやすくなります。
ケトン食はがん細胞のグルコースの利用を妨げ、エネルギー産生やNADPH生成を減らすので、高圧酸素で酸化ストレスが高くなると死滅することになります。
ケトン食の効果を高める2-デオキシ-D-グルコースの併用も有効です。2-デオキシ-D-グルコースは解糖系と同時にペントース・リン酸経路も阻害してHADPHの生成を減らします。
ペントース・リン酸経路では2カ所でNADPHが産生され、2-デオキシ-D-グルコース-6リン酸は最初のNADPH産生の代謝は受けますが2個目は反応が進まないため、NADPHの産生は半分になります。ただし、2-デオキシ-D-グルコース-6リン酸はヘキソキナーゼの活性を阻害するので、グルコース-6リン酸自体の生成を阻害するので、NADPHの産生を効率よく阻害することになります。(2-DGに関しては337話を参照)
高濃度ビタミンC投与と解糖系を阻害する治療の併用が相乗効果で、非小細胞性肺がんのアポトーシスを促進することが報告されています。この2つの治療法の組合せが、がん細胞の酸化ストレスと高めてアポトーシスを誘導するという結果を報告しています。
Ascorbic acid and a cytostatic inhibitor of glycolysis synergistically induce apoptosis in non-small cell lung cancer cells.(アスコルビン酸と増殖抑制性の解糖系阻害剤は相乗的に作用して非小細胞性肺がんのアポトーシスを誘導する)PLoS One. 2013 Jun 11;8(6):e67081. doi: 10.1371/journal.pone.0067081. Print 2013.
ケトン食は酸化ストレスを高めて肺がんの放射線化学療法の効果を高めるという論文が報告されています。以下のような報告があります。
Ketogenic diets enhance oxidative stress and radio-chemo-therapy responses in lung cancer xenografts.(ケトン食は移植肺がんの実験モデルにおいて、酸化ストレスと放射線化学療法の奏功率を高める)Clin Cancer Res. 2013 Jul 15;19(14):3905-13.
【要旨】
目的:ケトン食は脂肪が多く、糖質とタンパク質が少ない食事で、細胞のエネルギー(ATP)供給源を解糖系からではなく、脂肪酸の酸化とミトコンドリアでの呼吸によるATP産生を強制する食事である。
正常細胞に比べてがん細胞は、ミトコンドリアでの代謝によって慢性的な酸化ストレスの状態にあると考えられている。本研究では、移植肺がんの動物実験モデルを用いて、「ケトン食が酸化ストレスを高めることによって放射線化学療法(radio-chemo-therapy)の奏功率を高める」という仮説を検証した。
実験方法: NCI-H292とA549の2種類の肺がん細胞株を移植したマウスを通常食かケトン食(脂肪:タンパク質+糖質のカロリー比が4:1)で飼育し、通常の分割照射(1回1.8~2グレイ)か少分割照射(1回6グレイ)か通常の分割照射にカルボプラチンを併用した治療を行った。
マウスの体重と腫瘍のサイズを測定した。腫瘍組織の酸化ストレスのレベルは過酸化脂質生成物のヒドロキシノネナールで修飾されたタンパク質の量で、細胞増殖の程度はPCNA(proliferating cell nuclear antigen:増殖性細胞核抗原)の量で、DNAダメージの程度はリン酸化ヒストンH2AX(γH2AX)の量で、それぞれ評価した。
結果:NCI-H292細胞とA549細胞を移植したマウスの両方において、放射線治療単独群に比べて、放射線治療とケトン食を併用した群の方が、腫瘍の増殖速度はより低下した(P < 0.05)。
放射線治療とカルボプラチンの化学療法を併用した場合も、ケトン食を与えた群の方が通常食(コントロール)群より腫瘍の増殖速度が低下した。放射線治療とケトン食を併用したマウスの腫瘍組織では、ヒドロキシノネナールで修飾されたタンパク質の量で測定される脂質酸化による酸化障害の程度が高く、PCNAの免疫染色で評価される細胞増殖のレベルは低下した。
結論:これらの実験結果は、肺がんを移植したマウスの実験系において、ケトン食は酸化ストレスを高めることによって、放射線化学療法の効果を高めることを示している。
この結果は、放射線治療や抗がん剤治療を受けているときのケトン食の有効性を示唆しており、さらに抗酸化力を低下させるために2-デオキシグルコースやオーラノフィンやジスルフィラムを併用するとさらに効果が高まる可能性を示唆しています。(オーラノフィンとジスルフィラムについては509話参照)
がん細胞のグルタチオンを枯渇できれば、がん細胞は死滅します。グルタチオン合成を阻害する薬の臨床試験が行われていますが、有効性が認められているようです。
がん細胞により選択的に酸化ストレスを高める方法と、がん細胞の還元型グルタチオンの量を減らす方法を組み合わせれば、がん細胞の増殖抑制やがんの縮小効果が期待できます。そのような方法として、中鎖脂肪ケトン食、2-デオキシ-D-グルコース、ジクロロ酢酸ナトリウム、メトホルミン、オーラノフィン、ジスルフィラム、アルテスネイト、高濃度ビタミンC点滴、半枝蓮などの組合せが想定されます。
実際にこのような組合せで多くのがん患者さんを治療していますが、副作用はあまり経験しません。抗腫瘍効果も確認しています。
がん細胞は酸化ストレスを避けるためにいろんな手段を使っているようです。ミトコンドリアの活性を抑えたり、グルタチオンの産生を増やしたりしています。グルコースの取込みを亢進して解糖系とペントースリン酸回路を亢進しているのも酸化ストレスの軽減に役立っています。
このようながん細胞の代謝の特徴をターゲットにすれば、がん細胞を自滅に追いやることができます。

図:がん細胞の代謝の特徴であるワールブルグ効果(解糖系の亢進と酸化的リン酸化の抑制)を正常化し、がん細胞の酸化ストレスを高める方法として、がん細胞の解糖系やペントース・リン酸回路を阻害するケトン食と2-デオキシグルコース(2-DG)、ワールブルグ効果を引き起こしてる低酸素誘導因子-1(HIF-1)を阻害するシリマリンとジインドリルメタン、ミトコンドリアでの代謝を促進するジクロロ酢酸、呼吸鎖を阻害して活性酸素の産生を高めるメトホルミンやレスベラトロール、細胞質でフリーラジカルを産生するアルテスネイトや半枝蓮や高濃度ビタミンC点滴、グルタチオンやチオレドキシンによる抗酸化システムを阻害するオーラノフィンやジスルフィラムがある。さらに、メトホルミンはグルタミンの利用を阻害し、PPARリガンドのベザフィブラートとケトン食とメトホルミンとレスベラトロールはミトコンドリア新生を促進して活性酸素の産生を増やす。これらを組み合わせると、がん細胞のエネルギー産生と物質合成を阻害し、さらに酸化ストレスを高めてがん細胞を死滅させることができる。
ケトン食は、正常細胞や変性疾患の治療においては、抗炎症作用や抗酸化システムの活性化やミトコンドリアの活性化などの作用によって有益な作用を発揮します。(385話、491話参照)
しかし、解糖系が亢進し、ミトコンドリアの活性を抑制しているがん細胞においては、自滅する方向で作用します。
ミトコンドリアを活性化する方法は、正常細胞の若返りや抗老化、変性疾患の改善に有効ですが、がん細胞に対しては「ミトコンドリアを活性化するとがん細胞は自滅する」ということになります。
当クリニックで実践している「ケトン食とがんの酸化治療」は、理解するのが困難ですが、試してみる価値はあります。
| « 509) 代謝をタ... | 511)代謝をタ... » |



