がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
917)がん幹細胞はNrf2を活性化して治療抵抗性になる
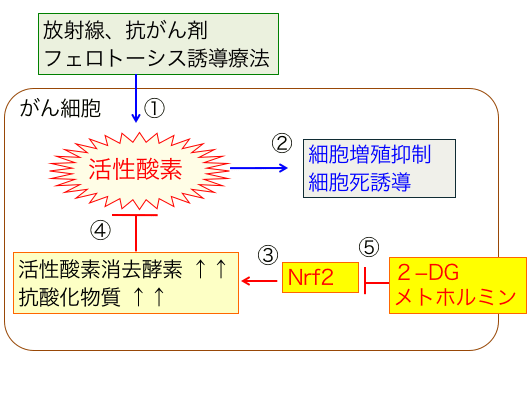
図:放射線照射や抗がん剤やフェロトーシス誘導療法はがん細胞の活性酸素の産生を高め(①)、細胞増殖抑制や細胞死誘導を引き起こす(②)。がん細胞はNrf2の活性を亢進し(③)、活性酸素消去酵素や抗酸化物質の産生を増やすことによって活性酸素種を消去し、酸化ストレスを軽減している(④)。2-デオキシ-D-グルコース(2-DG)とメトホルミンはNrf2の活性を阻害する作用が報告されている(⑤)。
917)がん幹細胞はNrf2を活性化して治療抵抗性になる
【がん幹細胞が増殖してがん組織を作る】
組織の細胞には幹細胞(stem cell)と成熟した体細胞が存在します。組織の幹細胞とは、組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる細胞です。
組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出しています。
組織幹細胞は、分裂して自分と同じ細胞を作り出すことができる自己複製能と、またいろいろな細胞に分化できる多分化能という二つの重要な性質を持ち、この性質により、限られた寿命のある体細胞を絶えず供給し、傷ついた組織を修復することができるのです。
がん組織においても同様の細胞の階層性が存在します。がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。がん幹細胞は正常な組織幹細胞と同様に自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化し成熟したがん細胞となります。(図)

図:(A)正常組織の細胞には幹細胞と成熟した体細胞が存在する。幹細胞は組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる。組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出している。
(B)がん組織にはがん幹細胞と呼ばれる細胞が存在して、通常のがん細胞(成熟がん細胞)を供給しながらがん組織を構成している。がん幹細胞は自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化した成熟がん細胞となっている。
【がん幹細胞は治療に抵抗して再発を引き起こす】
がん幹細胞は、通常のがん細胞に比べて抗がん剤や放射線に対する耐性を持っていることが多く、この細胞集団を完全に除去することは困難です。そのため、抗がん剤や放射線による治療が一時的に効果を示しても、生き残ったがん幹細胞が増殖して再発を引き起こす原因となります。
従来は、がん組織に存在する全てのがん細胞が無限の自己複製能(分裂能)を有し、がん組織を形成する能力を獲得していると考えられてきました。しかし最近の考え方は、無限の分裂能を有しがん組織を形成できるのはがん幹細胞だけであり、大部分のがん細胞は限定された分裂能を有するか、あるいはすでに分裂能を失っていると考えられています。
がん組織からがん細胞を取り出して培養液の中で培養すると、がん組織の中のがん幹細胞が分裂してがん細胞を増やします。マウスなどの動物にがん細胞を移植すると、成熟したがん細胞は腫瘍を作りませんが、がん幹細胞は腫瘍を作ることができます。がん幹細胞は自己複製できるからです。
また、がん幹細胞は抗がん剤や放射線治療に抵抗性であり、抗がん剤や放射線治療によって腫瘍が縮小しても、がん幹細胞は生き残ることが多いことが指摘されています。
治療によって大部分のがん細胞を除いても、ごく少数のがん幹細胞が生き残っていれば再発が起こりうることになります。現行の抗がん剤治療のほとんどは、成熟したがん細胞を標的として開発されており、がん幹細胞に対してはあまり効果が無い可能性が指摘されています。
抗がん剤治療によって腫瘍が縮小しても、多くは一時的な縮小であって、がん幹細胞が生き残っているかぎり、いずれ再増殖してきます。臨床的な奏功率(腫瘍の縮小率)が延命(生存期間の延長)に必ずしも結びつかないのは、通常の抗がん剤治療ではがん幹細胞が治療に抵抗して生き残るからだと言えます。
成熟したがん細胞が限定した分裂能しか有しないのであれば、これらは放置しておいても自然に死滅することになります。しかし、がん幹細胞が生き残っていれば、がん組織は増大し、転移も広がることになります。つまり、がん幹細胞が治療抵抗性になっているメカニズムを阻害すれば抗がん剤や放射線治療の効果を高めることができることになります。(図)

図: 抗がん剤や放射線治療(①)に対して、成熟がん細胞(②)は死滅しやすいが、がん幹細胞は様々な機序で抵抗性を示し生き残る(③)。がん幹細胞が生き残れば、腫瘍は増大し再発する 。
【細胞はNrf2を活性化して抗酸化力を増強する】
細胞には、抗酸化酵素や解毒酵素の発現を誘導することによって、活性酸素や有毒物質による害から細胞自身を守る手段や仕組みが備わっています。
細胞内で活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素の発現や活性を高めたり、フリーラジカルを消去する抗酸化物質の合成を高めたりして、活性酸素の害を軽減しようとします。
グルタチオンSトランスフェラーゼ(GST)などのフェーズ2(第2相) 解毒酵素と言われる代謝酵素は、様々な発がん物質や有害物質を無毒化する作用があります。
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、これらの活性酸素消去酵素や抗酸化物質やフェーズ2解毒酵素が細胞内に誘導され(遺伝子の発現が増えたりタンパク質の産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2(Nuclear factor erythroid 2-related factor 2)という転写因子です。
抗酸化酵素やグルタチオンの産生に関する酵素やフェーズ2解毒酵素の遺伝子の発現調節領域には、抗酸化剤応答配列(antioxidant response element:ARE)という領域があって、この部分にNrf2が結合するとこれらの遺伝子の転写が促進されるのです。
Nrf2 は非常に不安定なタンパク質であり、半減期が約20分と極めて短いのが特徴です。その活性化は主にタンパク質の安定性のレベルで制御され、これは最終的にユビキチン-プロテアソーム・システムによるNrf2 分解によって制御されます。
すなわち、正常細胞において酸化ストレスの無い状況では、Nrf2はKeap1(Kelch-like ECH-associated protein 1)というタンパク質に結合することによりユビキチン化を受けて分解しています。
しかし、酸化ストレスにさらされるとKeap1のシステイン残基が修飾を受けて構造が変化し、Keap1からNrf2が離れてNrf2は核へ移行します。
核内でNrf2は遺伝子上流に存在する抗酸化剤応答配列(ARE)に結合することによって、ARE配列をもつ様々な遺伝子(抗酸化酵素やグルタチオン合成に関与する酵素やフェーズ2解毒酵素など)の発現を誘導し、抗酸化や解毒に関するタンパク質や因子の合成を高めます。
このような作用によって、正常細胞においては、Nrf2の活性を亢進するNrf2活性剤は発がん過程を抑制するので、がん予防物質として認識されています。
しかし、がん細胞においては、Nrf2活性は抗がん剤や放射線治療に対する抵抗性の原因になっています。(図)

図: 転写因子のNrf2は細胞質でKeap1によって分解が促進されることによって活性が抑制されている(①)。酸化ストレス(②)が加わるとKeap1の構造が変化してNrf2から離れ(③)、フリーになったNrf2が核内に移行して(④)、抗酸化酵素や解毒酵素の遺伝子の上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合し(⑤)、これらの遺伝子の発現を亢進する(⑥)。その結果、細胞内の防御機構が増強される(⑦)。細胞内防御機構の増強は、正常細胞の発がんを予防する効果があるが(⑧)、がん細胞の放射線や抗がん剤に対する抵抗性の亢進の原因となる(⑨)。
【がん幹細胞は抗酸化力を高めて治療抵抗性になっている】
がん幹細胞が分化した成熟がん細胞よりも抗がん剤や放射線治療に対する感受性が低い理由は数多くあります。
例えば、がん幹細胞は抗がん剤の排出能力や解毒能力が高いことが指摘されています。つまり、細胞内の薬剤を排出するABC(ATP-binding cassette) トランスポーターが高発現しているために抗がん剤が効きにくいことや、活性酸素などのフリーラジカルを消去する活性(グルタチオンやNrf2活性など)が高いために抗がん剤や放射線治療が効きにくいことが報告されています。
さらに、がん幹細胞はダメージを受けたDNAを修復する能力が高くなっているので、抗がん剤や放射線で遺伝子がダメージを受けても簡単には死ににくい性質を持っています。
がん幹細胞では、成熟したがん細胞よりも細胞内の活性酸素種の量が少ないことが示されています。これは正常組織の幹細胞と非幹細胞(体細胞)で観察される結果と一致します。つまり、正常細胞もがん細胞も、幹細胞は複数の抗酸化システムの活性を高めて細胞内の活性酸素のレベルを低く保つことで幹細胞性特性を維持しています。
つまり、がん幹細胞は細胞内の抗酸化物質の量が多く、そのため活性酸素種によって誘導される細胞傷害や細胞死に抵抗性を持つことになると考えられています。がん幹細胞は抗酸化力を高めることによって抗がん剤や放射線治療に抵抗性になっているのです。
がん細胞は、細胞増殖を促進するために物質合成やエネルギー産生を高める結果、さらにミトコンドリアにおける機能異常の結果として、正常細胞と比較して大量の細胞内活性酸素種を生成することが示唆されています。
この増加した活性酸素種の産生に抵抗し、細胞毒性を防ぐために、がん細胞は酸化ストレスを軽減するために様々な適応メカニズムを進化させてきました。総合すると、これらのシステムは最終的にがん細胞の抗酸化能の増強につながります。
抗酸化力の増強という細胞特性は、多種多様な固形腫瘍や血液腫瘍で広く観察されており、現在ではがん細胞の重要な特徴として認識されています。
Nrf2シグナル伝達の活性化は、がん幹細胞の活性酸素量を減らし、腫瘍形成能や幹細胞特性や抗がん剤耐性を亢進します。
すなわち、転写因子のNrf2はがん幹細胞の酸化還元恒常性を制御することにより、細胞内の活性酸素量、造腫瘍性、抗がん剤感受性、幹細胞特性などを調節しているのです。(図)

図:がん組織内には成熟したがん細胞とがん幹細胞が共存している。それらの細胞の特性はNrf2 活性化の程度と密接に関連している。がん幹細胞はNRF2 含有量が高く、活性酸素を消去する活性が高いので細胞内の活性酸素のレベルが低く、腫瘍形成性が高く、抗がん剤感受性が低い(抗がん剤に耐性)という幹細胞特性を強く有している。逆に、Nrf2含有量が低いがん細胞は、細胞内活性酸素含有量が高く、分化度が高く腫瘍形成性が低く、抗がん剤感受性が高く、幹細胞特性は乏しい。抗がん剤治療では、Nrf2の活性が高いがん幹細胞特性を強く有するがん細胞が生き残り、再発の原因となる。
放射線治療も抗がん剤治療もフェロトーシス誘導療法も活性酸素の産生を高めて細胞を死滅します。しかし、がん細胞は細胞に備わった抗酸化システムを利用して酸化ストレスを軽減し、細胞死から免れようとします。
したがって、がん幹細胞における抗がん剤や放射線治療に対する感受性を低下させているメカニズムを阻止すると、がん幹細胞が死滅し、がん組織を消滅できます。その重要なターゲットの一つがNrf2と言えます。(図)

図:がん組織は成熟がん細胞(①)と少数のがん幹細胞(②)から構成される。抗がん剤や放射線治療で成熟がん細胞は死にやすいが、がん幹細胞は死ににくい性質を持つので生き残る。生き残ったがん幹細胞から成熟がん細胞が産生されるので、治療後に再燃や再発が起こる(③)。Nrf2活性の抑制は抗酸化力やDNA修復力の抑制などによってがん幹細胞の抗がん剤や放射線に対する抵抗性を阻止して(④)、がん幹細胞を死滅してがん組織を消滅できる(⑤)。
【K-Ras変異はNrf2活性化を亢進する】
GTP結合タンパク質(Gタンパク質)は内在性のGTP加水分解(GTPase)活性をもつタンパク質の総称で、この内、低分子量Gタンパク質群(Ras, Rho,など)は分子量が2万~3万のタンパク質で、これまで100種類以上報告されています。RasやRhoはがん遺伝子として知られています。
Gタンパク質はGTP結合型(on)/GDP結合型(off)として細胞内シグナル伝達に関与しています。
すなわち、Gタンパク質はGDPが結合した不活性型とGTPが結合した活性型の間をサイクル(GTPaseサイクル)することにより、細胞外からの情報を細胞内に伝達します。
Rasは21kDaの分子量の単量体GTPaseです。Rasサブファミリーの代表はH-Ras、K-Ras、N-Rasの3つです。H-RasとK-Rasはラット肉腫ウイルスから分離され、N-Rasはヒト神経芽細胞腫から分離されました。
Rasは細胞外のさまざまな刺激、例えばチロシンキナーゼ受容体やサイトカイン受容体やカルシウムチャネルなどの刺激を受けてGDPが結合した不活性の状態からGTPに結合した活性化の状態に移行します。GTPに結合したRASは内在性のGTPaseによりGDP結合型(不活性型)に戻ります。
活性化したGTP結合型のRasは幅広い下流のターゲット(エフェクター)と相互作用をし、下流のシグナルを活性化します。
そのエフェクターとして細胞増殖や生存を促進するRAFキナーゼやPI-3 キナーゼなど多数のシグナル伝達系が知られています。
がん細胞ではRasタンパク質の変異によって、GTPが結合した状態の活性型が持続して、細胞の増殖や運動や生存が促進されています。

図:低分子量Gタンパク質のRasは、GDP結合型が不活性型で(①)、上皮成長因子受容体などからの増殖刺激を受けてGTP結合型となって活性化され(②)、エフェクタータンパク質(RAFキナーゼ、PI-3キナーゼなど)に作用して情報を伝達し(③)、MAPK/ERK経路やPI3K/Akt経路などのシグナル伝達系を活性化し(④)、細胞の増殖や転移を亢進し、アポトーシス(細胞死)に抵抗性になる(⑤)。多くのがん細胞ではRas変異によるRasの恒常的活性化が起こっている。正常ではGTPに結合したRASは内在性のGTPaseによりGDP結合型(不活性型)に戻るが、がん細胞ではRasの変異によって不活性型に戻ることができず、活性化された状態が持続する(⑥)。
膵臓がんや大腸がんや肺がんなど多くのがん細胞ではがん遺伝子のK-Rasの変異が起こっており、これは細胞のがん化を引き起こす重要な要因の一つとなっています。
K-Ras(Kirsten rat sarcoma viral oncogene homolog)は、細胞増殖シグナルを制御するGTP結合タンパク質です。K-Rasは通常、GTPとGDPの結合の切り替えによって活性と不活性を制御されます。変異型K-RasではGTP加水分解活性が低下し、常に活性化状態になり、細胞増殖シグナルが止まらなくなります。
K-Rasは、細胞増殖や分化、アポトーシスなどの制御に関与するMAPK/ERK経路やPI3K/Akt経路などの上流で働きます。すなわち、成長因子が細胞表面の受容体に結合するとRasが活性化(GTPを結合)し、下流のシグナル(Raf → MEK → ERKなど)を伝達し、細胞の増殖や生存を促進します。したがって、変異によってK-Rasが恒常的に活性化されると、制御不能な細胞増殖やがんの発生を引き起こします。

図:抗がん剤や放射線は活性酸素の発生を増やし(①)、細胞の酸化傷害を引き起こして、細胞増殖を抑制し、細胞死を誘導する(②)。膵臓がん細胞はがん遺伝子のK-Rasが変異して活性化しており(③)、転写因子のNrf2の活性を亢進している(④)。Nrf2の活性化は活性酸素消去酵素や抗酸化物質の産生を高めて活性酸素による傷害を軽減する(⑤)。
【転写因子Nrf2はペントースリン酸経路を亢進する】
ペントースリン酸経路を阻害すると物質合成と抗酸化力が低下します。Nrf2はペントース・リン酸経路を亢進して、物質合成と抗酸化力を高めます。
ペントースリン酸経路とは、解糖系の中間体のグルコース6リン酸から分岐し、同じく解糖系の中間体グリセルアルデヒド3リン酸に戻る経路(回路)です。解糖系と同様に細胞質に存在する経路で、補酵素の一つであるNADPHを産生し、核酸の原料となるリボース5リン酸などの5単糖 (ペントース) を産生します(図)。

図:グルコース6リン酸から派生するペントースリン酸経路では、還元剤のNADPHが産生され、グルタチオン還元や脂肪酸合成など還元力を必要とする生合成反応に使われる。さらに、核酸合成の材料になるリボース5リン酸が産生される。がん細胞ではグルコースの取込みが増え、解糖系とペントースリン酸経路が亢進して、細胞分裂のためのエネルギー(ATP)と物質合成(核酸、脂肪酸、NADPHなど)が亢進している。
NADPHは還元剤です。脂肪酸やステロイドの合成、抗酸化物質のグルタチオンやチオレドキシンの還元剤として使用されます。
解糖系はATPを産生します。ペントースリン酸経路はATP産生には関与せず、核酸の原料や還元剤(NADPH)の産生を行っています。
細胞が増殖するにはエネルギー(ATP)だけでなく、核酸や脂肪酸などの物質合成や、酸化ストレスを軽減する還元剤の需要も増えます。したがって、がん細胞では解糖系とペントースリン酸経路の両方が亢進しています。
活発に増殖するがん細胞では同化反応が活性化されています。同化とは高分子の物質を合成することです。細胞が分裂して数を増やすには、新たな細胞成分を合成して増やす必要があります。細胞を構成するさまざまな物質の生合成が亢進しており、グルコースやグルタミンなどの栄養分が大量に消費されています。
転写因子Nrf2は生体における酸化ストレス応答において重要な役割をはたしていますが、さらにNrf2はペントースリン酸経路の酵素の遺伝子や、NADPHの産生に関与する酵素の遺伝子を直接的に活性化することが明らかになっています。また、核酸の新規合成に関与する酵素の遺伝子の発現にも関与してます。つまり、Nrf2は同化反応を促進します。
増殖シグナル伝達系のPI3K-Aktシグナル伝達経路の活性化状態がNrf2の核への蓄積を促進し、さらに、Nrf2とPI3K-Aktシグナル伝達経路とが相互の活性を増強しあうという正のフィードバックの関係があることも示されています。
がん細胞においてNrf2はストレス応答能の増強にくわえ同化反応を促進し、さらに増殖シグナル自体の増強をもたらすことでがんの悪性化の駆動力となっているものと考えられています。
したがって、Nrf2活性の阻害はがん細胞の増殖を抑制します。これは、酸化ストレスががん細胞の増殖を抑制するメカニズムの一つになっています。
【2-デオキシ-D-グルコースとメトホルミンはがん細胞特異的にNrf2活性を阻害する】
Nrf2の転写活性を介した抗酸化酵素や解毒酵素の発現にはグルコースの供給が必要であるという報告があります。
Glucose availability is a decisive factor for Nrf2-mediated gene expression.(グルコースの供給がNrf2を介した遺伝子発現のための決定的な要因である)Redox Biol. 2013 Jun 21;1(1):359-65.
この論文では、スルフォラファンでNrf2を活性化する方法や、Nrf2を阻害するKeap1遺伝子を機能欠損させる方法(遺伝子ノックアウト)でNrf2の活性を亢進する方法で実験しています。
Nrf2を活性化するとグルコースの取込みが増え、ペントースリン酸経路でのNADPHの産生が増えることが示されています。
そして、グルコースの供給や取込みを阻害するか、あるいはペントースリン酸経路を阻害してNADPHの産生を阻害すると、Nrf2を介した遺伝子発現が抑制され、抗酸化酵素や解毒酵素の発現が抑制されることが示されています。
つまり、糖質制限やケトン食や2−デオキシグルコースなどで、がん細胞におけるグルコースの取込みやペントースリン酸経路を抑制する方法は、グルコースの取込みが亢進しているがん細胞に選択的にNrf2の活性を阻害できる可能性があります。
メトホルミンががん細胞のNrf2活性を抑制して抗腫瘍作用を示すことが明らかになっています。
つまり、2-デオキシ-D-グルコースとメトホルミンの併用は、がん細胞のNrf2活性を低下して、がん細胞の治療抵抗性を軽減します。
| « 916)メラトニ... | 918)タンパク... » |



