がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
490)メトホルミンとβヒドロキシ酪酸はミトコンドリアでのグルコースとグルタミンの利用を抑制する
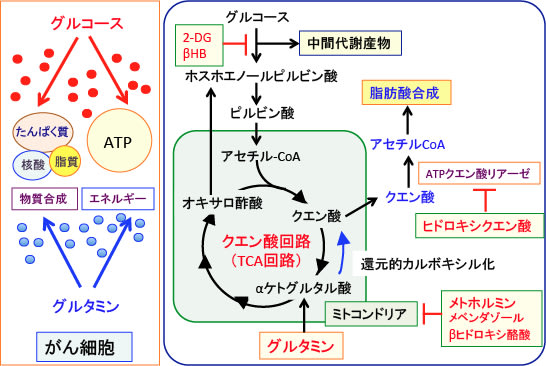
図:(左図)がん細胞にとってグルコースとグルタミンは二大栄養素である。細胞分裂して数を増やすために、たんぱく質、核酸、脂質などの生体内マクロ分子の合成とエネルギー(ATP)産生のために、グルコースとグルタミンの取込みと利用が亢進している。
(右図)グルコースとグルタミンの両方の利用を阻止できれば、がん細胞の増殖を抑え、細胞死を誘導できる。グルコースとグルタミンの利用と阻害する方法として、メトホルミン、2-デオキシ-D-グルコース(2-DG)、βヒドロキシ酪酸(βHB)、ヒドロキシクエン酸、メベンダゾールなどがある。(詳細は本文)
490)メトホルミンとβヒドロキシ酪酸はミトコンドリアでのグルコースとグルタミンの利用を抑制する
【メトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害する】
糖尿病治療薬のメトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。
その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。
この作用は、基本的には運動と同じことです。運動も体内のATP量が減るので、グルコースの分解が促進されるように代謝が変わります。代謝に関しては、メトホルミンは運動しないで運動と同じ効果を発揮します。(運動は筋肉を鍛えるので、健康作用は運動の方が勝っています)
メトホルミンは寿命を延ばす効果が知られています。この寿命延長効果は主にAMP活性化プロテインキナーゼ(AMPK)の活性化が関与しています。(384話参照)
AMPKはインスリンやインスリン様成長因子-1(IGF-1)によって活性が亢進するmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制します。
インスリン/IGF-1/TORC1シグナル伝達系は寿命を短くします。(362話参照)
寿命延長とがん予防の目的で低用量(1日250から500mg)のメトホルミンを服用している人が増えています。
最近の研究では、メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素(mitochondrial glycerol-phosphate dehydrogenase: mGDP)を阻害することも報告されています。(下図)

図:メトホルミンは有機カチオン輸送体1(organic cation transporter 1 :OCT1)によって細胞内に入り、ミトコンドリアに集積する。ミトコンドリアでは呼吸酵素複合体IとmGDP(ミトコンドリア・グリセロールリン酸脱水素酵素)を阻害してNADH酸化を阻害する。その結果、呼吸鎖活性の低下はミトコンドリアでのTCA回路の活性を低下させ、ミトコンドリアでのATP産生は低下する。これらの作用はAMP活性化プロテインキナーゼ(AMP)シグナル伝達系を亢進し、cAMP/PKAシグナル伝達系を抑制し、糖新生を抑制し、解糖を亢進する。(参考:BMC Biol. 2014; 12: 82.)
【メトホルミンはAMPKを活性化する】
前述のように、メトホルミンも運動も体内のATP量を減らすので、AMP活性化プロテイン・キナーゼ(AMPK)が活性化されて、グルコース代謝が亢進して血糖降下作用を発揮します。
AMPKは細胞のエネルギー代謝を調節する因子として重要な役割を担っています。
AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化されます。メトホルミンはミトコンドリアでのATP産生を阻害してAMP:ATP比を上昇させてAMPKを活性化します。
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。
γサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。
その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます。LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化します。
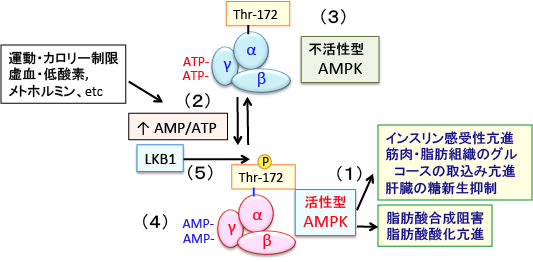
図:AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する(1)。AMPKは運動や低グルコースや低酸素や虚血やメトホルミン摂取など細胞のATP産生が減少しAMP/ATP比が上昇するようなストレスに応答して活性化される(2)。AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する(3)。γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる(4)。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される(5)。 LKB1はセリン・スレオニンキナーゼで、AMPKをリン酸化して活性化する。
【メトホルミンは多彩に機序で抗腫瘍効果を示す】
メトホルミン(Metformin)は2型糖尿病の治療に最も多く処方されているビグアナイド系の薬剤ですが、近年、メトホルミンの抗腫瘍効果が注目されています。その抗腫瘍効果についてはこのブログでも何回も解説しています。(308話、384話参照)
メトホルミンは一般名で、メトグルコ、グリコラン、メデット、ネルビスなどの製品名で糖尿病治療に使われています。
例えば、PubMedを「Metformin and Cancer」で検索すると2015年までに約2700の論文がヒットします。「Metformin and Cancer」でヒットする論文数は1990年代までは年間に0から10以下でしたが、2000年代には論文数が増加し、最近では1年間に500近くの論文が報告されています。(下図)
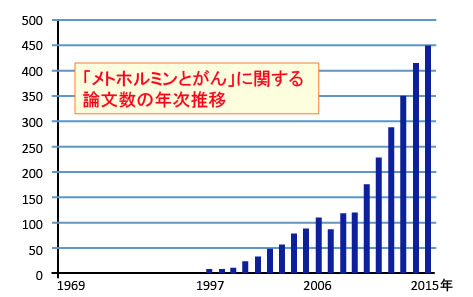
メトホルミンの血糖降下作用は1960年代から知られていますが、臨床レベルでメトホルミンのがん予防効果や抗がん作用が注目されてきたのは2009年以降です。
2009年に、メトホルミンが、糖尿病患者の膵がんリスクを低下させることを示す結果が、米テキサス大学M. D.アンダーソンがんセンターの研究グループから報告されています.(Gastroenterology 137:482-488, 2009)
この研究では、糖尿病の患者でメトホルミンを服用していた場合、メトホルミンを服用しなかった人々と比べて、膵がんのリスクが 62 %低減することが示されています。一方、インスリンまたはインスリン分泌促進薬を使用した糖尿病患者では、それらを使用しなかった患者と比較して、それぞれ、膵がんのリスクが 4.99 倍と 2.52 倍に増加しました。
その後、膵臓がん以外にも、肺がんや大腸がんや乳がんなど多くのがんの予防や治療にメトホルミンが有効であることが多くの研究で明らかになっています。(216話、217話参照)
前述のように、メトホルミンは肝臓での糖新生を抑制し、骨格筋でのグルコースの取込みを促進することによって血糖を低下させます。
世界中で1億2千万人が処方されているといわれており、膨大な疫学研究から、メトホルミンのがん予防効果が報告されています。
最近のメタ解析の研究では、全ての種類のがんを対象にして、メトホルミンの使用はがんの発生率を31%減少させ、がんによる死亡を34%減少させるという結果が報告されています。(Metformin and cancer risk and mortality: a systemic review and meta-analysis taking into account biases and confounders. Cancer Prev Res. 7: 867-885, 2014)
日本でも、低用量メトホルミンが安全に非糖尿病患者において,ポリペクトミー後のポリープ・腺腫の新規発生を抑制することを,多施設第Ⅲ相ランダム化比較試験(RCT)で確認したと本年4月の日本消化器病学会総会で報告がありました。
メトホルミンの抗腫瘍効果のメカニズムは間接作用と直接作用に分けられます。
1)メトホルミンは肝臓での糖新生を阻害することによってインスリンとインスリン様成長因子-1(IGF-1)の分泌を低下させ、インスリン/IGF-1依存性のがん細胞増殖促進作用を抑制することによって間接的にがん細胞の増殖を抑制します。
2)ミトコンドリアの呼吸酵素複合体Iの活性を直接的に阻害することによって酸化的リン酸化と物質合成を抑制することによってがん細胞の増殖を抑制します。ATP産生減少によってAMP活性化プロテインキナーゼ(AMPK)が活性化するとmTORC1シグナル伝達系が抑制されます。mTORC1の抑制は低酸素誘導因子-1(HIF-1)活性を抑制します。このような多彩なメカニズムで直接的な抗腫瘍効果を示します。さらに、がん細胞のミトコンドリアでのグルコースとグルタミンの利用を阻害し、物質合成を阻害す効果も報告されています。(下図)

図:メトホルミンは直接的および間接的なメカニズムで抗腫瘍作用を示す。肝臓における糖新生を阻害し(1)、全身のグルコースとインスリンの量を低下し、がん細胞の増殖を抑制する(2)。さらに、ミトコンドリアの呼吸酵素複合体Iの阻害によるATP産生抑制、AMP活性化プロテインキナーゼ(AMPK)活性化、mTORシグナル伝達系の抑制、低酸素誘導因子-1(HIF-1)活性の抑制などのメカニズムで直接的な抗腫瘍効果を示す(3)。がん細胞のミトコンドリアでのグルコースとグルタミンの利用を阻害し、物質合成を阻害す効果も報告されている(4)。(参考:BMC Biol. 2014; 12: 82.)
【メトホルミンはミトコンドリアでの物質合成を阻害する】
メトホルミンはミトコンドリアの電子伝達系の呼吸酵素複合体Iを直接的に阻害し、酸化的リン酸化を抑制します。
糖尿病においては、メトホルミンは肝臓における糖新生を阻害し、血中のグルコース量(血糖値)とインスリン量を低下させます。
血糖とインスリン量を低下させるので、がん予防効果があり、がんの進行を抑制できます。
実際に、2型糖尿病の患者でメトホルミンを服用している患者は、その他の薬を服用中の糖尿病患者に比べてがんの発生率が低く、がんの進行が遅いことが多くの疫学研究で明らかになっています。
糖尿病はがんの発生と進行を促進します。したがって、メトホルミンのがんの発生率やがん死亡の抑制効果は糖尿病の改善によるメカニズムだけかもしれません。
しかし、ビグアナイド系以外の他の糖尿病治療薬ではがん予防効果は認められていません。むしろ、インスリン分泌を刺激する様な薬は発がんを促進する可能性が指摘されています。前述のように、最近の研究で、メトホルミンの直接的な抗がん作用が明らかになっています。
ミトホルミンがミトコンドリアでのグルコースとグルタミンの利用を阻害して物質合成を阻害し、がん細胞の増殖を抑制する効果が報告されています。以下のような報告があります。
Metformin Antagonizes Cancer Cell Proliferation by Suppressing Mitochondrial-Dependent Biosynthesis (メトホルミンはミトコンドリア依存性の物質合成を抑制することによってがん細胞の増殖を阻止する)PLoS Biol. 2015 Dec 1;13(12):e1002309. doi: 10.1371/journal.pbio.1002309. eCollection 2015.
【要旨】
メトホルミンは2型糖尿病の治療に最も多く処方されているビグアナイド系の薬剤で、その抗腫瘍効果が注目されている。
最近の研究では、メトホルミンはミトコンドリアの電子伝達系の複合体Iに作用してがん細胞の増殖を直接的に阻害する作用が指摘されている。しかしながら、メトホルミンによる細胞増殖抑制作用のメカニズムは十分に解明されていない。
本研究では、メトホルミンによるがん細胞の増殖抑制作用は、代謝チェックポイント・キナーゼのAMP活性化プロテインキナーゼ(AMPK)やLKB1に非依存的であることを明らかにした。
さらに、メトホルミンはミトコンドリアにおける物質合成を阻害することによってがん細胞の増殖を阻害することを明らかにした。
培養細胞を使った実験(in vitro)で、メトホルミンがグルコースおよびグルタミン由来の中間代謝産物がTCA回路に入る過程を抑制し、その結果、クエン酸の合成を減らし、新規の脂肪酸合成を抑制することを明らかにした。
機能的なミトコンドリアを欠損するがん細胞では、メトホルミンの存在下でもグルタミン依存性の還元的カルボキシル化(reductive carboxylation)によって脂肪酸合成を維持できるので、メトホルミンによる増殖停止効果を受けにくくなる。
がん細胞の増殖に必要なミトコンドリア依存性の中間代謝産物の合成を抑制することによって、メトホルミンはがん細胞の増殖を阻止する。
このミトコンドリアにおける物質合成の阻害を代償する経路の存在が、メトホルミンの抗がん作用に対する抵抗性のメカニズムとなっている。
メトホルミンの抗腫瘍効果が注目されていますが、まだそのメカニズムの十分に解明されていません。
前述のように、一般的には、メトホルミンがミトコンドリアの呼吸酵素複合体を阻害してATP産生を減らし、その結果、AMP活性化プロテイン・キナーゼ(AMPK)を活性化することが増殖抑制につながると考えられています。AMPKはmTORC1(哺乳類ラパマイシン標的たんぱく質複合体1)の活性を抑制するからです。
しかし、この論文では、メトホルミンの増殖抑制のメカニズムにはAMPKの活性化もLKB1(AMPKを活性化する)も関係ないと報告しています。メトホルミンの血糖低下作用には、LKB1とAMPKの関与が重要だと考えられていますが、がん細胞の増殖抑制にはLKB1もAMPKも必要ないという結論です。
もし、メトホルミンの抗腫瘍作用がLKB1とAMPKに依存しないのであれば、メトホルミンのがん治療における有用性は高くなります。がん細胞はLKB1やAMPKシグナル伝達系に異常が起こっていることが多いので、メトホルミンの抗腫瘍効果がLKB1やAMPKシグナル伝達系に依存性であれば、抗腫瘍効果はLKB1とAMPKが正常な場合に限られます。LKB1とAMPKに依存しないのであれば、メトホルミンは多くのがん細胞に抗腫瘍効果を発揮できます。
【メトホルミンはミトコンドリアにおけるグルコースとグルタミンの利用を阻害する】
前述の論文では、メトホルミンはグルコースおよびグルタミン由来の中間代謝産物がTCA回路に入る過程を抑制し、その結果、クエン酸の合成を減らし、新規の脂肪酸合成を抑制して、増殖抑制効果を発揮するというメカニズムを提唱しています。
この論文の主な実験結果は以下のような内容です。(難解な部分は省略)
1)メトホルミンは酸化的リン酸化を抑制した。
2)メトホルミンはα-ケトグルタル酸を除く全てのTCA回路の代謝産物の量を顕著に減少させた。
3)メトホルミンは、グルコースとグルタミンに由来する炭素のTCA回路への取込みを減少させた。
4)メトホルミンはグルコース由来のクエン酸の産生量を用量依存的に減少した。
5)メトホルミン処理細胞ではグルタミン由来のクエン酸の量が顕著に減少した(コントロールの5%程度に)。
6)メトホルミンによるクエン酸の減少はAMPKに非依存的であった。
7)メトホルミンはがん細胞における新規の脂肪酸合成を抑制する。
ミトコンドリアのクエン酸は細胞質に移行してアセチルCoAに変換され、新規の脂肪酸合成に使用されます。
メトホルミンはTCA回路におけるグルコース由来のクエン酸合成を抑制し、さらにグルタミン由来のクエン酸合成も抑制します。その結果、メトホルミンは脂肪酸合成を抑制することになります。
このグルコースとグルタミンに由来するクエン酸→アセチルCoAによる脂肪酸合成の減少は正常細胞でもAMPKα欠損の細胞でも認められました。
つまり、メトホルミンによる脂肪酸合成阻害作用はAMPKに非依存的ということです。
メトホルミンは脂肪酸のβ酸化の阻害剤の存在下で、脂肪酸合成に使われるアセチルCoAの産生とパルミチン酸の合成を減少させました。
これは脂肪酸の減少が、脂肪酸の分解(β酸化)の亢進ではなく、脂肪酸の合成の抑制であることを意味しています。
細胞質のクエン酸をアセチルCoAに変換するATPクエン酸リアーゼ(ATP citrate lyase)ががん細胞における脂肪酸合成の律速段階になっています。
メトホルミンは、ATPクエン酸リアーゼの発現を干渉RNA(siRNA)を使って阻害したのと同じレベルでがん細胞の増殖を抑制しました。
以上の結果から、メトホルミンの増殖抑制作用は、ミトコンドリアでのグルコースとグルタミンの利用を阻害し、クエン酸依存性の脂肪酸合成の阻害が関与していることを示しています。

図:TCA回路で産生されるクエン酸は細胞質に出てATPクエン酸リアーゼでアセチルCoAに変換されて脂肪酸合成に使用される。急激に増殖するがん細胞のミトコンドリアでは、TCA回路の順行性の代謝に加えて、グルタミン由来のαケトグルタル酸がイソクエン酸脱水素酵素による還元的代謝によってTCA回路を逆行してクエン酸を増やしている。低酸素で増殖するがん細胞は、ミトコンドリア依存性の脂肪酸合成をバイパスするために還元的グルタミン代謝を使うことが報告されている。メトホルミンはグルコースおよびグルタミン由来のクエン酸合成を抑制し、その結果、脂肪酸合成を抑制する。
【脂肪酸合成を阻止するとメトホルミンの抗腫瘍効果を高めることができる】
がん細胞は増殖制御の破綻によって細胞増殖活性が亢進しています。細胞の増殖には細胞を作る物質の合成を大量に増やす必要があります。この物質合成を阻止できればがん細胞の増殖を阻止でき、がん治療に応用できます。
がん細胞の物質合成の材料になる2大栄養素が、グルコースとグルタミンです。グルコースが欠乏すると、グルタミンをエネルギー産生や物質合成の材料に使うように代謝系が変更されます。(489話参照)

図:細胞の増殖にとってグルコースとグルタミンは二大栄養素である。増殖している細胞では、増殖していない細胞(非増殖細胞)に比べて、細胞が分裂して数を増やすために、たんぱく質、核酸、脂質などの生体内マクロ分子の合成とエネルギー(ATP)産生のために、グルコースとグルタミンの取込みと利用が亢進している。
前述の論文では、メトホルミンはミトコンドリアにおける物質合成を阻害して、がん細胞の増殖に必要な代謝産物を減少させて、がん細胞の増殖を停止させることを報告しています。この増殖抑制の一部は、細胞膜に必要な脂肪酸の合成の抑制によるものでした。
メトホルミンは炭素がTCA回路に流入するのを抑制し、クエン酸依存性の新規の脂肪酸合成を含めてミトコンドリア依存性の物質合成を阻害することによって、がん細胞の増殖を抑制するというメカニズムです。
しかしながら、メトホルミンの増殖抑制作用に抵抗性を示すがん細胞も存在します。
この場合、TCA回路に非依存的な脂肪酸合成経路の関与が指摘されています。
これはグルタミン由来のαケトグルタル酸が還元的カルボキシル化によってクエン酸が作られて脂肪酸合成にいく経路が存在するからです。(αケトグルタル酸の還元的カルボキシル化の経路は489話で解説)
メトホルミンは酸素濃度が正常な場合(20%O2)は、がん細胞の増殖を抑制するが、低酸素(1% O2)ではがん細胞の増殖抑制はみられないという報告があります。低酸素で増殖するがん細胞は、ミトコンドリア依存性の脂肪酸合成をバイパスするために還元的グルタミン代謝を使うためと説明されています。
クエン酸から脂肪酸合成を促進するATPクエン酸リアーゼを阻害するヒドロキシクエン酸をメトホルミンや2-デオキシ-D-グルコースと併用すると、がん細胞のエネルギー産生と物質合成(特に脂肪酸合成)を阻止して、増殖を抑制できると言えます。(177話、404話、464話参照)
ヒドロキシ・クエン酸はダイエットのサプリメントとして市販されています。

図:ミトコンドリアのTCA回路で産生されるクエン酸は細胞質に出てATPクエン酸リアーゼでアセチルCoAに変換されて脂肪酸合成に使用される。急激に増殖するがん細胞のミトコンドリアでは、TCA回路の順行性の代謝に加えて、グルタミン由来のαケトグルタル酸の還元的代謝によってTCA回路を逆行してクエン酸を増やしている。ATPクエン酸リアーゼを阻害するヒドロキシクエン酸と、ミトコンドリアの物質合成を阻害するメトホルミンと、グルコースの取込みと解糖系を阻害する2-デオキシ-D-グルコース(2-DG)と併用すると、がん細胞のエネルギー産生と物質合成(特に脂肪酸合成)を阻止して、増殖を抑制できる。
【メトホルミンと解糖系阻害剤の相乗効果】
メトホルミンは呼吸酵素複合体Iを阻害してATPの産生を阻害します。その結果、メトホルミンは酸化的リン酸化から解糖系に代謝をシフトします。
細胞外の酸性化の程度(乳酸産生)と酸素消費量を測定すると、メトホルミン投与はがん細胞の酸素消費量を低下し乳酸産生を増やします。つまり、メトホルミンはグルコースの取込みを増やし乳酸産生を増やします。
がん細胞はもともと解糖系が亢進し、乳酸産生が増えていますが、メトホルミンはミトコンドリアの呼吸鎖でのATP産生を阻害するので、解糖系でのグルコース利用を増やすことになります。
したがって、メトホルミンを投与しているときに解糖系を阻害すると、がん細胞はダメージを受けやすくなります。
解糖系を阻害する2-デオキシ-D-グルコースとメトホルミンの併用が相乗的に抗腫瘍効果を示すことが報告されています。(338話、417話参照)
AMPKの発現のない細胞でも、メトホルミンは酸化的リン酸化を抑制し乳酸産生を増やすことが報告されています。
AMPKの発現のない細胞でも、メトホルミンはがん細胞の増殖を抑制します。
AMPKを活性化するLKB1を欠損した細胞でも、メトホルミンは細胞増殖を抑制します。
つまり、LKB1やAMPKに変異や欠損があっても、メトホルミンの抗腫瘍効果は発揮できます。メトホルミンはmTORC1活性も阻害します。
いろいろとメカニズムは複雑ですが、結論は、メトホルミンはLKB1やAMPKやmTORC1シグナル伝達系とは関係なく、がん細胞の増殖を抑制する作用があります。
解糖系阻害(2-デオキシグルコース、ケトン食)とメトホルミンとヒドロキシクエン酸の組合せは、がん細胞のエネルギー産生と物質合成を阻害してがん細胞の増殖を抑制する治療として有望です。(418話)
【βヒドロキシ酪酸はグルコースとグルタミンの利用を抑制する】
ケトン体のβヒドロキシ酪酸ががん細胞のミトコンドリアでのグルコースとグルタミンの利用を抑制する作用が報告されています。以下のような報告があります。
Metabolic reprogramming induced by ketone bodies diminishes pancreatic cancer cachexia. Cancer & Metabolism. 2014;2:18. doi:10.1186/2049-3002-2-18.
【要旨】
背景:エネルギー代謝の異常はがん細胞の最大の特徴である。がん細胞は増大するエネルギー要求を満たすために、サイトカインや様々な因子を分泌し、筋肉や脂肪の分解を促進し、これががん性悪液質と言われる状況である。がん関連死の20%程度が悪液質によると考えられている。しかし、がん性悪液質のメカニズムやその治療法に関しては十分に解明されていない。
高脂肪・低糖質食のケトン食では、ケトン体(アセト酢酸、βヒドロキシ酪酸、アセトン)の血中濃度が増加し、代替エネルギー源となる。さらに、ケトン食は全身的な代謝の変化を引き起こす。
がんでは代謝の異常が重要な役割を果たしている点を踏まえ、ケトン食はがん細胞におけるグルコース取り込みを減らし、悪液質状態を軽減し、有効な治療法になる可能性がある。
結果:複数の膵臓がん細胞を用いた実験で、培養がん細胞にケトン体を投与すると、がん細胞のグルコースとグルタミンの取込みと総ATP量を減少させ、細胞死を誘導した。代謝の制御に重要な働きをしているがん遺伝子のc-Mycの細胞内量と、解糖系酵素の遺伝子のプロモーター領域へのc-Mycの結合が減少し、これががん細胞における代謝の変化と関連していることが示唆された。
このようなケトン体によって誘導された膵臓がん細胞内の代謝の再構成は、がん細胞を用いた実験モデルでがん性悪液質を顕著に軽減することが示された。すなわち、マウスに膵臓がん細胞を移植した実験モデルにおいて、ケトン食が腫瘍の増殖と悪液質を抑制する効果があることが確認された。
結論:以上の結果から、がん性悪液質はがん細胞における特有の代謝異常によって引き起こされ、このがん細胞における代謝異常はケトン食によって是正でき、その結果、がん細胞の増殖を抑制し、筋肉と体重の減少を阻止した。
がんの増大によって筋肉と脂肪の両方が減少する状態をがん性悪液質と言います。がん組織が出す炎症性サイトカインなどが脂肪や蛋白質の分解(異化)を進行させるのです。悪液質は、脂肪組織だけでなく筋肉組織も進行性に減少するのが特徴で、通常の栄養不良や低カロリー摂取による生理的状態とは異なる病態です。
膵臓がん患者の83%ががん性悪液質の状態になり、膵臓がん関連の死亡の主要な原因となっているという報告があります。
膵臓がんの治療では、がん細胞の増殖と悪液質の進展を阻止する有効な治療手段が必要です。
この論文ではケトン食で血中濃度が上昇するβヒドロキシ酪酸が、がん細胞のグルコースとグルタミンの利用を抑制し、細胞増殖と悪液質を抑制するという結果です。
がん遺伝子のc-Mycは解糖系とグルタミン利用(グルタミノリシス)を亢進します。βヒドロキシ酪酸はc-Mycの発現を抑制する作用があります。
がん性悪液質の発症メカニズムで最も重要なのは全身的な慢性的炎症状態です。がん関連の体重減少において筋肉組織の減少が、体力や抵抗力の低下の原因として重要です。筋肉組織の減少によって、体力が低下し、生活の質が悪くなり、治療に対する抵抗力が低下します。ケトン体にはがん細胞の増殖を抑える作用だけでなく、炎症を抑える作用もあります。そのため、ケトン食はがん性悪液質の改善に有効です。
がん細胞のミトコンドリア機能の阻害には、チュブリンの重合を阻害してVDAC(Voltage-dependent anion channel:電位依存性陰イオンチャネル)を塞いでミトコンドリアへの物質移送を阻害するメベンダゾールの併用も有効です。(414話)
つまり、メトホルミン、2-デオキシ-D-グルコース、ヒドロキシクエン酸、メベンダゾール、ケトン食の組合せはがん細胞の解糖系とミトコンドリアでのエネルギー産生と物質合成を阻害することができます。

図:ケトン体の産生を増やすケトン食は、グルコースの取込みや解糖系を抑制し、ペントースリン酸経路におけるNADPHの産生を低下させ、がん細胞内の活性酸素消去能を低下させる。脂肪酸とケトン体はミトコンドリアでアセチルCoAに変換されて代謝されるため、がん細胞では脂肪酸とケトン体の代謝能は低下している。メトホルミンはミトコンドリアの呼吸酵素を阻害してATP産生を阻害する。メベンダゾールはチュブリンの重合を阻害し、VDAC(Voltage-dependent anion channel:電位依存性陰イオンチャネル)を塞いでミトコンドリアへの物質移送を阻害する。2-デオキシ-D-グルコース(2-DG)はヘキソキナーゼを阻害して解糖系とペントース・リン酸経路を阻害する。ヒドロキシクエン酸はATPクエン酸リアーゼを阻害して脂肪酸合成を阻害する。これらを組み合せると、がん細胞の解糖系とミトコンドリアでのエネルギー産生と物質合成を抑制できる。
【ジクロロ酢酸を併用するとさらに抗腫瘍効果が高まる】
ジクロロ酢酸とメトホルミンと2-デオキシ-D-グルコースが相乗的に抗腫瘍作用を示すことは417話で解説しています。
さらに最近の報告で、ジクロロ酢酸とメトホルミンとHIF-1α活性の阻害剤が相乗効果を示すことが報告されています。以下のような論文があります。
Targeting HIF-1α is a prerequisite for cell sensitivity to dichloroacetate (DCA) and metformin.(ジクロロ酢酸とメトホルミンに対する感受性を高めるためにはHIF-1αをターゲットにすることが必要条件である)Biochem Biophys Res Commun. 2016 Jan 8;469(2):164-70.
【要旨】
がん細胞における代謝異常をターゲットにした治療法ががんの治療法として近年注目されている。
本研究では、ジクロロ酢酸とメトホルミンの併用は、それぞれを個々に投与した場合と比べて顕著に細胞死を誘導した。
さらに、ヘキソキナーゼ-2(HK2)と乳酸脱水素酵素A(LDHA)とエノラーゼ-1(ENO1)を含む解糖系酵素の発現レベルは、この2つの薬の投与によって減少した。
興味深いことに、HIF-1αの活性化は、ジクロロ酢酸とメトホルミンによって誘導される細胞死を顕著に抑制し、この2つの薬剤によって減少した解糖系酵素の発現を回復させた。
以上の結果から、がん細胞の代謝をターゲットにした治療法の開発には、HIF-1α活性を阻害することが必要であることが示された。
Sensitization of metformin-cytotoxicity by dichloroacetate via reprogramming glucose metabolism in cancer cells.(がん細胞におけるグルコース代謝の再プログラム化を介するジクロロ酢酸によるメトホルミンの細胞毒性の増強)Cancer Lett. 346(2): 300-308, 2014
【要旨】
がん細胞に対するメトホルミンの細胞毒性を高める目的で、ピルビン酸脱水素酵素キナーゼの阻害剤であるジクロロ酢酸の作用を検討した。
メトホルミンの細胞毒性は主にグルコース利用性と、ペントース・リン酸経路で産生される還元力(NADPH)に依存していた。
一方、ジクロロ酢酸は、ピルビン酸脱水素酵素キナーゼを阻害しミトコンドリアでの呼吸(酸化的リン酸化)を亢進してグルコース代謝を再プログラム化(=正常化)することによってメトホルミンの細胞毒性を増強した。
グルコースとグルタチオンの濃度が高い条件下でも、ジクロロ酢酸とメトホルミンの併用投与は、がん細胞を死滅させた。
ジクロロ酢酸はがん細胞のグルコース代謝を好気的解糖主体の代謝からミトコンドリアでの酸化的リン酸化主体の代謝に再プログラム化することによって、メトホルミンの細胞毒性の感受性を高めることが明らかになった。
グルコース代謝の再プログラミング(reprogramming)というのは、がん細胞の特徴であるワールブルグ効果(酸素があっても解糖系でのグルコース代謝が亢進し、ミトコンドリアでの代謝が低下している)を正常化(初期化)するということです。
ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高めることによってミトコンドリアでの呼吸(酸素を使ったATP産生)が活性化され、解糖系でのATP産生は抑制されることになります。
一方、メトホルミンはミトコンドリアの呼吸酵素複合体1の働きを阻害するので、ATP産生は阻害され、活性酸素の発生が増加します。
がん細胞ではもともとミトコンドリアでの酸素を使った代謝が低下しているので、メトホルミン単独では細胞を死滅させる作用が弱いのですが、ジクロロ酢酸でミトコンドリアにおける酸素利用を高めれば、がん細胞は酸化傷害によって死滅するというストーリーです。
Dichloroacetate enhances apoptotic cell death via oxidative damage and attenuates lactate production in metformin-treated breast cancer cells.(メトホルミンを投与した乳がん細胞において、ジクロロ酢酸は酸化傷害によるアポトーシスを亢進し、乳酸の産生を抑制する)Breast Cancer Res Treat. 147(3):539-50. 2014年
【要旨】
乳がん細胞における代謝の特徴を明らかにすることは、乳がんの治療法の開発に役立つ。
メトホルミンは乳がんの治療に有用な薬剤であることが明らかになっている。このメトホルミンはミトコンドリアの呼吸酵素複合体Iの働きを阻害して活性酸素の産生を増やし、酸化傷害によって細胞死を誘導する。
呼吸酵素複合体Iの阻害は乳酸産生を増やすことになるが、がん細胞においては解糖系の亢進によって乳酸産生がもともと亢進した状態にあり、乳酸産生が高いほど予後が悪いことが知られている。
メトホルミンはがん治療に効果が期待できるが、乳酸産生を抑制する方法を組み合わせると、メトホルミンの抗がん作用を効率的に高めることができる。
ジクロロ酢酸はピルビン酸脱水素酵素キナーゼの活性を阻害することによってミトコンドリアでの代謝を促進する作用によって、乳酸アシドーシスの治療薬として使用されている。
この研究の目的は、メトホルミンとジクロロ酢酸を併用すると、乳がん細胞を死滅させる効果が相乗的に高まるかどうかと、そのメカニズムを検討することである。
乳がん細胞株を用い、メトホルミンとジクロロ酢酸を投与し、細胞死の程度や代謝の変化を解析した。
細胞死と活性酸素産生はフローサイトメトリーやウェスタンブロット法や細胞数測定法などの方法で解析した。細胞の形態学的変化は位相差顕微鏡や共焦点顕微鏡で解析した。
細胞の代謝の変化は、Seahorse XF24アナライザー、乳酸測定、pH測定で検討した。
実験の結果、ジクロロ酢酸とメトホルミンを同時に添加すると、乳がん細胞のアポトーシスは相乗的に増加することが明らかになった。
メトホルミンによって誘導される酸化傷害はジクロロ酢酸によって促進され、ジクロロ酢酸によるピルビン酸脱水素酵素キナーゼ活性の阻害はメトホルミンによって引き起こされる乳酸産生亢進を抑制した。
以上のことから、ジクロロ酢酸とメトホルミンを同時投与すると、酸化傷害を介するカスパーゼ依存性のアポトーシスの誘導を相乗的に亢進し、さらにメトホルミンによる乳酸産生を抑制することが明らかになった。
メトホルミンとジクロロ酢酸の併用は、乳がんの治療効果を高めることが期待できる革新的な治療法となる可能性がある。
ジクロロ酢酸はミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから使用されています。
メトホルミンはその副作用に「乳酸アシドーシス」があります。高齢者や腎機能障害者や心血管・肺機能障害、手術前後、肝機能障害などの患者、脱水、過度のアルコール摂取などで起こることがあります。
ジクロロ酢酸は乳酸アシドーシスの治療にも使われているので、メトホルミンとジクロロ酢酸の併用は副作用予防の観点からもメリットがあります。
メトホルミンとジクロロ酢酸と2-デオキシグルコース(2-DG)の併用は抗腫瘍効果を相乗的に高めます(下図)

図:がん細胞はミトコンドリアの様々な異常によって活性酸素が出やすい状況になっている。細胞質の解糖系とミトコンドリアの呼吸鎖を阻害しながら、ピルビン酸脱水素酵素を活性化して無理矢理ミトコンドリアの代謝を活性化すれば、がん細胞は活性酸素の増加とエネルギー(ATP)の産生阻害という2つのメカニズムで死滅することになる。2−DG(2-デオキシグルコース)は解糖系を阻害し、メトホルミンは呼吸鎖を阻害してATP産生を阻害すると同時に活性酸素の産生を増やす。ジクロロ酢酸ナトリウムでピルビン酸脱水素酵素の活性を亢進してミトコンドリアでの代謝を亢進すると、活性酸素の産生が増えるが、2-DGでグルコース-6-P(グルコース-6-リン酸)の産生を抑制するとペントース・リン酸経路におけるNADPHの産生が低下するので還元力が減少し、酸化ストレスは増大してがん細胞は死滅する。呼吸鎖でのATP産生に異常がない正常細胞では、この3つの組合せでダメージを受けにくいので、がん細胞に選択性の高い治療法になる。
| « 489)がん細胞... | 491)ケトン体... » |





