がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
604)がんの『水素ガス吸入療法』(その2):水素はミトコンドリアを活性化する
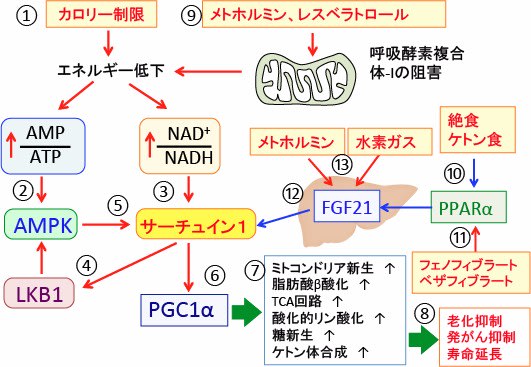
図:カロリー制限は細胞内エネルギーの低下によってAMP/ATP比とNAD+/NADH比を高める(①)。AMP/ATP比の上昇はAMP活性化プロテインキナーゼ(AMPK)を活性化し(②)、NAD+/NADH比の上昇はサーチュイン1(Sirtuin 1)を活性化する(③)。サーチュイン1はセリン・スレオニン・キナーゼのLKB1を脱アセチル化によって活性化し、LKB1はAMPK(AMP活性化プロテインキナーゼ)をリン酸化して活性化する(④)。AMPKはサーチュイン1を活性化する(⑤)。サーチュイン1はPGC-1αの発現を亢進する(⑥)。PGC-1αは、ミトコンドリア新生を亢進し、脂肪酸β酸化とTCA回路と酸化的リン酸化と糖新生とケトン体合成を亢進する(⑦)。その結果、細胞の老化と発がんを抑制し、寿命を延長する(⑧)。糖尿病治療薬のメトホルミンやレスベラトロールはミトコンドリアの呼吸酵素複合体Iを阻害して、カロリー制限と類似のメカニズムでPGC-1αたんぱく質の発現を亢進する(⑨)。絶食とケトン食はPPARα(ペルオキシソーム増殖因子活性化受容体α)を活性化する(⑩)。PPARαのリガンド(フェノフィブラートやベザフィブラートなど)はPPARαを活性化する(⑪)。PPARαの活性化は肝臓のFGF21の発現を亢進し、FGF21はサーチュインを活性化する(⑫)。メトホルミンと水素ガスはFGF21を介する機序でサーチュインを活性化し、PGC-1αを活性化することが報告されている(⑬)。これらの方法を組み合せることによってミトコンドリアの数を増やし、機能を高めることができる。
604)がんの『水素ガス吸入療法』(その2):水素はミトコンドリアを活性化する
【PGC-1αを活性化するとミトコンドリアが増える】
細胞内のミトコンドリアの増殖を刺激することによって、細胞内のミトコンドリアの数と量を増やすことができます。
その方法として、ペルオキシソーム増殖因子活性化受容体(PPAR)のリガンド(ベザフィブラートなど)、AMPプロテインキナーゼ(AMPK)を活性化するメトホルミン、カロリー制限、絶食やケトン食で体内で産生されるケトン体(βヒドロキシ酪酸など)が報告されています。
ミトコンドリアが増えることを「ミトコンドリア新生」や「ミトコンドリア発生」と呼んでいます。細胞内でミトコンドリアが新しく発生することです。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferator- activated receptor gamma coactivator-1α)です。日本語訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PPARのリガンド(フェノフィブラート、ベザフィブラートなど)やメトホルミンやレスベラトロールやカロリー制限やβヒドロキシ酪酸はこのPGC-1αを活性化する作用があります(下図)。
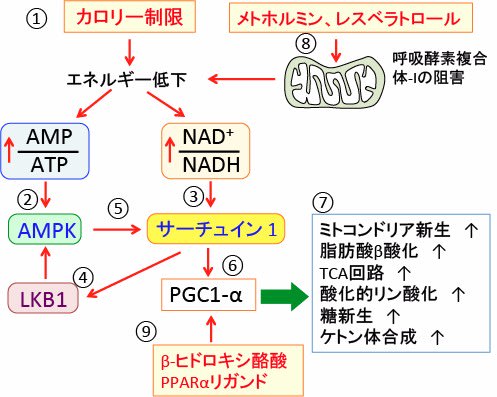
図:カロリー制限は体内のエネルギー低下によってAMP/ATP比とNAD+/NADH比を高める(①)。AMP/ATP比の上昇はAMP活性化プロテインキナーゼ(AMPK)を活性化し(②)、NAD+/NADH比の上昇はサーチュイン1(Sirtuin 1)を活性化する(③)。サーチュイン1はセリン・スレオニン・キナーゼのLKB1を活性化し、LKB1はAMPKを活性化する(④)。AMPKはサーチュイン1を活性化する(⑤)。サーチュイン1はPGC-1αの発現を亢進する(⑥)。PGC-1αは、ミトコンドリア新生を亢進し、脂肪酸β酸化とTCA回路と酸化的リン酸化と糖新生とケトン体合成を亢進する(⑦)。メトホルミンやレスベラトロールはミトコンドリアの呼吸酵素複合体Iを阻害して、カロリー制限と類似のメカニズムでPGC-1αたんぱく質の発現を亢進する(⑧)。ケトン体のβヒドロキシ酪酸やPPARαのリガンド(フェノフィブラートやベザフィブラートなど)はPGC-1αたんぱく質の発現を亢進する(⑨)。
【サーチュイン1はPGC-1αを活性化してミトコンドリア新生を亢進する】
サーチュイン(サーチュインファミリー)は食物不足(飢餓状態)の時に活性化される遺伝子群で、NAD依存性脱アセチル化酵素です。

図:サーチュインはNAD+/NADHの比率の変動を感知することによって、細胞内の栄養素の供給状況や物質代謝の状況を把握している。栄養素、特に糖が減少すると、NAD+が増え、サーチュインが活性化する。細胞質や核に存在するSIRT1やミトコンドリアに存在するSIRT3など7種類が知られている。サーチュインはタンパク質の脱アセチル化(アセチル基を除去する)によって様々な転写因子や酵素などの活性を調整することによって、細胞周期、代謝、抗酸化システム、オートファジーなどの細胞機能に影響する。その結果、細胞老化や発がんを抑制し、寿命を延長する効果を発揮する。
カロリー制限(栄養不良を伴わない低カロリー食事療法)で、霊長類を含む多岐にわたる生物種において老化を遅延させ、寿命を延長させることが知られていますが、このカロリー制限のときに活性化されて寿命延長と抗老化作用に関与するのがサーチュイン遺伝子です。
サーチュイン1はPGC-1αを脱アセチル化することによって活性化します。活性化したPGC-1αはミトコンドリア新生を亢進します。
サーチュイン1はAMPK(AMP活性化プロテインキナーゼ)やPPAP(ペルオキシソーム増殖因子活性化受容体)によって活性化されます。さらに絶食時に発現が亢進するFGF21というホルモンによっても活性化されます。
【絶食するとPPARα/FGF21を介してPGC-1αが活性化してミトコンドリアが増える】
FGF21(Fibroblast growth factor 21;線維芽細胞増殖因子21)は他の線維芽細胞増殖因子と構造上の相同性を持っていますが、細胞増殖を促進する「増殖因子」としての活性はなく、糖や脂質代謝を制御するホルモン様作用を示すタンパク質です。
肝臓・脂肪・筋肉・膵臓などで産生され、FGF21の主要な標的組織は肝・膵・脂肪組織と考えられています。
FGF21の生理的役割は、飢餓に対する適応と考えられています。
空腹に反応して肝の脂質代謝が亢進し、さらにケトン体が産生されると、FGF21が放出されます。
FGF21を全身的に投与すると、血糖・中性脂肪が低下し、膵臓β細胞の機能が改善し、肥満と脂肪肝が改善し、アディポネクチンが増加し、心血管リスクファクターマーカーが減少するなどの効果が見られます。
ケトン食では血中FGF21が増加します。ケトン食が様々な健康作用を持つことは、FGF21を介してAMP活性化プロテインキナーゼ(AMPK)とサーチュイン1を活性化し、さらにサーチュイン1がPGC-1αを活性化して、ミトコンドリアを増やし、脂肪酸β酸化や酸化的リン酸化を亢進するというメカニズムが関与しています。(下図)

図:絶食とケトン食はPPARα(ペルオキシソーム増殖因子活性化受容体α)を活性化してFGF21の発現を亢進する。FGF21はLKB1を活性し、LKB1はAMPK(AMP活性化プロテインキナーゼ)を活性化し、AMPKはサーチュイン1(Sirtuin1)を活性化する。サーチュイン1はPGC-1αを活性化し、PGC-1αはミトコンドリア新生を亢進し、ミトコンドリア機能を高める。
【分子状水素(水素ガス)はFGF21を誘導する】
分子状水素(水素ガス)がFGF21を活性化して、肥満や糖尿病を改善することが報告されています。以下のような報告があります。
Molecular hydrogen improves obesity and diabetes by inducing hepatic FGF21 and stimulating energy metabolism in db/db mice.(分子状水素は、db / dbマウスにおいて肝臓のFGF21を誘導し、エネルギー代謝を刺激することにより、肥満および糖尿病を改善する)Obesity (Silver Spring). 2011 Jul;19(7):1396-403.
【要旨】
水素ガスの吸入や水素を含有する水の飲用や注射によって分子状水素を体内に摂取することが、酸化ストレス関連疾患を改善する大きな可能性を有することが、最近の多くの研究で明らかになっている。しかしながら、体内での水素の動的な動きについてはほとんど知られていない。
まず、水素含有水の経口投与後に肝グリコーゲンが水素を蓄積し、短期間にわたる少量の水素の摂取でも様々な疾患モデルを効率的に改善する理由を説明する。
この知見は、グリコーゲン溶液が水素を保持するというインビトロ(in vitro)実験によって支持された。
次に、機能的レプチン受容体を欠くdb / db肥満モデルマウスを用いて2型糖尿病への水素含有水の随意飲水の効果を調べた。
水素含有水を飲むと肝臓の酸化ストレスが減少し、db / dbマウスの脂肪肝、および野生型マウスの高脂肪食誘導脂肪肝の実験モデルで、脂肪肝が有意に軽減された。
水素含有水の長期間の飲用は、食事と水の消費量が増加していないにもかかわらず、体重を有意に抑制した。さらに、水素含有水を飲むと、血糖値、インスリン、中性脂肪値が低下した。この高血糖に対する効果は食事制限と同様であった。
水素含有水の飲用による肥満および代謝パラメータの改善効果の分子メカニズムを調べるために、遺伝子発現プロファイルを解析し、脂肪酸とグルコースの消費を促進する肝臓のホルモンである線維芽細胞成長因子21(FGF21)の発現亢進を認めた。
実際に、水素がエネルギー代謝を亢進することは、酸素消費量の測定で確認された。
今回の結果は、肥満と糖尿病とメタボリックシンドロームの改善における分子状水素の潜在的有益性を示唆している。
FGF21はカロリー制限と同様の健康作用を発揮し、マウスの実験では寿命延長効果も見られています。FGF21は有望なカロリー制限類似薬と言えます。
FDF21を過剰に発現するように遺伝子改変したトランスジェニックマウスは寿命が30%(オス)〜40%(メス)延びたという実験結果が報告されています。
FGF21は成長ホルモン(GH)/インスリン様増殖因子-1(IGF-1)シグナル伝達系を抑制します。
カロリー制限ではFGF21の発現は亢進しませんが、絶食すると発現が亢進します。
FGF21の発現を亢進する薬は幾つか知られていますが、寿命を延ばすことが証明されているのは現時点ではメトホルミンのみです。
水素ガスがFGF21の発現を亢進することは、ミトコンドリア新生の亢進や寿命延長効果が期待できます。
成長ホルモン/インスリン様成長因子-1(IGF-1)シグナル伝達系の活性化は寿命を短縮することが明らかになっています。
FGF21はインシュリン感受性を高め、成長ホルモン/インスリン様成長因子-1(IGF-1)シグナル伝達系を阻害することによって、健康作用を発揮し、寿命を延長する効果を発揮します。
FGF21は肝臓から分泌されるホルモン様物質で、飢餓状態に適応する様に代謝を調節する作用があります。
【水素ガスはPGC-1αの発現を誘導してミトコンドリア機能を亢進する】
分子状水素(水素ガス)がFGF21の発現を亢進するのであれば、そのシグナル伝達系の下流に存在するサーチュイン1を活性化し、PGC-1αの発現を誘導する作用があるはずです。以下のような報告があります。(前述の論文と同じ研究グループからの報告です)
Molecular hydrogen stimulates the gene expression of transcriptional coactivator PGC-1α to enhance fatty acid metabolism(分子状水素は転写活性化因子PGC-1αの遺伝子発現を刺激して脂肪酸代謝を促進する)NPJ Aging Mech Dis. 2016; 2: 16008.
【要旨】
我々は以前に、分子状水素(H2)が多彩な機能を発揮する新規な抗酸化剤として作用することを報告した。
さらに水素水(水素を注入した水)の長期間の摂取は、Ⅱ型糖尿病モデルマウスのdb / dbマウスにおいて、エネルギー消費を高め、肥満と糖尿病状態を改善し、さらに未知の機序によって線維芽細胞増殖因子21(FGF21)の発現を増加した。
水素は水素水を飲むことによって、または水素生成物質のMgH2の経口投与によって摂取した。 db / dbマウスの肝臓における包括的な遺伝子発現プロファイルをDNAマイクロアレイで解析した。遺伝子発現に対する作用メカニズムは、培養されたHepG2細胞を用いて解析した。
さらに、水素水の飲水による寿命に対する効果を、脂肪食を与えた野生型マウスを用いて調べた。
遺伝子発現の包括的解析によって、脂肪酸およびステロイド代謝に関与する様々な遺伝子の発現の増加が認められた。
水素を摂取することによって、PPARαシグナル伝達経路に関与する遺伝子の発現亢進が認められた。
まず最初に、PGC-1αの遺伝子発現が一過性に増加し、続いてFGF21遺伝子の発現が増加した。
PGC-1αの発現は、水素、4-ヒドロキシ-2-ノネナール(4-hydroxy-2-nonenal)、およびAkt / FoxO1シグナル伝達系によって間接的に制御されることが培養細胞を用いた実験で示唆された。
脂肪食を与えた野生型マウスでは、水素水が血漿中性脂肪のレベルを改善し、平均寿命を延長した。
水素はPGC-1α遺伝子の発現を誘導し、続いてFGF21および脂肪酸およびステロイド代謝を調節するPPARα経路を刺激する。
この実験では、水素ガスが最初にPGC-1α遺伝子の発現を誘導し、PGC-1αの転写活性によってFGF21およびPPARα経路のたんぱく質の発現が誘導されることを示しています。つまり、PGC-1αとFGF21とPPARα経路は密接に相互作用して、飢餓時のエネルギー代謝を調節していると思われます。
メカニズムは複雑でまだ不明な点も多いのですが、水素ガスはPPARα/FGF21/PGC-1αシグナル伝達系に作用してミトコンドリア新生を亢進し、ミトコンドリア機能を高める効果があるようです。
【PPARとPGC-1α】
ペルオキシソーム(Peroxisome)は酵母から哺乳動物までのほぼ全ての真核細胞が持っている直径0.1〜2マイクロメートルの単層の膜で囲まれた球状の細胞内小器官です。
哺乳類の細胞では1個の細胞に数百から数千個が存在し、多様な物質の酸化反応を行っています。様々な物質を酸化する酸化酵素(オキシダーゼ)が多く含まれ、これらの酸化酵素は基質となる特定の有機化合物(R)から水素原子を奪う酸化反応を行います。
RH2 + O2 → R + H2O2
その結果、有害な過酸化水素(H2O2)が生じるので、この小器官の中には、過酸化水素(hydrogen peroxide)を分解するカタラーゼが多く含まれています。
つまり、ペルオキシソームは過酸化水素が発生するような酸化反応を行う場所で、物質を酸化する酸化酵素(オキシダーゼ)が多く含まれ、発生した過酸化水素を消去する細胞内小器官という意味で「ペルオキシソーム」と命名されました。ソーム(-some)というのは細胞内小器官を表わす接尾語です。
ペルオキシソームでは、脂肪酸のベータ酸化、コレステロールや胆汁酸の合成、アミノ酸やプリン体の代謝などが行われています。
ペルオキシソーム増殖因子あるいはペルオキシソーム増殖剤と呼ばれるペルオキシソームを増やす作用がある物質が古くから多数見つかっています。この中には、食事中の脂肪酸や、プラスチック可塑剤のフタル酸エステル類、除草剤のようなものも含まれています。
これらの物質がどのようにしてペルオキシソームを増やすのかという研究の結果、ペルオキシソーム増殖因子が結合する核内受容体が見つかり、「ペルオキシソーム増殖因子で活性化される受容体」という意味で「ペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptor:PPAR)」という長い名前になっています。
このようにPPARは細胞内のペルオキシソームの増生を誘導する受容体として発見されましたが、その後の研究で、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群であることが明らかになりました。脂質や糖質の代謝を促進するので、PPARを活性化する物質は高脂血症や糖尿病の治療薬として臨床で使用されています。
PGC-1α(ペルオキシソーム増殖因子受容体γコアクチベーター1α)は転写因子のPPAR-γと結合して、PPAR-γの転写活性を高める因子として見つかりました。その後、PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御するたんぱく質であることが明らかになっています。
PGC-1αはミトコンドリアの量の制御や、エネルギー供給に対する適応の制御に中心的な働きを担っています。
運動の様々な健康作用はPGC-1αによると言われています。
PGC-1αはミトコンドリア新生を亢進します。
前述のようにAMP活性化プロテインキナーゼ(AMPK)とサーチュイン-1(SIRT1)はPGC-1αのリン酸化と脱アセチル化によってPGC-1αの活性を亢進し、ミトコンドリアの新生を促進します。
AMPKとSIRT1は2つとも、PGC-1αを介するメカニズムで、脂肪酸酸化を促進し、解糖系を阻害し、タンパク質と核酸と脂肪酸の合成を抑制します。
つまり、AMPKとSIRT1を活性化するメトホルミンやカロリー制限やケトン食やレスベラトロールは、ワールブルグ効果を是正する作用がありますが、PGC-1αが重要な役割を果たしているようです。
【ミトコンドリアを増やすとがん細胞の増殖や浸潤や転移が抑制される】
がん細胞のミトコンドリア新生を刺激してミトコンドリアを増やすと、細胞のがん化や悪性進展が阻止されることが報告されています。
高脂血症治療薬のベザフィブラートはミトコンドリアを増やす作用があります。ベザフィブラートはペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptor:PPAR)の汎アゴニスト(pan-agonist)です。
PPARにはアルファ型(PPARα)、ガンマ型(PPARγ)、デルタ型(PPARδ)の3種類のサブタイプがありますが、ベザフィブラートはこの3種類のPPARを活性化する作用があります。
多くのがん細胞でミトコンドリアでの酸素呼吸が低下していますが、この現象ががん細胞の発生や悪性進展においてどのような役割を担っているかはまだ明らかになっていません。
この現象をより理解するために、培養したがん細胞にベザフィブラートを投与し、ペルオキシソーム増殖因子活性化受容体(PPAR)/ PPARγコアクチベーター1α (PGC-1α)経路を活性化することによってがん細胞のミトコンドリアを増やすとどうなるかが研究されています。
実験の結果、ミトコンドリアでの酸化的リン酸化を亢進させると、がん細胞の増殖能や浸潤能は低下し、がんの進展が阻止されることが明らかになっています。
がんというのは一般には遺伝子異常と考えられていますが、代謝異常という観点からミトコンドリアの異常ががん細胞の発生や進展に関与していることが指摘されています。
1920年代にオットー・ワールブルグが、酸素が十分に利用できる状況でも、がん細胞ではミトコンドリアでの酸化的リン酸化が低下し、解糖系でのエネルギー産生が亢進し、その結果、乳酸の産生が増えていることを指摘しています。
現在では、多くのがん細胞で、ミトコンドリアでの酸化的リン酸化が低下していることが知られています。解糖系が亢進し、乳酸が増え、がん細胞の周囲が酸性化すると、がん細胞が周囲組織に浸潤しやすくなり、転移が促進されます。血管新生も亢進します。
ミトコンドリアDNAを欠損させて、ミトコンドリアでの酸化的リン酸化を阻害すると、がん細胞は悪性度を増し、浸潤や転移が促進されることが報告されています。逆に、がん細胞のミトコンドリアの機能を活性化すると、がん細胞の浸潤や転移が抑制できることが報告されています。(577話参照)
ミトコンドリア新生で最も重要な働きを担っているのが、前述のPGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)です。
PGC-1αは転写因子のPPAR-γと結合して、PPAR-γの転写活性を高める因子として見つかりました。
PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御するたんぱく質です。骨格筋、心筋、脂肪、脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られています。
運動すると骨格筋のPGC-1α量が増えます。
ケトン体のβヒドロキシ酪酸はPGC-1αたんぱく質の発現を亢進します。カロリー制限はサーチュイン1(Sirtuin 1)を活性化し、PGC-1αの発現を亢進します。糖尿病治療薬のメトホルミンはAMP依存性プロテインキナーゼ(AMPK)を活性化してPGC-1αの発現と活性を亢進します。
高脂血症治療薬のベザフィブラートはPPARを活性化し、PGC-1αの発現量を増やし、ミトコンドリア新生を増加させる作用があります。
これらを使ってがん細胞のミトコンドリア機能を活性化すると、解糖系が抑制され、乳酸の産生が低下し、がん細胞の増殖や浸潤が抑制されることが明らかになっています。がん細胞のミトコンドリア(酸化的リン酸化)を活性化すると、がん細胞の悪性度は低下することになります。
分子状水素(水素ガス)もPGC-1αを活性化してミトコンドリア新生を亢進します。ミトコンドリアを活性化してがん細胞を死滅させる治療法において水素ガス吸入も役立つ可能性があります。(トップの図)
【ミトコンドリア新生を亢進するとミトコンドリア機能異常を是正できる】
ベザフィブラートでミトコンドリアを活性化すると、ミトコンドリアの機能異常を是正できるという報告があります。以下のような論文があります。
A metabolic shift induced by a PPAR panagonist markedly reduces the effects of pathogenic mitochondrial tRNA mutations.(PPARの汎アゴニストによって誘導される代謝シフトは病的なミトコンドリアtRNA変異の作用を顕著に軽減する)J Cell Mol Med. 2011 Nov;15(11):2317-25.
【要旨】
ミトコンドリアDNAでコードされたトランスファーRNA(tRNA)遺伝子の変異は多くの疾患の原因となっている。培養細胞(in vitro)と動物実験(in vivo)の系で、合成アゴニストによるペルオキシソーム増殖因子活性化受容体の活性化は、ミトコンドリアでの酸化的リン酸化反応を刺激し、ミトコンドリアの量を増やし、さらに酸化的リン酸化に関与するたんぱく質の遺伝子変異による欠損を部分的に代償する。
この研究では、異なるミトコンドリアtRNAの変異をもつ細胞を使って、PPARの汎アゴニストであるベザフィブラートが、酸化的リン酸化の欠損の効果を減弱できるかどうかを検討した。
実験の結果、ベザフィブラートはミトコンドリアの量とミトコンドリアtRNAの定常レベルの量を増やし、ミトコンドリアのたんぱく質の合成を亢進した。このミトコンドリア機能の改善の結果、酸化的リン酸化活性は上昇し、ミトコンドリアにおけるATP産生能を亢進した。
PPARの汎アゴニストは、ミトコンドリア新生を制御するPPARγコアクチベーター-1α(PGC-1α)の発現を亢進することが知られている。
さらに、変異したミトコンドリアtRNAを持って酸化的リン酸化が機能している細胞株を選択すると、これらの細胞では、ベザフィブラート投与と同様に、PGC-1αの発現が3倍に増えていた。
これらの実験結果から、ミトコンドリア新生を亢進し、酸化的リン酸化活性を高めることは、ミトコンドリアの異常に起因する疾患の治療として有効であることが示唆された。
ミトコンドリアDNAには22種類のtRNAの遺伝子がコードされています。ミトコンドリアDNAの変異などでミトコンドリア機能が低下していても、ベザフィブラートでミトコンドリア新生を亢進して酸化的リン酸化を促進すると、ミトコンドリア機能異常を改善できるということです。
PGC-1αの活性化はミトコンドリア新生の亢進と同時に、異常なミトコンドリアを分解するミトファジーを亢進して、ミトコンドリアの品質を良くする効果があるということです。(下図)

図:PPARの汎アゴニストのベザフィブラートやAMP活性化プロテインキナーゼやサーチュイン1を活性化するメトホルミン、カロリー制限、ケトン体はPGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)を活性化する。PGC-1αはミトコンドリア新生を亢進して新しいミトコンドリアを増やし、ミトファジーを亢進して異常なミトコンドリアの分解を亢進する。その結果、ミトコンドリアの品質を良好に維持する。
ベザフィブラートはミトコンドリア新生を亢進して、さらに異常なミトコンドリアの分解(ミトファジー)を亢進して、がん細胞におけるミトコンドリア異常を是正し、がん細胞の増殖や浸潤を抑制できる可能性が示唆されます。
ミトコンドリア新生を亢進するとがん細胞のワールブルグ効果は正常化することも報告されています。
転移抑制因子のKISS1がミトコンドリア新生を亢進してワールブルグ効果を正常化するという報告があります。以下のような論文があります。
Metastasis suppressor KISS1 appears to reverse the Warburg effect by enhancing mitochondrial biogenesis(転移抑制因子KISS1はミトコンドリア新生を促進することによってワールブルグ効果を正常化している)Cancer Res. 74(3):954-963, 2013
KISS1は145個のアミノ酸から構成されるポリペプチドで、これが断片化した幾つかのkisspeptins(metastinとも言う)というペプチドが、それらに対応するGたんぱく質共役型受容体に作用して転移を抑制する作用があります。
この論文では、KISS1がPGC-1αの発現量を増やし、ミトコンドリアの量と活性を高め、酸化的リン酸化を亢進し、解糖系と乳酸産生を抑制することを報告しています。
以下のような論文もあります。
Increases in Mitochondrial Biogenesis Impair Carcinogenesis at Multiple Levels(ミトコンドリア新生の亢進は様々な段階で発がん過程を阻止する)Mol Oncol. 2011 Oct; 5(5): 399–409.
【要旨】
多くのがん細胞ではミトコンドリアでの酸素呼吸が低下しているが、この現象が発がん過程やがんの進行においてどのような役割を担っているかは明らかになっていない。
がん細胞におけるミトコンドリアの酸素呼吸の低下という現象の意味をより理解するために、ミトコンドリア機能をさらに阻害するのではなく、PGC-1α(peroxisome proliferator activated receptor gamma 1 α coactivator: ペルオキシソーム増殖因子活性化受容体γ共役因子1α)経路を活性化することによってがん細胞におけるミトコンドリア新生を誘導する実験を行った。PGC-1αの発現を誘導はPPAR(ペルオキシソーム増殖因子活性化受容体)の汎アゴニストであるベザフィブラートで行った。ベザフィブラートの投与によってミトコンドリアのたんぱく質と酵素活性の上昇を確認した。
ミトコンドリアの数と機能が亢進したがん細胞では、グルコース含有培地においてがん細胞の増殖活性は低下した。さらに、このようながん細胞は浸潤性が低下し、この現象は乳酸の産生量の減少と直接的に関係していた。
驚くべきことに、ベザフィブラートを投与したがん細胞はミトコンドリアのマーカーの量が増加していたにも拘らず、酸素呼吸の量には変化は起こらなかった。しかしながら、呼吸共役とATP量においては増加が見られた。
これらの結果は、ミトコンドリアでの酸化的リン酸化を亢進させると、がん細胞の増殖能や浸潤能は低下し、がんの進展が阻止されることを示している。
ベザフィブラートにはがん予防効果も報告されています。以下のような報告があります。
Does the lipid-lowering peroxisome proliferator-activated receptors ligand bezafibrate prevent colon cancer in patients with coronary artery disease?(脂質低下作用のあるペルオキシソーム増殖因子活性化受容体リガンドのベザフィブラートは、冠動脈疾患の患者において大腸がんを予防できるのか?)Cardiovasc Diabetol. 2008; 7: 18.
【要旨】
背景:高脂血症とインスリン抵抗性が大腸がんの発症リスクを高める可能性が多くの疫学研究で示唆されている。細胞核におけるペルオキシソーム増殖因子活性化受容体(PPAR)は、脂質とグルコースの代謝において中心的な役割を担っており、大腸発がんにも関与していることが指摘されている。動物実験では血清脂質を低下させるPPARリガンドのベザフィブラートが大腸がんの増殖を抑える効果が示されている。しかしながら、人間における大腸発がんにおけるベザフィブラートの効果については明らかになっていない。ベザフィブラートを服用している冠動脈疾患患者を6年間追跡し、ベザフィブラートの大腸がん予防効果を検討した。
方法:ランダム化二重盲検ベザフィブラート心筋梗塞予防研究(the randomized, double blind Bezafibrate Infarction Prevention Study)の参加者で今までにがんの既往のない3011人を対象にした。患者は1日400mgのベザフィブラート徐放剤を1日1回服用する群(1506人)と、プラセボ服用群(1505人)の2群にランダムに分け、大腸がんの発生率を比較した。
結果:新規のがん(全ての種類)の発生は177人で確認された。ベザフィブラート服用群では79例(5.25%)、プラセボ群では98例(6.51%)であった。
大腸がんの発生は25例で、ベザフィブラート服用群は8例(0.53%)に対してプラセボ群は17例(1.13%)であった。
がん発生率の違いは服用後4年目以降に明らかになり、追跡期間とともに差が増大した。プラセボ群に対するベザフィブラート服用群の大腸がんの発生リスクのハザード比は0.47(95%信頼区間:0.2〜1.1)であった。
結論:冠動脈疾患患者を対象にした今回の試験の結果は、大腸がんの発生におけるベザフィブラートの予防効果を支持するものである。
AMPKやサーチュイン1やFGF21を活性化し、PGC-1αを活性化して、ミトコンドリア新生とミトコンドリア機能を活性化する方法は、老化と発がんを抑制し、寿命を延ばす効果が期待できます。その方法として、カロリー制限、ケトン食、メトホルミン、レスベラトロール、PPARαリガンド(フェノフィブラート、ベザイブラート)、水素ガス吸入などがあります。
老化と発がんの予防と寿命延長を実践する上で、AMPKとサーチュイン1とFGF21とPGC-1αとミトコンドリアの関係を理解することが重要です。(トップの図)
| « 603)がんの『... | 605)ケトン体... » |





