がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
605)ケトン体とミトコンドリアと寿命延長:グルコース利用を阻害すると寿命が延びる
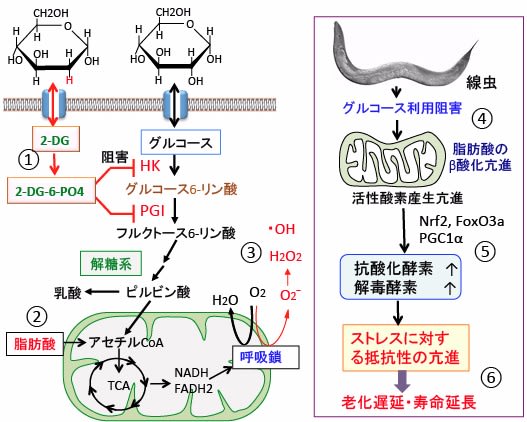
図:2−デオキシ-D-グルコース(2-DG)は細胞内でヘキソキナーゼ(HK)によって6位がリン酸化されて2-デオキシ-D-グルコース-6リン酸(2-DG-6-PO4)になる。2-DG-6-PO4は解糖系の酵素で代謝できないので細胞内に蓄積し、ヘキソキナーゼ(HK)とホスホグルコースイソメラーゼ(PGI)を阻害してグルコースの解糖系での代謝を阻害する。その結果、脂肪酸のβ酸化が亢進して(②)、ミトコンドリアで活性酸素の産生が増える(③)。線虫を使った実験で、2-DGを使用してグルコースの利用を阻害すると、脂肪酸のβ酸化が亢進してミトコンドリアでの酸素呼吸が亢進し(④)、その結果、活性酸素種の産生が増え、酸化ストレスが亢進する。酸化ストレスの亢進はNrf2やFoxO3aやPGC1αなどの転写因子を活性化して抗酸化酵素や解毒酵素の発現と活性を亢進することが示されている(⑤)。その結果、様々なストレスに対する抵抗性が亢進し、老化遅延と寿命延長の効果が得られる(⑥)。
605)ケトン体とミトコンドリアと寿命延長:グルコース利用を阻害すると寿命が延びる
【脂肪酸はミトコンドリアでATP産生に使用される】
細胞のエネルギー源(ATPを作る原料)は主にグルコース(ブドウ糖)と脂肪酸です。
穀物や糖類などから体内に吸収されたグルコースは細胞内に取込まれ、解糖系でピルビン酸まで分解されたあと、ミトコンドリアに入ってアセチルCoAに変換されてTCA回路で代謝され、さらに電子伝達系における酸化的リン酸化によってATPが産生されます。
解糖系では1分子のグルコースから2分子のATPが産生され、ミトコンドリアの酸化的リン酸化では、さらに30〜36分子のATPが産生されます。
解糖系では酸素を使わないので、活性酸素は発生しません。一方、ミトコンドリアの電子伝達系では酸素を使うので、活性酸素が発生します。
脂肪は脂肪酸とグリセロールに分解され、グリセロールは糖新生でグルコース合成に利用されます。脂肪酸はβ酸化でアセチルCoAに分解され、ミトコンドリアで酸化的リン酸化によってATP合成に使われます。
脂肪酸は解糖系では代謝できません。したがって、脂肪酸の摂取が多いと必然的にミトコンドリアでの代謝が増えます。タンパク質が分解してできるアミノ酸の一部は糖新生に利用されます。
脂肪酸の酸化はグルコースの酸化よりも酸素消費が多く、活性酸素の産生が多く、ATP産生に時間がかかります。
神経細胞ではβ酸化の酵素の発現が低下して、脂肪酸の分解ができなくなっています。それは、脂肪酸を酸化してエネルギー源にすると、活性酸素の産生が増えて、酸化ストレスが亢進するからと考えられています。脂肪酸をエネルギー源として利用しないためにβ酸化の酵素の発現が低下しているのです。(492話参照)
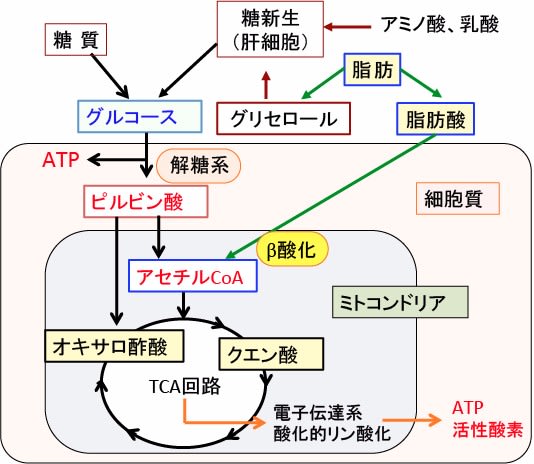
図:糖質はグルコースに分解されて細胞内に取込まれ、細胞内では細胞質の解糖系とミトコンドリアの酸化的リン酸化でATP産生と物質合成に利用される。脂肪は脂肪酸とグリセロールに分解され、脂肪酸はβ酸化でアセチルCoAに変換されたのち、TCA回路と電子伝達系でATP産生や物質合成に利用される。グリセロールや乳酸や一部のアミノ酸は糖新生に使用される。
【解糖系を阻害すると寿命が伸びる】
解糖系を阻害してグルコースの利用を低下させると、必然的に脂肪酸を分解するミトコンドリアでエネルギー産生を増やすことになります。ミトコンドリアでのATP産生は活性酸素種の産生を伴います。
「活性酸素種はDNAやタンパク質や脂質を酸化するので、細胞の老化を促進し、寿命を短縮する」と考えるかもしれませんが、実際は、ミトコンドリアで活性酸素が産生されると寿命が延びることが明らかになっています。以下のような報告があります。
Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress.(グルコース制限は、ミトコンドリアでの酸素呼吸を誘導し、酸化ストレスを増加させることにより、線虫の寿命を延ばす。)Cell Metab. 2007 Oct;6(4):280-93.
【要旨】
2型糖尿病の治療においては、細胞のグルコース摂取量の増加が基本的な考え方であるが、栄養価の高いカロリー制限は平均余命を延ばすことが明らかになっている。
グルコースの利用の増加は線虫(Caenorhabditis elegans)の寿命を短縮し、グルコース代謝の障害はミトコンドリアの酸素呼吸を亢進することにより寿命を延ばすことを明らかにした。
AMP依存性キナーゼ(AMPK)の相同体であるaak-2の機能破壊は、解糖系の阻害による寿命の延長を無効にした。一方、ヒストン脱アセチル化酵素のSir2.1は、この作用には無関係であった。
グルコースの利用可能性の低下は、活性酸素種(ROS)の産生を促進し、カタラーゼ活性を誘導し、酸化ストレス耐性および生存率を上昇させた。これは、これまでミトコンドリア・ホルミシスまたは「ミトホルミス」と呼ばれる仮想概念を直接的に証明している。
したがって、様々な抗酸化剤の投与は、寿命の延長を妨げる。
要約すると、これらのデータは、グルコース制限がミトコンドリア代謝を促進し、活性酸素種の産生を亢進し、ミトホルミシスの機序で寿命を延長することを示している。
したがって、2型糖尿病の現在の治療法および抗酸化サプリメントの広範な使用には大きな問題が指摘される。
カエノラブディティス・エレガンス (Caenorhabditis elegans) は線虫の1種で、生物学の実験に良く使われます。加齢や寿命の研究にも使われています。インスリン・シグナル伝達系が働かないと寿命が延長するという事実も、この線虫の変異体を解析して得られています。
この論文では、解糖系の阻害に2-デオキシ-D-グルコースを用いています。
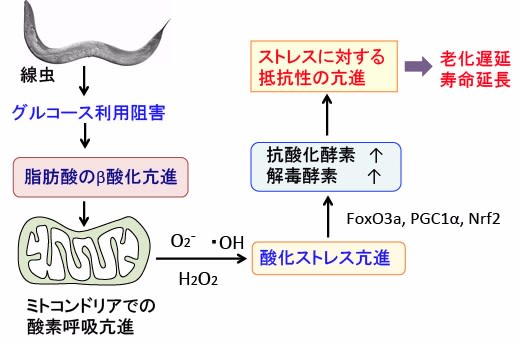
図:線虫を使った実験で、グルコースの利用を阻害すると脂肪酸のβ酸化が亢進してミトコンドリアでの酸素呼吸が亢進する。その結果、スーパーオキシド(O2-)や過酸化水素(H2O2)やヒドロキシルラジカル(・OH)などの活性酸素種の産生が増え、酸化ストレスが亢進する。酸化ストレスの亢進はFoxO3aやPGC1αやNrf2などの転写因子を活性化して抗酸化酵素や解毒酵素の発現と活性を亢進する。その結果、様々なストレスに対する抵抗性が亢進し、老化遅延と寿命延長を起こる。
2型糖尿病の治療ではインスリンを使って、グルコースの取込みを亢進して血糖を下げることが現在の糖尿病治療の基本になっています。しかし、「細胞内にグルコースの取込みを増やすことは、細胞の老化を促進し、寿命を短縮するから間違った治療法である」と、この論文の著者らは考察しています。
糖尿病の治療は、インスリンの働きを良くするか、インスリンを投与して、細胞内へのグルコースの取込みを亢進して血糖を低下させることを基本にしています。細胞がグルコースを多く取り込んで利用すると、細胞の働きが良くなると言っています。
しかし、この考え方は、抗老化の研究領域の考え方では完全に間違いです。
グルコースの利用を阻害したり、インスリンの働きを阻害すると老化が抑制されて、寿命が延びることは多くの研究で実証されています。
【グルコースはアルデヒド基を持つ】
炭水化物は、水酸基(-OH)を多数持ち、さらに、アルデヒド基(-CHO)またはケトン基(>C=O)のどちらかを持っています。アルデヒド基を持つ単糖をアルドース(ポリヒドロキシアルデヒド)といい、ケトン基を持つ単糖をケトース(ポリヒドロキシケトン)といいます。酸素原子と二重結合でつながっている炭素を末端に持つものがアルドースで、内部に持つものがケトースということになります。グルコース(ブドウ糖)はアルドース、フルクトース(果糖)はケトースになります(下図)。
分子内に遊離性のアルデヒド基やケトン基を持っていると還元性を示すので、このような糖類を還元糖と言います。「還元」というのは、他の物質から酸素を奪い、自分は酸化される性質です。この還元糖の性質があるため、グルコースやフルクトースはタンパク質やアミノ酸と反応します。

図:糖質は水酸基(-OH)を多数持ち、アルデヒド基(-CHO)かケトン基(>C=O)を持つ。アルデヒド基を持つ単糖をアルドース、ケトン基を持つ単糖をケトースと呼ぶ。グルコースはアルドースで、フルクトースはケトースになる。グルコースもフルクトースも還元性をもち、タンパク質やアミノ酸と結合する。
【糖質の摂取量が多いほど老化が促進される】
前述のように、グルコースやフルクトースは分子内に遊離性のアルデヒド基やケトン基を持っているのでタンパク質やアミノ酸と反応します。
料理で食材を加熱すると、グルコースやフルクトースのような還元糖とアミノ化合物(タンパク質やペプチドやアミノ酸)が反応して様々な物質ができます。これらの物質は料理の味や香りや色とも関係しています。この反応はアミノカルボニル反応、あるいは発見者の名前をとってメイラード(Maillard)反応と呼ばれています。
このメイラード反応は非酵素的な反応で、加熱によって短時間で進行しますが、常温でも長い時間をかけて進行します。ホットケーキを焼くと褐色になるのは、卵や牛乳のタンパク質と砂糖が反応するからです。味噌や醤油の色もメイラード反応によって生成した成分の色です。
生体内でグルコースやフルクトースなどの還元糖がタンパク質に結合する糖化反応も生体内で起こるメイラード反応です。
体内で生成した糖化タンパク質はその後分解して様々な低分子物質が生成します。これらの物質を糖化最終生成物(advanced glycation endproducts;AGE)と言います。AGE(エイ・ジー・イー)というのは糖化反応による生成物の総称で、多数の種類が知られています。このAGEという物質が、さらにタンパク質を変性させ、炎症や酸化ストレスを高めて老化を促進します。
AGEは細胞や組織の働きを障害します。すなわち、AGEは細胞外の結合組織に蓄積して結合組織のタンパク質(コラーゲンやエラスチンなど)をクロスリンク(架橋)して、弾力性を低下させます。これは血管や皮膚が硬くなる原因になります。
AGEは細胞のタンパク質も架橋して変性させます。グルコースが細胞質内の解糖系で代謝される途中の物質がタンパク質を糖化させることが知られています。糖の摂取が多くなり、細胞内での糖代謝が亢進すると細胞内のAGEも増えます。細胞膜や細胞内のタンパク質にAGEが結合すると細胞の老化が進み、働きが低下します。
さらにAGEは細胞の受容体を介して遺伝子発現に変化を及ぼします。マクロファージなどの炎症細胞や血管内皮細胞など多数の細胞に、AGEで修飾されたタンパク質が結合する複数の種類の受容体があります。
血中のAGE濃度が高くなるとアルブミンなどの血清中のタンパク質にAGEが結合します。このようなAGE修飾タンパク質がAGE受容体に結合すると細胞内のシグナル伝達系が活性化されて、増殖因子や炎症性サイトカインの産生が促進され、活性酸素の発生も増えてきます。
糖質を多く摂取すると血糖が上昇し、タンパク質の糖化やAGEの産生が増えます。
健常者でも、皮膚コラーゲン中のAGE蓄積量は加齢とともに増加し、糖尿病患者で同年齢の健常者よりもAGEの量が多いことが報告されています。
糖化によるAGEの生成・蓄積は、糖尿病における様々な組織の機能低下だけでなく、動脈硬化や認知症や骨粗鬆症や皮膚の弾力低下など、加齢に伴う多くの老化現象の根本的な原因となっています。AGEは老化促進物質であり、様々な病気を引き起こす元凶と言えます。
つまり、糖質自体に老化を促進する作用があり、タンパク質の糖化やAGEの産生を減らすこと、すなわち糖質摂取を減らすことで老化を遅らせることができると言えます。
空腹時の血液中のグルコースの濃度(血糖値)は100cc(1デシリットル)当たり80〜100mg程度です。体重60kgの人で血液は5リットル程度ですので、体内の血液中のグルコースの総量は5g程度です。これが、血液を介して全ての細胞に渡されてエネルギー産生に使用されます。5gというのは20キロカロリーですので、体のエネルギーを10分程度維持できる量です。
食事で糖質を摂取すると血糖値が上昇しますが、インスリンが直ぐに分泌されて、グルコースを肝臓や筋肉でグリコーゲンに変換したり、余ったグルコースは中性脂肪に変換して脂肪組織に貯蔵し、血中のグルコースを高い状態にしないように厳密に制御されています。これは、グルコースが基本的には生体に毒になるから必要最低限に血糖を維持する必要があるということです。
つまり、糖質はエネルギー源として有用ですが、基本的には生体にとって毒作用もあるという二面性を持っている物質なのです。
【脂肪酸のβ酸化を亢進すると寿命が延びる】
カロリー制限すると脂肪の燃焼が亢進します。このとき、カロリー制限がAMPK(AMP活性化プロテインキナーゼ)を活性化し、活性化したAMPKが脂肪酸のβ酸化を亢進するということになっています。
AMPKはエネルギー(ATP)の低下を感知して活性化され、ATP産生を増やすためにグルコースと脂肪酸の異化(分解)を促進します。糖質制限などによるインスリン/インスリン様成長因子シグナル系の抑制も脂肪酸β酸化を促進します。
β酸化(ベータさんか)とは脂肪酸を酸化して脂肪酸アシルCoA(fatty acyl-CoA; 脂肪酸と補酵素Aのチオエステル)を生成し、そこからアセチルCoAを取り出す代謝経路のことです。脂肪酸アシルCoAのβ位において段階的な酸化が行われることからβ酸化と名付けられました。
β酸化は4つの反応の繰り返しから成り、反応が一順するごとにアセチルCoAが1分子生成され、最終生産物もアセチルCoAとなります。生成されたアセチルCoAはTCA回路(クエン酸回路、クレブス回路)に送られ、酸化的リン酸化を経てATP産生に使われます。動物細胞では脂肪酸からエネルギーを取り出すための重要な代謝経路です。
脂肪酸のβ酸化はミトコンドリアで行われますが、長鎖脂肪酸はカルニチンが無いとミトコンドリアに入れませんが、中鎖脂肪酸はカルニチンの助けなしにミトコンドリアに運ばれ、β酸化で代謝されます。(下図)

さて、カロリー制限やAMPK活性化などで脂肪酸のβ酸化が亢進されますが、脂肪酸のβ酸化の亢進自体がカロリー制限と類似のメカニズムで寿命延長効果を示すことが報告されています。以下のような論文があります。
Overexpression of Fatty-Acid-β-Oxidation-Related Genes Extends the Lifespan of Drosophila melanogaster(脂肪酸β酸化に関連する遺伝子の過剰発現はショウジョウバエの寿命を延ばす)
Oxid Med Cell Longev. 2012; 2012: 854502. Published online 2012 September 11. doi: 10.1155/2012/854502
この研究グループは、ショウジョウバエの突然変異系統(ミュータント:変異体)を使って、寿命に関連する遺伝子の研究を行っています。ある遺伝子が過剰発現していることによって寿命が延長したショウジョウバエの突然変異系統を解析して、寿命延長効果のある遺伝子を幾つか発見しています。その中に、脂肪酸のβ酸化に関連する遺伝子のfatty-acid-binding protein(脂肪酸結合蛋白) と dodecenoyl-CoA delta-isomerase があったということです。
つまり、脂肪酸のβ酸化に関与する遺伝子が過剰に発現したショウジョウバエの突然変異系統は正常と比べて寿命が延びるという結果を報告しています。
コントロールの正常のハエの平均寿命が32日に対して、fatty-acid-binding proteinの遺伝子が過剰に発現しているハエの平均寿命は58日、dodecenoyl-CoA delta-isomerase遺伝子が過剰に発現しているハエの平均寿命は42日でした。
また、正常なハエでは、カロリー制限によって寿命が31.4%延長したのに対して、脂肪酸β酸化関連の遺伝子が過剰発現しているハエでは、カロリー制限による寿命延長が12%と15%と減少していました。これは、脂肪酸β酸化関連遺伝子の過剰発現による寿命延長作用のメカニズムはカロリー制限による寿命延長作用のメカニズムと共通していることを意味しています。つまり、カロリー制限を行わないでも、脂肪酸のβ酸化を促進することはカロリー制限と同じ寿命延長効果を再現できることを示しています。
ただし、カロリー制限の寿命延長効果が脂肪酸β酸化の亢進でゼロになったわけではなく、約半分に減少した程度なので、カロリー制限による寿命延長作用にはβ酸化亢進以外のメカニズムも関与していると考察しています。
さらに、酸化ストレスや飢餓に対する抵抗性が高まっていることを示しています。つまりβ酸化の亢進したハエでは、パラコートを使った酸化障害やエサを減らすことによる飢餓によって死亡する率が減少することが示されています。さらに、このような効果のメカニズムとしてFOXOシグナル伝達系が活性化されていることが示されています。
そして、この論文の結論は「脂肪酸のβ酸化に関与する遺伝子の過剰発現はカロリー制限と同じような機序で寿命を延ばし、そのメカニズムとして転写因子のFOXOの活性化の関与が示唆された」ということでした。
【FOXOとは】
長寿になるには、様々なストレスに対する抵抗性が高くなっている必要があります。医学の発達によって先進国の平均寿命は80歳を超えていますが、100歳を超えるような超高齢になるには、それなりの理由が必要です。医療や食事や生活環境の改善だけでは100歳を超えることは困難です。何らかの遺伝子的(体質的)な理由が存在します。
FOXOは様々なストレスに対する抵抗力を高める作用を担っており、カロリー制限における寿命延長や老化性疾患の抑制において重要な役割を果たしていることが知られています。
FOXOは「Forkhead box O」の略で、DNA結合ドメインFOX(Forkhead box)をもつForkheadファミリーのサブグループ“O”に属する転写因子です。哺乳類ではFOXO1,3,4,6の4種類が存在、線虫ではDaf-16、ショウジョウバエではdFOXOとそれぞれ1種類のみ存在し、栄養飢餓時に活性化される転写因子です。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質で、FOXOはストレス応答、代謝制御、細胞周期、アポトーシス、DNA修復などに関連する多くの遺伝子の発現誘導を促します。
がん抑制遺伝子としての性格ももっており、FOXOの活性化は抗がん作用があります。
FOXOはインスリン-PI3K-AKTシグナルによって負に制御されています。つまり、PI3K-AKTシグナルが活性化されるとAKTによって直接的にリン酸化され、FOXOの核外移行を促進することでその転写活性は抑制されます。
一方、栄養飢餓状態ではPI3K-AKTの不活性化に伴いFOXOの活性化が誘導されることになります。つまり、カロリー制限や糖質制限やAMPK活性化などによる寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています。
脂肪酸のβ酸化の亢進がどのようなメカニズムでFOXOを活性化するかは現時点では不明です。しかし、何らかの機序で、脂肪酸の燃焼(β酸化)の亢進はFOXOの活性化を介して寿命延長と抗がん作用を発揮する可能性が示唆されます。
【糖質摂取が多いほど死亡リスクが上昇する】
18ヶ国5大陸における「脂肪と糖質の摂取」と「心血管疾患および死亡率」の関連性を検討した前向きコホート研究の結果がランセットに報告されています。
Associations of fats and carbohydrate intake with cardiovascular disease and mortality in 18 countries from five continents (PURE): a prospective cohort study. (Lancet volume 390, No. 10107, p2050-2062, November 2017 )
主要栄養素と心血管疾患や死亡との関連性については、これまでのデータのほとんどが栄養過剰の傾向にある欧州や北米の集団からのもので、他の集団にも当てはまるか不明でした。そこで、この論文では、5大陸の18ヵ国の13万5千例以上を約7年半追跡しています。
すなわち、2003年1月1日~2013年3月31日に、高所得国(カナダ、スウェーデン、アラブ首長国連邦)、中所得国(アルゼンチン、ブラジル、チリ、中国、コロンビア、イラン、マレーシア、パレスチナ自治区、ポーランド、南アフリカ、トルコ)、低所得国(バングラデシュ、インド、パキスタン、ジンバブエ)の計18の国・地域において、35~70歳の13万5,335例を登録し、食事摂取量を食事摂取頻度調査票(FFQ)により調査した後、中央値7.4年(5.3~9.3年)追跡しました。
その結果、全死亡リスクは、炭水化物の摂取量が多いほど増加し、逆に脂質では低下することを明らかにしています。
追跡期間中に、死亡が5,796例、主要心血管イベントの発生が4,784例記録されました。炭水化物は、摂取量が多いほど全死亡リスクが高く、摂取量の少ない最低5分位群(エネルギー比中央値46.4%)に対する最高5分位群(同77.2%)のハザードリスク(HR)は1.28(95%信頼区間:1.12~1.46)でした。
一方、脂質は総脂質および種類別のいずれも、摂取量が多いほど全死亡リスクは低井という結果でした。脂肪摂取量の少ない最低5分位群に対する最高5分位群のHRは、総脂質が0.77(95%信頼区間:0.67~0.87)、飽和脂肪酸は0.86(95%信頼区間:0.76~0.99)、一価不飽和脂肪酸は0.81(95%信頼区間:0.71~0.92)、多価不飽和脂肪酸は0.80(95%信頼区間:0.71~0.89)でした。
つまり、脂肪摂取量が多く、糖質摂取量の少ないほど、死亡リスクが低下することが、大規模な疫学調査で証明されたことになります。
【カロリー制限で寿命が延びる】
食事を自由に摂取させた場合の摂取カロリー、あるいは通常の食生活で摂取されている摂取カロリーを基準にして、その摂取カロリーより30〜40%程度少ないカロリーを摂取する食事を「カロリー制限食」と言います。
タンパク質や必須脂肪酸やビタミンやミネラルの不足などの栄養失調を起こさずに、食事からの摂取カロリーを30~40%程度減らすと、老化速度が遅くなり、寿命が延びることが、酵母、線虫、昆虫、魚、げっ歯類、霊長類(アカゲザル)など多くの生物で確認されています。
マウスやアカゲザルの場合は寿命が30〜40%程度延びるくらいの顕著な効果が報告されていますが、人間ではそのような顕著な寿命延長効果が得られる可能性は低く、せいぜい10%までと言われています。
人間は医学の進歩や生活環境の改善によって、この50年の間に平均寿命が50歳代から80歳代まで延びており、寿命が延びる余地があまり無いというのが一つの理由です。寿命の延びは少ないのですが、体を若い状態に維持する効果はかなり期待できると言われています。つまり、カロリー制限は健康寿命を延ばす効果が高いと言えます。
カロリー制限で寿命が延びることが最初に報告されたのは、1935年のことです。ラットに与えるエサのカロリーを30%減らすと寿命が40%延びたという結果が報告されています。
霊長類では、米国のウィスコンシン大学の実験で、成体から開始した30%のカロリー制限ががんの発生率や死亡率を約半分に減らすことが報告されています。この研究では、7~14歳のアカゲザルを、食事摂取量を70%に制限した「カロリー制限群」と食事を制限なく自由に摂取させる「コントロール群」の2群に無作為に分けて20年間観察しています。
アカゲザルの寿命は25~30歳程度で,最長でも40歳程度と考えられています。2009年の段階で、コントロール群の生存率は50%であったのに対して、カロリー制限食群では80%が生存していました。さらに、カロリー制限食群では、糖尿病やがん、心臓血管系の疾患、脳の萎縮などの老化性疾患の発生率が3分の1程度に低下していたことが報告され、カロリー制限が老化を遅くするという結論が出されています。
論文には、コントロール群とカロリー制限食群の、それぞれ同じ27.6歳(一般的な平均寿命)の2匹の写真が掲載されていますが、明らかにカロリー制限食群のサルの方が毛並みや肉付きが良く、見た目が若々しいことが示されています。(Science 325:201-204, 2009年)
【カロリー制限はがんの発生を減らす】
カロリー制限ががん細胞の増殖を抑制することが初めて報告されたのは1909年です。この年、マウスにがんを移植する実験系で、カロリー制限ががんの増殖を抑制することが報告されています。その後も、自然発症がん、発がん物質で誘導されるがん、放射線誘導性発がんなど多くの動物実験モデルで、カロリー制限ががんの発生や増殖を抑える効果があることが報告されています。
この結果が人間に当てはまるかどうかはまだ不明ですが、カロリー制限によって、発がんに関連する様々な成長因子や増殖因子(インスリン様成長因子-1など)、ホルモン(成長ホルモンやインスリンや性ホルモンなど)、炎症性サイトカイン(TNF-αやIL-6など)の血中濃度は減少し、酸化ストレスの程度を示す指標も低下することが示されていますので、人間においてもカロリー制限ががんの発生や進展を抑制する可能性は高いと考えられています。
インスリン様成長因子-1(IGF-1)は成長ホルモンの作用によって肝臓で産生されますが、ネズミの実験では、カロリー制限でIGF-1濃度が30~40%減ることが報告されています。成長ホルモンの働かないネズミ(成長ホルモンや成長ホルモン受容体の欠損マウス)の研究では、がんの発生率が減少し、成長ホルモンが過剰に発現しているネズミは、IGF-1の濃度が上昇し、寿命が短くなり、がんの発生率が高まることが報告されています。
IGF-1の血中濃度が高いほどがんの発生率が高くなることは、乳がん、前立腺がん、大腸がんで示されています。飢餓状態になるとIGF-1の濃度が成長ホルモン欠損患者と同等レベルまで低下します。
【カロリー制限による寿命延長と抗がん作用のメカニズム】
カロリー制限による寿命延長効果や抗がん作用のメカニズムは複雑で様々な因子が関与しています。例えば、カロリー制限によって成長因子や増殖因子やインスリンが減少します。これらの因子は成長には必要ですが、成長が終了したあとは老化を促進する作用があります。
カロリー制限は、活性酸素の産生を減らし、内因性抗酸化システムを活性化して酸化ストレスを低減させ、フリーラジカルによるDNAダメージを減少する作用があります。さらに、炎症を悪化させる炎症性サイトカインの産生を低下させ、抗炎症作用とインスリン感受性を高めるアディポネクチンの産生を増やします。
生体エネルギーのATPが減少するため、AMP活性化プロテインキナーゼ(AMPK)が活性化します。このAMPKは細胞の老化やがん化を抑制する働きをします。
フリーラジカル(遊離活性基)は他の物質を酸化する性質が非常に強い物質で、細胞や組織を構成する成分を酸化してダメージを与えます。炎症性サイトカインはマクロファージなどの炎症細胞から分泌されるタンパク質で炎症を増悪させます。
アディポネクチンは脂肪細胞から分泌される善玉ホルモンのようなタンパク質で、肝臓や筋肉細胞のアディポネクチン受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。
このように様々なメカニズムを介して、カロリー制限は細胞の老化を遅くします。30~40%のカロリー制限というのは、軽度から中等度の飢餓状態であり、それに対して生体は様々な適応応答を行うために、代謝や防御機能に関与する遺伝子の発現レベルでの変化が生じるのです。
カロリー制限ではサーチュインというタンパク質が増えてきます。サーチュインは染色体のある領域に含まれる遺伝子群を一斉に転写させなくする、つまり不活性にする働きがあるタンパク質です。遺伝子の発現が起こらなくすることを「サイレンシング」と言いますが、サーチュインは老化を起こす遺伝子領域をサイレンシングすることによって老化を止める働きをするのです。
哺乳類ではサーチュイン遺伝子は幾つかの種類がありますが、そのうちSIRT1という遺伝子は絶食やカロリー制限によって、種々の組織において発現が上昇することが判っています。寿命延長やがん予防の効果を期待して、SIRT1遺伝子を活性化する医薬品の開発が注目されています。
【断食するとストレスに対する抵抗力が高まる】
断食というのは、一定期間すべての食物または特定の食物の摂取を断つことです。絶食というのは生物にとっては生きるか死ぬかの強いストレスになるので、体は最大の防衛モードに入ります。日頃細胞分裂を行っている細胞も一時的に増殖を止めるか分裂速度を低下させ、様々なストレスや毒物に対する抵抗性を高めるタンパク質の合成を促進させます。
すなわち、絶食を行うと、物質を合成する同化作用や細胞分裂させる作用をもったホルモンや増殖因子(インスリンやインスリン様成長因子など)は減少し、ストレスに対する抵抗力を高める遺伝子の発現は増加します。
酵母の実験では活性酸素や抗がん剤に対する抵抗性は、栄養飢餓(絶食)によって10倍以上に高まることが報告されています。
絶食はインスリンやインスリン様成長因子-1(IGF-1)の発現を低下させます。マウスの実験で、72時間の絶食で血中のIGF-1濃度が70%低下し、IGF-1の活性を阻害するIGF結合タンパク質-1 (IGFBP-1)の濃度は11倍に増加しました。IGF-1の血中濃度が70から80%減少したマウスでは、抗がん剤などによる細胞毒性に対して抵抗性を示しました。
成長ホルモン/IGF-1シグナル伝達系の阻害は、ストレス抵抗性を高め、寿命延長作用を示すことが多くの実験モデルで示されています。IGF-1シグナル伝達系が欠損している動物は寿命が長く、ストレスに対する抵抗性が高いことが報告されています。
つまり、絶食やカロリー制限はインスリンやIGF-1シグナル伝達系の抑制によってストレス抵抗性が増し、寿命を延ばすメカニズムが作動するのです。
前述のように、栄養飢餓時にFOXOという転写因子が活性化されます。FOXOは酸化ストレスや飢餓ストレスに対する抵抗力を高める作用があり、栄養飢餓を乗り越えるために進化の過程で獲得したメカニズムです。
FOXOの転写因子活性は、成長ホルモン/インスリン/インスリン様成長因子-1(IGF-1)のシグナル伝達系によって抑制されます。絶食はこの成長ホルモン/インスリン/IGF-1シグナル伝達系を抑制し、FOXOの転写因子活性を高めることによって、ストレスに対する抵抗性を高めます。
食糧が少なくなったとき単に寿命を延ばすだけでなく、食糧が得られるとき生殖活動を再開することが目的であるため、若々しく保つ(老化を抑制する)ことも重要です。すなわち、カロリー制限や間歇的な断食は寿命を延ばすだけでなく、体を若々しくする効果もあることになります。
【ケトン食はミトホルミシスのメカニズムで健康を高める】
最近の論文で以下のような総説があります。
Nutritional Ketosis and Mitohormesis: Potential Implications for Mitochondrial Function and Human Health(栄養性ケトーシスとミトホルミシス:ミトコンドリア機能とヒトにおける健康との関連の可能性)J Nutr Metab. 2018; 2018: 5157645.
【要旨】
ミトコンドリア機能の障害は、しばしば活性酸素種の過剰産生をもたらし、心血管疾患、糖尿病、神経変性障害、がんを含む多くの慢性疾患の病因に関与する。
しかしながら、ミトコンドリアの活性酸素種の適度なレベルの産生は、ミトコンドリア機能と、内因性抗酸化防御システムを高めることによって、慢性疾患の発症を阻止することができる。
ミトホルミシス(mitohormesis)と呼ばれるこの現象は、ミトコンドリアにおける酸素呼吸の増大によって誘発され、ミトコンドリア酸素呼吸は食餌または運動によって高めることができる。
栄養性ケトン症(Nutritional ketosis)は、糖質が少なく、タンパク質が中等度の高脂肪食によるケトン食によって誘導される安全かつ生理的な代謝状態である。 このような食事は、ミトコンドリア呼吸への依存を高め、したがって、ミトホルミスを誘発し得る。
さらに、食事性ケトーシスでは、絶食時ほどのレベルには達しないが、ケトン体のβヒドロキシ酪酸の濃度は上昇する。β-ヒドロキシ酪酸は、エネルギー源としての役割に加えて、シグナル伝達分子としても働く。
βヒドロキシ酪酸によるシグナル伝達は、ミトホルミスと同様の適応を誘導するので、単なる糖質制限よりも、食事性ケトーシスの潜在的利益は大きい。
この総説では、栄養性ケトーシスによって引き起こされるミトコンドリア機能および内因性抗酸化防御システムの強化を支持する証拠を示し、そのメカニズムについて考察している。
体には、軽度なストレスを受けると、そのストレスを排除するために細胞内システムが活性化して、そのストレスに対する抵抗力を高めるようになるという仕組みがあります。
生物に対して通常有害な作用を示すものが、微量であれば逆に刺激作用を示す有益な作用になるという現象で、こうした生理的刺激作用を「ホルミシス(Hormesis)」と言います。
ミトホルミシス(Mitohormesis)というのは「ミトコンドリアをターゲットにしたホルミシス効果」という意味です。

図:生物に対して通常有害な作用を示す刺激が、微量であれば逆に有益な作用(ストレス抵抗性の亢進)になるという現象を「ホルミシス(Hormesis)」と言う(①)。活性酸素は大量に発生すると細胞膜やDNAの酸化傷害から増殖抑制や細胞死誘導などの細胞傷害作用をしめす(②)。しかし、適度な活性酸素の産生は、転写因子のNrf2の活性化を介するホルミシス効果によって、抗酸化システムの亢進やストレス抵抗性の亢進を誘導する(③)。
例えば、ミトコンドリアでの活性酸素の産生が高まると、細胞内の抗酸化力が高まるので、ストレスに対する抵抗力が高まって寿命が延びるという考えです。
カロリー制限や適度な運動、2-デオキシ-D-グルコース(2-DG)、メトホルミン、レスベラトロールはミトコンドリアでの呼吸活性を上昇させ、活性酸素種の発生が増えます。その結果、細胞は転写因子のFox03aやPGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)やNfr2の活性を高め、抗酸化酵素酵素や解毒酵素の発現を高め、ストレス抵抗性を高め、加齢関連疾患の発症を抑制し、寿命を延ばす作用を発揮します。
全ての細胞は生命活動を維持するエネルギーとしてATPが必要です。ATPの多くはミトコンドリアで産生されます。
多くの慢性変性性疾患の病因にミトコンドリアの機能不全が関与しています。このような疾患としては肥満、心血管疾患、がん、糖尿病、ザルコペニア、神経変性疾患などが含まれます。
ミトコンドリア機能異常と疾患との関連においては、ミトコンドリアにおける活性酸素産生が関与しています。
活性酸素の産生は過剰であれば有害ですが、通常の適度な活性酸素の産生は、細胞の増殖や分化や免疫系などの生理的機能を刺激し促進します。
活性酸素の産生に適応するメカニズムがミトホルミシスです。
このミトホルミシスの機序を利用してミトコンドリアを鍛える(機能を高める)と、慢性疾患や変性性疾患に対する適応能力を高め、病気の治療に有効です。
ケトン食は、ケトン体産生と脂肪酸酸化を促進し、ミトコンドリア機能を高めます。
ケトン食の健康作用の研究は多いのですが、ミトコンドリア機能や酸化ストレスの観点からの研究は少ないようです。基本的にケトン食は脂肪酸の酸化を亢進します。その結果、ミトコンドリアの機能を亢進し、活性酸素の産生を高めます。
ケトン食はミトホルミシスの機序によってミトコンドリア機能を高め、酸化ストレスに対する抵抗力を高め、人間の健康寿命を延ばすことができます。
慢性疾患を予防し治療する上で、生活習慣の改善は、費用がかからず、より全人的な健康を達成できます。
ケトン食による病気の治療は100年以上の歴史があります。この15年間くらいは、さらにケト適応(keto-adaptation)と健康との関連が明らかになっています。
てんかんや神経変性疾患やがんの治療などでは厳密なケトン食が実施されていますが、体重減少、メタボリック症候群、2型糖尿病などの治療において、あるいは老化やがんの予防においては、糖質やタンパク質の厳しい制限を伴う厳密なケトン食は必要なく、よりマイルドなケトン食でも十分な効果が得られます。
マイルドなケトン食の場合の目安は、糖質は1日50g以下、タンパクは1日1.5g/kgです。βヒドロキシ酪酸の濃度は通常は0.3mM以下ですが、このマイルドなケトン食では0.5〜3mMを目標にします。長期間の絶食では5〜10mMに達します。
最近、断食やカロリー制限や超低糖質食の健康作用が注目されています。このような食事法で共通しているのが、脂肪の燃焼とケトン体の産生増加です。絶食や糖質の少ない食事を行うと体脂肪が燃焼してケトン体が増えます。このケトン体はブドウ糖の代わりになるエネルギー源として働きます。しかし、ケトン体は単なるエネルギー源としての働きだけでなく、様々な生理作用が明らかになっています。そして、ケトン体を増やす食事療法が、多くの病気の予防や治療や抗老化や寿命延長に役立つことが明らかになってきたのです。
| « 604)がんの『... | 606)乳酸はが... » |




