がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
500) DHA/EPAはAMPKを活性化してmTORC1を阻害する
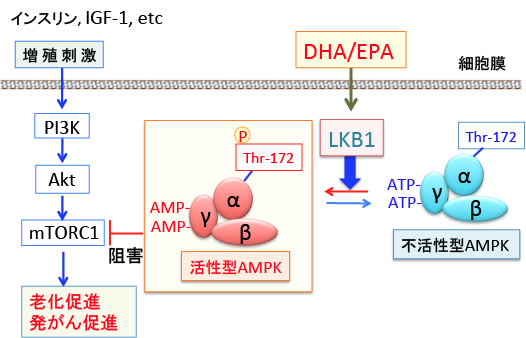
図:インスリンやインスリン様成長因子-1(IGF-1)などの増殖刺激はPI3K/Akt/mTORC1経路を活性化して老化と発がんを促進する作用がある。AMP活性化プロテインキナーゼ(AMPK)はα, β, γの3つのサブユニットからなるヘテロ三量体で、ATPが減少してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置換する。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がLKB1によってリン酸化されると、さらにAMPKの活性が高まる。活性化したAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を阻害し、がん細胞の増殖を抑制する。オメガ3系多価不飽和脂肪酸のDHA(ドコサヘキサエン酸)とEPA(エコサペンタエン酸)はLKB1の活性を亢進してAMPKを活性化し、mTORC1を抑制することが報告されている。すなわち、DHA/EPAは老化予防とがん予防効果を発揮する。
500) DHA/EPAはAMPKを活性化してmTORC1を阻害する
【LKB1はがん抑制遺伝子】
オメガ3系不飽和脂肪酸のドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)が、がん細胞のワールブルグ効果(がん細胞は酸素が十分に存在しても酸素を使わない解糖系でのエネルギー産生が亢進し、ミトコンドリアの酸化的リン酸化が抑制されている)を抑制する効果が報告されています。そのメカニズムの理解を助けるために、まずLKB1とAMPKというたんぱく質を解説します。
ポイツ・ジェガース症候群(Peutz-Jeghers syndrome)という遺伝性疾患があります。食道を除く消化管に多数のポリープを生じ、口唇、口腔粘膜、手掌、足底に特有な色素斑をみとめます。
ポリープの分布は小腸に多く、大腸には少なく、小腸ポリープが腸重積症の原因となり、イレウスや腹痛をきっかけに診断されることがしばしばあります。長期的にみると、この病気はがんの危険性が高く、特に大腸がんの発生が多くみられます。肺や卵巣や子宮など他の臓器のがんも認められます。
10万人に一人くらいの発症率で、常染色体性優性の遺伝形式をとり、原因遺伝子は19番染色体短腕にあるLKB1遺伝子です。
LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化します。
AMPKは細胞のエネルギー代謝を調節する因子として重要な役割を担っています。
AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化されます。
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。
γサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。
その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます。
リン酸化されたAMPKはmTORC1を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制します。
つまり、LKB1はAMPKを活性化する作用によってがん細胞の増殖を抑制する作用があるがん抑制遺伝子になります。(下図)

図:AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っている(1)。AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇しAMP/ATP比が上昇するようなストレスに応答して活性化される(2)。AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する(3)。γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる(4)。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される(5)。 LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化する。リン酸化されたAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制する(6)。
【オメガ3系多価不飽和脂肪酸はLKB1を活性化する】
DHA(ドコサヘキサエン酸)やEPA(エイコサペンタエン酸)のようなオメガ3系多価不飽和脂肪酸がLKB1を活性化して、解糖系酵素とmTORシグナル伝達系を阻害するという報告があります。以下のような論文があります。
Omega-3 polyunsaturated fatty acid promotes the inhibition of glycolytic enzymes and mTOR signaling by regulating the tumor suppressor LKB1.(オメガ3系多価不飽和脂肪酸はがん抑制遺伝子のLKB1の制御を介して、解糖系酵素とmTORシグナル伝達系の阻害を促進する)Cancer Biol Ther. 2013 Nov 1; 14(11): 1050–1058.
【要旨】
オメガ3系多価不飽和脂肪酸は、炎症性疾患や心血管系疾患や悪性腫瘍の治療に有効な脂質として知られている。食事からのオメガ3系多価不飽和脂肪酸の摂取量の多い人は、がんを含めて代謝系疾患の発症頻度が低いことが報告されている。
これらの疾患の予防や治療においてオメガ3系多価不飽和脂肪酸の有効性は良く認識されているが、その作用機序については十分に明らかになっていない。
この研究では、オメガ3系多価不飽和脂肪酸のドコサヘキサエン酸(DHA)ががん抑制遺伝子のLKB1の作用を亢進することを明らかにした。
LKB1遺伝子を発現している細胞にDHAを投与すると、LKB1活性が亢進し、AMP活性化プロテインキナーゼ(AMPK)のリン酸化を引き起こし、mTORシグナル伝達系を阻害した。
乳がん細胞MCF-7細胞をsiRNA(干渉RNA)でLKB1発現を阻止すると、DHAのAMPKの活性化とmTORシグナル伝達系阻害作用は見られなかった。
さらに、LKB1遺伝子を発現している細胞では、DHA投与によって細胞内代謝系が変化しATP量は減少した。
さらに重要な点は、LKB1を発現している上皮性細胞において、DHA投与によって細胞の解糖系酵素の発現が低下して解糖の活性が低下した。
その結果、細胞機能においては、これらの細胞の移動能が低下した。
全体的に、今回の研究結果は、オメガ3系多価不飽和脂肪酸がLKB1活性を亢進し、細胞の代謝を制御していることを明らかにした最初の発見である。
この論文の研究結果は、がん抑制遺伝子のLKB1の活性化とAMPKの活性化を介して、がん細胞のワールブルグ効果の是正にDHAやEPAは役立つことを示唆しています。
オメガ3系多価不飽和脂肪酸の健康作用や抗がん作用はすでに数多く報告されています。(351話参照)
オメガ6系不飽和脂肪酸(リノール酸)はコーン油などの植物性の油に多く、オメガ3系のDHAとEPAは魚の油、αリノレン酸は亜麻仁油とエゴマ油(シソ油)に多く含まれます。
食事から摂取する不飽和脂肪酸のオメガ3/オメガ6の比を大きくするほど、がんの発生予防や増殖抑制に有効であることが多くの報告で示されています。
魚油の摂取の多い人は乳がんや前立腺がんや大腸がんなど多くの種類のがんの発生率が低いことが疫学的研究で明らかになっています。
DHAとEPAの抗がん作用のメカニズムは多様です。
オメガ6系多価不飽和脂肪酸のアラキドンサンはプロスタグランジンE2やロイコトリエンなど炎症性メディエーターを産生して炎症や組織のダメージを悪化させ、がん細胞の増殖を促進する作用を持ちます。
一方、食事から摂取したDHAやEPAは細胞膜に取り込まれ、細胞膜脂質二重層中のアラキドン酸と入れ替わるので、DHAやEPAの摂取が多いと炎症やがんの抑制効果が得られます。(下図)

図:オメガ6系多価不飽和脂肪酸のアラキドンサンはプロスタグランジンE2やロイコトリエンなど炎症性メディエーターを産生して炎症や組織のダメージを悪化させ、がん細胞の増殖を促進する作用を持つ。一方、ω3系(n-3系)多価不飽和脂肪酸であるEPA(エイコサペンタエン酸)とDHA(ドコサヘキサエン酸)は代謝されて抗炎症作用を示す多様な脂質メディエーターを産生することによって、慢性炎症や組織のダメージを軽減する効果や、がん細胞の増殖を抑える効果を発揮する。この抗炎症作用や組織保護作用は抗がん剤や放射線治療による正常組織のダメージの軽減や悪液質の改善にも役立つ。食事から摂取したDHAやEPAは細胞膜に取り込まれ、細胞膜脂質二重層中のアラキドン酸と入れ替わるので、DHAやEPAの摂取が多いと炎症やがんの抑制効果が得られる。
この論文では、DHA/EPAが、がん抑制遺伝子のLKB1の活性を高めて、AMPKの活性を高め、解糖系酵素(ヘキソキナーゼ-2や乳酸脱水素酵素)の発現を抑制し、mTORシグナル伝達系を抑制して、抗がん作用を示すという新しいメカニズムが提唱されています。この作用はがん細胞のワールブルグ効果を是正するという作用機序です。
慢性炎症は老化と発がん過程を促進します。DHA/EPAは抗炎症作用や細胞保護作用など様々なメカニズムによって老化と発がんを抑制する効果を発揮します。
【哺乳類ラパマイシン標的蛋白質(mTOR)は細胞増殖を促進する】
LKB1がAMPKを活性化し、活性化したAMPKがmTORC1を阻害するので、単純に考えれば、LKB1の活性化は抗がん作用につながります。しかし、実際は、がん細胞ではこのシグナル伝達系の様々なレベルで遺伝子変異が起こっているので、思うようにはいきません。
それに対して戦略を立てるには、まず細胞内シグナル伝達系のPI3K/Akt/mTORC1経路とLKB1/AMPK経路を理解する必要があります。
ラパマイシン(Rapamycin)という薬があります。シロリムス(Sirolimus)という別名で呼ばれることもあります。
これは臓器移植の際の拒絶反応を防ぐために使用される薬ですが、このラパマイシンに寿命延長効果と抗がん作用が明らかになったことから、ラパマイシンの生体内のターゲット分子である哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin)、略してmTOR(エムトール)という蛋白質が注目されています。
ラパマイシンは1970年代にイースター島(モアイ像で有名な南太平洋の島)の土壌から発見されたStreptomyces hygroscopicsという放線菌の一種が産生する有機化合物です。
イースター島はポリネシア語で「ラパ・ヌイ(Rapa Nui)」と言い、この「ラパ」と「菌類が合成する抗生物質」を意味する接尾語の「マイシン」とを組み合わせて「ラパマイシン」と名付けられています。
ラパマイシンの薬効としては、臓器移植の拒絶反応を防ぐ作用の他に、抗がん作用や寿命延長効果が知られています。
寿命を延ばす方法として現時点で最も確実なのがカロリー制限です。カロリー制限とは、栄養障害(ビタミンやミネラルやタンパク質の不足)を起こさずに食事からの摂取カロリーを30~40%程度減らす食事を行うことで、カロリー制限には老化を遅延して寿命を延ばし、がんを含めて老化関連疾患の発症を抑制する効果が認められています。
このカロリー制限による老化過程の遅延と寿命延長とがん抑制に最も重要な因子がmTORです。
つまり、mTORの働きを抑制すると老化を抑制し寿命を延ばすことができます。
ラパマイシン自体に抗がん作用が報告されていますが、ラパマイシンの構造を改変した物質(ラパマイシン誘導体)が抗がん剤として開発されて、すでに幾つかの薬が臨床で使用されています。
このようなラパマイシンの多彩な薬効は、細胞の増殖やエネルギー産生に重要な役割を担っている細胞内蛋白質に作用することによって発揮されますが、このラパマイシンがターゲットにする蛋白質がmTORという蛋白質なのです。
【mTORはセリン・スレオニンキナーゼ】
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼ(タンパク質のセリンやスレオニンをリン酸化する酵素)です。細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。
初め、酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログ(相同体)が見出されてmTOR(哺乳類ラパマイシン標的タンパク質)と命名されました。
mTORにはmTOR複合体1((mammalian target of rapamycin complex 1:mTORC1)とmTOR複合体2(mammalian target of rapamycin complex 2:mTOR2)の2種類があります。
mTORに幾つかの他のタンパク質が結合して複合体を形成しますが、結合しているタンパク質の違いで2種類の複合体ができ、異なる機能を担っています。(下図)

図:mTOR(哺乳類ラパマイシン標的タンパク質)は2種類の複合体(mTORC1とmTORC2)として存在する。mTORC1とmTORC2はそれぞれ異なる蛋白質と複合体を形成し、それぞれ異なる機能をもつ。ここに記載されているエフェクタータンパク質は一部であり、もっと多くのタンパク質が関与している。まだ十分に解明されていない部分も多い。 例えば、mTORC1はタンパク質翻訳を抑制する4E-BPをリン酸化してその機能を抑制する。また、リボソームの生合成を促進するS6Kをリン酸化して活性化する。これらの作用によってmTORC1は蛋白質合成を促進する。その他、多くの標的タンパク質をリン酸化することによって細胞内のタンパク質合成を促進することによって細胞の増殖や物質代謝を制御する。また、細胞内小器官の消化・再利用に重要なオートファジーを抑制する作用や、低酸素誘導因子-1(HIF-1)を活性化して解糖系を亢進する作用、脂質合成を亢進する作用などもある。このように、mTORC1は栄養素の供給状況や増殖刺激や細胞内のエネルギーの状況などに対するセンサーとして作用し、細胞内の物質代謝やエネルギー産生を調節する中心的な役割を担っている。一方、mTORC2は細胞骨格やシグナル伝達の制御などに関与している。mTORC2はS6K1とAKTの活性化を介して、細胞の寿命を延長するFOXO3aを抑制する作用がある。ラパマイシンはFKBP12と結合し、mTORとraptorの相互作用を阻害することによってmTORC1の活性を阻害する。
【mTORC1は増殖刺激によって活性化される】
mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御をしています。
インスリンやインスリン様成長因子やロイシンによって活性化されるのはmTORC1の方です。ラパマイシンで阻害されるのもmTORC1の方です。
mTORC1は、糖やアミノ酸などの栄養素の状況、エネルギー状態、成長因子(増殖因子)などによる情報を統合し、エネルギー産生や細胞分裂や生存などを調節しています。
細胞の増殖というのは、栄養とエネルギーが利用できる状態にあるときに、新たな細胞構成成分(タンパク質、核酸、脂質など)を合成して、細胞の数を増やす生化学的プロセスのことです。
したがって、増殖するためには、細胞を新たに作る材料(栄養素)とエネルギー(糖質や脂質を分解して得られるATP)が必要です。
増殖因子や成長因子やホルモンなどによって細胞増殖の指令(シグナル)が来たときに、栄養素とエネルギーの供給が十分にあることを判断し、タンパク質や脂質の合成を促進して細胞増殖を実行するスイッチを入れるのがmTORC1です。
栄養摂取やインスリン、成長ホルモン、IGF-1、サイトカインなどの増殖刺激が細胞に作用すると、それらの受容体などを介してPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAkt(別名:Protein Kinase B)というセリン・スレオニンリン酸化酵素をリン酸化して活性化します。活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。このAktのターゲットの一つがmTORC1というわけです。
Aktによってリン酸化(活性化)されたmTORC1は細胞分裂や細胞死や血管新生やエネルギー産生などに作用してがん細胞の増殖を促進します(下図)。

図:栄養摂取やインスリン、インスリン様成長因子-1(IGF-1)、サイトカインなどの増殖刺激が細胞に作用すると、PI3Kが活性化され、その下流に位置するAktの活性化、mTORC1の活性化と増殖シグナルが伝達される。mTORC1は栄養素の取込みやエネルギー産生、細胞分裂・増殖、細胞生存、抗がん剤抵抗性、血管新生を亢進し、オートファジー(自食作用)を抑制するので、mTORC1の活性化はがん細胞の発生や増殖や転移を促進する方向で働く。ラパマイシンはmTORC1の活性を直接阻害することによって抗がん作用を発揮する。
この経路をPI3K/Akt/mTORC1経路と言い、がん細胞や肉腫細胞の増殖を促進するメカニズムとして極めて重要であることが知られています。すなわち、PI3K/Akt/mTORC1経路の阻害はがん細胞や肉腫細胞の増殖を抑制し、細胞死(アポトーシス)を誘導することができるため、がん治療のターゲットとして注目されています。
PI3K/Akt/mTORC1経路の阻害は、抗がん剤や放射線治療の効き目を高める効果や、血管新生を阻害することによってがん細胞の増殖を抑制する効果も報告されています。
低酸素誘導因子-1(HIF-1)はmTORC1によって活性化されるため、ラパマイシンはHIF-1の活性を阻害することによってがん細胞の代謝異常(解糖系亢進)を正常化する作用があります。
mTOR阻害剤は免疫抑制という欠点を持ちますが、がん細胞や肉腫細胞の多くにおいてmTORが活性化されているため、抗がん剤として有効性が高く、すでに幾つかのmTOR阻害剤が開発され、抗がん剤として使用されています。(免疫に関しては単純な免疫抑制ではなく、記憶キラーT細胞の数を増やすなど抗腫瘍免疫にはプラスに働く面も報告されています。)
前述のようにカロリー制限による老化過程の遅延と寿命延長とがん抑制に最も重要な因子がmTORC1です。mTORC1は老化と発がんを促進しますが、カロリー制限は栄養素やエネルギーの供給が低下するのでmTORC1活性が抑制され、その結果、老化を抑制し寿命を延ばすことができると考えられています。
【がん細胞では細胞内シグナル伝達系に異常が多発している】
mTORC1の活性の制御には、多数の抑制因子(AMPKやTSC1/TSC2など)や促進因子(インスリン、インスリン様成長因子-1、Akt、アミノ酸など)が関わっています。
これらの制御系や細胞内のシグナル伝達系が正常に働いていれば、メトホルミンやDHA(ドコサヘキサエン酸)やEPA(エイコサペンタエン酸)などでAMPKを活性化すればmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)は抑制できます。
糖質摂取の制限やケトン食によってインスリン/インスリン様成長因子-1のシグナル伝達系を抑制してもmTORC1の抑制に効果があります。
しかし、がん細胞の場合は、このようなシグナル伝達系の上流で阻止する薬を使っても必ずしもうまくいきません。それは、このシグナル伝達系の至る所で異常が起きているからです。
メトホルミンでAMPKを活性化しても、AMPKとmTORC1との間に存在するタンパク質(TSC1/TSC2やRheb)が異常を起こしていればmTORC1は抑制できません。インスリンの分泌を減らしても、PI3KやAktが遺伝子異常で恒常的に活性化しておればmTORC1の抑制はできません。
実際に、がん細胞ではAkt遺伝子の増幅(数が増えていること)や、PI3KやAktやmTORC1の活性を抑制するがん抑制遺伝子(PTENやTSC1/TSC2など)の遺伝子変異など、PI3K/Akt/mTORC1/HIF-1シグナル伝達系の至るところで異常が起こっていることが明らかになっています。
グルコースの取込みや解糖系の阻害は、エネルギー産生と物質合成を直接的に阻害するので、PI3K/Akt/mTOR/HIF-1シグナル伝達系の異常があっても効果は期待できますが、抗腫瘍効果は減弱します。
そこで遺伝子異常が高度に生じている進行がんの治療の場合は、mTORC1を直接阻害する薬が必要になります。メトホルミンやケトン食や解糖系の阻害(2-デオキシグルコースなど)でがん細胞の増殖が十分に抑制できない場合は、mTORC1に直接的に作用する薬(ラパマイシンやその誘導体)の併用が有効と言えます(図)。(メトホルミンはAMPKの活性化を介する機序以外に、mTORC1を直接阻害するという報告もあります)

図:栄養摂取やインスリン、成長ホルモン、インスリン様成長因子-1(IGF-1)などの増殖刺激が細胞に作用すると、それらの受容体などを介してPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化する。活性化したAktは細胞内のシグナル伝達に関与する様々な蛋白質(mTORC1など)の活性を制御することによって細胞の増殖や生存(死)の調節を行う。正常細胞では、栄養摂取の制限やメトホルミンでmTORC1の阻害ができる。しかし、がん細胞では、PI3K/Akt/mTORC1シグナル伝達系に関与する様々なタンパク質の遺伝子変異などによってAktやmTORC1は恒常的に活性化しており、さらに、AMPKとmTORC1の間のシグナル伝達に関与するTSC1/TSC2やRheb(Ras homolog enriched in brain)に変異があるとメトホルミンでAMPKを活性化してもmTORC1を抑制できない。このような場合はラパマイシンやラパマイシン誘導体によるmTORC1の直接阻害が有効になる。(メトホルミンはAMPKを介してmTORC1活性を抑制するルート以外に、mTORC1を直接阻害する作用があるという報告もある)
【TSC1/TSC2の変異があるとmTORC1が活性化されてがんが発生する】
結節性硬化症(tuberous sclerosis)は、皮膚の血管線維腫や腎臓の血管筋脂肪腫や肺のリンパ脈管平滑筋腫症などの腫瘍性病変や、脳の機能障害(てんかん、知的障害、自閉症など)を合併する疾患です。
その原因遺伝子がTSC1とTSC2です。TSC1は9番染色体に存在し、TSC2は16番染色体に存在します。TSCはtuberous sclerosis complex(結節性硬化症複合体)の略です。
遺伝子がコードするタンパクは、TSC1がハマルチン(hamartin)、TSC2がチュベリン(tuberin)で、両因子は互いに結合して複合体を形成し、mTORC1の上流に位置して、mTORC1の活性を抑制する働きがあります。
したがって、TSC1/TSC2の遺伝子変異などによってハマルチン-チュベリン複合体の機能が障害されるとmTORC1が活性化され、HIF-1が活性化され、血管内皮細胞増殖因子(VEGF)の発現が誘導され、血管増生が高度な腫瘍が発生します。
mTORC1によるHIF-1αの発現亢進は3つのメカニズムによって引き起こされます。
① mTORC1はSTAT3 (Signal Tranducer and Activator of Transcription-3:シグナル伝達兼転写活性化因子-3) の転写を亢進し、STAT3がHIF-1αの遺伝子転写を促進する
② mTORC1はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1αタンパク質の産生を増やす。
③ 真核生物翻訳開始因子4E(eIF4E)はmRNAのたんぱく質への翻訳を開始させる。リン酸化されていない4E-BP1(eIF4E結合たんぱく質1)はeIF4Eに結合することによってたんぱく質の翻訳を阻止する。mTORC1が4E-BP1をリン酸化すると、eIF4Eの機能が回復するので、たんぱく質合成が促進される。

図:インスリンやインスリン様成長因子-1(IGF-1)や上皮成長因子(EGF)や血小板由来増殖因子(PDGF)などの増殖因子や、インターロイキンやサイトカイン類がmTORC1とJAK2を活性化し、STAT3を相乗的に活性化する。STAT3は低酸素誘導因子-1α(HIF-1α)の転写を亢進する。mTORC1は翻訳を阻害する4E-BP1の発現を阻害し、たんぱく合成を促進するS6K1の発現を亢進することによってHIF-1αのたんぱく質量を増やす。STAT3とHIF-1αはVEGF(血管内皮増殖因子)の遺伝子発現を亢進し、mTORC1はeIF4Eを介してVEGFのたんぱく質合成を亢進する。その結果、血管新生が亢進する。(参考:Oncoscience. 2015; 2(11): 913–914.)
mTORC1はSer727をリン酸化することによってSTAT3の転写活性を高めます。さらに、様々なサイトカインや増殖因子は、受容体チロシンキナーゼのJAK2を介する機序で、STAT3を活性化します。
多くのがん細胞で、JAK2/STAT3シグナル伝達系とmTORC1シグナル伝達系の両方の活性が亢進しており、この異常はHIF-1αの活性亢進に収束しています。
がん細胞の増殖はmTORC1とHIFとVEGFに高度に依存的です。
mTORC1とVEGFをターゲットにした治療薬はありますが、HIFを直接ターゲットにした薬はまだありません。
血管新生阻害に関しては、mTORC1阻害剤とVEGF受容体阻害剤が使用されています。
HIFのすぐ上流に位置するSTAT3の阻害はHIF阻害のターゲットとして有用です。
血管の豊富な腫瘍の治療薬としてSTAT3阻害剤は有効性が期待できます。
STAT3阻害剤としてはオーラノフィン、ジインドリルメタン、セレコキシブが使用できます。(427話、428話参照)
HIF-1活性の阻害にはラパマイシン、メラトニン、ベザフィブラートなどが使用できます。(487話参照)
ジインドリルメタン、シリマリン、ジクロロ酢酸もHIF-1活性の阻害作用が報告されています。(364話参照)
さらにAMPKを活性化するメトホルミン、DHA/EPA、ケトン食などの組合せも有効です。
VEGFやIL-6の発現を抑制するサリドマイドも有効です。
ラパマイシン(mTORC1阻害)、オーラノフィン(IL-6/STAT3阻害)、セレコキシブ(COX-2阻害+IL-6/STAT3阻害)、ジインドリルメタン(STAT3阻害+HIF-1阻害)、ベザフィブラート(PPARの汎アゴニスト)、フェノフィブラート(PPARα選択的アゴニスト)、メラトニン、DHA/EPA、サリドマイドなどの組合せは、がん細胞におけるワールブルグ効果を引き起こす最大の因子であるmTORC1と低酸素誘導因子-1(HIF-1)の発現と活性を阻害することによって、がん細胞の増殖を抑制できると思います。
このような複数のメカニズムを組み合せて、がん細胞のmTORC1/HIF-1/VEGF系を抑えるとがん細胞の増殖の抑制に有効と思われます。
魚の脂に多く含まれるドコサヘキサンエン酸(DHA)とエイコサペンタンエン酸(EPA)はmTORC1/HIF-1シグナルの抑制、抗炎症作用、抗酸化作用など多様なメカニズムで抗老化、がん予防、寿命延長の効果が期待できます。
サプリメントや脂ののった魚で1日数グラムのDHA/EPAを摂取することは有用だと思います。マグロの大トロは100グラムで5グラム程度のDHA/EPAを摂取できます。他の脂ののった魚も100グラム当たり1〜4グラム程度のDHA/EPAを摂取できます(423話参照)。
AMPKの活性化はがん予防や抗老化に有効なので、運動やカロリー制限にDHA/EPAの多い食事は抗老化とがん予防に効果が期待できます。
【培養した微細藻類由来DHAが注目されている】
がんや認知症や循環器疾患の予防や治療にDHAやEPAが有効であることは確立しています。従って、DHAやEPAの多い脂の乗った魚を多く食べることが推奨されています。しかし、魚のメチル水銀やマイクロプラスチックなど海洋汚染に由来する有害物質の魚への蓄積の問題が、魚食を安易に推奨できない事態になっています。
メチル水銀は毒性が強く、血液により脳に運ばれ、やがて人体に著しい障害を与えます。母親が妊娠中にメチル水銀を体内に取り込んだことにより、胎児の脳に障害を与えることもあります。
魚は自然界に存在する水銀を食物連鎖の過程で体内に蓄積するため、日本人の水銀摂取の80%以上が魚介類由来となっています。魚摂取が増えるとメチル水銀の体内摂取が増え、胎児の脳の発育に悪影響を及ぼすことが明らかになり、厚生労働省は平成15年(2003年)に妊婦の魚摂取に関する注意事項を公表しています。つまり、妊婦や小児は魚を多く食べてはいけないと言っています。
海洋でDHAとEPAを作っている微細藻類を培養して、培養した微細藻類からDHAとEPAを取り出せば、汚染物質がフリーのDHA/EPAを製造できます。閉鎖環境での培養のため、汚染の心配がありません。植物由来なので菜食主義者も抵抗なく摂取できます。(下図)

図:オメガ3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)は微細藻類が合成している(①)。プランクトン(②)が微細藻類を食べ、小型魚(③)がプランクトンを食べ、大型魚(④)が小型魚を食べるという食物連鎖によって、魚油にEPAやDHAが蓄積している。人間は魚油からDHAとEPAを摂取している(⑤)。環境中の水銀(⑥)が魚に取り込まれてメチル水銀になって魚に蓄積する(⑦)。DHAとEPAを産生している微細藻類をタンク培養して油を抽出すると(⑧)、汚染物質がフリーで、植物由来のDHA/EPAが製造できる(⑨)。
がん治療には1日3から5グラムのDHAの摂取が有効であることが多くの研究で示されています。通常の魚油の場合、DHA含有量は10%から20%程度です。1日5グラムのDHAを摂取するには25gから50gの魚油の摂取が必要になります。
そこで、微細藻類の中でもDHA含有量が極めて多いシゾキトリウム(Schizochytrium sp.)をタンク培養して製造したDHA(フランス製)を原料にした「微細藻類由来オイル(DHA含有量51%)」を製造してがん治療に使用しています。
詳細は以下のサイトで紹介しています。
| « 499)アンジオ... | 501)医療大麻... » |




