がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
487)メラトニンは低酸素誘導因子-1活性とワールブルグ効果を抑制する

図:活性化した炎症細胞から産生される炎症性サイトカインのIL-6は受容体を介してSTAT3を活性化し(1)、低酸素誘導因子-1(HIF-1)の転写を亢進する(2)。増殖因子や成長因子によるシグナルはPI3K/Aktシグナル伝達系を介してmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を活性化する(3)。mTORC1はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1タンパク質の産生を増やす(4)。酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される(5)。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行し(6)、HIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する(7)。その結果、解糖系が亢進し、酸化的リン酸化が抑制され、血管新生を促進されて、がん細胞の増殖・浸潤・転移が促進される(8)。シクロオキシゲナーゼ-2(COX-2)阻害剤のセレコキシブ(celecoxib)は炎症細胞の活性を抑制し(9)、オーラノフィンはSTAT3の活性化を抑制する(10)。ラパマイシンはmTORC1を直接的に阻害し(11)、メラトニンとベザフィブラートはHIF-1αの分解を促進してHIF-1活性を抑制する。これらの医薬品を組み合せると、がん細胞におけるワールブルグ効果を抑制してがん細胞の増殖を抑制できる。
487)メラトニンは低酸素誘導因子-1活性とワールブルグ効果を抑制する
【メラトニンは日本ではサプリメントとして認可されていない】
世の中には何千、何万という種類のサプリメントが販売されています。「がんに効く」という宣伝のサプリメント(いわゆる抗がんサプリメント)も何百種類と販売されています。
抗がんサプリメントの中で、効能の点において、メラトニンはかなり上位にくるサプリメントです。個人的意見としては、トップに位置づけても良いと思うほどエビデンスがあり、その研究論文は最近も増えています(下図)。
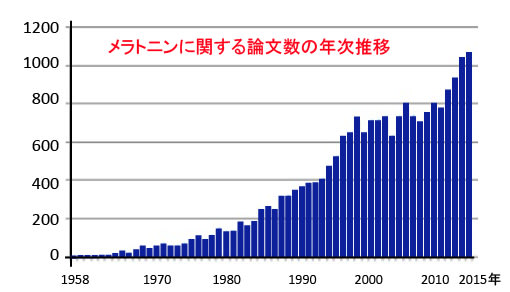
図: PubMed(アメリカ国立医学図書館の国立生物工学情報センターが運営する医学・生物学分野の学術文献検索サービス)で「Melatonin」で検索すると21000件以上の論文がヒットする(2016年4月時点)。メラトニンが発見された1958年の論文から、1996年には年間500報を超え、最近では1年間に1000以上のメラトニンに関する論文が発表されている。
米国ではサプリメント(dietary supplement)として販売されており、ドラッグストアーなどで誰でも容易に購入できます。
日本ではメラトニン製剤は医薬品に区分されていますが、医薬品として認可された製品はありません。欧州諸国でも同様にサプリメントとしては認可されていません。
日本で医薬品として製造するためには、有効性や安全性について科学的な資料を整えた上で、薬事法に基づく製造の承認の申請を行なわなければなりません。しかし、製薬会社にとってはメラトニンを薬にするメリットがありません。
メラトニンは体内に存在し、50年以上前から知れ渡っている成分であるため、物質特許がとれません。特許が取れなければ、医薬品として開発しても製薬会社は儲けにならないため、どこも医薬品としての開発を申請しないため、医薬品にはならないのです。メラトニン自体は米国から安く個人輸入で入手もできます。
メラトニンそのものでなく、メラトニン受容体に作用する化合物が2010年に承認されています。ラメルテオン(商品名ロゼレム)という医薬品で、「副作用が少なく、自然の眠りを誘う」というまさにメラトニンそのものの薬効で処方されています。この薬の場合は物質特許が取れるので、製薬会社は儲けが期待できるので、医薬品として申請したのです。
しかし、ラメルテオンよりメラトニンの方がメリットが大きいのは確かです。メラトニンにはメラトニン受容体を介する睡眠作用以外に、受容体を介さない多数の効能があるからです。
日本ではメラトニンは医薬品としてもサプリメントとしても販売されていません。
メラトニンを利用する方法として、個人輸入で入手するか、米国渡航時に入手するなどがあります。個人使用の場合は、原則として1度に2ヶ月分までは輸入できることになっています。インターネット上では、メラトニンの個人輸入を代行するサイトも数多くあります。
医師の場合は、薬監証明(医薬品輸入報告書)を取得して輸入し、処方薬として病気の予防や治療に使えます。
すなわち、日本で認可されていない医薬品でも、医師であれば、厚生労働省から薬監証明を取得することによって合法的に輸入し、日本国内で処方薬として治療に使えます(ただし、健康保険は使えないため自費診療になります。)。
メラトニンは米国ではサプリメントの扱いですが、日本では食品とは認めていませんので、医薬品として処方しなければなりません。私のクリニックで漢方薬についで最も処方数が多いのがメラトニンです。
【メラトニンは体内時計を制御する】
生体の生理機能は昼夜常に同じ状態を保っているわけではなく、ほぼ1日を周期として変動する概日リズム(サーカディアンリズム)が存在します。
私達の体の中(脳)にはいわゆる『体内時計』があり、昼夜サイクルの時間を刻みながら、体の多くの機能に活動と休息のリズムを与えています。これをサーカディアンリズム(circadian rhythm)と言います。ラテン語で「サーカ」は「約」、「ディアン」は「1日」という意味で、日本語では「概日リズム」と言います。
メラトニンは睡眠を促すホルモンで、脳のほぼ真ん中にある『松果体』と呼ばれる、松かさに似たトウモロコシ1粒くらいの大きさの器官から放出されるホルモンです。
夜暗くなると、メラトニンが松果体から分泌され始め、メラトニンが増えると睡魔が襲ってきます。そして、生体リズムは睡眠や体息に適したものに調整されます。
朝、太陽光線が目に入ると、松果体にその刺激が伝わりメラトニンの分泌が抑制されます。これによって覚醒スイッチがONとなり、諸々の生体機能は昼間の活動に適応した状態になります。
ところが夜の時間帯に強い光を浴びると、メラトニンの産生が減って寝つきが悪くなります。昼夜サイクルを無視した生活をすると体内時計の調子が狂い、体調を損ねる原因となります。
夜間に光を浴び続けると、メラトニンの分泌が低下し、免疫力が低下し、がんの発生が増えることが報告されています。

図:メラトニンは脳の松果体から分泌される。①夕方になって暗くなると松果体からメラトニンの産生が始まる。②夜間にメラトニンの血中濃度が上昇し、真夜中(午前2時から5時ころ)にピークに達する。夜間のメラトニンの濃度は日中の5〜10倍に達する。③メラトニンは分泌開始から10~12時間で分泌を中止し、急激に血中濃度が低下し、午前7時ころに最低になって覚醒する。
メラトニンの原料は必須アミノ酸のトリプトファンです。トリプトファンに2種類の酵素が働いてセロトニンに変わります(トリプトファン → 5-ヒドロキシトリプトファン → セロトニン)。
セロトニンは神経細胞と神経細胞のつなぎ目(シナプス)で情報伝達の役目をする神経伝達物質の一つです。
このセロトニンに2種類の酵素が働いてメラトニンが合成されます(セロトニン → N-アセチルセロトニン → メラトニン)。メラトニンの化学名はN-アセチル-5-メトキシトリプタミン(N-acetyl-5-methoxytrypamine)です。
セロトニン → メラトニンという段階は、体内時計(視交叉上核)からの指令が来ないとスタートしない仕組みになっています。すなわち、目から入った光の情報は視神経と通って脳にある視交叉上核に伝えられ、さらに神経によって松果体に連絡が入ってメラトニンの合成が制御されます。
メラトニンは松果体から分泌された後、血液に乗って全身に運ばれ、最終的には肝臓で代謝されます。唾液や脳脊髄液、卵巣の卵包液、胆汁中にも移行します。血液脳関門や胎盤も通過します。メラトニンは松果体の他にも、網膜や消化管や皮膚や骨髄からも産生されることが明らかになっています。
【メラトニンは細菌や植物にも存在する】
メラトニンは細菌やプランクトンや植物を含めて、自然界に広く存在し、生物の進化において、最も古くから存在する生体活性物質の一つと考えられています。
メラトニンは多くの生物において、睡眠の制御や体の日内リズムの調整に働いていますが、その他にも多彩な生理活性を持っています。
メラトニンは光を感知して体内に昼夜のシグナルを送るセンサーとして働きます。
哺乳動物では、メラトニンは光刺激を受けた視交叉上核からのシグナルによって脳の松果体から分泌され、視床下部に作用して睡眠が始まります。
抗酸化物質としては、自然界で最も強力なフリーラジカル消去活性を有すると言われています。植物では、油の多い種子に多く含まれ、紫外線が多く当たる植物に多いという報告があります。
メラトニン受容体は7回膜貫通型のGプロテイン共役型受容体(G protein coupled receptor : 略してGPCR)の一種です。
GPCRは多くの種類の細胞に分布しており、光・匂い・味などの外来刺激や、神経伝達物質・ホルモン・イオンなどの内因性の刺激を感知して細胞内に伝達する役割を担っています。
例えば、光を感じて視覚に関わるロドプシン、におい物質に作用する嗅覚受容体、さまざまな生理現象を司る神経伝達物質(アドレナリン、ヒスタミン、セロトニンなど)の受容体などは全てGPCRの仲間です。
GPCRは酵母や原虫など単細胞の真核細胞でも外界の情報伝達に重要な働きを担っています。多細胞生物では進化の過程でさらに多くの種類のGPCRを持つようになっています。
人間ではGPCR遺伝子は1000種類以上が見つかっており、個々のGPCRは特定のシグナルに特異的に反応して生理機能を引き起こします。
メラトニンが作用するGプロテイン共役型受容体が存在することは、生物の進化の歴史の早い段階から、メラトニンは細胞のシグナル伝達系において重要な役割を担っていることを意味しています。
メラトニンは細胞の生体防御やストレス抵抗性や増殖や生存などに重要な働きを行っているのですが、その作用機序などは十分に解明されていません。
生物が昼夜を識別するメカニズムが必要なことは直感的には理解できますが、その生物学的意義は不明です。
動物界では睡眠と覚醒のサイクルは恒常性維持と生存に重要です。
昼間は紫外線から防御し、様々な危険を感知して逃避しなければなりません。
睡眠というのは、周囲の環境を察知する感覚から脳を切り離す状態です。メラトニンは睡眠を誘導しますが、睡眠状態におけるメラトニンの作用や生物学的意義は不明です。
いずれにしても、生物進化の過程において、かなり早い段階からメラトニンが重要な生理作用を担ってきたことは確かです。人体においても多彩な健康作用が確認されています。(下図)
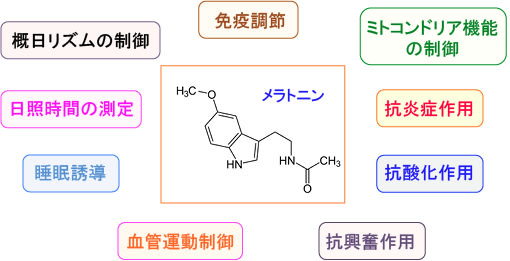
図:メラトニンには多彩な健康作用が報告されている。(参考:Ital J Pediatr. 2013; 39: 61.[PMCID: PMC3850896])
【夜間の照明は発がんを促進する】
夜間の光照射(light exposure at night)が乳がんなど幾つかのがんの発生を促進することが明らかになっています。その理由として夜間の照明がメラトニンの分泌を低下させるからだと考えられています。
乳がんに対するメラトニンの抗腫瘍効果を支持する研究結果は数多く報告されています。
そのため、米国や西洋諸国における工業化と電化に伴って、夜間のおけるメラトニンの産生が抑制されることが、乳がんの増加と関連しているという仮説が提唱されています。
夜間における光照射が、視交叉上核に存在する日内リズムの制御システムを乱す重要な環境要因であることは、よく知られています。
脳の松果体からのメラトニンの夜間の分泌は、夜間の光照射によって抑制され、その効果は光強度と期間と波長に依存することが明らかになっています。
メラトニンが細胞の代謝やシグナル伝達系に作用して、乳がん細胞の発生や進展を抑制することは、多くの研究によって示されています。
さらに、疫学研究の結果などによって、世界保健機関(WHO)の附属組織で人間への発がんリスクの評価を専門に行っている国際がん研究機関(IARC)は、2007年に概日リズムを乱す交代制の仕事(shift-work)を、発がん作用の可能性がある(group 2A)と分類して発表しています。
乳がん組織を用いた実験で、女性から夜間に採取した血液(メラトニン量が多い)は乳がん細胞の増殖を抑制し、夜間に光照射を受けた女性から採取した血液(メラトニン分泌が減少)は細胞増殖シグナル系やリノール酸取込み・代謝を亢進したという報告があります。
この効果はメラトニン受容体(MT1/MT2)の阻害剤によって阻止されるので、メラトニンの乳がん細胞増殖抑制効果は受容体依存性のメカニズムによると考えられています。
ラットに乳がん細胞を移植する実験系で、夜間や昼間に光照射を行うと、増殖シグナル伝達系の活性化が起こり、腫瘍の増大が亢進することが報告されています。そのメカニズムはメラトニンの分泌が抑制されるためであると考えられています。夜間の照明によるがん細胞の増殖促進はメラトニン投与によって阻止できるからです。
乳がん組織の増殖活性やリノール酸の取込み・代謝、解糖系酵素の活性、生存シグナル伝達系は夜間のメラトニン産生によって日内変動を受ける事が報告されています。
夜間に光照射を受けると、メラトニン産生が抑制され、高血糖、高インスリン血症、好気性解糖(ワールブルグ効果)亢進、がん細胞の増殖促進が起こることが実験で示されています。
夜間の光照射が乳がんのホルモン療法や抗がん剤治療の効果を弱めることが乳がんの移植腫瘍の実験系で明らかになっています。
夜間のメラトニンの分泌低下が好気性解糖(ワールブルグ効果)と増殖や生存のシグナル伝達系(PI3K/AKT経路、EGFR/HER2経路、RAS/MAPK/ERK経路、mTOR経路など)を亢進することが報告されています。
その結果、乳がん細胞は死ににくくなり、増殖速度が亢進します。
したがって、がんの治療中や再発予防の目的(特に乳がんの場合)では、夜間はできるだけ暗い状態で規則正しく睡眠を取ることが大切です。就寝前にメラトニンを10〜20mg程度摂取することも有益です。
【夜間の照明は肥満を増やす】
肥満は乳がんを含めて多くのがんの発生リスクを高めます。現在では世界規模で「肥満の流行(Obesity Epidemic)」と表現されるように肥満が増加しています。肥満が増えている最大の理由は精製した糖質や糖類の摂取量が増えているからです。さらに夜間の照明が肥満を増やしているという疫学データも報告されています。以下のような報告があります。
Does artificial light-at-night exposure contribute to the worldwide obesity pandemic?(夜間の人工照明は世界的な肥満の流行に関与しているのか?)Int J Obes (Lond). 2016 Jan 22. doi: 10.1038/ijo.2015.255. [Epub ahead of print]
【要旨】
研究の背景:過体重や肥満が世界中で増加しており、世界保健機関(WHO)によると、世界中で過体重は19億人、肥満は6億人と推定されている。電灯による夜間の人工的な光の照射(照明)が、メラトニンの産生を抑制し、日内リズムを乱すことによって人体に生理学的あるいは行動学的な変化を及ぼして体重にも影響し、世界的な肥満の流行を引き起こす要因となっている可能性が指摘されている。
方法:米国防衛気象衛星プログラム(US Defense Meteorological Satellite Program:DMSP)から入手可能な、夜間照明の最近の衛星画像を分析し、WHOから報告されている国別の男女の過体重と肥満の率との関連を検討した。一人当たりのGDP(国内総生産)、都市化の程度、出生率、食糧摂取量、地域の違いなどを調整して、夜間照明の程度と過体重・肥満の関連に着いて解析した。
結果:夜間照明は過体重と肥満の発生と統計的有意な相関を示し((t>1.97; P<0.05))、世界80カ国以上における男女の過体重と肥満の率の違いの70%くらいが、他の要因とともに説明可能であった。夜間照明と肥満の間の相関関係の地域間の強さの違いも認められた。
結論:この研究は、夜間照明が人間の肥満を引き起こす要因になることを示した実験結果や疫学研究の結果を確認した、人口レベルでの最初の研究である。
以下のような論文もあります。
Outdoor artificial light at night, obesity, and sleep health: Cross-sectional analysis in the KoGES study.(夜間の屋外の人工照明と肥満と睡眠健康:KoGES研究における縦断的解析)Chronobiol Int. 2016;33(3):301-14.
韓国からの報告でKoGES研究は「Korean Genome and Epidemiology Study(韓国のゲノムと疫学研究)」というコホート研究で、この研究では39〜70歳の8526人の成人を対象にした縦断的疫学研究(特定の集団を長期間に渡って観察する研究方法)で検討しています。
前述の論文と同じように、この研究でも米国防衛気象衛星プログラムから入手した衛星画像で屋外の夜間照明のデータを得ています。
肥満の率は女性が47%、男性が39%、屋外の夜間照明が強い場合の肥満率が55%に対して、夜間照明が低い場合は40%でした。屋外の夜間照明が強い場合の肥満のリスクのオッズ比は1.24(95%信頼区間:1.14-1.35)でした。
年齢や性など様々な要因を調整した値で、屋外の夜間の照明が強いと肥満の率が1.2倍くらいに上がるという結果でした。
年齢や性など様々な要因を調整した値で、屋外の夜間の照明が強いと肥満の率が1.2倍くらいに上がるという結果でした。
この研究の結論は、屋外の夜間の照明が強いほど、肥満のリスクが高くなるということでした。
以上のように、世の中の近代化に伴う夜間の照明や活動が、肥満やがんや様々な不健康状態を増やしているという指摘が近年増えています。
【メラトニンはワールブルグ効果を抑制する】
がん細胞の代謝の特徴であるワールブルグ効果を夜間の照明が誘導し、メラトニンがワールブルグ効果とがん細胞の増殖を抑制するという実験結果が報告されています。以下のような論文があります。
Light Exposure at Night Disrupts Host/Cancer Circadian Regulatory Dynamics: Impact on the Warburg Effect, Lipid Signaling and Tumor Growth Prevention.(夜間における光照射は宿主/腫瘍間の概日リズムの制御を乱す:ワールブルグ効果と脂質シグナルと腫瘍増殖予防への影響)LoS One. 2014; 9(8): e102776.(PMCID: PMC4123875)
【要旨】
視交叉上核に存在する中枢性体内時計は、がん細胞の増殖における昼夜の日内リズムの制御において重要な役割を担っており、内在性のがん予防のメカニズムとしても寄与している。
がん細胞が増殖するために必要なエネルギーと代謝産物は、好気性解糖(ワールブルグ効果)と脂質代謝に由来している。
ヌードラットに移植して増殖させたヒト乳がん組織を用いて検討し、腫瘍組織におけるワールブルグ効果とリノール酸の取込み・代謝と増殖シグナル活性が、脳の松果体から分泌される抗腫瘍ホルモンであるメラトニンによって24時間の昼夜の日内リズムによって制御されていることを明らかにした。
夜間における光照射はメラトニン分泌を抑制し、日内リズムによって制御されている宿主・腫瘍間の増殖抑制系のシグナルバランスを崩し、高血糖と高インスリン血症を引き起こし、がん細胞における好気性解糖と脂質シグナル系と増殖活性を亢進する。
1958年に牛の松果体からメラトニンが分離され構造が決定されました。このメラトニンが分離される以前から、メラトニンを産生する組織である松果体の抗腫瘍効果が指摘されていました。
すなわち、1940年代から50年代には、動物実験で松果体を切除するとがん細胞の増殖が促進されること、がん患者に松果体の抽出物を注射すると症状の改善に効果があることが報告されています。
そして、1973年のCancer Researchに、松果体切除によって亢進するがん細胞の増殖がメラトニンの投与によって阻止されるという研究結果によって、メラトニンの抗腫瘍効果が証明されました。(Reversal by melatonin of the effect of pinealectomy on tumor growth. Cancer Res. 1973;33:2830–2833.)
1970年代には臨床試験での有効性が報告されてきました。
メラトニンは松果体以外にも、消化管、網膜、胸腺、骨髄、白血球などでも合成されています。
睡眠や日内リズムの調整以外に、免疫機能の制御、フリーラジカル消去や抗酸化酵素の産生誘導などの抗酸化作用を持っています。メラトニンの抗がん作用については様々な作用メカニズムが報告されています。
ここでは、メラトニンがワールブルグ効果を抑制する機序として「メラトニンは低酸素誘導因子-1(HIF-1)を抑制する」という効果を解説します。
メラトニンがなぜワールブルグ効果(好気生解糖)を阻害するかというメカニズムについては、まだはっきりと判っているわけではありません。
がん細胞のワールブルグ効果を成立させる最も重要な因子は低酸素誘導因子-1(HIF-1)です。
メラトニンは抗酸化作用によってHIF-1の活性化を阻害するという報告があります。メラトニンは自然界で最強の抗酸化剤と言われています。この抗酸化作用によってHIF-1の活性化を抑制し、ワールブルグ効果を抑制するというメカニズムです。
このメカニズムを理解するために、HIF-1の活性化のメカニズムから説明します。
【HIF-1は低酸素になると活性化される】
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。
この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase)と呼ばれるタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。
すなわち、HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリル・ヒドロキシラーゼにより水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。
VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
VHLはフォンヒッペル・リンドウ(von Hippel-Lindau)病の原因遺伝子として発見されています。
フォンヒッペル・リンドウ病は常染色体優性遺伝疾患で、脳・脊髄・網膜の血管芽腫や腎臓がんや褐色細胞腫などの腫瘍が多発します。
VHLたんぱく質が欠損するとHIF-1αが分解されないので、HIF-1転写活性が亢進した状態になり、VEGF(血管内皮細胞増殖因子)のタンパク量が増え、血管の豊富な腫瘍が発生します。
プロリル・ヒドロキシラーゼ(prolyl hydroxylase)は酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリル・ヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。
安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮細胞増殖因子(VEGF)、造血因子エリスロポイエチンなど、 多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(下図)。
図:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、コアクチベーター(CBP/p300)やRNAポリメラーゼがリクルートされて、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
【がん細胞では低酸素でなくてもHIF-1が恒常的に活性化している】
がん細胞の代謝の特徴は、酸素が十分に利用できる状況でも、酸素を使わない解糖系が亢進し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されていることです。つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。
このような代謝の特徴の根本的なメカニズムは、がん細胞では酸素濃度とは関係なく、恒常的にHIF-1が活性化しているためです。つまり、がん細胞では恒常的に低酸素シグナルがオンになっているということです。その理由は、がん細胞で活性化されているmTORC1やSTAT3がHIF-1の産生を促進するからです。
がん細胞の増殖シグナル伝達系であるPI-3キナーゼ/Akt/mTORC1シグナル伝達系においてmTORC1はHIF-1のタンパク質の産生(mRNAからタンパク質の翻訳)を促進します。
また、増殖因子やサイトカインで活性化されるSTAT3という転写因子はHIF-1遺伝子の転写を亢進します。
mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1タンパク質の産生を増やします。
一方、STAT(signal transducer and activator of transcription;シグナル伝達兼転写活性化因子)は、様々な増殖因子やサイトカインを中心とする細胞外からの刺激によって活性化されたJAKなどのチロシンキナーゼによってリン酸化を受けると2量体を形成し、核内に移行してさまざまな遺伝子の発現を誘導します。
STAT転写ファミリーには7種類が存在しますが、特にSTAT3はほとんどすべての固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっています。
STAT3はHIF-1の遺伝子発現(転写)を促進することが知られています。つまり、がん細胞で活性が亢進しているmTORC1とSTAT3はHIF-1タンパク質の産生量を相乗的に高めることが報告されています(下図)。
HIF-1αタンパク質の発現量が増えても、HIF-1αの分解に関与するプロリル・ヒドロキシラーゼ(prolyl hydroxylase)やVHL(von Hippel-Lindau)タンパク質が正常に働けばHIF-1の活性亢進を抑制できますが、がん細胞ではプロリル・ヒドロキシラーゼやVHLの発現低下や遺伝子変異によってHIF-1αの分解過程に異常を起こしていることが多いので、HIF-1αは恒常的に高いレベルに亢進しています。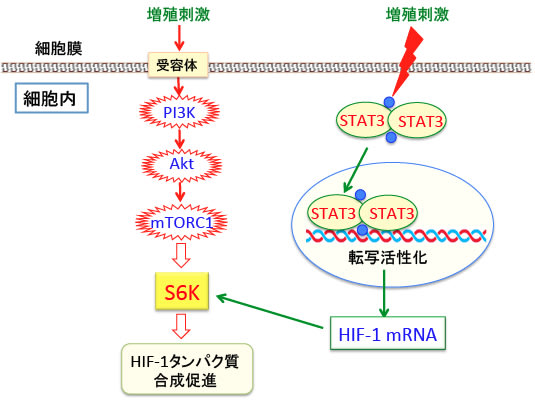
図:増殖刺激や遺伝子変異などによってがん細胞で恒常的に活性が亢進しているSTAT3(シグナル伝達兼転写活性化因子)はHIF-1遺伝子の転写(mRNAの産生)を促進し、mTORC1はリボソームの生合成を促進するS6Kを活性化してHIF-1タンパク質の合成を促進する。
STAT-3を阻害する物質として、オーラノフィン、ジインドリルメタン、セレコキシブがあります。(427話、428話参照)
mTORC1の阻害剤としてラパマイシンがあります。(383話参照)
つまり、HIF-1αの発現と活性を阻害する方法として、オーラノフィン、ジインドリルメタン、セレコキシブ、ラパマイシンの組合せは有効かもしれません。メラトニンもHIF-1の活性化を阻害するという報告があります。
【メラトニンは酸化ストレスを軽減する】
メラトニンには受容体を介さないメカニズムでの作用もあります。その代表が抗酸化作用です。
メラトニンはヒドロキシルラジカルや過酸化水素や一酸化窒素ラジカルなど様々なフリーラジカルを消去する活性を持っています。さらに、抗酸化酵素の発現を亢進する作用もあります。このように、メラトニンは細胞の酸化ストレスを軽減する作用を発揮します。
脳細胞の酸化を防ぐことにより、痴呆やアルツハイマー病やパーキンソン病を予防できるのではないかと期待されています。メラトニンは細胞膜や血液脳関門を容易に通過できるので、脳の神経細胞の酸化障害を防ぐことができるのです。
メラトニンの抗酸化作用は、活性酸素だけでなく、一酸化窒素や過酸化脂質など様々なフリーラジカルを消去できることが特徴です。毒性の強いヒドロキシラジカルはメラトニンによって効率的に消去されます。不飽和脂肪酸の酸化によって生じるペルオキシラジカルを消去する活性はビタミンEよりも高いことが知られています。メラトニン1分子は4つ以上のフリーラジカルを消去できます。
メラトニンはフリーラジカルを消去して自身が酸化されても、酸化剤(pro-oxidant)として副作用は起こらないと言われています。
つまり、他の抗酸化剤は、フリーラジカルを消去すると、自身は酸化されて酸化剤(プロオキシダント)となって他の物質を酸化するようになるのですが、メラトニンは酸化されても安定で、他の物質を酸化することはありません。
さらに、グルタチオンペルオキシダーゼ、スーパーオキシドデスムターゼ、カタラーゼなどの細胞内の抗酸化酵素の活性を高める効果も報告されています。
逆に、フリーラジカルを産生する酵素(リポギシゲナーゼ、一酸化窒素合成酵素など)の産生を抑制する効果も報告されています。
このような多方面の抗酸化作用によって、メラトニンは細胞膜の脂質や細胞内の蛋白、核内のDNA、ミトコンドリアにおける、フリーラジカルによるダメージを防ぎ、その結果、これらの細胞成分の酸化によって生じる病気(がん、動脈硬化、神経変性疾患など)を防ぐ効果を発揮します。
組織の酸化障害を軽減する効果は炎症を抑える効果になるため、メラトニンは抗炎症作用を持つと言えます。
活性酸素などのフリーラジカルによる遺伝子の酸化障害は細胞のがん化の原因として重要です。また、抗がん剤や放射線治療による副作用の原因もフリーラジカルによる正常組織のダメージです。がんの発生や再発の予防、治療による副作用軽減においてメラトニンが有効である理由として、免疫増強作用と同時に抗酸化作用の関与が大きいと考えられています。
【メラトニンは低酸素誘導因子-1の活性化を阻止する】
HIF-1αは解糖系酵素の発現を亢進してがん細胞のエネルギー産生に影響します。すなわち、解糖系に関与する10種類の酵素のうち9種類がHIF-1αによって制御されています。
HIF-1αはピルビン酸脱水素酵素キナーゼの発現を誘導することによってピルビン酸脱水素酵素(ピルビン酸からアセチルCoAを作る酵素)を阻害し、ミトコンドリアでの酸化的リン酸化を阻害します。
したがって、HIF-1αの活性を低下させ、核への移行を阻止し、HIF-1αの転写活性を抑制すれば、ワールブルグ効果や血管新生を抑制できます。
HIF-1α誘導性のVEGF発現誘導をメラトニンが阻害することが多くの研究で示されていますが、その分子メカニズムに関しては幾つかの説があります。
他の多くの抗酸化剤と異なり、メラトニンには脳や様々な末梢組織の細胞の細胞膜に受容体が存在します。
すなわち、メラトニンには、受容体に依存性の作用と非依存性の作用が知られています。
メラトニンには受容体とは非依存性の機序で、腎臓がん細胞において、HIF-1αの分解を促進してタンパク量を減らし、血管新生阻害作用を示すことが報告されています。
このHIF-1αとVEGFの発現を抑制するメラトニンの作用は、主に受容体非依存性の抗酸化作用が関連しています。抗酸化作用によって、メラトニンはHIF-1αたんぱく質の分解を促進します。
メラトニンはフリーラジカルを消去することによって、活性酸素によるPHD酵素の不活性化(PHD酵素の二価鉄イオンを酸化することによって)を阻止し、HIF-1αの分解を亢進してHIF-1αの量を減らします。
すなわち、メラトニンはHIF-1αのmRNA量には影響せず、HIF-1αの核への移行を阻止し、HIF-1αとそのco-activatorであるCBPとp300の相互作用を阻害します。
VEGF遺伝子のプロモーター領域のHREにおいて、HIF-1αとコアクチベーターの結合を阻害する作用も知られています。
メラトニンには免疫増強作用やがん細胞の直接的な抑制作用がありますが、がん細胞のHIF-1αの分解を促進してワールブルグ効果と血管新生を阻害する効果もメラトニンの抗腫瘍効果のメカニズムとして重要です。
メラトニンの免疫増強作用については454話で解説しています。
リンパ球を刺激する作用があるため、自己免疫疾患(慢性関節リュウマチなど)や悪性リンパ腫や白血病など免疫細胞の腫瘍の場合は、メラトニンの服用は病気を悪化させる可能性があるため使用できません。血液凝固を抑える作用があるため、血液凝固に異常がある場合や、ワーファリンのような血液凝固を阻害する薬を服用中は注意が必要です。
血圧を低下させる作用があるため、降圧剤を服用中は注意して服用します。
これらの点に注意していれば、副作用はほとんど無く、がん治療にメラトニンの使用はメリットが高いと言えます。がん治療には1日1回、就寝前に10〜40mgを目安に服用します。
メラトニンの抗腫瘍効果に関しては以下のサイトでまとめています。
http://www.1ginzaclinic.com/melatonin-and-cancer.html
ペルオキシソーム増殖因子活性化受容体αの活性化はがん細胞における低酸素誘導因子-1αシグナルを抑制することが報告されています。
【PPARα(ペルオキシソーム増殖因子活性化受容体α)はHIF-1活性を低下する】
PPARを活性化する薬や食品成分は脂肪酸のβ酸化を亢進し、グルコースの解糖系を抑制する働きがあるので、がん細胞のワールブルグ効果(酸素がある条件でも、がん細胞はグルコースの嫌気性解糖系でエネルギーを産生していること)を阻害して、がん細胞の増殖を抑える可能性が指摘されています。この作用以外にも、インスリン様成長因子-1のシグナル伝達系(PI3K/Akt/mTORC1)を抑制する作用や、抗炎症作用、血管新生阻害作用、分化誘導作用などの抗腫瘍効果も報告されています。
がん細胞のワールブルグ効果の根本的な原因である低酸素誘導因子-1(HIF-1)の活性をPPARの活性化によって抑制できることが報告されています。以下のような論文があります。
Activation of peroxisome proliferator-activated receptor α (PPARα) suppresses hypoxia-inducible factor-1α (HIF-1α) signaling in cancer cells.(ペルオキシソーム増殖因子活性化受容体αの活性化はがん細胞における低酸素誘導因子-1αシグナルを抑制する)J Biol Chem. 287(42): 35161-9, 2012年
【要旨】
ペルオキシソーム増殖因子活性化受容体α(PPARα)の活性化はがん細胞の増殖と血管新生を阻害することが報告されているが、その作用機序に関しては十分に解明されていない。
この研究では、ヒト乳がん細胞(MCT-7)とヒト卵巣がん細胞(A2780)を使って、低酸素誘導因子-1α(HIF-1α)シグナル伝達系に対するPPARα活性化の作用について検討した。
酸素濃度が1%の状態でがん細胞を16時間培養するとHIF-1αの発現量が著明に増加する。低酸素で培養する前にPPARαのアゴニスト(受容体を活性する物質)で処理すると、低酸素で誘導されるHIF-1αの発現と活性が抑制され、PPARαのアンタゴニスト(受容体の作用を阻害する物質)を投与するとPPARαのアゴニストによるHIF-1αシグナルの抑制作用が減弱した。このような作用はPPARγでは認めなかった。
PPARαの活性化は、低酸素で誘導されるHIF-1αタンパク質の量を減少させたが、変異したHIF-1αタンパク質の発現量には変化はなかった。このことは、PPARαの活性化はHIF-1αの分解を促進することを示している。この作用機序は、低酸素条件で誘導されるHIF-1α発現に対するPPARα活性化による抑制が、タンパク分解酵素を投与すると阻止されるという、タンパク分解酵素阻害剤を用いた実験で確かめられた。
共免疫沈降法(co-immunoprecipitation)を用いた実験で、HIF-1αのユビキチン-プロテアソーム経路での分解を促進するタンパク質であるvon Hippel-Lindauタンパク質とHIF-1αとの結合をPPARαの活性化によって促進されることを示した。
PPARαの活性化によってHIF-1αシグナル伝達経路が抑制されると、がん細胞からの血管内皮細胞増殖因子(VEGF)の分泌は著明に減少し、腫瘍血管の新生は阻害された。
以上の結果から、PPARαを活性化するとがん細胞における低酸素で誘導されるHIF-1αシグナル系が抑制されることが確かめられた。この結果は、PPARαのアゴニストの抗がん作用の新しい作用機序を提示している。
この論文では、PPARαの活性化がHIF-1αの分解を促進するという作用機序を示しています。分解を促進する機序として、HIF-1αとVHLとの結合を促進すると考察していますが、HIF-1αとVHLとの結合促進はプロリル・ヒドロキシラーゼの活性化によるものかもしれません。いずれにしても、PPARαの活性化はHIF-1αの分解を促進して低酸素で誘導されるHIF-1の活性を抑制するということです。
HIF-1の活性阻害を目的とする場合にはPPARαのリガンドであるフィブラート系薬剤の使用は有効かもしれません。
以上のことから、ラパマイシン(mTORC1阻害)、オーラノフィン(IL-6/STAT3阻害)、セレコキシブ(COX-2阻害+IL-6/STAT3阻害)、ジインドリルメタン(STAT3阻害)、ベザフィブラート(PPARの汎アゴニスト)、フェノフィブラート(PPARα選択的アゴニスト)、メラトニンなどの組合せは、がん細胞におけるワールブルグ効果を引き起こす最大の因子である低酸素誘導因子-1(HIF-1)の発現と活性を阻害することによって、がん細胞の増殖を抑制できると思います。(トップの図を参照)
画像をクリックするとサイトに移行します。
| « 486)ミトコン... | 488)ミトコン... » |





