がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
427)IL-6 / STAT3をターゲットにしたがん治療(その1):オーラノフィン
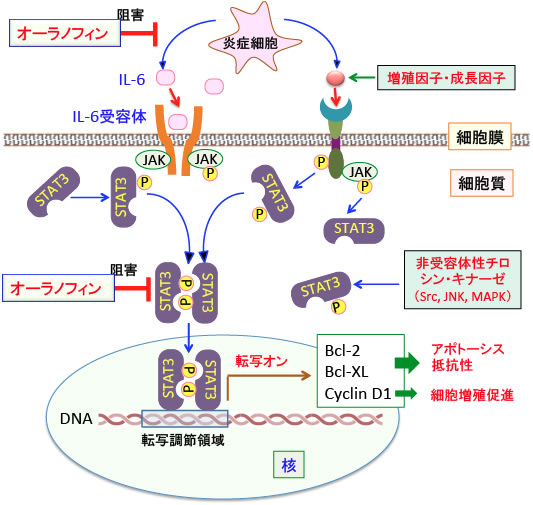
図:STAT3(シグナル伝達兼転写活性化因子-3)は不活性な状態では細胞質に存在する。IL-6や成長因子(EGFなど)などの受容体が刺激されたり、非受容体性チロシンキナーゼの活性化によってSTAT3がリン酸化されると、STAT3は二量体を形成して核内に移行する。核内に移行したSTAT3二量体は、標的となるDNAに結合して標的遺伝子の転写を活性化する。STAT3は細胞をアポトーシス抵抗性にするBcl-2やBcl-XL、細胞周期を促進するサイクリンD1(Cyclin D1)などの遺伝子発現を誘導することによってがん細胞の増殖や転移を促進する。関節リュウマチの治療薬であるオーラノフィンはSTAT3の活性化や炎症細胞の活性化を阻害する作用があり、がん細胞の増殖や転移を阻害する効果が報告されている。
427)IL-6 / STAT3をターゲットにしたがん治療(その1):オーラノフィン
【炎症とがんとIL-6/STAT3】
「慢性炎症は、がんの発生や進展を促進する」というのは、多くのエビデンスがあり、がん研究では常識的な考えになっています。
がんと炎症との関連においては、炎症性サイトカイン(TNF-α、IL-1、IL-6など)や、転写因子のNF-κBや、シグナル伝達系のSTAT(Signal Tranducer and Activator of Transcription:シグナル伝達兼転写活性化因子)ファミリーのタンパク質や、化学伝達物質のプロスタグランジンなどが複雑に関与しています。
この中で、IL-6/STAT3シグナル伝達系が炎症とがんの治療のターゲットとして注目されています。多くのがんでは炎症過程が亢進しており、この炎症過程の中心にいるのがIL-6とSTAT3の連携です。
インターロイキン6(IL-6)はB細胞に作用して抗体産生を誘導するT細胞由来のサイトカインとして発見されました。サイトカインというのは、リンパ球や炎症細胞から分泌されて、免疫や炎症や創傷治癒など様々な生理機能の調節を担うタンパク質です。
サイトカインは細胞表面の膜上にある受容体に結合することによって、受容体に特有の細胞内シグナル伝達の引き金となります。
炎症過程に関与するものは炎症性サイトカインと呼ばれています。
IL-6は代表的な炎症性サイトカインであり、自己免疫疾患など慢性炎症性疾患の発症や進展に重要な役割を担っており、IL-6の働きを阻害する薬は関節リュウマチのような慢性炎症性疾患の治療に使用されています。
IL-6は免疫や炎症のみならず、乳がんや前立腺がんを始めとする様々ながん細胞の増殖や悪性化にも深く関わっていることが明らかになっています。
慢性炎症によってIL-6の体内での産生が高い状態はがんの発生や進展を促進します。IL-6の血中濃度が高いほどがん患者の予後が悪いという報告もあります。
IL-6の作用は主にシグナル伝達分子であるSTAT3によるものであることが明らかにされています。
STAT3はさまざまなサイトカインや成長因子からのシグナルを統合して免疫や炎症を制御する転写因子であり、また、炎症に起因した発がんに重要な働きをすることが報告されています。
【外科手術ががん細胞のがん幹細胞の性質獲得を促進する】
古代ギリシャでは「がんを扱うな」という考え方がありました。がんを下手にいじると病状を悪くすることも多いので、むしろそっとしておく方が結果的に良い場合が多いということです。この時代の医師たちも、がんの手ごわさを実感していて、最終的に「いろいろやるよりかは静かにしておくほうがいい」というのを体験的に修得したのかもしれません。
現在でも、「がんの放置療法」を推奨する意見はあります。実際、進行がんを無理して手術したり、強力な抗がん剤治療を行ったために死を早めるケースがかなり多いのは確かです。
がん研究の領域でも、がん治療ががんを悪化させたり進行を早めることが指摘されています。
例えば、外科手術ががん細胞の悪性進展や再発を促進することが以前から指摘されており、その理由としてIL-6/STAT3系などの炎症過程の関与が推測されています。
最近の研究で以下のような論文があります。
Surgery-induced wound response promotes stem-like and tumor-initiating features of breast cancer cells, via STAT3 signaling. (手術によって誘導される創傷応答はSTAT3シグナル系を介して、乳がん細胞のがん幹細胞様の性質を促進する) Oncotarget. 2014;5(15):6267-6279.
【要旨】
臨床的に炎症はがんとの関連が強いが、そのメカニズムに関してはまだ十分に解明されていない。
手術はある種の炎症反応を引き起こすので、手術ががんの局所再発や転移形成の過程に関与している可能性が示唆されている。
乳がん患者から得た手術後の創傷部の浸出液(post-surgery wound fluid)にはサイトカインや増殖因子が多く含まれており、乳がん培養細胞を使った実験で、この創傷部浸出液は乳がん細胞の増殖を促進し、STATの転写活性を強力に活性化する作用を示した。
そこで、この手術後炎症過程による乳がん細胞の増殖促進にSTATシグナル系が関与しているかどうかを検討した。
創傷部浸出液は、乳がん細胞のSTAT3活性を高め、がん幹細胞の性質をもった乳がん細胞の数を増やした。
培養細胞を用いた実験で、創傷部浸出液は乳がん細胞の腫瘍様塊(mammosphere)形成と自己複製能を高度に活性化した。
動物実験(in vivo)での検討では、移植した乳がん細胞の腫瘍形成と、外科切除後の局所再発の過程においてSTAT3シグナル系の活性化が必須であった。
以上の結果から、手術によって引き起こされる炎症が、乳がん細胞のがん幹細胞様の性質の獲得を促進することが示された。この過程(手術後の炎症によって乳がんの幹細胞化が促進されること)は、手術の前後にSTAT3シグナル伝達系を阻害することによって阻止することができる。乳がん幹細胞と周囲組織の環境の間の相互作用を理解することは、乳がんの発生や再発を防ぐ重要な手段を提供することになる。
stem-like(幹細胞様)もtumor-initiating(腫瘍起源)もがん幹細胞(cancer stem cell)のことを意味しています。「stem-like and tumor-initiating features」というのは「がん幹細胞の性質」ということです。
がん細胞の培養で腫瘍様塊(mammosphere)を形成するのはがん幹細胞の性状を持っていることを意味します。「自己複製能」も幹細胞の性質です。
がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境(ニッチ)中に存在し、ニッチより分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。
つまり、がん細胞が「がん幹細胞様の性質」を獲得することは、抗がん剤などで死ににくいがん細胞になることを意味します。(下図)

図:がん組織にはがん幹細胞 (cancer stem cells)と呼ばれる細胞が存在して、通常のがん細胞(成熟がん細胞)を供給しながらがん組織を構成している。がん幹細胞は自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっている。 成熟がん細胞は抗がん剤や放射線で死滅しやすいが、がん幹細胞は死滅しにくいので抗がん剤治療や放射線治療で生き残る。がん幹細胞は腫瘍形成能を持つので、生き残ったがん幹細胞が増殖して再発や再燃が起こる。がん幹細胞がアポトーシス抵抗性になっているメカニズムを阻害すれば抗がん剤や放射線治療の効果を高めることができる。
手術後の創傷治癒過程では、炎症反応、血管新生、細胞外マトリックスの産生、細胞の増殖と組織の再生、組織幹細胞の増殖と自己複製などが起こっており、これらの過程には様々な炎症性サイトカインや増殖因子や化学伝達物質が関与しています。そして、このような因子ががん細胞の増殖や転移を促進する可能性が以前から指摘されています。
この論文は、「手術を行うと、創傷治癒の過程で起こる炎症反応が乳がん細胞のがん幹細胞様の性質の獲得を促進する」「そのメカニズムは、STAT3の活性化を介している」という実験結果を報告しています。
つまり、手術によって引き起こされる炎症ががん細胞の再発や転移を促進する可能性があるということです(下図)。

図:手術でがん細胞の取り残しがあると、手術行為が原因となってがん細胞の転移や再発を促進され、抗がん剤抵抗性などの性質を獲得する可能性が指摘されている。その理由として、手術後の創傷部位では炎症反応や血管新生が起こり、炎症細胞などから様々な炎症性サイトカインや増殖因子や成長因子や化学伝達物質などが産生され、がん細胞のIL-6/STAT3シグナル系が活性化される。STAT3の活性化はがん細胞をがん幹細胞様の性質に変え、その結果、がん細胞の増殖や転移が促進され、がん細胞は抗がん剤などの治療に抵抗性を獲得する。
【抗がん剤治療ががん細胞をがん幹細胞化して抗がん剤耐性にする】
以下のような論文があります。
Activation of an IL-6 Inflammatory Loop Mediates Trastuzumab Resistance in HER2 Overexpressing Breast Cancers by Expanding the Cancer Stem Cell Population.(IL-6炎症性回路の活性化は、がん幹細胞の数を増やすことによって、HER2を過剰発現している乳がん細胞のおいて、トラスツズマブ抵抗性を引き起こす) Molecular cell. 2012;47(4):570-584.
【要旨】
HER2をターゲットにする抗体医薬品トラスツズマブ(trastuzumab)に対する抵抗性の獲得には、PTEN遺伝子の不活性化が関与していることが指摘されているが、この抵抗性獲得のメカニズムに関しては十分に明らかになっていない。
HER2を過剰に発現している乳がん細胞株にPTEN遺伝子を欠損させることによってトラスツズマブ抵抗性の細胞を作成した。このトラスツズマブ抵抗性の獲得の過程において、IL-6を介する炎症性機序の活性化と、がん幹細胞の数の増加を認めた。
トラスツズマブを長期間投与していると、がん細胞は上皮間葉移行の性状を示し、IL-6の産生量がもとのがん細胞の100倍以上に増えたがん幹細胞が顕著に増加した。
マウスの移植腫瘍の実験モデルにおいて、IL-6受容体に対する抗体でこの炎症反応過程を阻害すると、がん幹細胞の数が減少し、腫瘍の増殖と転移が抑制された。
これらの結果は、乳がん細胞のトラスツズマブ抵抗性がIL-6を介するメカニズムで起こっており、この過程を阻害することが、トラスツズマブ抵抗性を克服する手段となることを示唆している。
トラスツズマブ(Trastuzumab)はヒトがん遺伝子HER2(human epidermal growth factor receptor type2)の遺伝子産物であるHER2蛋白に特異的に結合して抗腫瘍効果を発揮する分子標的薬で商品名はハーセプチンです。
HER2蛋白は、ヒト上皮細胞増殖因子受容体ファミリーに属する増殖因子受容体で、乳がん細胞などで過剰に発現したり活性化したりして細胞の増殖や悪性化に関わっています。
乳がん細胞にトラスツズマブ(ハーセプチン)で治療をしていると、次第にトラスツズマブに抵抗性を獲得し、このトラスツズマブ抵抗性細胞は乳がんの幹細胞と似た性質を持ってくるという研究結果です。
トラスツズマブで長期間治療していると、がん幹細胞の性質をもった抗がん剤抵抗性の高い乳がん細胞が増えてくるということと、IL-6の働きを阻害するとこの抗がん剤抵抗性や悪性進展を阻止できるという結果です。
なお、このIL-6を介する経路にはNF-κBやSTAT3が重要な役割を担っています。
また、HER2が過剰発現している乳がんでもハーセプチンが効くのは半分程度です。そこでIL-6の働きを阻害するとハーセプチンの効き目が高くなる可能性があります。
つまり、乳がんでハーセプチンの治療を受けているときは、IL-6やSTAT3の活性を阻害する治療法を併用すると抗がん作用(奏功率)を高めることができる可能性があります。
このように、抗がん剤で治療していると、がん細胞は細胞死(アポトーシス)を起こしにくくする細胞内のメカニズムを利用して死ににくくしようとします。この細胞死(アポトーシス)抵抗性を獲得するために、がん細胞ではNF-κB/IL-6/STAT3シグナル伝達系の活性化を利用していると考えられます。
がん細胞はIL-6の産生とIL-6受容体の発現を亢進しています。増殖因子や成長因子の受容体の発現も亢進し、非受容体性チロシンキナーゼの活性も恒常的に亢進しています。その結果、STAT3が恒常的に活性化され、細胞増殖やアポトーシス抵抗性に関与する遺伝子の発現が亢進します。
酸化ストレスやTNF-αなど炎症性サイトカインは転写因子のNF-κBを活性化し、NF-κBはIL-6の発現を亢進します。IL-6はNF-κBの発現を亢進する作用もあります。
つまり、がん細胞ではNF-κB/IL-6/STAT3シグナル伝達系がpositive feedback によって恒常的に活性化することによって増殖とアポトーシス抵抗性の性質を獲得しています。
このfeedback loop(悪循環)を断ち切れば、がん細胞は死にやすくなります。
手術や抗がん剤治療のように「がん細胞を攻撃する治療」には、がん細胞を悪化させる作用があるというのが「がんの放置治療」派の根拠の一つになっています。がん治療を行う場合は、その悪影響を除去する治療を併用することが重要だと言えます。
【STAT3はがん細胞の増殖を促進する】
STAT3は、STAT (Signal Tranducer and Activator of Transcription:シグナル伝達兼転写活性化因子) ファミリーに属する蛋白質で、その名の通り、「シグナル伝達」と「遺伝子転写活性化」の両方において働きます。
STAT3は非活性化状態においては細胞質に存在しますが、ヤーヌスキナーゼ(Janus Kinase; JAK)が活性化されることによってリン酸化を受け、核内へ移行して目的遺伝子を活性化する転写因子として機能します。
JAKはサイトカイン受容体のサブユニットとして存在し、チロシンをリン酸化する酵素(チロシンキナーゼ)の一種です。
IL-6ファミリーのサイトカインあるいは上皮成長因子(EGF)等の成長因子がそれらの受容体に結合することによりヤーヌスキナーゼ(JAK)が活性化されると、活性化されたJAKがSTAT3のチロシン705をリン酸化します。
チロシン705がリン酸化されたSTAT3二分子のSH2ドメインがそれぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行し、核内に移行したSTAT3二量体は標的となるDNAに結合する事で転写を活性化します。これをJAK-STAT経路と言います。
STAT3のリン酸化はJAKを介する以外に、増殖因子や成長因子の受容体が直接リン酸化する場合や、Srcなどの非受容体性チロシン・キナーゼによっても起こります。つまり、様々な細胞刺激に応答してSTAT3がリン酸化されて、増殖や生存を促進する作用を発揮します(下図)。

図:JAK(Janus Kinase;ヤーヌスキナーゼ)はサイトカイン受容体のサブユニットとして存在し、チロシンをリン酸化するチロシンキナーゼ活性を持つ。IL-6や上皮成長因子(EGF)などの受容体が刺激されるとJAKが活性化されてSTAT3がリン酸化される。STAT3のリン酸化は受容体性チロシンキナーゼや非受容体性チロシンキナーゼ(Srcなど)でも起こる。STAT3は不活性な状態では細胞質に存在し、JAK(ヤーヌスキナーゼ)などでチロシン705がリン酸化されると、STAT3二分子のSH2ドメインが、それぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行する。核内に移行したSTAT3二量体は、標的となるDNAに結合する事で転写を活性化する。STAT3は細胞をアポトーシス抵抗性にするBcl-2やBcl-XL、細胞周期を促進するサイクリンD1(Cyclin D1)などの遺伝子発現を誘導することによってがん細胞の増殖や転移を促進する。
【STAT3はワールブルグ効果の成立にも関与する】
様々なサイトカインや増殖因子によるJAK/STAT経路の活性化は、約20年前に発見されて以降、細胞内の主要なシグナル伝達系として多くの研究が行われています。
この経路の制御の異常が、様々な炎症性疾患や悪性腫瘍の発症や進展に重要な役割を有していることが明らかになっており、この経路の阻害剤が炎症性疾患やがんの治療薬として注目されています。
すでに、IL-6の働きを阻害する抗体薬やJAK阻害剤が関節リュウマチの治療薬として使用されており、これらの薬のがん治療での有効性も報告されています。
がん細胞の代謝は「酸素が存在する条件でも、酸素を使わない解糖系が亢進し、ミトコンドリアでの酸化的リン酸化が抑制されている」と言う特徴があり、これをワールブルグ効果と言います。
このワールブルグ効果の成立にSTAT3が関与していることが報告されています。
がん細胞のワールブルグ効果を是正することはがん治療に有効です。その方法として2-デオキシグルコースやジクロロ酢酸やメトホルミン(417話)やケトン食(418話)などがあります。さらにSTAT3活性を阻害する方法はワールブルグ効果の是正に役立つ方法と言えます。
最近の論文で、STAT3の活性化が低酸素誘導因子-1(HIF-1)を活性化し、解糖系を亢進していることが報告されています。以下のような論文があります。
STAT3 Activities and Energy Metabolism: Dangerous Liaisons.(STAT3活性とエネルギー代謝;危険な連携) Cancers 6(3):1579-1596.2014年
【要旨】
STAT3はサイトカインや増殖因子とそれらの受容体によるシグナル伝達系において重要な働きを行っており、STAT3のチロシン705のリン酸化(Y-P)によってその転写活性は活性化される。
チロシン705がリン酸化された活性型のY-P STAT3は多くのがん細胞で見られ、このSTAT3の恒常的な活性化がその下流に位置する様々ながん遺伝子を活性化し、細胞のがん化の原因となっている。
我々は最近の研究で、STAT3が恒常的に活性化されているがん細胞において、STAT3の活性化が低酸素誘導因子-1α(HIF-1α)の転写活性の誘導とミトコンドリア活性の抑制によって、解糖系主体のエネルギー産生を促進していることを報告している。
このような代謝の変化は、アポトーシスや細胞周期停止に対して抵抗性になり、細胞増殖活性を高め、細胞のがん化を促進する機序と関連していると思われる。
慢性炎症状態が細胞のがん化やがん細胞の悪性進展を促進するという良く知られた因果関係のメカニズムとして、慢性炎症によって恒常的に活性化されるSTAT3が強く関連していることが指摘されている。
セリン727のリン酸化がミトコンドリアにおけるエネルギー産生を制御しているというSTAT3の新たに解明された作用と今回の研究結果は、細胞のがん化やがん細胞のエネルギー代謝の変化やがん細胞の増殖や生存において、STAT3が中心的役割を果たしていることを示唆している。
STAT3は細胞核に移行して遺伝子転写を誘導するだけでなく、ミトコンドリアに移行してミトコンドリアの機能にも作用することが報告されています。その際には、セリン727のリン酸化が必要という報告があります。
がん細胞におけるSTAT3の働きはまだ不明な点が多く残されていますが、がん細胞の増殖や代謝や分化を制御する際に、重要なターゲット分子であることは間違いないようです。
【オーラノフィンのSTAT3阻害作用】
オーラノフィン(Auranofin)は、関節リュウマチの治療に使われる経口金製剤です。通常、非ステロイド抗炎症剤を使用しても効果がないときに使われます。
最近、オーラノフィンの抗腫瘍効果が注目されており、米国ではがん治療へのオーラノフィンの効果を検討する第2相臨床試験の実施がFDA(食品医薬品局)から承認されています。
オーラノフィンの抗腫瘍作用のメカニズムとして様々な作用が報告されていますが、特にチオレドキシン還元酵素の阻害による抗がん剤作用が注目されています。これに関しては424話で解説しています。
オーラノフィンがSTAT3の活性化を阻害する作用が報告されています。つまり、オーラノフィンの抗炎症作用と抗がん作用の共通の作用メカニズムとしてSTAT3の阻害作用が提唱されています。以下のような報告があります。
Auranofin blocks interleukin-6 signalling by inhibiting phosphorylation of JAK1 and STAT3.(オーラノフィンはJAK1とSTAT3のリン酸化を阻害することによってインターロイキン-6シグナル伝達系を阻害する)Immunology. 122(4):607-14.2007年
【要旨】
オーラノフィンはイオウ含有の金製剤で、抗炎症作用と免疫抑制作用を有し、関節リュウマチの治療薬として広く使用されている。しかしながら、その作用機序については十分に解明されていない。
オーラノフィンの抗炎症作用の作用メカニズムを解明する目的で、インターロイキン-6(IL-6)に対する細胞応答に対するオーラノフィンの作用を検討した。
ヒト肝臓がん細胞HepG2を用いた実験で、オーラノフィンはIL-6によるヤーヌスキナーゼ1(JAK1)とSTAT3のリン酸化と、STAT3の核への移行を阻害した。
この実験結果と一致して、オーラノフィンはIL-6で産生が誘導されるハプトグロビン、フィビリノーゲン、補体C3、α1-酸性糖タンパク質などの急性期タンパク質(炎症の急性期に肝臓から産生されるタンパク質)の産生、および血管内皮細胞増殖因子の遺伝子発現を抑制した。これらの遺伝子の転写活性はSTAT3によって活性化されることが知られている。
関節リュウマチ患者の滑膜細胞、ヒトの𦜝帯静脈の血管内皮細胞、ラットのアストロサイトを使った実験でも、オーラノフィンによるSTAT3のリン酸化の阻害作用が確認された。
オーラノフィンによるSTAT3リン酸化の阻害作用は、チオール基をもつ抗酸化剤を添加することによって減弱した。
これらの結果は、オーラノフィンの抗炎症作用にはJAK1/STAT3シグナル伝達系の阻害作用が関与していることを示唆している。この作用にはチオール基反応性のタンパク質がJAK1/STAT3リン酸化に関与していることを示唆している。
オーラノフィンはチオレドキシン還元酵素を阻害する作用があります。チオレドキシン(Thioredoxin: Trx)は、分子内に酸化還元活性を有するSH基(チオール基)を持つ抗酸化酵素です。
還元型チオレドキシンは、酸化された標的タンパク質に結合し、標的タンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身の チオール基は酸化されます。酸化型チオレドキシンは、NADPHの存在下でチオレドキシン還元酵素の作用により還元され、 再び還元型に戻ります(下図)。

図:チオレドキシンは-Cys-Gly-Pro-Cys-という大腸菌から哺乳類までよく保存された活性部位を持ち、この活性部位の2つのシステイン基の間でジスルフィド(S-S)結合を作る酸化型とジチオール(-SH-SH)を作る還元型が存在する。還元型チオレドキシンは、酸化された標的タンパク質に結合して標的タンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身のチオール基(-SH)は酸化されてジスルフィド(S-S)になる。酸化型チオレドキシンは、NADPHの存在下でチオレドキシン還元酵素の作用により還元され、再び還元型に戻る。NADPHはペントースリン酸回路で産生される。オーラノフィンはチオレドキシン還元酵素を阻害する。
つまり、チオール基(-SH)をもつタンパク質がJAK/STAT3の活性化に関与しており、オーラノフィンのJAK/STAT3活性化阻害作用はチオレドキシン還元酵素阻害作用が関与していることを示しています。これはチオール基をもつ抗酸化剤(N-アセチルシステインやグルタチオン)を添加するとオーラノフィンのJAK1/STAT3活性化阻害作用が阻止されたことから示されています。
オーラノフィンの抗がん作用がSTAT3の抑制と関連していることも報告があります。以下のような報告があります。
The gold compound auranofin induces apoptosis of human multiple myeloma cells through both down-regulation of STAT3 and inhibition of NF-κB activity.(金製剤オーラノフィンはSTAT3の抑制とNF-κB活性の阻害作用によってヒト多発性骨髄腫細胞のアポトーシスを誘導する)Leuk Res. 35(2): 243-249, 2011年
【要旨】
NF-κBとSTAT3の恒常的は活性化は、多発性骨髄腫の細胞増殖と生存に重要な役割を担っている。我々は、オーラノフィンが骨髄腫細胞にG1期での細胞周期の停止とアポトーシスを誘導することを報告している。
さらに、オーラノフィンは恒常的なJAK2活性化およびIL-6誘導性のJAK2の活性化とSTAT3のリン酸化を阻害し、アポトーシスを阻害する作用があるMcl-1タンパク質の発現を抑制した。
オーラノフィンはNF-κBの活性化を抑制し、オーラノフィンとNF-κBの選択的阻害剤の併用は、Mcl-1タンパク質の発現を顕著に減少させた。
Mcl-1はさまざまな血液悪性腫瘍において過剰な発現が認められているタンパク質でアポトーシス(細胞死)を阻害する作用があります。Mcl-1はSTAT3によって遺伝子転写が誘導されます。
オーラノフィンはSTAT3の活性を阻害してMcl-1の発現を抑制し、骨髄腫細胞のアポトーシスを誘導するという作用機序です。
NF-κBは炎症や細胞のがん化を促進する転写因子です。NF-κB活性が高まると、アポトーシスが起こりにくくなり、がん細胞の増殖や転移が起こりやすくなります。(261話)
NF-κBはリポポリサッカライド(LPS)、IL-1、TNF-α、酸化ストレス(活性酸素)で活性化されます。
NF-κBはIL-6の遺伝子発現を促進します。
オーラノフィンはNF-κBを阻害する作用もあるようですが、STAT3とNF-κBを同時に阻害すると、抗炎症作用と抗がん作用が強化できるという話です。
Antiproliferative effect of gold(I) compound auranofin through inhibition of STAT3 and telomerase activity in MDA-MB 231 human breast cancer cells.(ヒト乳がん細胞MDA-MB231におけるSTAT3とテロメラーゼ活性の阻害による有機金化合物オーラノフィンの増殖抑制効果)BMB Rep. 46(1): 59-64, 2013年
【要旨】
STAT3とテロメラーゼはがん治療のターゲットとして重要である。この研究では、STAT3が恒常的に活性化されているヒト乳がん細胞株MDA-MB231細胞を用いて、金製剤(有機金化合物)オーラノフィンのin vitro(試験管内の実験)における抗がん活性について検討した。
培養細胞の実験において、オーラノフィンは用量依存的にがん細胞の増殖を阻害した。
この阻害作用は、活性酸素の消去剤であるN-アセチル-L-システイン(NAC)によって阻止された。
DNA合成およびソフト寒天における足場非依存性増殖をオーラノフィンは抑制した。
オーラノフィンは、乳がん細胞におけるSTAT3のリン酸化とテロメラーゼ活性を抑制した。しかし、NAC(N-アセチル-L-システイン)で前処理すると、オーラノフィンによるSTAT3リン酸化とテロメラーゼ活性の阻害作用は阻止された。
これらの結果は、ヒト乳がん細胞MDA-MB231に対するin vitroの抗腫瘍効果はSTAT3とテロメラーゼ活性の阻害が関与している可能性を示唆している。
このように、オーラノフィンはSTAT3とテロメラーゼをターゲットにする新規の抗がん剤としての可能性を示している。
関節リュウマチ(Rheumatoid Arthritis)は炎症性自己免疫疾患で、自己の免疫が手足の関節の組織を攻撃する結果、関節の痛みや変形が発生する疾患です。
関節リュウマチの治療は、免疫抑制作用や抗炎症作用が主なターゲットになります。
つまり、免疫細胞を活性化するシグナル伝達系や炎症を増悪させるシグナル伝達系を抑制する作用が、関節リュウマチの治療に効果を発揮します。
そこで、抗炎症作用を有する関節リュウマチの薬ががんの治療薬となる可能性があります。
実際に、抗炎症作用のある抗リュウマチ薬のシクロオキシゲナーゼ-2(COX-2)阻害剤などの非ステロイド性抗炎症剤(NSAIDs)、炎症性サイトカインのTNF-αやIL-6の働きを阻害する抗体薬、JAK阻害剤、金製剤のオーラノフィン、スルファサラジンなどのがん治療効果が報告されています。
逆に、抗がん剤として開発されたメソトレキセート(葉酸代謝拮抗剤に分類される抗悪性腫瘍薬)やリツキシマブ(B細胞の発現するCD20に対する抗体薬)のように関節リュウマチの治療薬に認可されたものもあります。
抗IL-6受容体抗体薬やJAK阻害剤は、高額であったり副作用の観点から安易には使えませんが、オーラノフィンは極めて安価です。下痢などの消化器症状やその他の副作用には十分に気をつけなければなりませんが、その作用機序と副作用を十分に理解して使用すればがん治療に利用価値が高い薬かもしれません。
| « 426)水素ガス... | 428)IL-6 / S... » |



