がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
423)魚油とヒドロキシクエン酸と中鎖脂肪ケトン食
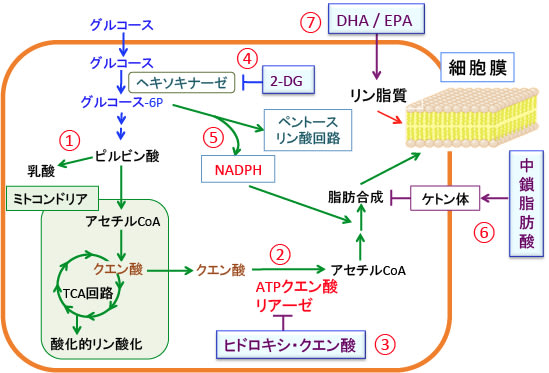
図:がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸の産生が増えている(①)。TCA回路で生成されたクエン酸はアセチルCoAに変換されて脂肪酸の合成に使われる(②)。クエン酸をアセチルCoAに変換するATPクエン酸リアーゼを阻害すると、がん細胞で亢進している脂肪合成を抑制できる。ATPクエン酸リアーゼの阻害剤としてヒドロキシ・クエン酸がある(③)。さらにヘキソキナーゼを阻害する2-デオキシグルコースを併用すると、がん細胞における解糖系とペントース・リン酸回路を阻止できる(④)。ペントース・リン酸回路で産生されるNADPHは脂肪酸合成に必要なので(⑤)、ペントースリン酸回路の阻害は脂肪酸合成を抑制する。中鎖脂肪酸を多く摂取するケトン食を併用するとケトン体による脂肪酸合成阻害が加わる(⑥)。細胞内の新規(de novo)の脂肪酸合成を抑制した状態で、食事中のDHA(ドコサヘキサエン酸)やEPA(エイコサペンタエン酸)などのω3系不飽和脂肪酸の摂取を増やすと、細胞膜へのDHA/EPA取込みが増える。がん細胞の細胞膜にDHA/EPAの取込みが増えるとがん細胞の増殖を抑制できる(⑦)。
423)魚油とヒドロキシクエン酸と中鎖脂肪ケトン食
【魚を多く食べる人はがんの発生が少ない】
「魚の摂取量とがん発生率」に関する疫学研究は1990年代ころから多数報告されています。
一般的に、毎日魚を食べている人は、そうでない人に比べ大腸がんや乳がんや前立腺がんなど欧米型のがんになりにくいと考えられています。特に前立腺がんを予防する効果は大規模な疫学研究で証明されています。
例えば、米国における47,882名の男性の食事の解析では、1週間に3回以上魚を食べるグループは、月に2回以下のグループと比較して、前立腺がんの発生頻度は7%の低下、進行した前立腺がんは17%の低下、転移のリスクは44%の低下を認めています。
スウェーデン人の6272名の男性を30年以上にわたって追跡調査した研究では、魚をほとんど食べないグループの前立腺がんの発生頻度は、魚を良く食べるグループの2~3倍でした。
消化器系のがんに関する疫学研究のメタ解析が最近報告されていますので、以下に紹介します。
Fish consumption and risk of gastrointestinal cancers: A meta-analysis of cohort studies.(魚の摂取量と消化器系がんのリスク:コホート研究のメタ解析)World J Gastroenterol 20(41): 15398-15412, 2014年
この論文は、食事中の魚の摂取量と消化器系のがん(胃がんや大腸がん)の発生率の関係を検討した42件の前向きコホート研究をメタ解析の手法で検討しています。
対象になった人数は2,325,040人で、平均13,6年間の追跡期間中に24,115例の消化管のがん(gastrointestinal cancer)を認めています。
魚をほとんどあるいは全く摂取しないグループの消化管がんの発生率を1.0とした場合の相対リスクは、習慣的に魚を食べている人(regular fish consumers)で0.93 (0.88-0.98)、中等度に魚を摂取している人(low to moderate fish consumers)で0.94 (0.89-0.99)、魚の摂取が多い人(high fish consumers)で0.91 (0.84-0.97)でした。()内の数字は95%信頼区間。
全体として、1日の魚の摂取量が20g増えると消化管のがんが2%減少することが示されています(RR = 0.98; 95%信頼区間: 0.96-1.01).
サブグループの解析の結果、魚を多く摂取している人は結腸直腸がんのリスクが0.93(95%信頼区間:0.87-0.99; P <0.01)、食道がんのリスクが0.91(95%信頼区間:0.83-0.99; P <0.05)、肝細胞がんのリスクが0.71(95%信頼区間:0.48-0.95; P <0.01)に減少していました。
つまり、多くの前向きコホート研究のメタ解析の結果は、魚の摂取が増えると消化器系のがん(食道、胃、結腸、直腸、肝臓など)の発生リスクが減少し、一つの目安として1日20gの摂取で2%の減少、1日100gの摂取で10%程度の減少効果が得られるようです。
一般的に、魚にはエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)のようなオメガ3系不飽和脂肪酸が豊富です。また、がん予防効果のあるビタミンDやセレニウムも豊富です。
特に、オメガ3系不飽和脂肪酸のがん予防効果が重視されています。
細胞膜の脂肪酸から作られるプロスタグランジンやロイコトリエンなどの化学伝達物質の種類は脂肪酸の種類によって異なります。
プロスタグランジンE2(PGE2)は炎症反応や血管新生を促進し、細胞の増殖や運動を活発にしたり、細胞死が起こりにくくする生理作用があるため、がん細胞の増殖や転移を促進します。PGE2はω6 系不飽和脂肪酸のリノール酸から合成され、DHAなどのω3 系不飽和脂肪酸はPGE2が体内で増えるのを抑える働きがあります。
したがって、魚(特に魚の油)を多く食べる人はがんの発生が予防できると考えられています。
上記の論文で示された「魚の摂取量が20gで2%の発がん抑制」というのはあまり大きな予防効果ではないようにも思います。これは、調理法の違いを考慮しない摂取総量だけの効果からかもしれません。調理法を限定すれば、もっと発がん予防効果が高い可能性があります。(後述)
【「魚の摂取量が増えても膵臓がんは減らない」は正しいのか?】
魚の摂取量と発がんリスクの関係は、がんの種類によって異なります。膵臓がんに関しては、今まで報告された疫学研究のほぼ全てが「魚の摂取は膵臓がんを予防しない」という結論になっています。2012年に膵臓がんと魚の摂取に関するメタ解析の結果が報告されています。
Fish or long-chain (n-3) PUFA intake is not associated with pancreatic cancer risk in a meta-analysis and systematic review. (メタ解析およびシステマティック・レビューにおいて、魚や長鎖のオメガ3系多価不飽和脂肪酸の摂取は膵臓がんの発生リスクと関連しない)J Nutr. 142(6):1067-73. 2012年
【論文内容の要点】
動物実験や一部の疫学研究などで、ドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)のようなオメガ3系多価不飽和脂肪酸が膵臓がんのリスクを低下させる作用があることが推測されています。
しかし、魚やオメガ3系多価不飽和脂肪酸の摂取量と膵臓がんの発生率の関係を検討した疫学研究の結果は一定せず、結論はでていません。
そこで、この論文では、膵臓がんの発生リスクと魚やオメガ3系多価不飽和脂肪酸の摂取量の関係を検討した2012年までの論文を調査し、それらの論文のメタ解析とシステマティック・レビュー(系統的なレヴュー)の結果を報告しています。
9件のコホート研究を合わせた対象人数は1,209,265人で、平均9年の追跡で膵臓がんが3082例認めています。また10件のケース・コントロール(症例対照)研究では膵臓がん患者2514人と対照18,779人を比較しています。
魚やオメガ3系多価不飽和脂肪酸の摂取量の最も少ない群と最も多い群を比較していますが、結論は「魚やオメガ3系多価不飽和脂肪酸の摂取量と膵臓がんの発生リスクの間には関連は認めなかった」つまり「魚やオメガ3系多価不飽和脂肪酸を多く摂取しても膵臓がんを予防する効果は得られない」というものでした。
ただし、この論文の最後に「摂取する魚の種類や調理法の違いによる効果の違いをさらに検討する必要がある」と言っています。
さて、膵臓がんの予防効果が様々な食品や食品成分で検討されています。
そのような食品成分の中で、オメガ3系不飽和脂肪酸は膵臓がんを予防する効果が推測されています。それは、オメガ3系不飽和脂肪酸には抗炎症作用や抗酸化作用など様々な抗がん作用が報告されているからです。
膵臓がんの発生には慢性炎症の関与が強いので、抗炎症作用のある食品は膵臓がんなど多くのがんを予防すると考えられています。
しかし、膵臓がんの発生率や死亡率と魚の摂取量との関連を検討した7件のコホート試験の結果では、いずれのコホート研究でも、魚の摂取量が増えても膵臓がんの発生や死亡を減らす効果は認められていません。
しかし、これらの研究では、調理法の違い(フライなど)による影響は検討されておらず、魚の総摂取量しか検討されていません。
もともと、肉や脂肪の摂取量と膵臓がんの関係を主体に検討したコホート研究のデータを使ってついでに解析したような研究なので、魚の調理法などは解析の対象になっていないのです。
調理法の違いを考慮せずに単に摂取量だけの比較だと、魚やオメガ3系不飽和脂肪酸の健康作用やがん予防効果がマスクされる可能性があります。
実際、生の魚の摂取が多いと膵臓がんを予防するという報告はあります。魚のがん予防効果は調理法によって異なる可能性がかなり以前から指摘されています。
【魚のがん予防効果は調理法で異なる】
以下のような研究があります。
Types of Fish Consumed and Fish Preparation Methods in Relation to Pancreatic Cancer Incidence: The VITAL Cohort Study. (食事から摂取する魚の種類と調理法と膵臓がんの発生率との関係:VITALコホート研究) American Journal of Epidemiology 177(2):152-160. 2013年
【論文の要旨】
食事から摂取する魚の種類や調理法と膵臓がんの発生リスクとの関連は検討されていない。
この関連に関して、VITAL(VITamins And Lifestyle)コホート研究に参加しているワシントン州西地区の50~76歳の66,616人を対象に前向きコホート研究を行った。
食事の内容は摂取した食品の頻度のアンケート調査で行った。平均6.8年間の追跡期間中に151人が膵臓がんと診断された。
オメガ3系多価不飽和脂肪酸とフライにしていない魚の摂取量は膵臓がんの発生率と負の相関を認めた。(摂取量が多いほど膵臓がんの発生が少ない)
摂取量の多い上位3分の1の人は、摂取量の少ない下位3分の1の人に比べて、オメガ3系不飽和脂肪酸の場合で膵臓がんのハザード比は0.62(95%信頼区間:0.40 - 0.98. P=0.08)、フライにしていない魚(nonfried fish)の場合で0.55(95%信頼区間:0.34 – 0.88, P=0.045)であった。
ドコサヘキサンエン酸はエイコサペンタエン酸より膵臓がん予防効果が高かった。
フライにした魚や貝類の摂取量と膵臓がんの発生率の間には関連を認めなかった。
食事中の魚の摂取の健康作用はその魚の種類や調理法によって異なることが示唆された。
オメガ3系多価不飽和脂肪酸(特にドコサヘキサエン酸)とフライにしていない魚の摂取は膵臓がんの発生予防に有効であるが、貝類やフライにした魚は膵臓がんを予防する効果は認めなかった。
つまり、魚の膵臓がん予防効果は、魚の調理法によって影響を受けるということです。
魚の揚げ物(フライ)や焼き魚では、魚に含まれるオメガ3系多価不飽和脂肪酸が減少したり、酸化して飽和脂肪酸になると、オメガ3系不飽和脂肪酸の健康作用は減少します。フライにするとトランス脂肪酸が生成されるという報告もあります。
さらに、揚げたり焼くと、ヘテロサイクリックアミンやベンゾピレンのような変異原物質が産生し、膵臓発がんを促進する可能性もあります。
「焦げたものを食べるとがんになる」ということがよく言われます。肉や魚などの焦げた部分に発がん物質(DNAに変異を起こしてがんを発生させる物質)が含まれています。高温によって肉や魚などに含まれるアミノ酸やクレアチニンが反応して生じるヘテロサイクリックアミンや有機化合物の加熱によって生じるベンゾ[a]ピレンが、遺伝子を傷つける発がん物質(変異原物質)であることは良く知られています。
動物にヘテロサイクリックアミンやベンゾ[a]ピレンを投与するといろんながん(大腸がん、膵臓がん、乳がん、肝臓がんなど)を発生できます。
(ただし、動物実験でがんを発生するヘトロサイクリックアミンの量は極めて多く、通常の食生活において、焦げたものを多少多く摂取しても、それが高める発がんリスクは極めて低いと考えられています。ただし、肉や魚を高温で加熱すると、焦げに含まれる発がん物質だけでなく、脂肪が酸化されて過酸化脂質が多く産生され、この過酸化脂質はがんや動脈硬化のリスクを高めます。)
膵臓がんの発生率や死亡率と魚の摂取量との関連を検討した7件のコホート試験の結果では、いずれのコホート研究でも、魚の摂取量が増えても膵臓がんの発生や死亡を減らす効果は認められていません。その結果、「魚の摂取量と膵臓がんの発生リスクの間に関係はない」という結論が出ています。
しかし、魚の調理法の違いを含めた詳細な解析を行うと、フライにしない調理法での魚の摂取は膵臓がんを予防する効果が示されたということです。
つまり、ハンバーガーの代わりにフィッシュバーガーを食べても、魚のがん予防効果や健康作用は得られないということです。
【ω3系多価不飽和脂肪酸の抗がん作用】
ω3系多価不飽和脂肪酸のDHAとEPAの抗がん作用や抗炎症作用については211話、314話、351話で解説しています。
脂肪は代謝されてエネルギー源となり、また分解されて生成した脂肪酸は細胞膜などに取り込まれて細胞を構成します。
細胞の構成成分として使われる場合、その脂肪酸自体は変化せず、それぞれの構造や性質を保ったまま使われます。つまり、細胞膜をつくるとき脂肪酸の違いを区別せず、手当たり次第にあるものを使用するのです。その結果、食事中の脂肪酸の種類によって細胞の性質も変わってきます。
さらに、その細胞膜の脂肪酸から作られるプロスタグランジンやロイコトリエンなどの化学伝達物質の種類も違ってきて、炎症やアレルギー反応や発がんに影響することが明らかになっています。
例えば、リノール酸のようなω6系不飽和脂肪酸を多く摂取すると、血栓ができやすくなり、アレルギー反応を増悪させ、がんの発生頻度を高めます。ω6系不飽和脂肪酸を多く取り込んだがん細胞は増殖が早く転移をしやすくなります。
一方、魚油に多く含まれるドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)のようなω3系不飽和脂肪酸を多く摂取すると、炎症やアレルギーを抑え、血栓の形成や動脈硬化やがん細胞の発育を抑える作用があります。
DHAやEPAを多く摂取するとがん細胞が抗がん剤で死にやすくなることも報告されています。その理由は、食事から摂取されたω3系不飽和脂肪酸ががん細胞の膜の脂質組成を変えることによって、細胞増殖のシグナル伝達系に影響して増殖を抑えるからです。
したがって、ω3系不飽和脂肪酸/ω6系不飽和脂肪酸の比を上げるとがん細胞はおとなしくなります。(下図)

図:肉や食用油はアラキドン酸などω6不飽和脂肪酸が多く、プロスタグランジンE2の産生を増やして、がん細胞の増殖・転移や血管新生を促進し、がん細胞のアポトーシス(細胞死)を抑制する。魚に含まれるDHAやEPAなどのω3不飽和脂肪酸は逆の作用でがん細胞の増殖を抑制する。植物性油(コーン油、大豆油、ベニバナ油など)に含まれるリノール酸はω6不飽和脂肪酸で、亜麻仁油(フラックスシードオイル)と紫蘇油(エゴマ油)に含まれるαリノレン酸はω3不飽和脂肪酸になる。
DHAががんの予防や治療の効果を高めることは多くの臨床的研究や実験的研究で明らかになっています。
その他にも、抗がん剤の効果を増強し副作用を軽減する効果や、がん性悪液質を改善する効果なども報告されています。がん性悪液質とは、がん細胞や炎症細胞から産生される炎症性サイトカイン(TNF-αやIL-6など)によって体重減少や食欲不振などの症状が出る状態です。DHAやEPAには、TNF-αやIL-6などの炎症性サイトカインの産生を抑える抗炎症作用があります。
免疫状態を改善し、感染症を予防する効果も指摘されています。手術前や手術後にEPAやDHAを1日2~3グラム補充した食事は、手術後の炎症を軽減し、体重減少や栄養状態の悪化を防ぐ効果があるという臨床試験の結果が多数報告されています。
手術侵襲によって挫滅した組織で炎症反応がおこり、炎症性サイトカインの産生などが原因となって筋肉や体重の減少が起こりますが、EPAやDHAは炎症性サイトカインの産生を抑えるなどの作用によって筋肉の異化を抑制し、体重減少を予防し術後の経過を良くします。
このようにDHAやEPAやαリノレン酸のようなω3系脂肪酸はがんの発育を抑制し、アラキドン酸のようなω6系脂肪酸はがんの発育を促進するので、摂取するω3系脂肪酸とω6系脂肪酸の比が腫瘍の発育に影響することになります。(下図)。

図:ω6系(n-6系)多価不飽和脂肪酸のアラキドンサンはプロスタグランジンE2やロイコトリエンなど炎症性メディエーターを産生して炎症や組織のダメージを悪化させ、がん細胞の増殖を促進する作用を持つ。一方、ω3系(n-3系)多価不飽和脂肪酸であるEPA(エイコサペンタエン酸)とDHA(ドコサヘキサエン酸)は代謝されて抗炎症作用を示す多様な脂質メディエーターを産生することによって、慢性炎症や組織のダメージを軽減する効果や、がん細胞の増殖を抑える効果を発揮する。この抗炎症作用や組織保護作用は抗がん剤や放射線治療による正常組織のダメージの軽減や悪液質の改善にも役立つ。食事から摂取したDHAやEPAは細胞膜に取り込まれ、細胞膜脂質二重層中のアラキドン酸と入れ替わるので、DHAやEPAの摂取が多いと炎症やがんの抑制効果が得られる。
【脂肪酸合成を阻害するヒドロキシクエン酸と魚油と中鎖脂肪酸の相乗効果】
がん細胞では新規(de novo)の脂肪酸合成が亢進しています。
脂肪酸には2つの大きな役割があります。細胞の周囲や内側を構成する膜の主成分となっているリン脂質をつくることと、エネルギーを圧縮して貯蔵することです。
細胞の膜はリン脂質でできています。リン脂質(Phospholipid)は、構造中にリン酸エステル部位をもつ脂質の総称です。両親媒性を持ち、脂質二重層を形成して糖脂質やコレステロールと共に細胞膜の主要な構成成分となるほか、生体内でのシグナル伝達にも関わっています。
リン脂質は自己組織化によって脂質二重層を形成し、細胞膜の主要な構成要素となります。このリン脂質は、がん細胞内で新規に合成された脂肪酸をリン酸化して作られます。
がん細胞が分裂して増殖するためには、細胞の構成成分を作ることが必要で、細胞膜の主な構成成分であるリン脂質を作るために、新規(de novo)の脂肪酸合成が亢進しています。
細胞膜での飽和脂肪酸の構成比を増やすことによって細胞外のストレスから防御する機能があるとも言われています。
様々な理由でがん細胞では脂肪酸合成が亢進しており、脂肪酸合成の亢進ががん細胞の増殖や転移や抗がん抵抗性に関与していることが明らかになっています。
脂肪酸合成酵素の発現量が多いほど、がん細胞は抗がん剤が効きにくく、予後が悪い(再発や転移をしやすく、生存期間が短い)ことが報告されています。特に、乳がんや前立腺がんでは、脂肪酸合成酵素の発現が高いほど予後が悪いことを示す研究結果が多く報告されています。
正常細胞では、食事から摂取した外来性脂質が積極的に利用され、脂質の新規合成経路が抑制されています。脂肪酸の新規合成にはエネルギーが必要であるため、エネルギーを節約する観点からは、食事から摂取した脂肪酸をそのまま利用する方が良いといえます。
しかし、がん細胞では外来性脂質の摂取が多くても、それを利用しようとせず、エネルギーを消費してでも、自分で新たに合成する方を選択しているのです。
そこで、がん細胞内での新規の脂肪酸合成を阻害し、食事からのDHAやEPAの摂取を増やすと、がん細胞の細胞膜に取込まれるDHAやEPAの量が増えて抗がん作用を増強できる可能性があります。
脂肪酸の合成を阻害する方法としてダイエットに使われているヒドロキシクエン酸があります(404話参照)
さらに、ケトン体が脂肪酸の合成を阻害する作用があるので、ケトン食の併用も有効です(388話)。
さらに、ω3系不飽和脂肪酸(DHA, EPA)と中鎖脂肪酸(MCTオイル、ココナッツオイル)の併用は抗がん作用を高めます(349話参照)。
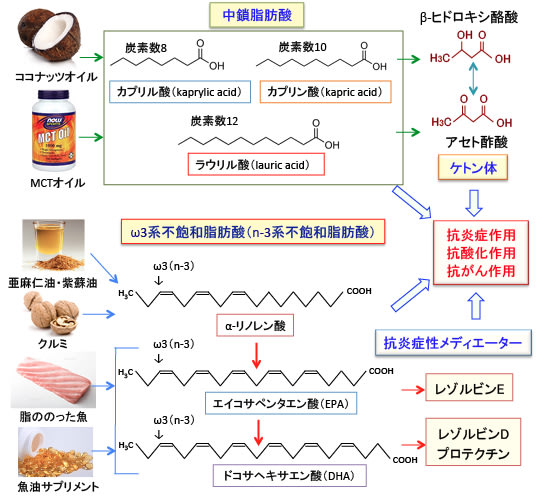
図。ココナッツオイルやMCTオイル(100%中鎖脂肪酸)の中鎖脂肪酸は糖質制限の条件下でケトン体(βヒドロキシ酪酸やアセト酢酸)を多く産生する。ω3系不飽和脂肪酸のドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)はレゾルビンやプロテクチンなどの抗炎症性の脂質メディエーターを産生する。ケトン体やDHA/EPA由来の抗炎症性メディエーターは抗炎症作用や抗がん作用を有する。さらに、ω3系多価不飽和脂肪酸自体に抗酸化作用があり、アラキドン酸と競合することによって抗炎症作用や抗がん作用を発揮する。がんのケトン食療法において、ω3系多価不飽和脂肪酸(αリノレン酸、DHA、EPA)と中鎖脂肪酸を多く摂取するメリットは大きい。(349話より引用)
以上のことから、中鎖脂肪酸とω系不飽和脂肪酸を多く摂取するケトン食に脂肪合成を阻害するヒドロキシクエン酸の併用は抗腫瘍効果を高める作用が期待きると言えます。
さらに、解糖系とペントースリン酸経路を阻害する(その結果、脂肪酸合成も阻害できる)2−デオキシグルコースの併用も効果が期待できます。(トップの図)
脂ののった魚には100グラム当たり数グラムから20グラム程度の脂肪が含まれ、ω3系多価不飽和脂肪酸が1~6グラム程度含まれています。DHA/EPAも数百mgから4グラム程度含まれています。
魚の脂のω3:ω6の比率は5~10程度あります。
肉類が多い西洋食ではω6がω3の20倍以上という報告もあります。魚の多い日本食ではω6はω3の2~3倍程度に低いのですが、野菜や大豆はω6が主体なので、ω3の摂取量が ω6の摂取量を超えるというのは至難です。しかし、魚の油はω3がω6の数倍なので、脂(油)の多い魚を多く摂取して、食事中のω3:ω6の比を1以上に上げれば、がん細胞の増殖抑制に有効です。
脂の多い魚かDHA/EPAのサプリメントでDHA/EPAを1日数グラム程度を摂取するのは、抗がん作用を高めることになると言えます。脂ののった魚を1日100~200g程度食べることはがんの予防や治療に効果が期待できます。

表:脂の多い魚には、オメガ3系多価不飽和脂肪酸がオメガ6系多価不飽和脂肪酸の数倍から10倍程度含まれる。抗がん作用のあるDHAとEPAも100g当たり1~4g程度と多く含まれる。
【培養した微細藻類由来DHAが注目されている】
がんや認知症や循環器疾患の予防や治療にDHAやEPAが有効であることは確立しています。従って、DHAやEPAの多い脂の乗った魚を多く食べることが推奨されています。
しかし、魚のメチル水銀やマイクロプラスチックなど海洋汚染に由来する有害物質の魚への蓄積の問題は、魚食を安易に推奨できないレベルまで深刻になっています。
そこで、海洋でDHAとEPAを作っている微細藻類を培養して、培養した微細藻類からDHAとEPAを取り出せば、汚染物質がフリーのDHA/EPAを製造できます。(下図)

図:オメガ3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)は微細藻類が合成している(①)。プランクトン(②)が微細藻類を食べ、小型魚(③)がプランクトンを食べ、大型魚(④)が小型魚を食べるという食物連鎖によって、魚油にEPAやDHAが蓄積している。人間は魚油からDHAとEPAを摂取している(⑤)。環境中の水銀(⑥)が魚に取り込まれてメチル水銀になって魚に蓄積する(⑦)。DHAとEPAを産生している微細藻類をタンク培養して油を抽出すると(⑧)、汚染物質がフリーで、植物由来のDHA/EPAが製造できる(⑨)。
最近の多くの研究で、がん治療におけるドコサヘキサエン酸(DHA)の有効性が明らかになっています。植物油に含まれるαリノレン酸は人間の体内ではDHAにはほとんど変換されません。抗がん作用はエイコサペンタエン酸(EPA)よりドコサヘキサエン酸(DHA)の方が強いことが報告されています。
がん治療には1日3から5グラムのDHAの摂取が有効であることが多くの研究で示されています。通常の魚油の場合、DHA含有量は10%から20%程度です。1日5グラムのDHAを摂取するには25gから50gの魚油の摂取が必要になります。
そこで、微細藻類の中でもDHA含有量が極めて多いシゾキトリウム(Schizochytrium sp.)をタンク培養して製造したDHA(フランス製)を原料にした「微細藻類由来オイル(DHA含有量51%)」を製造してがん治療に使用しています。閉鎖環境での培養のため、汚染の心配がありません。しかも、植物由来なので、菜食主義者(ベジタリアン、ヴィーガン)も摂取できます。
詳細は以下のサイトで紹介しています。
http://www.f-gtc.or.jp/DHA/DHA-51.html
【油を変えるとがんが消える?】
食事の内容が、がんの発生や再発、さらにはがん治療の結果に影響することが多くの研究で明らかになっています。食品の中にはがん細胞の増殖を促進する成分や抑制する成分があるからです。
食事中のいくつかの栄養素の変更が、がん治療の有効性を変える可能性が指摘されています。特に脂肪は、その種類によってがん細胞への影響が異なります。がん細胞が細胞分裂して数を増やすとき、食事から摂取した脂肪酸を細胞膜に取り込むからです。取り込んだ脂肪酸の種類によってがん細胞の性質が変化するのです。
魚油に多く含まれるドコサヘキサエン酸やエイコサペンタエン酸のようなオメガ3系多価不飽和脂肪酸、オレイン酸とポリフェノール類の多いオリーブオイルはがん細胞の増殖を抑制します。中鎖脂肪酸はケトン体の産生を増やすことによってがん細胞の増殖を抑えます。
一方、肉に含まれる飽和脂肪酸や食用油に含まれるオメガ6系不飽和脂肪酸はがん細胞の増殖や転移を促進する作用があります。
がん細胞の増殖を抑制する油の摂取を増やし、がん細胞を悪化させる油の摂取を減らすと、がんを縮小したり消滅することも不可能ではありません。がんの治療や再発予防における油の種類による影響の違いを知ることは、がん治療の効果や生存率を高める上で重要です。
新刊紹介:

| « 422)高身長は... | 424)オーラノ... » |




