がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
681)医薬品再利用とイベルメクチン
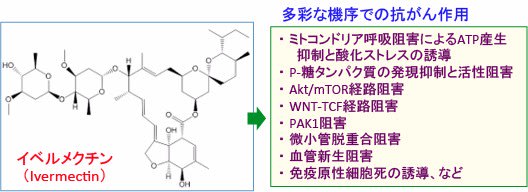
図:寄生虫疾患治療薬のイベルメクチンは、ミトコンドリア呼吸阻害によるATP産生抑制と酸化ストレスの亢進、がん細胞における抗がん剤多剤耐性の原因であるP-糖タンパク質の発現抑制と活性阻害、がん細胞の増殖を亢進するAkt/mTOR経路やWNT-TCF経路の阻害、RASシグナル伝達系の中心的役割を担うp21活性化キナーゼ(PAK-1)の阻害作用、微小管脱重合阻害による細胞分裂阻止、血管新生の阻害、抗腫瘍免疫を活性化するがん細胞の免疫原性細胞死の誘導など様々な機序で抗がん作用が報告されている。
681)医薬品再利用とイベルメクチン
【がん治療薬以外でがんに効く薬が多数ある】
莫大な費用がかかる新薬の開発において、近年注目されているのが、既存の医薬品が他の治療薬にならないかを検討する医薬品再開発(再利用)です。がん以外の疾患の治療に用いられている既存薬を、がんの治療薬として再開発(再利用)する研究が注目されています。
がん治療以外で承認されている2000以上の医薬品のうち、少なくとも235個の薬において、in vitro、in vivoまたは臨床的に抗腫瘍活性が証明されています。
この235種類の医薬品のうち、67(29%)はWHO必須医薬品リストの薬であり、176(75%)は特許期限切れの医薬品で、133(57%)はがん患者での臨床データがあります。4種類(サリドマイド、全トランス・レチノイン酸、ゾレドロン酸、非ステロイド性抗炎症剤)はがん治療における使用法のガイドラインが既に存在します。
その他に、ランダム化臨床試験でがん治療に有効性が報告されている再利用医薬品としてシメチジン(大腸がん)、プロゲステロン(乳がん)、イトラコナゾール(肺がん)などが報告されています。(出典:Repurposing non-cancer drugs in oncology - How many drugs are out there? bioRxiv. 2017:197434.)
このような薬をがん治療の目的で使用しようとすると、日本では保険適用の疾患を持っていなければ処方はできません。例えば、メトホルミンを保険で処方するには「糖尿病」という病名が必要です。保険診療の医療機関では、保険適用の病気を持っていなければ、たとえがんに対する効果が証明されていても使えないことになります。
しかし、自由診療の医療機関であれば保険適用外の処方も可能になります。自由診療(自費診療)であれば、医師は保険適用外(off-label)での医薬品の処方はできます。
このようながん治療において有用な保険適用外使用の例は多くあり、このような薬ががんの代替医療で利用されています。
【がん治療薬として注目されている寄生虫治療薬のイベルメクチン】
最近のがん治療薬は高額です。日本では、国民皆保険と高額療養費制度によって患者さんの個人負担が少ないので、1ヶ月数百万円の薬でも積極的に使用しています。
しかし、開発途上国のように高額な治療薬の使用が困難な国では、安価な医薬品を使ったがん治療の研究が盛んです。
以下のような総説論文があります。
Old wine in new bottles: Drug repurposing in oncology. (新しいボトルの古いワイン:腫瘍学における薬物の再目的化)Eur J Pharmacol. 2020 Jan 5;866:172784.
【要旨】
新しい抗がん剤の開発は、コストの増加と、多くの時間の消費、および高い失敗リスクにより、製薬業界は薬品開発プロセス全体を促進および加速する代替戦略を模索している。特に、既存の医薬品を再利用(再目的化)する戦略は、治療効果が不十分ながん治療において、新しい治療選択肢を提供する可能性を秘めている。
しかし、薬剤開発の新しいトレンドである再利用戦略は、新しい抗がん剤の発見プロセスを補完するものであり、新規の医薬品の開発そのものに代わりうるものではない。
再利用可能な抗腫瘍薬候補として最良の条件は、元の特許保護がすでに失効しており、新しい治療適応症とともに新しい特許保護を可能にする製剤を作成する可能性がある薬剤である。
この総説論文では、再目的化戦略の利点を説明し、がんの予防と治療の両方で抗がん剤として再利用できる可能性があるアルテスネイト、アスピリン、シメチジン、ドキシサイクリン、イベルメクチン、メトホルミン、ラパマイシン(、サリドマイドなどの有望な候補の概要を提供する。さらに、これらの薬物が作用するシグナル伝達経路および分子標的に関する研究のいくつかを紹介し、それらの抗がん効果の根底にある作用機序について解説する。
この論文はポーランドの研究者からの報告です。
この論文で言及されているアルテスネイト、アスピリン、シメチジン、ドキシサイクリン、イベルメクチン、メトホルミン、ラパマイシン、サリドマイドは私が実践しているがんの補完・代替療法のリストに全て入っています。(全て処方可能です)
これは、医薬品再利用によるがん治療の研究を調査すると、必然的にたどり着く結論とも言えます。
開発途上国では、高額な新薬の開発より、安価ながん治療薬が求められており、医薬品再利用の研究が注目されています。
一方、日本では、がん治療の専門医は医薬品再利用によるがん治療に全く興味が無いので、そのような研究論文は無視します。したがって、このような医薬品が実際にがん治療に有効であることも知りません。
この論文でも解説されているイベルメクチン(ivermectin)はこの数年間に多くの研究が報告され、がんの代替療法の分野で注目されています。
【イベルメクチン:ノーベル賞を受賞した寄生虫疾患治療薬】
イベルメクチンは、中南米やアフリカのナイジェリアやエチオピアで感染者が多く発生している糸状虫症の特効薬です。糸状虫症はオンコセルカ症や河川盲目症とも呼ばれ、激しい掻痒、外観を損なう皮膚の変化、永久失明を含む視覚障害を起こします。
その他、リンパ系フィラリア症など多くの種類の寄生虫疾患に有効で、人間だけでなく、動物の寄生虫疾患治療薬として広く使用されています。
2015年ノーベル生理学・医学賞は「寄生虫感染症に対する新規治療物質に関する発見」で北里大学特別栄誉教授の大村智氏および米ドリュー大学名誉リサーチフェローのW. C. キャンベル(William C. Campbell)氏、「マラリアの新規治療法に関する発見」で中国中医科学院教授の屠呦呦(ト・ユウユウ,Youyou Tu)氏の3人に贈られています。
「マラリアの新規治療法」というのはアルテミシニン誘導体のことです。このアルテミシニン誘導体も非常に安価なので、がん治療での使用が積極的に行われています。
大村博士は様々な抗生物質を作り出すストレプトマイセス属の土壌細菌に注目し、土壌サンプルから採集した菌を培養し、キャンベル博士はこれらの活性を調べ、寄生虫に対して有効な物質を突き止めました。それがストレプトマイセス・アベルミティリス(Streptomyces avermitilis)という菌が作り出す物質で、アベルメクチンと名づけられました。 このアベルメクチンを化学的に改変してさらに効果を高めたのがイベルメクチンです。
アベルメクチンの発見が1967年で、イベルメクチンの人間への使用が1987年にFDA(米国食品医薬品局)によって承認されています。
この薬によって、オンコセルカ症(河川盲目症)やリンパ系フィラリア症など寄生虫が引き起こす感染症を劇的に減らすことが可能になりました。
オンコセルカ症は寄生虫によって目の角膜に慢性の炎症が起こり、失明につながります。リンパ系フィラリア症は現在も世界で1億人以上が感染し、成虫やミクロフィラリアに起因するリンパ管やリンパ節の炎症を起こし、これが繰り返されることでリンパ管の閉塞や破裂が起こります。その結果、身体の感染部位が膨れ上がって象皮病や陰嚢水腫などの症状を引き起こします。
イベルメクチンは、無脊椎動物の神経・筋細胞に存在するグルタミン酸作動性クロール(Cl)チャネルに選択的かつ高い親和性を持って結合します。その結果、クロール(Cl)に対する細胞膜の透過性が上昇して神経又は筋細胞の過分極が生じ、寄生虫が麻痺を起こし、死に至ります。哺乳類ではグルタミン酸作動性Cl−チャネルの存在が報告されていないので、安全性は極めて高いと言えます。
このように、イベルメクチンの安全性は非常に高く、寄生虫に感染した人間に対して、寄生虫が死滅する過程で引き起こされる免疫応答や炎症反応に起因する症状以外には、副作用をほとんど起こらないと言われています。したがって、寄生虫が体内にいなければ、副作用はほとんど発生しません。
さらに、多数の前臨床試験で抗がん作用が確認されています。したがって、がん治療薬として再利用を検討する候補薬としての条件が揃っていると言えます。
【イベルメクチンは1回の投与で牛皮膚乳頭腫を消滅する】
乳頭腫がイベルメクチンのたった1回の投与で完全に消失するという報告があります。
Ivermectin is an effective treatment for bovine cutaneous papillomatosis.(イベルメクチンは、ウシ皮膚乳頭腫症の効果的な治療法である)Res Vet Sci. 2007 Dec;83(3):360-3.
【要旨】
この研究は、ウシ皮膚乳頭腫症の治療に対するイベルメクチンの有効性を評価する目的で行った。 皮膚乳頭腫症の生後9か月から17か月の24頭のホルスタイン子牛を、グループ1に6頭、グループ2および3に9頭の3グループに分けた。
グループ1はコントロール群で治療を受けなかった。 体重1kg当たり0.2mgの用量のイベルメクチンを、グループ2の動物に1回皮下投与し、グループ3の動物には15日間隔で2回皮下投与した。
最初のイベルメクチンの投与を0日目として、3か月後まで15日間隔で動物をモニターした。 対照グループ(グループ1)では腫瘍の縮小は観察されなかった。 グループ2では9匹中8匹(88.8%)、グループ3では9匹中7匹(77.7%)が3か月の観察期間内に皮膚乳頭腫の完全に消失した。 イベルメクチンは、単回投与または二回投与のいずれかの投与法で皮膚乳頭腫症の治療として有効であると結論付けられた。
牛皮膚乳頭腫症というのは牛パピローマウイルスの感染によって発症する皮膚のイボ(乳頭腫)です。
皮膚乳頭腫ができた9頭の乳牛に、イベルメクチンを一度だけ皮下注射したところ、3か月後に8頭の乳牛から皮膚乳頭腫が消滅してしまった、という結果です。
薬の投与量は体重1 kg 当たり0.2 mg です。この量は、寄生虫を駆除するために人間が通常経口する量と同じです。一回の投与だけで、イボがほとんど大部分 (9割) 消えてしまうということです。
【イベルメクチンは様々な機序で抗がん作用を発揮する】
培養細胞を使った実験では、乳がん、卵巣がん、前立腺がん、頭頸部がん、大腸がん、膵臓がん、悪性黒色腫など多くのがん種で抗腫瘍効果が報告されています。
増殖抑制やアポトーシス誘導だけでなく血管新生阻害作用を示すことも報告されています。動物実験でも抗腫瘍効果が認められています。
イベルメクチンの抗がん作用のメカニズムとして、ミトコンドリア呼吸阻害によるATP産生抑制と酸化ストレスの誘導、がん細胞における抗がん剤多剤耐性の原因であるP-糖タンパク質の発現抑制と活性阻害、がん細胞の増殖を亢進するAkt/mTOR経路やWNT-TCF経路の阻害、RASシグナル伝達系の中心的役割を担うp21活性化キナーゼ(PAK-1)の阻害作用、微小管脱重合阻害による細胞分裂阻止、血管新生の阻害、抗腫瘍免疫を活性化するがん細胞の免疫原性細胞死の誘導など、様々な機序で抗がん作用が報告されています。
イベルメクチンの培養細胞および動物実験で認められた抗腫瘍活性は、ヒト薬物動態研究に基づいて臨床的に到達可能な濃度で達成されます。
ターゲットが単一で非常に選択的な抗がん剤は、抵抗性を獲得したがん細胞の出現が早いという欠点が知られています。したがって、ターゲットが複数の多彩なメカニズムで抗がん作用を発揮する抗がん剤を開発することの重要性が指摘されています。
この観点で、イベルメクチンは複数の分子をターゲットにし、複数の増殖シグナル伝達経路に作用して抗腫瘍効果を発揮します。がん幹細胞の特性を維持する遺伝子の発現を抑制することも報告されています。
【イベルメクチンは微小管に作用して細胞分裂を阻害する】
微小管は細胞骨格を形成する蛋白質であり, チュブリンというタンパク質が集まった長い直径約25nmの管状構造をもっています。
細胞分裂する際に、複製されたDNAは染色体と呼ばれる構造に凝集し、細胞の両極へと引き寄せられ、等分されますが、このとき染色体を分裂した2つの細胞に分離する働きをするのが微小管です。
微小管はαチュブリンとβチュブリンが結合したヘテロ二量体(ヘテロダイマー)を基本単位として構成されています。
チュブリンから微小管が形成される過程を重合、微小管がチューブリンに戻る過程を脱重合といいます。この重合や脱重合の過程を阻害すると細胞分裂を阻害することになるので、微小管阻害剤が抗がん剤として多く開発されています。

図:微小管はαチュブリンとβチュブリンが結合したヘテロ二量体(ヘテロダイマー)を基本単位として構成され(①)、チュブリンのヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び(②)、これが13本集まって管状の構造(直径25nm)を取ったものが微小管となる(③)。細胞分裂が行われる際、細胞の中ではDNAが複製され、複製されたDNAは微小管によって引き寄せられ、分裂後のそれぞれの細胞に分けられる(④)。微小管の重合や脱重合を阻害すると、細胞分裂のM期を停止させてアポトーシスを起こす。
イベルメクチンが微小管に結合して細胞分裂を阻止する作用が報告されています。以下のような報告があります。
Ivermectin binds to Haemonchus contortus tubulins and promotes stability of microtubules.(イベルメクチンは捻転胃虫のチュブリンに結合し、微小管の安定性を促進する)Int J Parasitol. 2015 Aug;45(9-10):647-54.
【要旨】
捻転胃虫(Haemonchus contortus)は家畜の線虫で、重度の病気や死亡を引き起こすことがある。
イベルメクチンは、グルタミン酸依存性塩化物チャネルを標的とする抗寄生虫薬であり、人間、家畜、愛玩動物、農業で広く使用されている。 β-チューブリンの遺伝的変化とイベルメクチンへの曝露との関連性は以前に報告されているが、イベルメクチンとチューブリンの直接の結合はこれまで実証されていない。
チューブリン/微小管は、寄生虫疾患やがんの治療で使用される多くの有糸分裂阻害薬の重要な標的である。
イベルメクチンは捻転胃虫のα-およびβ-チューブリンの重合の速度と程度を増加し、トリプシンによるタンパク質分解からα-およびβ-チューブリンを保護する。イベルメクチンとチューブリンモノマー間の直接結合は、低マイクロモルレベルの濃度での親和性を示した。
イベルメクチンとタキソールはチューブリンへの結合をめぐって競合し、イベルメクチンが寄生虫および哺乳類のチューブリンのタキソール結合ポケットと相互作用することが予測された。
まとめると、我々のデータは、イベルメクチンが微小管に結合してそれを安定化させ、その結果、有糸分裂を停止させることを示している。この研究は、イベルメクチンの新規の薬理作用を示し、有糸分裂阻害剤としての可能性を明らかにしている。
イベルメクチンはタキソールと同じ場所に結合して、微小管を安定化して脱重合を阻止し、細胞分裂を阻止するという報告です。以下の同じグループからの報告です。
Ivermectin exhibits potent anti-mitotic activity.(イベルメクチンは強力な細胞分裂阻害作用を示す)Vet Parasitol. 2016 Aug 15;226:1-4.
【要旨】
イベルメクチンは、家畜やペットや人間の抗寄生虫薬として使用されている。 イベルメクチンの主要な作用部位は、グルタミン酸依存性塩化物チャネルであると考えられている。しかし、我々は最近、イベルメクチンと線虫チューブリンとの間でマイクロモルレベルの親和性で、直接的な相互作用を示すことを報告した。
ここでは、イベルメクチンが哺乳類のチューブリンとも相互作用することを報告する。
この可能性をテストするために、チューブリン重合アッセイを使用して、イベルメクチンが哺乳類チューブリンの重合度を増加させることを発見した。
さらに、イベルメクチンをHeLa細胞に投与すると、哺乳類のチューブリンの低温によって誘導される脱重合作用に対してチューブリンの重合が安定化され、in vitroでHeLa細胞の細胞分裂が妨げられた。ただし、HeLa細胞の分裂に対するイベルメクチンによる阻害作用は可逆的であった。
これらの実験結果は、哺乳類の微小管がイベルメクチンに結合し、マイクロモルのレベルの濃度でイベルメクチンによって微小管の重合が安定化されたことを示唆している。したがって、イベルメクチンはチューブリンの重合と脱重合のダイナミクスに影響を与え、その結果、細胞死を引き起こす可能性がある。
イベルメクチンはすでにヒトでの使用が承認されているため、有糸分裂阻害剤としての開発は魅力的な選択肢の可能性がある。
同じ寄生虫疾患治療薬のメベンダゾールは微小管の重合の段階で阻害します。抗がん剤のビンクリスチンも微小管の重合を阻害します。
イベルメクチンはタキサン系抗癌剤(パクリタキセル、ドセタキセル)と同じで、微小管に結合し、微小管の重合促進・安定化をもたらし細胞分裂を阻害すると考えられています。
したがって、メベンダゾールとイベルメクチンは異なる機序で微小管阻害作用を発揮すると言えます。
【イベルメクチンはp21活性化キナーゼ(PAK)を阻害する】
がん細胞の多くは、がん遺伝子とそのシグナル伝達経路によって制御されています。これらの経路の分析により、多くのがん治療薬(分子標的薬)が開発されています。
最も成功した薬のいくつかは、プロテインキナーゼを標的にしています。細胞の生存、細胞の増殖、および細胞の移動に重要な役割を果たすプロテインキナーゼは、がん細胞の成長と腫瘍浸潤における役割のため、重要な標的です。
そのようなキナーゼの1つのグループであるp21活性化キナーゼ(PAK)は、がん治療の標的として有望視されています。
多くの悪性腫瘍において、PAKの過剰な発現や活性化が認められており、PAKをターゲットにした治療法が注目されており、選択的なPAK阻害剤の探索と開発に関する取り組みが進行しています。
PAKキナーゼの阻害ががん細胞の抗がん剤感受性を高め、抗腫瘍免疫を増強することが報告されています。
がんの進行は、複数の遺伝的変異の蓄積によって特徴付けられ、Krasがん遺伝子の変異が多くのがん細胞で見られます。
Kras遺伝子内のコドン12、13または61にミスセンス変異が存在すると、Krasタンパク質の生理的不活性化サイクルが破壊され、GTPase活性化タンパク質(GAP)の存在下でも構成的に活性化された状態になります。
Krasは、上皮成長因子受容体(EGFR)のシグナル伝達経路において重要な役割を担うタンパク質です。そのシグナル伝達経路は複雑なカスケードを構成し、がんの発生と進行に関与しています。
Krasの変異による恒常的な活性化は、PAKキナーゼなどのエフェクタータンパク質の活性化によってがん細胞の増殖や転移を促進します。

図:低分子量Gタンパク質の一種のKRASは、GDP結合型が不活性型で(①)、上皮成長因子受容体などからの刺激を受けてGTP結合型となって活性化され(②)、エフェクタータンパク質に作用して情報を伝達し、細胞の増殖や転移を亢進し、アポトーシス(細胞死)に抵抗性になる(③)。多くのがん細胞で、Kras変異によるKrasの恒常的活性化が起こっている。
p21活性化キナーゼ(PAK)はKrasの重要な下流エフェクターであり、細胞増殖、アポトーシス、浸潤/移動および化学療法抵抗性の調節に関与しています。
Krasシグナル伝達の下流エフェクターとして、p21活性化キナーゼ(PAK)は、複数の発がん性シグナル伝達経路の連結部に位置しています。
Krasタンパク質は、その表面に明確な薬物結合ドメインが存在しません。これまでのところ、30年以上にわたる研究にもかかわらず、直接Krasのタンパク質をターゲットにした薬は開発されていません。
PI3K、AKT、MEKなど、Krasシグナル伝達系の重要な下流のエフェクターを標的とした治療薬が開発されましたが、ほとんどすべてのケースで耐性が急速に出現し、これらの分子標的の効果が低下しました。
この課題を克服するために、Krasタンパク質の新しい下流エフェクターを標的とするアプローチが研究されており、そのような新規エフェクターのファミリーの1つとしてp21活性化キナーゼ(PAK)が注目されています。
PAKはKrasおよびCdc42やRacのような低分子量GTPaseによって、直接的および間接的なメカニズムによって活性化されます。PAKは複数の発がん性シグナル伝達経路の中心に位置しています。
イベルメクチンがPAK-1の活性を阻害することが報告されています。
以下のような報告があります。PAK研究の第一人者の丸田浩博士たちの研究報告です。
Ivermectin inactivates the kinase PAK1 and blocks the PAK1-dependent growth of human ovarian cancer and NF2 tumor cell lines.(イベルメクチンは、キナーゼPAK1を不活性化し、ヒト卵巣がんおよびNF2腫瘍細胞株のPAK1依存性の成長を阻止する)Drug Discov Ther. 2009 Dec;3(6):243-6.
【要旨】
イベルメクチンは、線虫のGABA(γ-アミノ酪酸)受容体を阻害し、哺乳類の対応する受容体には作用しないので、線虫を非常に低用量(0.2 mg / kg)で選択的に死滅する寄生虫治療薬である。
数年前にロシアのグループから、イベルメクチンは、マウスに悪影響を与えることなく、はるかに高い用量(3-5 mg / kg)でマウスのヒトメラノーマおよび他のいくつかのがん異種移植片の成長をほぼ完全に抑制できることが報告された。
しかし、その抗がん機序は分子レベルでまだ解明されていない。イベルメクチンのPAK1阻害作用の可能性に対する最初のヒントは、致死量以下のイベルメクチンが線虫の産卵数を劇的に減少させるという最近の発見であった。
PAK1遺伝子欠損(遺伝子ノックアウト)、またはプロポリスの主要な抗がん成分であるCAPE(カフェ酸フェネチルエステル)やARC(アルテピリンC)などの天然のPAK1阻害剤による治療も、全く同じ効果を引き起こす。この事実は、キナーゼPAK1がイベルメクチンの新しい標的である可能性を示唆している。
このキナーゼは、膵臓がん、結腸がん、乳がん、前立腺がん、NF(神経線維腫症)腫瘍などのヒトのがんの70%以上の増殖に必要である。
この研究では、イベルメクチンがヒト卵巣がんおよびNF2欠損シュワン細胞腫細胞株の発がん性キナーゼPAK1を阻害し、細胞培養におけるPAK1依存性の増殖を抑制することを初めて実証した。50%増殖阻害濃度(IC50)は細胞株に応じて5〜20μMの間であった。
以下のような報告があります。フランスの研究グループからの論文です。
Macrocyclic lactones inhibit nasopharyngeal carcinoma cells proliferation through PAK1 inhibition and reduce in vivo tumor growth.(大環状ラクトンは、PAK1阻害を介して鼻咽頭がん細胞の増殖を阻害し、in vivoでの腫瘍成長を抑制する)Drug Des Devel Ther. 2018 Sep 7;12:2805-2814.
【要旨】
目的:エプスタイン-バーウイルス(Epstein-Barr virus :EBV)に関連するがんである鼻咽頭がんは、ヨーロッパおよび北米では稀であるが、南アジア、北アフリカ、イヌイットなど、世界の一部の地域では公衆衛生上の問題となっている。
鼻咽頭の解剖学的構造と位置のため、原発鼻咽頭がんの治療に手術が使用されることはほとんどない。化学療法と併用または非併用の放射線療法による治療は、原発腫瘍には有効であるが、致命的な再発や転移を防ぐことはできない。
方法:高容量スクリーニングによる新しい治療用分子の検索は、有望な薬剤としてのイベルメクチンを同定した。イベルメクチンは、米国食品医薬品局(FDA)が承認した大環状ラクトンであり、駆虫剤および殺虫剤として広く使用されており、がんに対する有効性も示されている。
結果:この研究では、イベルメクチンが鼻咽頭がん細胞に対してin vitroの実験系で細胞傷害活性を持ち、PAK-1活性の阻害によるMAPK経路の活性化と抑制することを示す。
さらに、テストされたすべての大環状ラクトンとPAK1阻害剤は、EBV陽性およびEBV陰性の鼻咽頭がん細胞に対してin vitroで細胞毒性を示す。また、米国食品医薬品局(FDA)が承認した用量でのイベルメクチンの腹腔内反復注射は、有意な毒性がなく、ヌードマウスの皮下に移植した鼻咽頭がんの増殖を減少させることも示した。
結論:大環状ラクトンは、検出可能な有害作用なしにPAK-1を標的とする鼻咽頭がんに対する有望な治療薬と思われる。
活性化したPAK-1がシグナル伝達経路に位置する様々なタンパク質をリン酸化して生存や増殖を制御しています。したがって、PAK-1阻害はがん細胞の増殖抑制に重要なメカニズムになります。

図:セリン/スレオニンキナーゼのAktは、多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こす。PAK-1はAktやRaf/MEK/Erk経路を亢進してがん細胞の増殖や生存を促進する。
以上のように、イベルメクチンのPAK阻害作用は世界中のがん研究者が注目しています。
がん治療のターゲットとしてのPAKの重要性と、その安全性の高さを考慮すると、PAK阻害剤としてのイベルメクチンの利用は極めて有用だと思います。
【イベルメクチンの服用量についての考察】
イベルメクチンを使用した臨床試験の結果はまだ出ていません。多分、まだ臨床試験は実施されていないと思います。したがって、どの程度の服用量が必要かは不明です。人間のがんに対する有効性も不明です。
私個人の経験としては、標準治療で匙を投げられた進行がんの患者さんにインフォームド・コンセントのもとに、がんの代替療法として実践しています。
寄生虫疾患の場合は、体重1kg当たり0.2mg(60kgで12mg)を1回服用するだけです。寄生虫疾患の場合は、1回の服用で体内の寄生虫は全滅できます。
しかし、がん治療の場合は継続して体内濃度を維持する必要があります。
したがって、体重1kg当たり0.2mg(60kgで12mg)の連日投与を行っていますが、副作用はほとんど経験しません。
体内の半減期が18時間くらいなので、1から2週間ほど連日投与した後は2日に12mgという投与も行っています。
連日あるいは隔日投与の根拠は、培養細胞を用いた実験では、抗がん作用を期待するには数μmolレベルの濃度が必要だからです。
日本人における研究では、健康成人男子にイベルメクチンを錠剤で単回経口投与した場合、主要成分(H2B1a)の平均血清中濃度は、12mg投与では投与後4時間で32.0(±7.3)ng/mL、6mg投与では投与後5時間で19.9(±4.8)ng/mLの最高値を示しました。
外国人における研究では、イベルメクチンを錠剤で12mg(平均用量は165μg/kg)単回経口投与した場合、主要成分(H2B1a)の平均最高血漿中濃度は、投与後約4時間で46.6(±21.9)ng/mLでした。血漿中濃度は、投与量(6、12、15mg)にほぼ比例して増加しました。
イベルメクチンの血漿中消失半減期は約18時間でした。 イベルメクチンは肝臓で代謝されます。
イベルメクチンの分子量は約870くらいなので(イベルメクチンは2種類の構造体の混合なので、正確な分子量は評価不能)、30ng/ml(30μg/L)は 35nM(nano mol)程度になります。50ng/mlは58nMです。
870μg/Lが1μMですので、10μMは8.7μg/mlになります。
そこで、培養細胞や動物実験のデータを参考にする必要があります。
丸田先生のPAK1阻害の研究では、50%増殖阻害濃度(IC50)は細胞株に応じて5〜20μMの間でした。
以下のような報告もあります。
Ivermectin inhibits the growth of glioma cells by inducing cell cycle arrest and apoptosis in vitro and in vivo.(イベルメクチンは、in vitroおよびin vivoで細胞周期停止とアポトーシスを誘導することにより、神経膠腫細胞の増殖を抑制する)J Cell Biochem. 2019 Jan;120(1):622-633.
この論文では、培養した神経膠腫細胞を用いた実験で、5マイクロモル(μmol/L)以上で用量依存的に増殖抑制を認めています。72時間培養後の50%阻害濃度(IC50)が10μmol/L(10μM)程度でした。10μMは8.7μg/mlになります。
マウスの移植腫瘍を用いた実験では、1日に20 mg/kgのイベルメクチンを3週間連日腹腔内投与しています。(代謝率と寿命から人間で換算すると1日に3mg/kgを1〜2年間連日投与に相当)
以下のような実験もあります。抗がん剤の感受性を高める効果の検討です。
Ivermectin reverses the drug resistance in cancer cells through EGFR/ERK/Akt/NF-κB pathway.(イベルメクチンは、EGFR / ERK / Akt /NF-κB経路を介して癌細胞の薬剤耐性を逆転させる) J Exp Clin Cancer Res. 2019 Jun 18;38(1):265.
この研究では、抗がん剤耐性のがん細胞株の培養で、抗がん剤感受性を高める目的でイベルメクチンを3μmol/L(3μM)の濃度で投与しています。イベルメクチンの分子量を約870とすると、3μmol/Lは2610μg/L (2.6μg/ml)になります。
移植腫瘍のin vivoの実験系では、抗がん剤の感受性を高める目的で、 イベルメクチン (2 mg/kg/day) を27日間腹腔内に連日投与しています。
マウスと人間の代謝率の比を考慮すると、抗がん剤治療との併用であれば、0.2mg/kg/dayの連日投与は効果が期待できる量と言えます。
問題は、がん細胞の種類によって感受性に差があることです。消化管での吸収や体内での薬物代謝にも個人差があります。
in vitroの実験では数マイクロモル以上の血中濃度が必要と言えます。
以上を考察すると、成人では1日12mgを連日投与し、血中濃度が上昇して吐き気や下痢などの副作用が出現すれば、半減期が18時間というデータから2日から3日に12mgに減らせば良いと思います。
以上のような投与法で、副作用はほとんど経験していません。
【イベルメクチンの服用法のまとめ】
イベルメクチンは通常の寄生虫疾患(糸状虫症、糞線虫症、ぎょう虫感染症)では150から200 μg/kg、リンパ系フィラリア症では400μg/kgを1から2回服用します。体重60kgで1日に12mgから24mgになります。
寄生虫に対する死滅作用が強いので、寄生虫疾患の治療の場合は、通常は1回か2回で治療は終了します。つまり、寄生虫の場合は、1回か2回の投与で、ほとんどの寄生虫は死滅します。
しかし、がん治療の場合は、がん細胞は直ぐには死滅しないので、ある程度の期間服用します。
がんに対する効果を高めるためにはイベルメクチンの血中濃度を高める必要があります。イベルメクチンは脂溶性なので、脂肪の多い食事で吸収が高くなります。
寄生虫疾患の治療では、脂肪で吸収が亢進して血中濃度が高くなるのを懸念して空腹時の服用を指定しています。しかし、がん治療の場合は、むしろ少ない服用量で血中濃度を高めるために脂肪の多い食事の後の服用の方が理にかなっています。
また安全性は極めて高いのですが、半減期が長いので、長期に継続して服用すると血中濃度が高くなって副作用が出る可能性もあります。
ただし、薬の吸収や代謝は個人差があるので、がん治療に使うときは、副作用の有無や効果を評価しながら、試行錯誤の服用になります。
進行がんの場合は、がん細胞を死滅する効果を高めるために血中濃度を高める必要があります。しかし、血中濃度が高くなると副作用も出やすくなります。
副作用(吐き気、食欲低下、下痢、肝機能異常、貧血など)が出ない範囲で、上記の薬物動態を参考に服用量を調節します。
がん治療におけるイベルメクチンの服用量と服用法に関する考察は以下のサイトをご参照ください。
http://www.f-gtc.or.jp/Ivermectin/effective_dose.html
https://blog.goo.ne.jp/kfukuda_ginzaclinic/e/ca0736d4984bf683f20fcc5d8f3111e4
| « 680)2−デオキ... | 682)腫瘍循環... » |



