がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
657)抗生物質ニトロキソリン(Nitroxoline)の抗がん作用(その2):BETタンパク質阻害作用
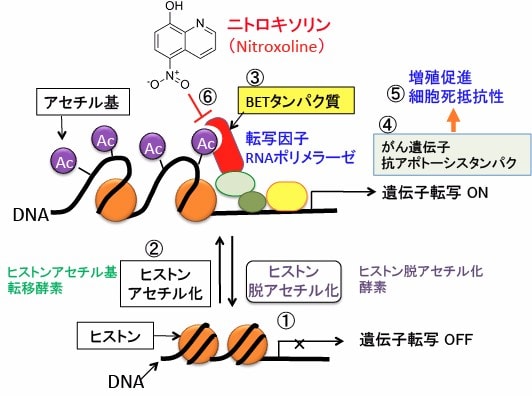
図:ヒストン脱アセチル化酵素によってヒストンのアセチル化が低下するとクロマチンが凝集して遺伝子転写活性は抑制される(①)。ヒストンアセチル基転移酵素によってヒストンがアセチル化されるとクロマチンが緩み、遺伝子転写活性が亢進する(②)。ヒストンのアセチル化されたリシンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質(③)は、ヒストンのアセチル化リシンに結合し、転写因子やRNAポリメラーゼなどの転写に必要なタンパク質をリクルートして、がん遺伝子(c-Mycなど)や抗アポトーシスタンパク質(Bcl-2など)の転写を活性化する(④)。その結果、がん細胞の増殖を促進し、細胞死(アポトーシス)に抵抗性になる(⑤)。ニトロキソリンはアセチル化リシンとブロモドメインの結合を阻害する(⑥)。その結果、がん細胞の増殖を抑制し、細胞死を誘導する。
657)抗生物質ニトロキソリン(Nitroxoline)の抗がん作用(その2):BETタンパク質阻害作用
【エピジェネティクスとは】
細胞の遺伝情報は細胞核の中の遺伝子(=DNA)に入っています。
人間の1個の細胞の核には、約30億対のヌクレオチドからなるDNA(デオキシリボ核酸)が格納されており、このDNAが遺伝子の本体です。
ヒト遺伝子は約2万種類のタンパク質を作る設計図(遺伝情報)をもっていますが、このゲノムの持つ遺伝情報の発現は、DNAの塩基配列と転写装置だけで制御されているわけではなく、DNAのメチル化やヒストン(DNAに結合するタンパク質)の修飾などによって複雑に制御されています。
「ゲノム(遺伝子)の塩基配列以外のメカニズムで遺伝子発現を制御し、細胞や生体に変化を生じさせる現象」のことをエピジェネティクス(epigenetics)と言います。
エピジェネティクスの「エピ」はギリシャ語の接頭語で「上にある、別の、後から」という意味で、本来の遺伝情報(DNAの塩基配列)の土台の「上にかぶさる別の遺伝情報」や「後天的に獲得した遺伝情報」という意味を示しています。
例えば、私たちの体を構成する細胞は全て同じ遺伝情報を持っていますが、皮膚や神経や筋肉や肝臓など機能の異なる細胞になれるのは、それぞれの細胞において、使う遺伝子と使わない遺伝子に違いがあるからです。約2万個の遺伝子の全てが発現しているわけではなく、発現している遺伝子の違いによって細胞の種類が決まります。
このように、DNAの塩基配列(=遺伝情報)が同じなのに、使う遺伝子と使わない遺伝子に目印をつけて、細胞に変化を生じさせる現象がエピジェネティクスです。エピジェネティクスの機序による遺伝子調節の一つに「ヒストンのアセチル化」があります。
【遺伝子(DNA)はヒストンに巻き付いている】
人間の1個の細胞の核には、約30億対のヌクレオチドからなるDNA(デオキシリボ核酸)が格納されています。このDNAが遺伝子の本体です。
細胞核内では、DNAはヒストンという球状の蛋白質複合体に巻き付くような状態で存在します。
ヒストンはリシン(リジンともいう)やアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。
ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。ヒストンによる遺伝子発現の調節は複雑ですが、簡単にまとめると、「ヒストンとDNAの結合は転写に阻害的に働く」ということです。
遺伝子がmRNAに転写されるためには、転写因子やRNAポリメラーゼなどの他の蛋白質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。

図:細胞核内でDNAとタンパク質(ヒストンなど)の複合体をクロマチンという。クロマチンが凝集している部分はDNAが強く折り畳まれており遺伝子転写が抑制されている。一方、クロマチンが緩んでいる部分は、遺伝子の転写が活発になっている。
【ヒストンアセチル化は遺伝子発現を亢進する】
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。アセチル化というのはアセチル(CH3CO)基が結合することです。
ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。

図:ヒストン・アセチル基転移酵素によってヒストン・タンパク質のリシン(リジンとも言う)のアミノ基(-NH2)にアセチル(CH3CO)基が結合するとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになる。その結果、遺伝子の転写が起こりやすくなる。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進(正に制御)し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制(負に制御)されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素(=ヒストン・アセチルトランスフェラーゼ)」と「ヒストン脱アセチル化酵素(=ヒストン・デアセチラーゼ)」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています。アセチル基はグルコースや脂肪酸の分解によって産生されるアセチルCoAが使われます(下図)。

図:ヒストンアセチル基転移酵素はヒストンをアセチル化することによってクロマチン構造を緩めて遺伝子転写を活性化する。一方、ヒストン脱アセチル化酵素はヒストンのアセチル化を減らすことによってクロマチン(DNAとヒストンの複合体)を凝集して遺伝子転写を抑制する。アセチル基はグルコースや脂肪酸が分解して産生されるアセチルCoAから供給される。
【BETファミリータンパク質ががん治療のターゲットとして注目されている】
がん細胞の発生原因は、がん遺伝子やがん抑制遺伝子の変異、すなわち塩基配列上の変化が蓄積し、細胞増殖や接着や細胞死などの制御が異常になることによると考えられています。さらに、遺伝子の塩基配列の変化を伴わない遺伝子の発現異常,すなわちエピジェネティクスの機序による遺伝子発現異常も発がんに大きく寄与していることが近年明らかになってきました。
多くのがん細胞において、がん遺伝子や抗アポトーシスタンパク質(Bcl-2など)の発現上昇が確認されています。これらのタンパク質はがん細胞の増殖を促進し、細胞死(アポトーシス)に抵抗性になります。
BETファミリータンパク質は高アセチル化ヒストンへの結合を介して、がん遺伝子や抗アポトーシスタンパク質の発現を促進する作用があります。
ブロモドメインはヒストンのアセチル化リシンを認識し,制御タンパク質を集めてクロマチン構造や遺伝子発現を制御する機能が知られているタンパク質ドメインです。
ブロモドメイン繰り返し配列および特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質としてBRD2,BRD3,BRD4,BRDTが知られています。
ヒストンのアセチル化による遺伝子発現の制御には、アセチル化を促進するヒストンアセチル基転移酵素、ヒストンからアセチル基を除去するヒストン脱アセチル化酵素、ヒストンのアセチル化した部分を認識するBETファミリータンパク質の3つが必要ということです。
ヒストンアセチル基転移酵素の「書き屋(Writer)」とヒストン脱アセチル化酵素の「消し屋(Eraser)」と、BETファミリータンパク質の「読み屋(Reader)」の3つの役割を担うタンパク質が、ヒストンアセチル化の制御を行ってます(下図)。

図:「書き屋(Writer)」のヒストンアセチル基転移酵素によってヒストンにアセチル基が結合し(①)、「消し屋(Eraser)」のヒストン脱アセチル化酵素によってアセチル基が除去される(②)。ヒストンアセチル化の少ない部分では遺伝子転写は抑制される(③)。「読み屋(Reader)」のBETファミリータンパク質はヒストンのアセチル化リシンと結合して(④)、転写を制御するタンパク質をリクルートして遺伝子転写を促進する(⑤)。
BETファミリータンパク質は、c-Mycなどのがん遺伝子やBcl-2などの抗アポトーシスタンパク質の転写を亢進します。
したがって、ヒストンのアセチル化リシンとBETファミリータンパク質のブロモドメインの結合を阻害する薬剤をがん細胞に投与すると、遺伝子発現パターンが正常細胞に近づくことが知られています。
ヒストンとBETファミリータンパク質の結合を阻害する低分子化合物(BET阻害剤)が、がんや炎症性疾患の治療薬として注目されています。臨床試験が行われているBET阻害剤が幾つかあります。
このようなBET阻害剤は、ある種のがん細胞に投与すると腫瘍促進遺伝子の発現を選択的に抑制することから、がん治療薬としての可能性が期待されています。
【ニトロキソリンはBETタンパク質を阻害する】
656話で解説したニトロキソリンがBETタンパク質を阻害することが報告されています。以下のような論文があります。
Discovery of novel BET inhibitors by drug repurposing of nitroxoline and its analogues.(ニトロキソリンとその類似体の薬物再利用による新規BET阻害剤の発見)Org Biomol Chem. 2017 Nov 15;15(44):9352-9361.
【要旨】
ブロモドメイン含有タンパク質(bromodomain-containing proteins)のBETファミリーは、がん、炎症および心血管疾患を含む多くの疾患の治療に有望な薬物標的であると考えられている。それ故、BET阻害作用のある新規な化合物の開発が注目されている。
安全性および薬物動態が既知の化合物から阻害剤を見出すという薬物再利用戦略は大きな利点を有しており、それ故近年の医薬品開発者の関心を高めている。
この薬物再利用戦略を使って、薬物ライブラリーからBRD4特異的阻害作用を有する化合物を探索し、続いてALPHAスクリーニングアッセイ試験を実施した。
FDA承認抗生物質であるニトロキソリンは、BRD4(ブロモドメイン含有タンパク質4)の第一ブロモドメインとアセチル化ヒストン4ペプチドとの間の相互作用を50%阻害濃度(IC50)が0.98μMで阻害することを明らかにした。
ニトロキソリンは、非BETブロモドメイン含有タンパク質に対して阻害作用を示さず、良好な選択性で全てのBETファミリーメンバーを阻害した。従ってニトロキソリンは選択的BET阻害剤と呼べる。
ニトロキソリン-BRD4_BD1複合体の結晶構造に基づいて、ニトロキソリンの作用機構およびBET特異性を決定した。
BET関連疾患の1つであるMLL白血病に対するニトロキソリンの抗がん活性はこれまで研究されていなかったので、我々はニトロキソリンがMLL白血病の治療薬として有効かどうかを試験した。
ニトロキソリンは細胞周期停止とアポトーシスを誘導することによりMLL白血病細胞の増殖を効果的に抑制した。ニトロキソリンの有効性は、少なくとも部分的には、BETの阻害および標的遺伝子転写の抑制によるものである。 BET阻害剤としてのニトロキソリンの発見は、BETファミリー関連疾患の治療のためのニトロキソリンおよびその誘導体の潜在的用途を示唆している。
真核細胞生物では、DNAはヒストンと結合して複合体を形成し、通常は不活性化状態になっています。一般的に、ヒストンの高アセチル化領域では遺伝子の転写が活性化され、低アセチル化領域では転写が不活性であることが知られています。ヒストンのアセチル化は、ヒストンアセチル化転移酵素とヒストン脱アセチル化酵素によって制御されています。これが「書き屋」と「消し屋」です。
BET (bromodomain and extra-terminal)ファミリータンパク質は、ブロモドメインにおいてヒストンのアセチル化されたリシンを認識することにより、転写活性化因子として機能します。BRD4はBETファミリータンパク質の1つで、多くの遺伝子の発現の制御に関与しています。
染色体の転座によって偶然できた融合タンパク質が、細胞増殖を刺激してがんができるのは、Bcr-AblやEML4-ALKのキナーゼ活性化の例が良く知られています。上記のBRD4も転座によってNUTというタンパク質との融合タンパク質をつくり、NUT midline carcinoma(NMC)という致死性の高い悪性腫瘍を生じることが知られています。NMCは、若年者(0~70歳、平均17.6歳)に好発し、気道、胸腺、縦隔、および膀胱などの正中線上の上皮組織に発生する腫瘍です。
BRD4-NUTは、通常は不活性の染色体の一部に働いてアセチル化を亢進させることが知られています。そこで、BETブロモドメインの働きを阻害する薬剤はNUT midline carcinoma(NMC)の治療に効果が期待できます。
【ニトロキソリンはBETタンパク質阻害を介してPD-L1の発現を抑制する】
岡山大学の泌尿器科のグループから以下のような論文が最近報告されています。
The Novel Combination of Nitroxoline and PD-1 Blockade, Exerts a Potent Antitumor Effect in a Mouse Model of Prostate Cancer.(ニトロキソリンとPD-1遮断薬の新規併用は前立腺がんのマウスモデルにおいて強力な抗腫瘍効果を発揮する)Int J Biol Sci. 2019 Mar 9;15(5):919-928.
【要旨】
プログラム細胞死タンパク質1(Programmed cell death protein 1:PD-1)遮断は前立腺がんに対する有望な治療戦略である。ニトロキソリンは、いくつかの種類のがんにおいて有効な抗がん作用を有することが知られている。前立腺がんのマウスの実験モデルにおけるニトロキソリンとPD 1遮断の併用療法の有効性を検討した。
インビトロの実験系において、ニトロキソリンはマウス前立腺がん細胞株RM9-Luc-PSAの生存と増殖を阻害することを見出した。
さらに、ニトロキソリンは、リン酸化PI3キナーゼ、リン酸化Akt(Thr308)、リン酸化Akt(Ser473)、リン酸化GSK-3β、Bcl-2、およびBcl-xLの発現を抑制した。
さらに、ニトロキソリンは培養した前立腺がん細胞および腫瘍組織におけるプログラム細胞死リガンド-1(PD-L1)の発現レベルを抑制した。
マウス前立腺がん同所性移植モデルにおいて、ニトロキソリン+ PD-1遮断は、ニトロキソリンまたはPD-1遮断をそれぞれ単独で使用した場合と比較して、腫瘍増殖を相乗的に抑制し、腫瘍重量、生物発光腫瘍シグナル、および血清中の前立腺特異抗原(PSA)レベルの減少をもたらした。
さらに、ニトロキソリンと PD-1遮断の併用は末梢血中のCD44+CD62L+CD8+ メモリーT細胞の細胞数の増加および骨髄由来抑制細胞の数を減少して、抗腫瘍免疫を有意に増強することを示した。
結論として、我々の実験結果はニトロキソリンとPD-1遮断薬の併用が、前立腺がん患者における有望な治療戦略になる可能性を示唆している。
リンパ球の一種のT細胞は、病原菌やがん細胞を攻撃・排除する働きがあります。しかし、T細胞が暴走して正常な細胞を攻撃すると危険なので、いくつかのブレーキ装置が備わっています。これを「免疫チェックポイント」と呼びます。
がん細胞は、ときに巧みにこの免疫チェックポイントを悪用して、T細胞にブレーキをかけてT細胞からの攻撃を逃れようとするのです。がんによるブレーキがかからないようにする薬が免疫チェックポイント阻害薬です。
細胞傷害性T細胞にはPD-1という受容体が存在します。PD-1はプログラム細胞死1(programmed death-1)の略です。
PD-1のリガンド(受容体に結合して作用する物質)となるPD-L1を抗原提示細胞が持つことによって細胞傷害性T細胞の働きを抑制しています。
つまり、PD-1受容体がリガンドによって刺激されると、T細胞の増殖が停止し細胞死を来すことになります。このようにして細胞傷害性T細胞の過剰な応答を制御しているのです。
細胞傷害性T細胞の働きを阻害するPD-L1はがん細胞にも発現しています。つまり、がん細胞は免疫系の制御システムを利用して、がん組織内の細胞傷害性T細胞の働きを阻止しています。
PD-1受容体は細胞傷害性T細胞を死滅させるスイッチなようなものなので、このスイッチが入らないようにすれば、細胞傷害性T細胞は生き残ってがん細胞の攻撃力を高めることができます。ヒト型抗PD-1モノクローナル抗体のニボルマブ(nivolumab商品名「オプジーボ(Opdivo)」)はPD-1とPD-L1の結合を阻害することによって細胞傷害性T細胞の細胞死を防ぐ薬です。
このような免疫チェックポイント阻害剤を使用すると、がん細胞を攻撃する細胞傷害性T細胞の働きを高めることが可能になります。免疫チェックポイント阻害剤にニトロキソリンを併用すると、抗腫瘍効果を高めることができるという報告です。
このPD-L1の発現抑制作用がBETタンパク質の阻害作用による可能性を示唆する研究が米国から報告されています。以下のような報告があります。
BET Bromodomain Inhibition Promotes Anti-Tumor Immunity by Suppressing PD-L1 expression.(BETブロモドメイン阻害はPD-L1発現を抑制することにより抗腫瘍免疫を促進する)Cell Rep. 2016 Sep 13; 16(11): 2829–2837.
【要旨】
抗体を用いてPD-L1シグナル伝達を遮断することによる抗腫瘍免疫の回復はがん治療に有益であることが証明されている。 この研究では、BETブロモドメイン阻害がPD-L1発現を抑制し、卵巣がんにおける腫瘍進行を抑制することを示す。
PD-L1をコードする遺伝子CD274は、BRD4媒介遺伝子転写の直接の標的である。
マウスの実験モデルにおいて、BET阻害剤のJQ1による治療は、腫瘍細胞ならびに腫瘍関連樹状細胞およびマクロファージにおけるPD-L1発現を有意に減少させ、これは抗腫瘍細胞傷害性T細胞の活性の増加と相関していた。 BET阻害剤は細胞傷害性T細胞依存的に腫瘍の進行を抑制した。
以上の結果は、PD-L1シグナル伝達を遮断するための化合物の有効性を実証している。 臨床試験でBET阻害剤は毒性が低く安全性が高いことが証明されているので、薬理学的BET阻害剤はPD-L1発現を標的とする治療戦略となり得ることを示している。
この論文で使用されているBETファミリータンパク質BRD4の阻害剤のJQ1は医薬品として開発中の化合物です。このJQ1がPD-L1の発現を抑制することを報告しています。
PD-L1をコードする遺伝子CD274は、BRD4媒介遺伝子転写の直接の標的だからです。
岡山大学泌尿器科のグループの論文では、ニトロキソリンがPD-L1の発現を阻害することを報告していますが、BRD4の関与は考察していません。
BETブロモドメイン阻害がPD-L1発現を抑制することは2016年9月に報告されており、ニトロキソリンにBET阻害作用があることは2017年11月の論文に報告がありますので、2019年3月の論文で考察されていないのは文献考察が不十分かもしれません。
岡山大学の研究ではマウスの実験ではニトロキソリンを1日に体重1kg当たり15mgを経口投与しています。この量は人間に換算すると2〜3mg/kg/日程度になります。一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。したがって、15mg/kgの7分の1の用量が一つの目安となります(詳しくは293話参照)
ニトロキソリンの尿路感染症の治療に使う量は1日に500から750mgです。したがって、尿路感染症に使用する服用量で十分な抗腫瘍効果が期待できそうです。

図:ヒストンのアセチル化されたリシンを認識するブロモドメイン繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質の一つのBRD4は、ヒストンのアセチル化リシンに結合し、転写制御因子やRNAポリメラーゼなどをリクルートして(①)、PD-L1をコードするCD274遺伝子の転写を促進する(②)。ニトロキソリンはBRD4の第一ブロモドメインとアセチル化ヒストンの結合を阻害する(③)。その結果、転写制御因子やRNAポリメラーゼのリクルートが阻害され(④)、CD274遺伝子の転写を抑制し、PD-L1の発現を抑制する(⑤)。
【ニトロキソリンは尿路感染症治療薬として50年以上前から使用されている】
ニトロキソリンはヨーロッパやアジアやアフリカで50年以上前から使用されている抗生物質です。
経口摂取で消化管から効率よく吸収され、尿中に排泄され、尿中の濃度が高くなるので、尿路感染症に使用されています。

近年、ニトロキソリンは強力な抗腫瘍活性を持つことで注目されています。
血管新生阻害作用、アポトーシスの誘導、がん細胞の遊走や浸潤の阻害作用などが報告されています。
人間で、尿路感染症に使われる1日500mg〜750mgで十分な抗腫瘍効果が期待できます。
656話で解説したようにニトロキソリンがメチオニン・アミノペプチダーゼ-2を阻害する作用があります。
メチオニン・アミノペプチダーゼ-2もBETブロモドメインタンパク質も、がん治療のターゲットとして最近注目されています。
50年以上前から使用されているニトロキソリンはこの2つのタンパク質の阻害剤であることが医薬品再利用の検討で明らかになっています。
前述の岡山大学泌尿器科の報告では、ニトロキソリンは、リン酸化PI3キナーゼ、リン酸化Akt(Thr308)、リン酸化Akt(Ser473)を抑制する作用が報告されています。
栄養摂取やインスリン、成長ホルモン、IGF-1、サイトカインなどの増殖刺激が細胞に作用すると、それらの受容体などを介してPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。
PI3K/Akt経路の阻害は、抗がん剤や放射線治療の効き目を高める効果や、血管新生を阻害するすることによってがん細胞の増殖を抑制する効果も報告されています。

図:チロシンリン酸化型受容体にリガンド(増殖因子や成長因子)が結合し2量体化すると、受容体がリン酸化されて活性化する。受容体が活性化されるとホスファチジルイノシトール3-キナーゼ(PI3K)がリン酸化されて活性化される。PI3Kは,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する.PI3K/Akt経路の活性化は、がん細胞の増殖や転移を亢進し、アポトーシスに抵抗性(死ににくくなる)の性質を持つようになる。
ニトロキソリンには、血管新生阻害、がん細胞の増殖抑制、アポトーシス誘導、抗腫瘍免疫増強といった抗腫瘍作用が期待できそうです。しかも副作用が少ないので再発予防にも有用です。
以下のサムネイルをクリックするとYouTubeの解説に移行します。
https://www.youtube.com/watch?v=sN5My8xwbvs
◉ ニトロキソリンを使ったがん治療についてはこちらへ:
| « 656)抗生物質... | 658)クエン酸... » |




