がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
658)クエン酸ががんを消す:代謝をターゲットにしたがん治療の効力
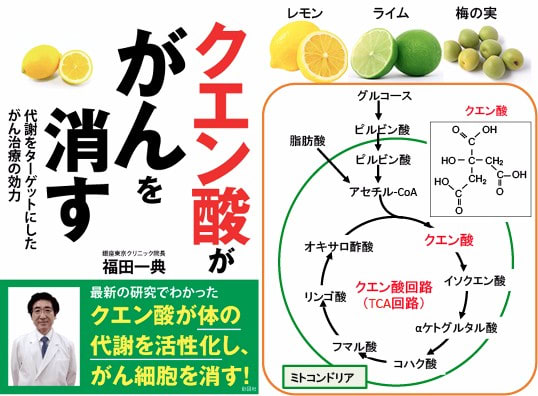
図:クエン酸は柑橘類(レモン、ライムなど)や梅の実に多く含まれる。細胞内でもグルコース(ブドウ糖)や脂肪酸から生成されるアセチルCoAからミトコンドリアのクエン酸回路(TCA回路)で生成されている。クエン酸を多く摂取すると免疫細胞の活性や体の解毒力・治癒力を高めることができる。がん細胞のクエン酸量を増やすと、増殖を抑え細胞死を誘導できる。「クエン酸ががんを消す」ことが最近の研究で明らかになっている。
658)クエン酸ががんを消す:代謝をターゲットにしたがん治療の効力
【がん予防効果をもつ果物のトップを占める柑橘類】
1990年代に米国立がん研究所が中心となって「がん予防に重要な野菜や果物や香辛料」がまとめられました。そのトップはニンニクで、キャベツ、大豆、生姜、タマネギ、お茶などが上位にランクされています。
果物のトップは柑橘類(オレンジ、レモン、グレープフルーツ)で、お茶や玄米やアブラナ科野菜(ブロッコリー、カリフラワー、芽キャベツ)と同じランクになっています(下図)。

図:1990年から米国国立癌研究所を中心に行なわれた「デザイナーズフーズ・プログラム」における研究から得られた結果に基づく「がん予防効果が期待される野菜や果物」。果物のトップは柑橘類で、お茶やアブラナ科野菜と同じランクに位置している。
柑橘類はみかんの仲間です。ミカン科の常緑樹の果実で、世界中に数百種類もあります。温州みかん、オレンジ、レモン、グレープフルーツ、八朔、など様々な柑橘類が販売されています。
食品とがん予防の関連を検討した疫学研究の多くが、柑橘類の摂取ががん予防に有効であると結論づけています。
例えば、胃がんの発生率と柑橘類の摂取との関係を検討した14の論文を統計的にまとめた研究によると、柑橘類を多く摂取すると胃がんの発生率が28%減少するという推定が報告されています。(Gastric Cancer 11: 23-32, 2008)
膵臓がんの発生率と柑橘類の摂取の関連を調べた複数の研究論文をまとめて統計的に解析した研究では、柑橘類の摂取が多いほど膵臓がんの発生率が低下することが示されており、柑橘類を多く摂取すると膵臓がんの発生リスクが0.83(95%信頼区間;0.70-0.98)に低下するというデータが報告されています。(Pancreas 38:168-174, 2009)
約13000人のがん患者と、その時期に同じ病院でがんとは別の急性疾患で治療を受けた患者を対照にして、柑橘類とがんの発生率の関連を検討する検討がイタリアとスイスの共同研究で行われています。この研究では、柑橘類をほとんど食べない人に比べて、柑橘類を多く摂取している人のがん発生リスクは、口腔・咽頭がんでは0.47(95%信頼区間:0.36-0.61)、食道がんでは0.42(95%信頼区間:0.25-0.70)、胃がんでは0.69(95%信頼区間:0.52-0.92)、大腸がんでは0.82(95%信頼区間:0.72-0.93)、喉頭がんでは0.55(95%信頼区間:0.37-0.83)でした。この研究では、柑橘類の摂取は消化器系や上部気道系の腫瘍の発生を予防する効果が示唆されています。(Cancer Causes Control 21: 237-42.2010)
宮城県大崎市の住民基本台帳に登録されている40~79歳の住民(42470人)を対象に、あらゆるがんの発生を追跡(1995から2003年)している「大崎コホート」研究でも、柑橘類の消費とがん発生率の関連が調べられています。その結果、柑橘類の1日摂取量が多いほどあらゆるがんの発生率が低下することが示されています。柑橘類を多く摂取することによって全てのがんの発生リスクは、男性が0.86(95% CI = 0.76-0.98)、女性が0.93(95% CI = 0.79-1.09)、男女総合で0.89 (95% CI = 0.80-0.98)でした。特に、膵臓がん(RR = 0.62, 95% CI = 0.38-1.00)と前立腺がん((RR = 0.63, 95% CI = 0.41-0.97)の発生率の低下が著明でした。また、柑橘類の摂取と同時にたくさんの緑茶を飲用していた人は、がん発生率がさらに低下することが示されています。(Int J Cancer 127(8):1913-1922, 2010)
【柑橘類には多彩な抗がん成分が含まれる】
私は20年くらい前(1995年〜1997年)に国立がんセンター(現在の国立がん研究センター)研究所のがん予防研究部第一次予防研究室の室長をしていました。
がんの第一次予防というのは、食生活や生活習慣の改善によってがんの発生を予防することです。
その当時は食品や薬草などからがん予防成分を見つける研究が盛んに行われていました。柑橘類のがん予防成分の研究も多く報告されています。
動物発がん実験を用いて柑橘類に含まれるがん予防成分を研究した結果、モノテルペン類のリモネン(limonene)、フラボノイドのヘスペリジン(hesperidine)、カロテノイドのベータ・クリプトキサンチン(β-cryptoxanthin)、クマリンのオーラプテン(auraptene)、ポリメトキシフラボノイドのノビレチン(nobiletin)、水様性食物繊維のペクチン類などの多彩な成分にがん予防効果が報告されています。
がん予防の作用メカニズムはそれぞれの成分によって異なっています。
果皮に多く含まれているリモネンはがん細胞の増殖を抑制しアポトーシス(細胞死)を誘導することが、カロテノイド類やフラボノイド類やオーラプテンには抗酸化作用や抗炎症作用などが報告されています。
水様性食物繊維のペクチン類や低分子のオリゴ糖には、ビフィズス菌や乳酸菌などの善玉菌を増やして、腸内環境を改善し免疫機能を高めて抗腫瘍効果を示すことも報告されています。
異なる作用メカニズムを持つがん予防物質を組み合わせて用いると、相乗効果によってがん予防効果が高まります。
柑橘類のがん予防効果についてはこのブログでは2011年7月2日(239話)で解説しています。その時のまとめの図が以下です。クエン酸は柑橘類に多く含まれる有機酸ですが、この当時は柑橘類のがん予防成分としてクエン酸は検討も指摘もされていませんでした。

図:みかんなどの柑橘類を丸ごと利用すると、作用メカニズムが異なる様々ながん予防成分を摂取することができ、それぞれの相乗効果によってがん予防効果が高まる。果皮を利用することが大切。最近まで、柑橘類のがん予防成分としてクエン酸は考慮されていなかった。
【クエン酸のがん予防効果は最近になって指摘されるようになった】
クエン酸というのは柑橘類や梅の実に多く含まれる有機酸です。クエン酸はレモンジュースから最初に発見されたのですが、柑橘類や梅の実が酸っぱいのはクエン酸が多いからです。
前述の柑橘類のがん予防成分の中にはクエン酸は入っていません。
柑橘類のがん予防成分としては精油成分のリモネンや、フラボノイドのヘスペリジン、カロテノイドのベータ・クリプトキサンチンなどの関与が注目されていましたが、クエン酸のがん予防効果が指摘されたのは最近のことです。
最近の論文(2019年6月)で以下のような報告があります。
Effect of citrus peel extracts on the cellular quiescence of prostate cancer cells.(前立腺がん細胞の細胞周期停止に対する柑橘類果皮抽出物の効果)Food Funct. 2019 Jun 19;10(6):3727-3737.
【要旨の抜粋】
柑橘類の皮抽出物(Citrus peel extracts :CPE)には、がん細胞の増殖を阻害する成分が含まれている。しかしながら、細胞周期制御におけるCPEの作用は十分に検討されていない。
この研究では、前立腺がん細胞(PC-3 と LNCaP)の培養細胞を使った実験系で、がん細胞の細胞周期の調節における酢酸エチル:ヘキサン抽出物(CPE /ヘキサン)および水抽出物(CPE /水)の作用を検討した。
柑橘類の皮の水抽出物(CPE /水)は前立腺がん細胞(PC-3 and LNCaP)の細胞静止期(G0/G1)から分裂期(S)への移行を抑制した。
G0/G1細胞の割合は対照群では12〜18%の減少を認めたが、CPE/水抽出分の存在下では2〜3%であった。対照的に、CPE /ヘキサンは両方の細胞株において細胞周期阻害活性を全く示さなかった。
柑橘類皮抽出物(CPE)で処理した静止がん細胞において、DNAの合成の抑制と軽度のアポトーシスが観察された。
柑橘類の果実に見られる主なフラボノイドのヘスペリジン(Hesperidin)およびナリルチン(narirutin)は観察された生物学的活性には関与せず、フラボノイド以外の生物活性化合物の存在を示唆した。
特にクエン酸は、細胞周期再進入阻害剤として作用する柑橘類皮抽出物中に存在する化合物の1つとして同定された。クエン酸は、非がん性のRWPE-1前立腺細胞よりもPC-3前立腺がん細胞に対してより高い細胞毒性効果を示し、がん治療薬としての利点を示唆した。
結論として、クエン酸やその他の様々な生物活性化合物を一緒に含有する柑橘類皮抽出物は、がん治療後の再発を予防する化学予防剤として使用され得る。
柑橘類皮抽出物を有機溶媒(酢酸エチル:ヘキサン)で抽出したものと水で抽出したものに分けて検討すると、水で抽出される成分(水に溶ける成分)に細胞増殖を抑制する成分が存在し、その成分の一つとしてクエン酸が同定されています。つまり、がん細胞の増殖抑制作用を示す柑橘類の成分としてクエン酸が重要だという報告です。
この論文は今年の6月に発表されています。最近でも、「柑橘類の抗がん成分としてクエン酸が関与している」という研究結果が論文として発表される意義があるということです。つまり、クエン酸のがん予防効果や抗がん作用は最近まであまり認識されていなかったということを意味しています。
【メキシコはがん死亡率が低い】
メキシコではがんの死亡率が極端に低いことが知られています。経済協力開発機構(OECD)が国別のがん死亡率を報告しています。OECD(Organisation for Economic Co-operation and Development)は国際経済全般について協議することを目的とした国際機関で、国別に比較した様々な統計を発表しています。
OECDのホームページに国別の年齢調整がん死亡率が報告されています。
データのダウンロードは以下
http://dx.doi.org/10.1787/888933602405
OECD加盟国の2010年の人口構成を基準にして年齢調整した数値なので、高齢化によるがん死亡の増加の影響を無くして、人口構成の異なる国の間のがん死亡率を比較できます。
2015年の統計によると、人口10万人当たりの1年間のがん死亡数が一番多いのがハンガリーの282人です。イギリスは222人、アメリカ合衆国は188人、日本は177人です。最も少ないのがメキシコの115人です。つまり、メキシコの年齢調整がん死亡率は他の国と比べて極端に少ないことがわかります。先進国を中心にしたOECDの統計で、がん死亡率が一番多いハンガリーの40%、日本の65%くらいです。

図:2015年の国別年齢調整がん死亡率(人口10万人当たりのがん死亡数)。メキシコは他の国に比べて極端にがん死亡が少ない。
がん死亡が少ない理由は様々考えられると思います。たとえば、日光によるビタミンDの産生量が発がんに影響する可能性を報告されています。
北アメリカで、緯度が高いところ(北)に住む人は南の人よりもがんの発生率が高いことが1941年に報告され、その後もビタミンDの産生が少ない状況(緯度の高いところに住んでいる、日光に当たらない生活習慣など)ががんの発生や増殖を促進することは多くの研究で示されています。
緯度の高い地域では日照時間が短いので、体内のビタミンDの量が低下し、様々ながんの増加が指摘されています。
血清のビタミンDレベルと発がん率やがんの死亡率との関連はメラノーマ(悪性黒色腫)、乳がん、前立腺がん、結腸直腸がん、卵巣がん、腎臓がん、食道がん、胃がん、非ホジキンリンパ腫など多くの悪性腫瘍で示されています。
人種による遺伝的理由も存在するかもしれません。がんになりやすい遺伝的素因の存在は、人種によるがん発生率の差に寄与しています。
私は、食事とがん予防の関係から、メキシコではライムとアボカドの摂取量が多いことが関係しているのではと考えています。
ライムとアボカドの生産量はメキシコが世界一で、メキシコ料理では、ライムとアボカドをふんだんに使用しています。ライムはレモンと並んでクエン酸の多い柑橘類で、メキシコでは飲料や食事にライムを丸ごと絞って使います。個人一人当たりの消費量は世界一です。
アボカドには脂質が果肉可食部100g中に15g以上含まれ、脂質に含まれる脂肪酸の約65%はオレイン酸です。オレイン酸はオリーブオイルに多く含まれるn-9系の一価不飽和脂肪酸で、循環器疾患やがんの予防に効果がある脂肪酸です。善玉コレステロール(HDLコレステロール)を増やし、悪玉コレステロール(LDLコレステロール)を減らし、動脈硬化を予防する効果があります。
さらに、多種類のカロテノイド(βカロテン、αカロテン、ルテイン、ゼアキサンチンなど)、ビタミンB群、ビタミンC、ビタミンEなどのビタミンや、カリウムやマグネシウムやリンなど多くのミネラル、食物繊維、蛋白質などが多く含まれています。世界一栄養価が高い果物と言われています。原産地の中央アメリカでは「生命の源」と呼ばれるほど貴重な果実です。
アボカドにはクエン酸は含まれていません。従って、アボカドとライムの組み合わせは、がん予防効果を相乗的に高めると言えます。アボカドとライムの組み合わせはメキシコ料理の定番の一つで、実際にこの組み合わせは病み付きになるほど美味です。
1年ほど前に、テレビの取材を受け、「なぜメキシコはがん死亡率が低いのか」という質問を受けました。その時にメキシコでは尋常でない量のライムを食べることをから、ライムとがん予防効果についてコメントしたことがあります。その時は、柑橘系のがん予防成分はリモネンやヘスペリジンやベータ・クリプトキサンチンなどが主体だと思っていましたが、その時論文を検索してまとめると、クエン酸の抗がん作用が最近多く報告されていることを知りました。
2017年に米国のハーバード大学医学部のヴィカス・スカトメ(Vikas P. Sukhatme)博士らの研究グループから「クエン酸が様々な機序でがん細胞の増殖を抑える」という趣旨の総説論文が発表されています。
Citrate Suppresses Tumor Growth in Multiple Models through Inhibition of Glycolysis, the Tricarboxylic Acid Cycle and the IGF-1R Pathway (クエン酸は解糖系やTCA回路やIGF-1受容体経路の阻害を介した多彩なメカニズムで腫瘍の増殖を抑制する) Sci Rep. 2017; 7: 4537.
【要旨】
この研究では、我々は様々ながんの実験モデルを用いてクエン酸療法の有効性を検討した。
クエン酸投与はA549肺がん細胞の増殖を阻害し、抗がん剤のシスプラチンとの併用でシスプラチンの抗がん作用を強化した。
興味深いことにクエン酸はRasで誘導された肺がんを縮小した。さらに、クエン酸はがん細胞の分化を誘導した。
クエン酸を投与した動物の腫瘍サンプルにはT細胞の浸潤が有意に増加し、様々なサイトカインの血中レベルの増加を認めた。
さらに、クエン酸はIGF-1受容体のリン酸化を阻害した。
In vitroの実験では、クエン酸はAKTのリン酸化を阻害し、PTENを活性化し、リン酸化eIF2a(p-eIF2a)の発現を増やした。PTENを欠損させるとp-eIF2aは減少した。これらの結果はクエン酸がIGF-1R/AKT/PTEN/eIF2a経路に作用することを示唆している。
さらに、代謝系においては、in vitroおよびin vivoの両方の実験系で、がん細胞において解糖系とTCA回路がともに阻害された。
Her2/Neuで誘導された乳がんモデルと膵臓がん(Pan02)の移植腫瘍のモデルにおいても、これらの作用が再現された。
これらの実験結果は、クエン酸が様々な腫瘍タイプ作用において複数の作用機序でがん細胞の増殖を阻害することを示唆している。食事からのクエン酸の補充はがん治療として有用であるかもしれない。
この論文では、様々ながん細胞株を用いた実験系(培養細胞と動物実験)でクエン酸が抗腫瘍効果を示すことを報告しています。
そのメカニズムとして、①がん細胞の分化誘導、②腫瘍組織内のリンパ球のT細胞の動員と活性化、③インスリン様増殖因子-1(IGF-1)受容体の活性化(リン酸化)の阻害、④AKTリン酸化の阻害、⑤解糖系とTCA回路の両方の抑制など多様なメカニズムでがん細胞の増殖を阻害し、アポトーシスを誘導することを報告しています。
「がん細胞の分化誘導」というのは「がん細胞を正常細胞の性状に近づける」作用です。がん細胞の特徴である無制限の増殖や、周囲組織への浸潤や、遠隔臓器への転移といった性質を弱めることを意味します。
リンパ球のT細胞はがん細胞を排除するので、Tリンパ球の動員と活性化という作用は、免疫システムによるがん細胞の排除をクエン酸は促進するということです。
インスリン様増殖因子-1(IGF-1)受容体のリン酸化やAKTのリン酸化は増殖シグナルを促進するので、その阻害作用はがん細胞の増殖を阻止します。
IGF-1はインスリンと配列が類似したタンパク質でIGF-1受容体に結合してIGF-1受容体が活性化すると細胞増殖のシグナルが亢進します。
AKTはセリン・スレオニンキナーゼで細胞のシグナル伝達経路のマスタースイッチとしての役割を果たし、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。
クエン酸は細胞の増殖を誘導するするIGF-1受容体やAKTの活性化を阻止して、がん細胞の増殖を抑制するのです。
さらに、クエン酸は解糖系とTCA回路の両方を阻害してエネルギー(ATP)の産生を抑制する作用があります。
つまり、クエン酸は、免疫系を活性化し、がん細胞の増殖シグナルの伝達系を抑制し、エネルギー産生系を阻害してATPを枯渇し、これらの総合作用でがん細胞の増殖を抑制するという結果です。多くの研究結果から、クエン酸を摂取する食事療法ががん治療に有効である可能性を明らかにしています。
この論文の結論は「食事からのクエン酸の補充はがん治療として有用かもしれない(Dietary supplementation with citrate may be beneficial as a cancer therapy.)」となっています。
この論文の責任著者のヴィカス・スカトメ博士は、がん細胞の代謝や抗腫瘍免疫など腫瘍学の広い範囲における基礎研究や臨床研究で顕著な業績を挙げている研究者です。つい最近まで、がんのクエン酸療法はインチキ医療という意見が大勢を占めていましたが、最新の研究結果はクエン酸の抗がん作用を支持しているのです。
【クエン酸はPI3K-Akt経路を阻害する】
細胞の増殖は、増殖因子受容体が細胞外ドメインで増殖シグナルを受け取ることから始まります。
細胞内で機能している多数のシグナル伝達経路の中で、がん細胞の増殖と生存で最も重要なのが、PI3K-Akt経路(生存シグナル経路)とERK-MAPK経路(増殖シグナル経路)です。
細胞膜の増殖因子受容体にリガンド(増殖因子)が結合し2量体化すると、PI3Kのリン酸化活性からAktのリン酸化を通して、アポトーシス(細胞死)の誘導を阻害します。(PI3K-Akt経路)
増殖因子による刺激は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路(MAPKカスケード)によりシグナルが伝達されます。活性化したERKは最終的に核へ移行し、転写因子が活性化され、細胞増殖関連の遺伝子が発現します。(ERK-MAPK 経路)

図:チロシンリン酸化型受容体にリガンド(増殖因子や成長因子)が結合し2量体化すると、受容体がリン酸化されて活性化する(①)。受容体が活性化されるとPI3Kのリン酸化活性からAktがリン酸化されて活性化する(PI3K/Akt経路)(②)。一方、受容体の活性化は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路によりシグナルが伝達される(③)。PI3K/Akt経路とMAPK経路の活性化は、最終的に核の転写因子の活性化を介して、がん細胞の増殖や転移を亢進し、アポトーシスに抵抗性(死ににくくなる)の性質を持つようになる(④)。
Akt (プロテインキナーゼBまたはPKBとしても知られている) はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。
Aktは、CDK阻害因子のp21及びp27に対する直接作用や、サイクリンD1 (Cyclin D1) 及びp53のレベルに対する間接的な作用によって細胞周期と細胞分裂を調節するとともに、mTORとp70 S6キナーゼ経路に対する効果を通じて細胞増殖を調節します。
Aktは、BadやForkheadファミリーの転写因子のようなアポトーシス促進性のシグナルを直接阻害することによって、細胞の生存を媒介する主要なメディエーターです。したがって、Aktの活性化を阻害することはがん細胞の増殖を抑制し、細胞死(アポトーシス)を誘導します。
PI3K-Akt経路は、乳がん、卵巣がん、大腸がん、前立腺がん、神経膠芽腫など多くの腫瘍において恒常的機能亢進が認められています。PI3K-Akt経路の活性抑制は多くのがん細胞の増殖や転移を抑制します。

図:PI3キナーゼ-AKT経路は,細胞外からのシグナルを細胞内に伝える主要な経路の一つで、増殖因子やインテグリンを介した細胞接着など、様々な刺激により活性化され、細胞の生存促進,細胞増殖・大きさの制御、細胞運動、代謝の制御など多くの細胞機能に関与している。ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。がん細胞の生存と増殖はAKTシグナル伝達系の活性に依存度が高いので、AKTシグナル伝達系の阻害はがん細胞の増殖抑制やアポトーシス誘導を引き起こす。
ヴィカス・スカトメ博士の研究グループの論文では、クエン酸がAktのリン酸化(=Aktの活性化)を抑制することが報告されています。
その他にも、クエン酸がPI3K-Aktシグナル伝達系を阻害する報告があります。Akt活性化の阻害は好気性解糖(ワールブルグ効果)を抑制する効果もあります。以下のような論文もあります。
Citrate-Induced p85α⁻PTEN Complex Formation Causes G2/M Phase Arrest in Human Pharyngeal Squamous Carcinoma Cell Lines.(クエン酸によって引き起こされるp85α-PTEN複合体形成はヒト咽頭扁平上皮がん細胞株においてG 2 / M期停止を引き起こす)Int J Mol Sci. 2019 Apr 29;20(9).
【要旨】
クエン酸はトリカルボン酸回路(TCA回路)の重要な中間代謝産物であり、細胞内ATPの産生を調節するアロステリックシグナルとして作用する。細胞質内のクエン酸濃度が高いと、がん細胞の増殖が抑制されることが幾つかのヒトがん細胞で示されている。しかし、クエン酸ががん細胞の増殖停止を誘導する根本的なメカニズムは解明されていない。
本研究では、増殖を抑制する濃度のクエン酸によるヒト咽頭扁平上皮がん細胞の処置が、G2/M期で細胞周期停止を引き起こすことを示した。
免疫共沈降試験は、G2/M期におけるクエン酸誘導性の細胞周期停止が、サイクリンB1とリン酸化サイクリン依存性キナーゼ1(CDK1)(Thr 161)複合体の形成の安定化と関連していることを示した。
クエン酸によって引き起こされるサイクリンB1およびG2/M期停止の増加は、カスパーゼ−3阻害剤Ac-DEVD-CMKおよび変異型p21(D112N)のカスパーゼ−3切断によって抑制された。
恒常的に活性化したプロテインキナーゼB(Akt1)の異所性発現は、クエン酸によるp21切断、サイクリンB1 – リン酸化CDK1(Thr161)複合体、およびG2/M期停止の誘導を阻止した。
クエン酸によって誘導されるG2/M期細胞周期停止には、p85α-ホスファターゼとPTENの複合体によるAktの不活性化が必要であった。これは、クエン酸によるAkt活性の抑制とcyclin B1-p-CDK1 (Thr 161) 複合体の誘導と、G2/M期細胞周期停止がPTENの阻害剤によって阻止されたからである。
結論として、クエン酸は、ヒト咽頭扁平上皮がん細胞において、p85α-PTEN複合体を形成してAktシグナル伝達系を抑制し、cyclin B1-p-CDK1 (Thr 161) 複合体を形成することによってG2/M期細胞周期停止を誘導する。
ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素です。ホスファチジルイノシトール4,5-二リン酸(PIP2)の3位のOHをリン酸化してホスファチジルイノシトール3,4,5-三リン酸(PIP3)を生成する酵素です。PIP3がAktをリン酸化して活性化します。
PTENは脱リン酸化する酵素でPIP3をPIP2に変化することによってAktの活性化を阻止します。

図:ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。PTENはPIP3を脱リン酸化してPIP2に変換し、Akt活性化を阻止する。
PI3K-Aktシグナル伝達系は細胞の生存と増殖の制御の中心です。活性化したAktがシグナル伝達の下流に位置する様々なタンパク質をリン酸化して生存や増殖を制御しています。

図:PI3Kによってリン酸化されて産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。リン酸化(活性化)したAktがシグナル伝達の下流に位置する様々なタンパク質をリン酸化して生存や増殖を制御している。
PI3Kはp85αとp110の2つのサブユニットから構成されています。前述の論文ではクエン酸がp85α-PTEN複合体形成を促進してPI3Kを阻害するという機序で、Akt活性化を阻止するという結果です。以下がこの論文のまとめの図です。

図:クエン酸によるヒトPSC細胞におけるG2/M期停止の誘導の分子モデル。細胞内のクエン酸取り込みが高い条件下では、クエン酸はピルビン酸デヒドロゲナーゼおよびホスホフルクトキナーゼの活性を抑制し、したがってATPの産生を阻害し、p85α(Tyr508)のリン酸化を減弱し、細胞膜におけるp85αとp110αとの相互作用を妨害する。 細胞内ATPレベルの低下は、PTENのプロテアソームによる分解を阻害し、PTEN量を増やす。 p110αと結合していないp85αとリン酸化されていないPTENは、細胞膜中で優先的にp85α-PTEN複合体を形成する。 その結果、p85αはPTENを活性化して、Akt活性を低下させ、カスパーゼ-3を介したp21切断、サイクリンB1-p-CDK1(Thr 161)複合体形成、およびG2 / M期の細胞の蓄積を誘導する。(Int J Mol Sci. 2019 May; 20(9): 2105.のFig.7の説明文の日本語訳)
がん細胞内のクエン酸を増やす方法として、TCA回路を促進するジクロロ酢酸ナトリウム、脂肪酸とコレステロールの合成を阻害するメトホルミン、シンバスタチン、デルタ・トコトリエノールがあります。解糖系を阻害する2-デオキシ-D-グルコースや高濃度ビタミンC点滴やケトン食も有効です。
クエン酸を1日に10〜15g摂取する方法に、これらの治療法を組み合わせると、がん細胞の増殖を阻止し、アポトーシス(細胞死)を誘導できます。体内とがん細胞内のクエン酸を増やすと、がんを消滅することができそうです。
新著紹介

(くわしくはこちらへ)
| « 657)抗生物質... | 659)重曹とク... » |




