がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
739)断酒薬ジスルフィラムの抗がん作用(その1):アルデヒド脱水素酵素阻害作用
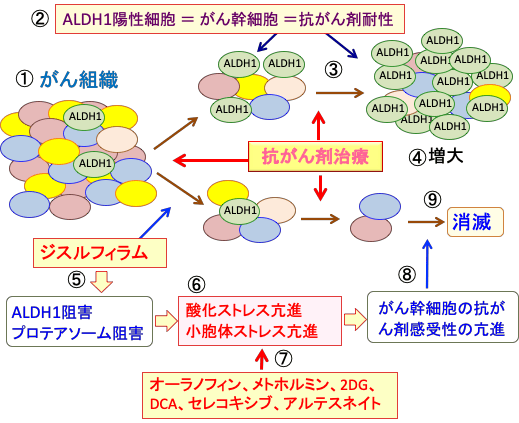
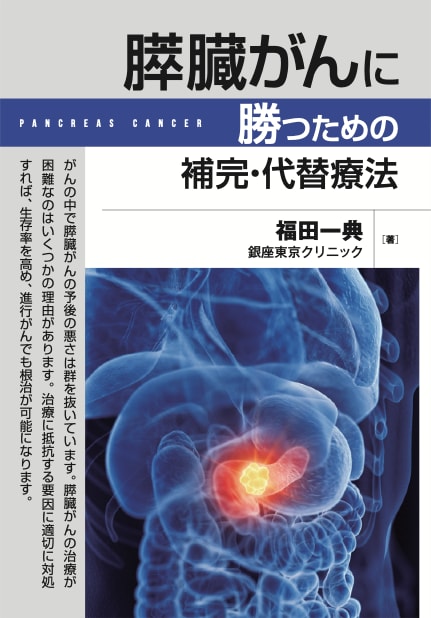
図:がん組織の中にはアルデヒド脱水素酵素1(ALDH1)を多く発現するがん細胞(ALDH1と記載)が存在する(①)。ALDH1の発現が多いがん細胞はがん幹細胞の性状を有し、抗がん剤耐性の性質を持つ(②)。ALDH1の発現が少ないがん細胞は抗がん剤で死滅しやすいが、ALDH1陽性のがん細胞は抗がん剤に抵抗性なので、生き残って増殖する(③)。がん幹細胞は腫瘍形成能を持つので、生き残ったALDH1陽性のがん幹細胞が増殖して、抗がん剤治療を繰り返すと抗がん剤抵抗性のがん幹細胞(=ALDH1発現の亢進したがん細胞)が増え、腫瘍はさらに増大する(④)。ジスルフィラムはアルデヒド脱水素酵素(ALDH1)やプロテアソームを阻害し(⑤)、がん細胞の酸化ストレスと小胞体ストレスを亢進する(⑥)。オーラノフィン、メトホルミン、2-デオキシ-D-グルコース(2-DG)、ジクロロ酢酸(DCA)、セレコキシブ、アルテスネイトもがん細胞の酸化ストレスと小胞体ストレスを亢進する(⑦)。これらを組み合わせると、抗がん剤感受性が亢進して、抗がん剤治療で死滅し(⑧)、がんを消滅できる(⑨)。
739)断酒薬ジスルフィラムの抗がん作用(その1):アルデヒド脱水素酵素阻害作用
【抗がん剤を使っていると効き目が弱くなる】
がん研究では、「がん細胞の抗がん剤感受性を高める方法」は重要な研究領域です。「抗がん剤感受性を高める」というのは抗がん剤の効き目を高める方法です。
単純に抗がん剤治療だけを実施しても、その効果には限界があります。一般的に、固形がんに対しては抗がん剤だけではがん細胞を消滅できません。さらに、抗がん剤を使い続けていると、いつか効かなくなるときが来ます。がん細胞がその抗がん剤に耐性を獲得するためです。
例えば肺腺がんで分子標的薬のチロシンキナーゼ阻害剤(イレッサ、タルセバなど)が効いても、多くは10〜14ヶ月程度で効かなくなります。通常の殺細胞作用を持った抗がん剤治療も、数ヶ月から1年もすれば効かなくなってきます。
がん細胞が抗がん剤でダメージを受けると、いろんなメカニズムを使って生き残る手段を獲得してきます。
抗がん剤を細胞の外に排出するポンプの作用を持つ蛋白質の合成を増加させたり、抗がん剤を不活化させる物質や薬の目標になる蛋白質を増産させて薬剤の作用を妨害します。抗がん剤の攻撃目標がDNAであれば、DNA修復を促進することにより細胞死を阻止しようとします。
多くの抗がん剤は細胞のアポトーシスを引き起こすことによって効果を発揮します。細胞には自ら細胞死を実行するプログラムが内在しており、細胞が傷付くとこのプログラムによって死にます。この細胞死をアポトーシスといいます。がん細胞はいろんな機序によってアポトーシスに対する抵抗性を獲得していきます。細胞死が起きにくくなるというアポト−シス耐性の獲得も抗がん剤耐性の重要なメカニズムです。

図:がん細胞は様々なメカニズムで抗がん剤の効き目を弱めている。例えば、抗がん剤の分解や代謝による不活性化の促進(①)、排出ポンプを増やして抗がん剤を細胞外への排出の促進(②)、抗がん剤のターゲット分子の増産(③)、アポトーシスに抵抗性になるBcl-2サブファミリーのタンパク質を増やしたり、アポトーシスを誘導するBaxサブファミリーの活性を抑制して細胞死に対する抵抗性の獲得(④)、ダメージを受けたDNAなど細胞成分の修復の促進(⑤)、など多くのメカニズムが知られている。
【アルコールの代謝産物のアセトアルデヒドは毒性がある】
多くのコホート研究をまとめた研究では、50gのアルコール(5%のビールで1000ml)を毎日飲むと、大腸がんの発生リスクを約40%高めることが報告されています。膵臓がんもアルコールで発がんリスクが上がることが明らかになっています。
アルコールが発がんを促進する理由は幾つかあります。例えば、アルコールが腸粘膜の透過性を亢進して発がん物質の細胞内への取込みを増やす可能性が指摘されています。
エタノールが薬剤代謝酵素のチトクローム P4502E1 (CYP2E1)の発現を誘導し、活性酸素の産生を増やすメカニズムも提唱されています。
しかし、最も大きな原因は、アルコールがアルコール脱水素酵素やCYP2E1やカタラーゼでアセトアルデヒドに変換されるからです。アセトアルデヒドはDNAと結合してDNA付加体を作ってDNA変異を引き起こしたり、様々な毒作用があります。
このアセトルデヒドを酢酸に変換する酵素がアルデヒド脱水素酵素(ALDH)です。ALDHはアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。
飲酒するとエチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝されます。アセトアルデヒドは毒性が強く、細胞や組織にダメージを与え、二日酔いや発がんの原因になります。そこで体は、アルデヒド脱水素酵素によってアセトアルデヒドを無害な酢酸に変換しています(下図)。

図:エチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝され、アセトアルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。
【がん幹細胞はアルデヒド脱水素酵素の発現が亢進している】
私たちの体は、一つの受精卵が分裂して分かれた胚細胞が、神経細胞や心筋細胞や肝細胞や皮膚細胞など異なった機能を持つ細胞に分化していきます。「分化」というのは、単一あるいは同一であったものが、複雑化したり、異質化したりしていく現象で、未熟な胚細胞が異なった機能をもった細胞に成熟する過程が細胞分化です。
組織の細胞には幹細胞(stem cell)と成熟した体細胞が存在します。組織の幹細胞とは、組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる細胞です。組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂(非対称分裂)により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出しています。
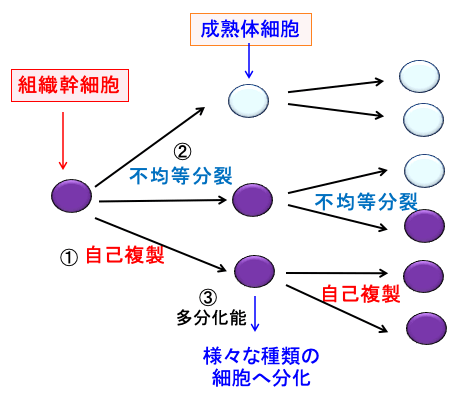
図:組織幹細胞は自己複製によって幹細胞を増やす(①)。幹細胞は不均等分裂(非対称分裂)を繰り返し、幹細胞自身と成熟した体細胞を作る(②)。幹細胞は多分化能を持ち、様々な細胞へ分化できる(③)。
組織幹細胞は、分裂して自分と同じ細胞を作り出すことができ(自己複製能)、いろいろな細胞に分化できる(多分化能)という二つの重要な性質を持ち、この性質により、限られた寿命のある体細胞を絶えず供給し、傷ついた組織を修復することができるのです。
がん組織においても正常組織における幹細胞システムに類似した階層性が存在し、その中にがん幹細胞と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成していることが明らかになっています。
がん幹細胞(cancer stem cell)は、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。

図:がん組織には成熟したがん細胞(①)とがん幹細胞(②)が存在する。がん幹細胞は自己複製を行うと同時に、不均等分裂により一部が自己複製のサイクルから逸脱して通常のがん細胞となり、がん組織の成熟がん細胞の供給源となる(③)。抗がん剤治療や放射線治療(④)に対して、成熟したがん細胞が死滅しやすいが、がん幹細胞は抵抗性を示す(⑤)。がん幹細胞が生き残れば、がんはいずれ再燃・再発する(⑥)。抗がん剤や放射線治療に対するがん幹細胞の感受性を高めることができれば、がん組織を消滅できる(⑦)。
がん幹細胞のマーカーの一つがアルデヒド脱水素酵素です。つまり、アルデヒド脱水素酵素はがん幹細胞に多く発現しています。
細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するためにアルデヒド脱水素酵素が必要なのかもしれません。この酵素の発現が多いがんほど増殖が早く予後が悪いことが報告されています。以下のような報告があります。
Aldehyde dehydrogenase 1A1 circumscribes high invasive glioma cells and predicts poor prognosis(アルデヒド脱水素酵素1A1は高度に浸潤性のグリオーマ細胞に多く発現し、予後不良を示唆する)Am J Cancer Res. 2015; 5(4): 1471–1483.
【要旨】
神経膠腫は高度に浸潤性の性質を持ち、極めて悪性度の高い脳腫瘍である。神経膠腫の浸潤性を評価できる信頼できる実践的なマーカーは治療の選択において役にたつ。
この研究では、237例の神経膠腫患者から採取した腫瘍組織におけるアルデヒド脱水素酵素1A1(ALDH1A1)発現が、神経膠腫の診断および予後を評価する上で有用かどうかを検討した。その結果、低悪性度のグリオーマ(WHO grade I-II)に比較して高悪性度のグリオーマ(WHO grade III-IV)ではALDH1A1が過剰に発現していることが明らかになった。
がん細胞内のALDH1A1の発現量は、腫瘍組織の中心部より、腫瘍組織の周辺部(正常組織との境界部)のがん細胞においてより発現が高かった。
ALDH1A1の過剰発現はがん細胞の分化度の低下と予後不良と関連を認めた。
正常組織との境界部にALDH1A1陽性の腫瘍細胞が存在する患者の全生存期間および無進展生存期間はより短かかった。
ALDH1A1の発現はグリオーマ患者の予後不良の独立したマーカーであることが明らかになった。
グリオブラストーマ細胞株U251および原発のグリオブラストーマ組織から採取したALDH1A1陽性の腫瘍細胞は、ALDH1A1陰性の腫瘍細胞に比べて、マトリックス・メタロプロテイネース2, 7, 9(MMP2, MMP7,MMP9)のmRNAとたんぱく質発現が亢進し、浸潤性やクローン形成性や増殖が強かった。
これらの結果は、ALDH1A1がグリオーマの浸潤や増殖を促進し、予後を不良にする因子であることを示している。したがって、高度に悪性度の高い神経膠腫の治療において、ALDH1A1をターゲットにする治療は重要である。
アルデヒド脱水素酵素はがん幹細胞に多く発現し、この酵素の発現が多いがんほど増殖が早く予後が悪いことは膠芽腫だけでなく多くの種類のがんで報告されています。
【アルデヒド脱水素酵素は酸化ストレスを軽減している】
アルデヒド脱水素酵素は、内因性および外因性のアルデヒド性物質を解毒する役割を担っています。
内因性のアルデヒドはアミノ酸やアルコールや脂肪酸やビタミンの代謝の過程で発生します。外来性のアルデヒドは環境中の成分や薬物(タバコの煙、自動車の排気ガス、細胞毒性のある医薬品など)などから由来します。アルデヒド脱水素酵素はこれらのアルデヒドを解毒する働きがあるのです。
ALDHは正常組織の組織幹細胞とがん組織のがん幹細胞のマーカーとして知られており、幹細胞における自己複製、分化、細胞保護に関与しています。ALDHの過剰発現および活性亢進は、乳がん、肺がん、食道がん、大腸がん、胃がんなど多くのがん種で、がん患者の予後不良と密接に関連していることが明らかになっています。ALDHの活性が高いがん細胞は多くの抗がん剤や放射線照射に抵抗性になることが明らかになっています。
ALDHは細胞内のアルデヒドを酸化することによってがん細胞内の酸化ストレスを軽減しています。つまり、ALDHを阻害すると酸化ストレスが亢進することになります。
【アルデヒド脱水素酵素は抗がん剤耐性を引き起こす】
アルデヒド脱水素酵素(ALDH)が抗がん剤のシスプラチン耐性に重要な働きをしていることが複数の研究で示されています。
シスプラチンは白金錯体に分類される抗悪性腫瘍剤(抗がん剤)です。2つの塩素原子部位でDNAと結合するため、DNA鎖内に架橋が形成され、DNA複製を阻害し、細胞分裂しているがん細胞および正常細胞を死滅させます。多くの固形がんの治療に使用され、効き目は高いのですが、その作用機序から副作用が強いのも特徴です。
しかし、最近の研究では、シスプラチンの抗がん作用はDNAに結合することより、細胞内で酸化ストレスを高める機序の関与が大きいと考えられています。
その理由は、シスプラチンの抗がん作用は抗酸化剤の投与で減弱すること、シスプラチン耐性細胞では抗酸化システムの増強が起こっていること、などが明らかになっているからです。
培養がん細胞にシスプラチンを添加すると細胞周期の停止や細胞死(アポトーシス)の誘導が起こりますが、抗酸化剤のN-アセチルシステインを加えるとシスプラチンの増殖抑制作用が阻止されることが示されています。
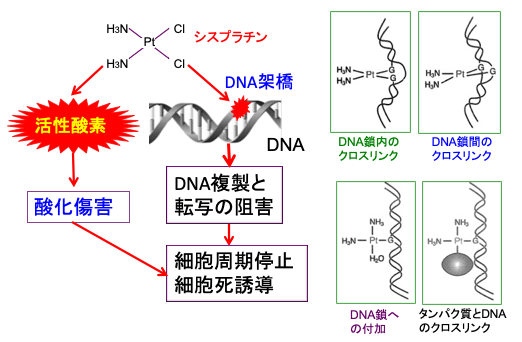
図:シスプラチンの2つの塩素(Cl)原子が、DNAの塩基の水酸基に結合し、DNA鎖内に架橋(クロスリンク)が形成され、DNAの複製やmRNAの転写を阻害して細胞にダメージを与え、細胞周期の停止(増殖抑制)と細胞死(アポトーシス)を誘導する。さらにシスプラチンは細胞内で活性酸素の産生を高め、酸化傷害によって細胞の増殖を抑制し細胞死を誘導する。最近の研究では、シスプラチンの殺細胞作用は、DNAのクロスリンクより活性酸素の産生を高めて細胞傷害を引き起こす作用の方が大きいと考えられている。
放射線治療や抗がん剤治療でDNAが切断されるとポリ(ADP-リボース)ポリメラーゼ(PARP)が活性化され、その結果NAD+が低下あるいは枯渇すると解糖系は阻害されます。NAD+を産生するためにNAD(P)H Oxidaseが活性化され、活性酸素種(スーパーオキシド、過酸化水素)の産生が増えるというメカニズムも報告されています。
ポリ(ADP-リボース)ポリメラーゼ(PARP)は,核DNAに生じた一本鎖切断端を認識してDNAに結合します。核DNAに結合したPARPは活性化され、ニコチンアミドアデニンジヌクレオチド(NAD+)を基質としてPARP自身やDNA修復関連タンパク質にADP-リボースを付加し、ポリ-ADP-リボシル化を引き起こします。通常、ポリ-ADP-リボシル化はDNA修復反応を活性化しますが、過度のPARPの活性化はNAD+とATPを枯渇します。
NAD+を産生するためにNAD(P)H Oxidaseが活性化され、活性酸素種(スーパーオキシド、過酸化水素)の産生が増えることになります。
つまり、DNAに損傷を与える放射線治療や抗がん剤治療は、PARPの活性化を介する機序で活性酸素の産生を高めます。(下図)

図:放射線治療や抗がん剤治療でDNAが切断されるとポリADPリボース合成酵素(Poly(ADP-ribose) plymerase:PARP)が活性化され、その結果NAD+が低下あるいは枯渇する。NAD+を産生するためにNAD(P)H Oxidaseが活性化される。NAD(P)H OxidaseはNADH(NADPH)とH+とO2から、NAD+(NADP+)とH2O2を生成する。過酸化水素が発生して酸化ストレスを高める。
アルデヒド脱水素酵素は酸化ストレスを軽減する作用があるので、アルデヒド脱水素酵素の発現が多いがん幹細胞はシスプラチンに耐性になりやすいと言えます。
シスプラチンで治療していると、ほぼ確実にシスプラチン耐性のがん細胞が出現し、シスプラチンはいずれ効かなくなります。
シスプラチン感受性および耐性の非小細胞性肺がん細胞株において、シスプラチンの投与はアルデヒド脱水素酵素(ALDH)の発現の高いがん細胞集団の出現または増大を誘導し、シスプラチン耐性をさらに高める結果が報告されています。つまり、ALDHを発現しているがん細胞はシスプラチンに耐性の性質を持つので、ALDH陽性細胞が選択的に増え、シスプラチンがさらに効きにくくなるという現象が起こることを示唆しています(下図)。

図:がん組織は様々な性状のがん細胞から構成されている。シスプラチンを投与すると、多くのがん細胞は死滅するが、アルデヒド脱水素酵素1(ALDH1)を発現しているがん細胞(図中でALDH1と記載)はシスプラチンに耐性を示して生き残る。さらにシスプラチンを投与しても、アルデヒド脱水素酵素1(ALDH1)の発現の高いがん細胞はシスプラチンに耐性を示すので、シスプラチン治療に生き残って増殖する。増殖したがん細胞はアルデヒド脱水素酵素陽性がん細胞(ALDH1)の割合が増え、さらにシスプラチン耐性が増強される。
膵臓がん細胞のゲムシタビン耐性にもアルデヒド脱水素酵素の関与の可能性が報告されています。
ゲムシタビン(Gemcitabine)はピリミジン代謝を阻害することによって抗がん作用を発揮します。ゲムシタビンは細胞内でゲムシタビン3リン酸に代謝されてDNAに取り込まれてDNA合成を阻害し、細胞死(アポトーシス)を誘導します。進行した膵臓がんの抗がん剤治療でファーストラインの抗がん剤として単独あるいは他の抗がん剤と併用して使用されています。
しかし、膵臓がん細胞は内因性あるいは獲得性にゲムシタビンに耐性を持つことが治療効果を妨げています。したがって、このような抗がん剤耐性を阻止できれば、膵臓がんに対する抗がん剤治療の有効性を高めることができます。
耐性獲得のメカニズムとしては、薬物の取込みや代謝、細胞死や増殖に関する遺伝子の変化(死滅しにくくなる)などがあります。さらに、がん幹細胞はアルデヒド脱水素酵素活性が亢進しており、アルデヒド脱水素酵素活性を阻害すると、ゲムシタビン耐性が阻止できることが報告されています。
ゲムシタビンは細胞内で活性酸素種を増やしアポトーシスを促進します。したがって、活性酸素を消去するとゲムシタビンによる増殖抑制効果は低下します。このようにゲムシタビンの抗腫瘍効果に活性酸素種の産生亢進が関与しており、アルデヒド脱水素酵素は活性酸素の産生を減らすので、ゲムシタビンの抗腫瘍効果を低下させることになります。
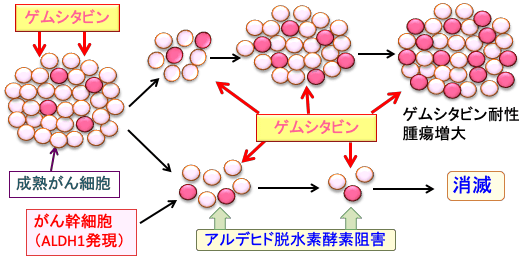
図:がん組織にはがん幹細胞が少数存在する。がん幹細胞は自己複製してがん幹細胞を維持すると同時に、成熟がん細胞を供給してがん組織を構成している。抗がん剤治療に対して、成熟がん細胞は死滅しやすいが、がん幹細胞は様々な機序で抵抗性を示す。がん幹細胞が生き残れば、がんは再燃・再発する。抗がん剤治療(ゲムシタビン)を繰り返すと、ゲムシタビンに抵抗性のがん幹細胞が生き残り、がん幹細胞が増えることによって、さらにゲムシタビン抵抗性が増強し、腫瘍は増大する。がん幹細胞が過剰に発現しているアルデヒド脱水素酵素を阻害するとがん幹細胞はゲムシタビンで死滅しやすくなり、がん組織を消滅できる。
ゲムシタビン耐性だけでなく、白金製剤やタキサン系の抗がん剤に耐性の卵巣がん、多剤耐性の胃がん細胞、シクロフォスファミド耐性のヒトがん細胞などでアルデヒド脱水素酵素の発現亢進が報告されており、アルデヒド脱水素酵素は多くの種類のがん細胞における薬剤耐性の原因となっている可能性が示唆されています。
アルデヒド脱水素酵素は、乳がん、大腸がん、膵臓がん、肺がん、肝臓がん、卵巣がんなど多くの種類のがんにおいて、がん幹細胞のマーカーとして認められており、がん幹細胞において発現が亢進しています。そして、アポトーシス抵抗性や抗がん剤耐性の原因となっています。
膵臓がんだけでなく、抗がん剤治療一般において、アルデヒド脱水素酵素の阻害は、抗腫瘍効果を高める効果が期待できます。
【ジスルフィラムはアルデヒド脱水素酵素を阻害する】
アセトアルデヒドはDNAと結合してDNA付加体(DNA adducts)を作ってDNA変異を引き起こしたり、様々な毒作用があります。アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
ジスルフィラム(Disulfiram)は、加硫促進剤や寄生虫疾患の治療薬(軟膏)など様々な領域で利用されている汎用性の高い物質です。ゴム処理労働者や疥癬患者が、アルコール飲料を飲んだあとに極めて強い有害反応を経験することが知られ、その原因がゴム処理過程で使用する加硫促進剤や疥癬の治療薬に含まれるチウラム・ジスルフィド(thiuram disulfides)に曝露されたことによることが70年以上前に明らかになりました。この発見により、ジスルフィラムは断酒薬として有用であることが示され、アルコール中毒の治療薬として認可され、60年間以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです。 ジスルフィラムはALDHの多くのアイソフォームを不可逆的に阻害します。
ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸(diethyldithiocarbamate)に速やかに変換され、さらにジエチルチオカルバミン酸メチルエステル・スルホキシド(diethylthiocarbamic acid methyl ester sulfoxide)に代謝されます。
ジスルフィラムのこの代謝物(ジエチルチオカルバミン酸メチルエステル・スルホキシド)は、アルデヒド脱水素酵素(aldehyde dehydrogenase:ALDH)の酵素活性部位のスルフヒドリル基(-SH)と反応してALDHの酵素活性を強力に阻害する作用があります(図)。

図:ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸(diethyldithiocarbamate)に変換される(①)。ジエチルジチオカルバミン酸は、さらにジエチルチオカルバミン酸メチルエステル・スルホキシド(diethylthiocarbamic acid methyl ester sulfoxide)に代謝される(②)。ジエチルチオカルバミン酸メチルエステル・スルホキシドは、アルデヒド脱水素酵素(aldehyde dehydrogenase:ALDH)の酵素活性部位のシステインのスルフヒドリル基(-SH)と反応してALDHに結合し、ALDHの酵素活性を阻害する。
アルデヒド基(-CHO)はタンパク質の側鎖のアミノ基と反応して結合します。病理検査で組織を固定する時にホルマリン(ホルムアルデヒドの水溶液)やグルタールアルデヒドを使用します。これは、ホルムアルデヒドやグルタールアルデヒドのアルデヒド基が組織のタンパク質のアミノ基と反応してタンパク質を架橋して凝固させる作用を持つからです。
「タンパク質の架橋」というのは、異なるタンパク質分子に橋を架けるようにして結合させることです。架橋されたタンパク質は正常の働きを行うことができなくなります。
したがって、このような毒性の強いアセトアルデヒドを早く分解する必要があります。この有害なアセトアルデヒドを無害な酢酸に代謝する酵素がアルデヒド脱水素酵素です。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです。
ジスルフィラムの抗がん作用はかなり古く(1970年代ころ)から研究されていますが、2010年代からその抗がん作用がかなり注目されるようになっています。ジスルフィラムの断酒作用はアルデヒド脱水素酵素の阻害によるのですが、アルデヒド脱水素酵素はがん幹細胞のマーカーになるほど、がん幹細胞ではアルデヒド脱水素酵素は重要な働きをしており、この酵素を阻害すると、がん細胞の抗がん剤感受性が亢進することが明らかになっています。
【ジスルフィラムはがん細胞の酸化ストレスを高める】
ジスルフィラムはタンパク質のシステインに反応して活性を阻害する機序によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼなど様々ながん促進性のタンパク質を阻害します。
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります。

図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
【ジスルフィラムはプロテアソームを阻害する】
プロテアソーム(Proteasome)は生体のすべての細胞に存在する複数のサブユニットから成る酵素複合体で、細胞内で不要になったタンパク質を分解する重要な役割を担っています。細胞内のタンパク質は秩序だった分解を受けますが、これに関与する分解系がユビキチン依存性プロテアソーム系です。
プロテアソームで分解されるためには,標的タンパク質に特定の目印が付かなければなりませんが、この目印の代表がユビキチンです。ユビキチンはアミノ酸76個から成るポリペプチドで,標的タンパク質のリジン残基にイソペプチド結合で結合します。ユビキチンは種を超えて極めて保存性の高いタンパク質です。
プロテアソームによるタンパク質分解は、細胞周期を遂行するうえで必須であるため、プロテオソームの働きを阻害するとがん細胞は細胞分裂が阻害されて死滅します。増殖や代謝の盛んな細胞ほどプロテアソームによる蛋白質分解活性が高く、したがって、がん細胞ではプロテアソームの発現が亢進し、高いプロテアソーム活性を有することが知られています。
プロテアソーム阻害剤としてベルケード(一般名 ボルテゾミブ)があります。ベルケードは化学療法に抵抗性になった難治性の多発性骨髄腫の治療薬として認可されています。ベルケードは強い副作用がありますが、それは正常細胞でもその機能維持にプロテアソームの働きが必要だからです。がん細胞におけるプロテアソームの活性のみを阻害できれば副作用の少ない抗がん剤となる可能性があります。
プロテアソームを阻害し、新規な抗がん剤として使用できる薬剤の大規模スクリーニングの結果、ジスルフィラムがプロテアソーム阻害活性を有することが明らかになっています。
その作用機序として、ジスルフィラムがp97セグレガーゼのアダプターNPL4に作用してユビキチン・プロテアソーム系でのタンパク質分解過程を阻害することによって、がん細胞を死滅するというメカニズムが報告されています。
p97はタンパク質の分解に重要な働きを行っているユビキチン・プロテアソーム系で重要なタンパク質です。p97はユビキチン化されたタンパク質と、そのタンパク質と結合している他のタンパク質から引き離す働きをしています。
ジスルフィラムはp97のアダプターのNPL4に作用してp97の働きを阻害し、ユビキチン・プロテアソーム系でのタンパク質の分解を阻害することによって、抗がん作用を発揮しているというメカニズムです。
実際は、ジスルフィラムは多くの物質に作用するので、p97のアダプターのNPL4もターゲットの一つだという認識で良いと思います。前述のようにジスルフィラムはアルデヒド脱水素酵素も阻害します。その他にも複数のターゲット分子が知られています。
【ジスルフィラムは多くの抗がん剤治療の抗腫瘍効果を高める】
ジスルフィラムと抗がん剤を併用した臨床試験の結果が数多く報告されています。
たとえば、非小細胞性肺がんの抗がん剤治療(シスプラチン+ビノレルビン)にジスルフィラムを併用する臨床試験の結果が報告されています。
新規に診断されたステージ4の非小細胞性肺がん患者40例が抗がん剤(シスプラチン+ビノレルビンで2サイクル以上)で治療を受けています。この40例のうち20例はジスルフィラム(1回40mgを1日3回)を服用しています。
生存期間の平均は、抗がん剤単独群が7.1ヶ月で、抗がん剤+ジスルフィラム併用群が10ヶ月でした。長期生存患者が2名いて、どちらもジスルフィラム併用群でした。ジスルフィラム併用による安全性には問題はありませんでした。
つまり、ステージ4の非小細胞性肺がんのシスプラチン+ビノレルビンの抗がん剤治療にジスルフィラムを併用すると、生存期間を延ばす効果があるという結果です。
疫学研究からは、がんと診断された後もジスルフィラムの使用を継続した患者は、がんの診断時にジスルフィラムの使用を中止した患者よりも、がんによる死亡リスクが低いことが報告されています。
ジスルフィラムは比較的安価であり、アルコールさえ飲まなければジスルフィラムは極めて副作用の少ない薬です。
しかし、ドセタキセルのように溶解にエタノールを使う薬があるので、点滴を受けているときは、エタノールフリーであることを確認することが重要です。
【酸化ストレス亢進におけるジスルフィラムとオーラノフィンの相乗効果】
酸化ストレスの亢進に対して細胞は内因性の抗酸化物質の量を増やすことによって細胞を守ろうとします。このような抗酸化物質は、フリーラジカルを直接消去するようなものであったり、酸化したジスルフィド結合(S-S)に水素を与えて還元する(-SH)作用を持つもの(NADPHのようなもの)になります。
細胞内の酸化還元常状態の恒常性維持には2つのシステムが主要な貢献を行っています。その2つというのはグルタチオンとチオレドキシン・システムです。
この2つの抗酸化システムはがん細胞において過剰に発現しています。その理由は、がん細胞ではその特徴的な代謝によって活性酸素の産生が亢進しており、それに対抗して細胞を守るためです。
がん細胞の抗酸化システムを阻害するような他の薬をジスルフィラムと併用すると、ジスルフィラムの抗腫瘍活性を高めることができると予測できます。
リュウマチ治療薬のオーラノフィン(Auranofin)はチオレドキシン還元酵素(thioredoxin reductase)の活性を阻害する作用を有するので、ジスルフィラムの抗腫瘍効果を増強する効果が期待できます。
実際に、卵巣がん細胞を用いた実験系で、がん細胞を死滅させるジスルイフィラムの効果をオーラノフィンが増強する結果が得られています。
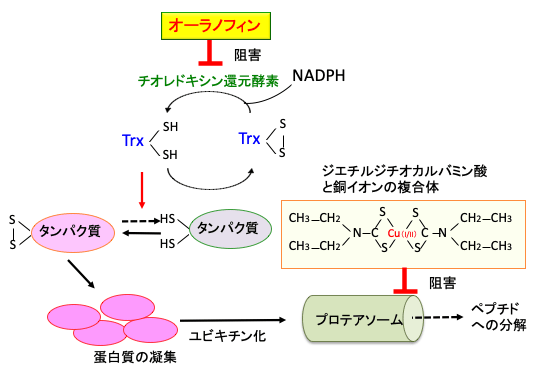
図:チオレドキシン(Trx)は酸化したタンパク質を還元作用によって元に戻そうとする。酸化したチオレドキシンをNADPHを使って還元型に戻すチオレドキシン還元酵素をオーラノフィンは阻害する。チオレドキシンの作用が阻害されると、酸化したタンパク質は活性を失い、正常な構造を保てずに凝集が起こる。このような異常細胞はプロテアソームで分解されるが、ジスルフィラムの代謝物質(ジエチルジチオカルバミン酸)と銅イオンの複合体はプロテアソームの働きを阻害する。その結果、毒性の強いタンパク質凝集物が細胞内に蓄積して細胞は死滅する。
ジスルフィラムとオーラオフィンは極めて多彩なメカニズムで抗腫瘍作用を発揮します。オーラノフィンとジスルフィラムの相乗効果のメカニズムを以下にまとめています。

図:ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸に変換され、さらにジエチルチオカルバミン酸メチルエステル・スルホキシドに代謝される(①)。ジエチルチオカルバミン酸メチルエステル・スルホキシドは、アルデヒド脱水素酵素の酵素活性部位のシステインのスルフヒドリル基(-SH)と反応して結合し、酵素活性を阻害する。同様なメカニズム(タンパク質のシステインに反応して活性を阻害する機序)によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼを含む、様々ながん促進性のタンパク質を阻害する(②)。ジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する(③)。複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める(④)。スルフヒドリル基(-SH)が酸化されたタンパク質は凝集しプロテアソームで分解される。ジエチルジチオカルバミン酸と銅の複合体はプロテアソームにおけるタンパク質の分解機能を強力に阻害する。プロテオソームの働きが阻害されるとユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によって致死的に作用する(⑤)。チオレドキシン(Trx)は酸化したタンパク質を還元作用によって元に戻そうとする。酸化したチオレドキシンをNADPHを使って還元型に戻すチオレドキシン還元酵素をオウラノフィンは阻害する(⑥)。酸化したタンパク質は活性を失い、正常な構造を保てずに凝集が起こる。このような異常細胞はプロテアソームで分解されるが、ジエチルジチオカルバミン酸と銅イオンの複合体はプロテアソームの働きを阻害する。その結果、毒性の強いタンパク質凝集物が細胞内に蓄積して細胞は死滅する。(参考: Cell Cycle. 13(10):1513-4.2014の図を改変)
【タンパク質分解阻害作用におけるオーラノフィンとジスルフィラムの相乗効果】
オーラノフィンは関節リュウマチの治療薬です。このオーラノフィンとジスルフィラムが抗がん作用において相乗効果を示すことが報告されています。以下のような報告があります。
Two clinical drugs deubiquitinase inhibitor auranofin and aldehyde dehydrogenase inhibitor disulfiram trigger synergistic anti-tumor effects in vitro and in vivo(脱ユビキチン化酵素阻害剤のオーラノフィンとアルデヒド脱水素酵素阻害剤のジスルフィラムの2つの薬剤はin vitroおよびin vivoの実験系において相乗的な抗腫瘍効果を引き起こす)Oncotarget. 2016 Jan 19; 7(3): 2796–2808.
【要旨】
プロテアソーム関連脱ユビキチン化酵素の阻害は、がん治療のための新規な戦略として注目を集めている。関節リウマチの治療に使われている金(I)含有化合物のオーラノフィンが、プロテアソーム関連脱ユビキチン化酵素の阻害剤であることが最近報告された。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコール中毒の治療に使われている。ジスルフィラムが抗腫瘍活性を有することが最近の研究で明らかになっている。
本研究では、肝臓がん細胞を用いて、がん細胞のアポトーシス誘導と増殖抑制におけるジスルフィラムとオーラノフィンの相乗効果について検討した。
その結果、オーラノフィンとジスルフィラムはin vitroとin vivoの両方の実験系において、肝臓がん細胞に対して相乗的な抗腫瘍活性を示した。
さらに、オーラノフィンとジスルフィラムの併用は、カスパーゼの活性化、小胞体ストレス、活性酸素産生を亢進した。
汎カスパーゼ阻害剤z-VAD-FMKは、オーラノフィンとジスルフィラムの併用投与によって引き起こされるアポトーシスを阻害したが、プロテアソーム阻害作用は阻害しなかった。オーラノフィンとジスルフィラムの併用によるアポトーシス誘導には活性酸素は関与していなかった。
以上の結果から、肝臓がん細胞におけるアポトーシス誘導におけるジスルフィラムとプロテアソーム関連脱ユビキチン化酵素阻害剤のオーラノフィンとの間の相乗作用が確認され、新規ながん治療法となる可能性が示された。
この論文では、ジスルフィラムとオーラノフィンは異なる作用メカニズムでタンパク質分解を阻害するので、相乗的な抗腫瘍効果が期待できるということです。したがって、この2つの薬剤の組合せは、がんの代替療法として使用してみる価値は高いと思います。
私自身、数年前からこの2つをがん治療に併用していますが、飲酒しなければ副作用はほとんど経験しません。
【メトホルミンはジスルフィラムの抗がん作用を強化する】
糖尿病治療薬のメトホルミンがジスルフィラムの抗がん作用を増強することが報告されています。以下の様な報告があります。
Disulfiram/copper-disulfiram Damages Multiple Protein Degradation and Turnover Pathways and Cytotoxicity is Enhanced by Metformin in Oesophageal Squamous Cell Carcinoma Cell Lines.(ジスルフィラム/銅-ジスルフィラムは食道扁平上皮がん細胞株において複数のタンパク質分解と代謝回転経路を障害し、細胞毒性はメトホルミンによって増強される)J Cell Biochem. 2015 Oct;116(10):2334-43.
【要旨】
1950年代からアルコール依存症の治療に使用されているジスルフィラムは、還元的に活性化されてジエチルジチオカルバメートになり、どちらの化合物もチオール反応性で銅と容易に複合体を形成する。最近では、ジスルフィラムと銅-ジスルフィラムが強力な抗がん活性を示すことが明らかになっている。
我々は以前の研究で、抗糖尿病薬メトホルミンが食道扁平上皮癌がん細胞株において増殖を抑制し、細胞内還元環境を誘導することを示した。
これらの観察に基づいて、本研究では、銅-ジスルフィラマおよびジスルフィラの抗腫瘍効果を、メトホルミンとの併用の有無との関連で検討した。
銅-ジスルフィラムとジスルフィラムが食道扁平上皮癌がん細胞株のパネル全体で顕著な細胞毒性を引き起こし、メトホルミンがジスルフィラムの抗腫瘍効果を大幅に増強することを発見した。
細胞不透過性銅キレート剤であるバソクプロインジスルホン酸(bathocuproinedisulfonic acid)がこれらの薬剤の細胞毒性効果を減弱させ、興味深いことに、メトホルミン処理食道扁平上皮がん細胞はより多くの細胞内銅を含んでいた。
これは、銅輸送の上昇がジスルフィラムおよびメトホルミン-ジスルフィラム誘発細胞毒性に寄与していることを示唆している。
さらに、がん細胞はタンパク質分解/代謝回転経路への依存度が高いため、ジスルフィラムはがん細胞を優先的に標的とする可能性があり、プロテアソーム阻害剤としてのジスルフィラムの抗腫瘍効果をメトホルミンがさらに強化することを発見した。
リソソームがジスルフィラムの新規のターゲットである可能性がある。実際に、この酸に不安定な化合物(ジスルフィラム)はリソソームの酸性化を減少させ、ジスルフィラム-メトホルミンの同時処理はこれらの細胞のオートファジーの進行を妨げた。
要約すると、リソソームはジスルフィラムのターゲットであり、ジスルフィラムの単独またはメトホルミンとの併用投与はin vitroでの細胞毒性効果を示した最初の報告であり、食道扁平上皮がん細胞の新しい治療法として提案する。
以下の様な論文もあります。
The Combination of Metformin and Disulfiram-Cu for Effective Radiosensitization on Glioblastoma Cells.(膠芽腫細胞に対する効果的な放射線増感のためのメトホルミンとジスルフィラム-Cuの組み合わせ)Cell J. 2020 Oct-Dec; 22(3): 263–272.
【要旨】
目的:膠芽腫は標準的な治療法に対する反応が乏しく、予後の極めて悪い原発性脳腫瘍の1つである。ジスルフィラムやメトホルミンなどの再利用薬は、膠芽腫を含むさまざまな細胞株で抗腫瘍特性を示している。本研究では、6MV X線ビームに照射されたU87-MG細胞のアポトーシスの誘導に対するメトホルミンとジスルフィラム-Cuの組み合わせ効果に焦点を当てた。
材料および方法:この実験的研究では、MTTアッセイを用いて各薬剤の細胞毒性を評価した。照射後、フローサイトメトリー、ウエスタンブロット、およびリアルタイムPCR法を使用してアポトーシス細胞を評価し、BAXやBCL-2などのいくつかの細胞死マーカーの発現を分析した。
結果:メトホルミンとジスルフィラムの両薬剤併用は、U87-MG細胞株に対する細胞毒性の影響を及ぼし、放射線照射に対する感受性を高めた。両方の薬剤を組み合わせて使用すると、細胞増殖が大幅に減少し、アポトーシスが誘導され、BAX、P53、CASPASE-3の発現が亢進し、抗アポトーシスタンパク質BCL-2の発現は遺伝子およびタンパク質レベルの両方で著しく減少した。
結論:放射線照射にメトホルミンとジスルフィラムを併用すると、U87-MG細胞株の増殖を著しく減少させる。これは、内因性経路の刺激を介してアポトーシスを誘導する。放射線治療とメトホルミンとジスルフィラムの併用は、膠芽腫の治療成績を高める可能性がある。
以上の多くの研究報告から、がん治療においてジスルフィラム+オーラノフィン+メトホルミンは相乗効果が期待できます。さらに、2-デオキシ-D-グルコース、ジクロロ酢酸ナトリウム、セレコキシブ、アルテスネイトもがん細胞の酸化ストレスと小胞体ストレスを亢進します。これらを組み合わせると、抗がん剤や放射線治療に対するがん細胞の感受性を高め、がんを消滅できる可能性が高くなります(トップの図)。
この治療は飲酒はできませんが、飲酒しなければほとんど副作用は出ません。副作用が出ても、軽度の消化器症状(胃痛、吐き気、下痢など)程度です。がんの補完・代替療法として試してみる根拠は十分にあると思います。
(ドセタキセルのように溶解にエタノールを使う薬があるので、点滴を受けているときは、エタノールフリーであることを確認することが重要です。)
膵臓がんの補完・補完代替療法は多数の種類があります。その一部を以下の書籍でまとめています。
| « 738)ミトコン... | 740)断酒薬ジ... » |