がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
665)がんのアルカリ療法(その2):COX-2阻害剤セレコキシブは炭酸脱水酵素を阻害する
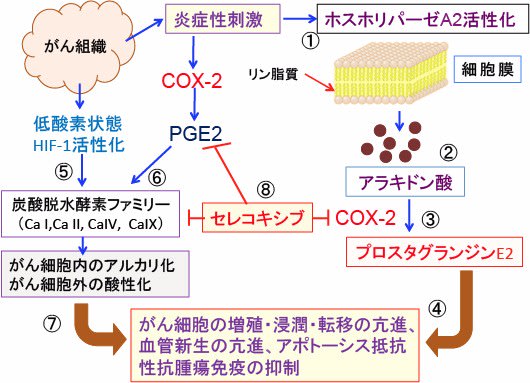
図:がん組織内では炎症反応が起こり、ホスホリパーゼA2が活性化され(①)、アラキドン酸が生成される(②)。アラキドン酸は炎症刺激によって誘導されるシクロオキシゲナーゼ-2(COX-2)によってプロスタグランジンE2が産生される(③)。プロスタグランジンE2はがん細胞の増殖や浸潤や転移や血管新生を亢進し、アポトーシス(細胞死)に抵抗性にし、がん細胞に対する免疫応答(抗腫瘍免疫)を抑制する(④)。がん組織内における低酸素環境は低酸素誘導因子-1(HIF-1)を活性化して炭酸脱水酵素ファミリーの発現を亢進する(⑤)。がん組織内の炎症刺激はCOX-2の発現を亢進し、産生されるプロスタグランジンE2(PGE2)は炭酸脱水酵素IX(CA IX)の発現を亢進する(⑥)。炭酸脱水酵素ファミリーはがん細胞内のアルカリ化とがん細胞外の酸性化を促進し、がん細胞の浸潤・転移や血管新生を亢進し、抗腫瘍免疫を抑制する(⑦)。セレコキシブはCOX-2と炭酸脱水酵素ファミリーのCa IIやCa IXを阻害することによって、がん細胞の増殖を抑制し、細胞死を誘導する(⑧)。セレコキシブによる炭酸脱水酵素の阻害作用は、COX-2依存性と非依存性の両方のメカニズムで引き起こされる。
665)がんのアルカリ療法(その2):COX-2阻害剤セレコキシブは炭酸脱水酵素を阻害する
【酸塩基平衡と重炭酸緩衝系】
水素イオン指数(pH:potential of hydrogen)は水素イオンの濃度を表す物理量です。pHの読みは「ピーエイチ」(英語読み)、または「ペーハー」(ドイツ語読み)です。
pHは水素イオンのモル濃度を mol/Lで表した数値の逆数の常用対数で示したもので、数値が低いほど酸性(プロトン量が多い)、数値が高いほどアルカリ性(プロトン量が少ない)になります。
体内のpHは非常に狭い範囲で厳密に制御されています。正常な動脈血のpHは7.35〜7.45という非常に狭い範囲で調節されています。
このpHの調節は酸と塩基のバランスで行われます。
「酸」というのは水素イオン(H+)を放出する物質で、「塩基」というのは水素イオン(H+)を受け取る物質です(下図)。

図:酸は水素イオンを放出し、塩基は水素イオンを受け取る
酸塩基のバランスを一定に保つ働きは体のいろいろなところで行なわれていますが、その中でも代表的な部位は、血液・体液、肺、腎臓です。
血液・体液における酸塩基平衡の調節で最も重要なのが重炭酸緩衝系です。
この系は、重炭酸イオン(HCO3-)が塩基となってプロトン(水素イオン)を受けとって中和してpHを一定に維持します。

体内で産生される水素イオンを重炭酸イオンが中和して、二酸化炭素は肺から排出されて血液・体液のpHが一定に維持されます。
【炭酸脱水酵素は重炭酸緩衝系の働きを高める】
炭酸脱水酵素(Carbonic Anhydrase)は炭酸(H2CO3)から水(H2O)を抜き取り二酸化炭素(CO2)にする酵素です。
私たちは酸素を体内に取り込んで、ミトコンドリアで糖や脂肪を分解してエネルギー(ATP)を産生しています。肺から取り込んだ酸素は血液中に拡散し、赤血球中のヘモグロビンに結合して全身の細胞に運ばれます。この酸素呼吸の副産物として細胞内で二酸化炭素(CO2)が産生されますが、これは体外に排出する必要があります。この二酸化炭素は細胞外に拡散し、何種類かの方法で血液中を輸送されます。
10%未満は血漿中に溶けて、約20%はヘモグロビンと結合して運搬され、大半は炭酸(H2CO3)に変換されて輸送されます。
赤血球中に炭酸脱水酵素(Carbonic Anhydrase)があって、二酸化炭素が炭酸と重炭酸イオンに変換する作用を助けます。
肺では赤血球の炭酸脱水酵素が重炭酸イオンを二酸化炭素に戻す作用を助け、できた二酸化炭素は拡散して肺から排出されます。
この反応は酵素がなくても自然に起こりますが、炭酸脱水酵素は触媒作用によってこの変換速度を100万倍に加速することができます。
つまり、炭酸脱水酵素は二酸化炭素ガスを血液中に溶解させることによって呼吸によって排出できるようにしています。
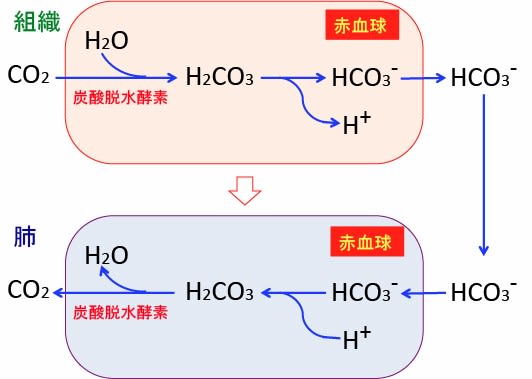
図:体内の組織で産生された二酸化炭素(CO2)は拡散して赤血球内で炭酸脱水酵素によって重炭酸イオン(HCO3)に変換されて血清中に溶け込む。重炭酸イオンは肺で赤血球中の炭酸脱水酵素によって二酸化炭素に変換され、肺から排出される。
炭酸脱水酵素は二酸化炭素と水を炭酸(重炭酸イオン+水素イオン)に変換する酵素で、1933年に牛の赤血球から発見されました。その後、体内の全ての細胞に存在することが明らかになっています。
哺乳類の炭酸脱水酵素は構造や局在の異なる10種類以上のアイソザイムが知られています。
炭酸脱水酵素は重炭酸緩衝系を促進することによって、体液や細胞内の酸塩基平衡の制御に重要な働きを担っています。
つまり、動物においてこの酵素の主たる機能は、二酸化炭素と炭酸水素イオンとを相互変換することで、血液や他の組織の酸-塩基平衡を維持し、組織から二酸化炭素を運び出す補助をしています。
【炭酸脱水酵素はがん細胞内をアルカリ化する】
解糖系で産生される乳酸やプロトン(水素イオン)は、664話で解説したようにV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って細胞外に排出されます。
二酸化炭素は炭酸脱水酵素によって排出が促進されます。この場合、細胞質内の炭酸脱水酵素II(CA II)は二酸化炭素(CO2)と水(H2O)から重炭酸イオン(HCO3-)と水素イオン(H+)を産生し、水素イオンは上記の方法で細胞外に排出され、重炭酸イオンは細胞内に保持されます。
また、細胞膜に存在する炭酸脱水酵素IX(CA IX)は細胞外で二酸化炭素を水から生成される炭酸を重炭酸イオン(HCO3-)とプロトン(H+)にして重炭酸イオンは共輸送体によって細胞内に取り込まれます。
この炭酸脱水酵素IX(CA IX)は低酸素誘導因子-1(HIF-1)によって発現が誘導されます。がん細胞ではHIF-1の発現と活性が亢進しています。HIF-1は解糖系を亢進してプロトン(水素イオン)の産生を亢進して細胞外を酸性化します。
炭酸脱水酵素IXの発現亢進はがん細胞内をアルカリ化するのに役立っています。
がん細胞の外部は酸性化し、細胞内部はアルカリ化していることは664話で解説しています。

図:炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する(①)。細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる(②)。細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素を重炭酸イオンと水素イオンに変換する(③)。水素イオンは細胞外に排出され、重炭酸イオンは細胞内に保持される(④)。その結果、細胞外pH(pHe)は低下してより酸性化し(⑤)、細胞内pH(pHi)はよりアルカリ化される(⑥)。
がん組織の微小環境は血液やリンパ液の循環が悪いので、水素イオンはがん組織に蓄積します。その結果、がん細胞の周囲の組織は水素イオンの濃度が高くなってpHが低下します。
正常の組織のpHは7.3〜7.4程度とややアルカリ性ですが、がん組織の微小環境のpHは6.2〜6.9とより酸性になっていると言われています。
一方、がん細胞の細胞内は、重炭酸イオンが蓄積してアルカリ化しています。

図:正常細胞では細胞内pH(pHi)は6.99〜7.05とほぼ中性で、細胞外pH(pHe)は7.3〜7.4とアルカリ性になっていて、pHeがpHiより高い。一方、がん細胞では細胞内pHは7.12〜7.7とアルカリ性になって、細胞外pHは6.2〜6.9と酸性になって、pHiがpHeより高い。
【がん細胞内のアルカリ化は解糖系亢進(ワールブルグ効果)を促進している】
上述のように、細胞内pHと細胞外pHの差は正常細胞ではマイナス(細胞外の方がpHは高い)でがん細胞ではプラス(細胞内の方がpHは高い)になっています。
がん細胞において、細胞内pHがアルカリ性で、細胞外が酸性という状況が細胞増殖や血管新生を促進する重要な要因になっていることが明らかになっています。
したがって、がん細胞の細胞内pHを低下(酸性化)させ、細胞外pHを高める(アルカリ化)方法は、有望ながん治療となります。
がん細胞では、解糖系の亢進によって乳酸とプロトン(水素イオン)の産生は亢進しています。しかし、がん細胞では、プロトンの細胞外排出能を高めることによって、細胞内をアルカリ性に維持し、細胞外の酸性度を高めています。
この細胞外へのプロトンの排出は前述のように、Na+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)、液胞型プロトンATPアーゼ(vacuolar H+-ATPases)、H+/Cl− 共輸送体(H+/Cl− symporter)、モノカルボン酸輸送体(monocarboxylate transporter:乳酸-プロトン共輸送体)、ナトリウム依存性Cl−/HCO3− 交換体(Na+-dependent Cl−/HCO3− exchangers)、炭酸脱水酵素(Carbonic anhydrase)、ATP合成酵素(ATP synthase)などのトランスポーターや酵素によって制御されています。
がん細胞はグルコースの取り込みと解糖系での代謝が亢進しており、その結果、乳酸とプロトン(水素イオン)の産生が増えています。
この乳酸とプロトンを細胞外に積極的に放出することによって、細胞内はアルカリ側に維持しています。
がん組織は細胞外液の循環が悪いので、細胞外に乳酸やプロトンが蓄積して、細胞外は酸性になっています。このpH勾配の逆転ががん細胞の悪性化進展に関与していることが明らかになっています。
がん遺伝子を導入して細胞のがん化を誘導する実験で、細胞のがん化の過程の初期にNa+-H+ exchanger 1(Na+-H+ 交換輸送体1: NHE1)活性が亢進して、がん細胞内のpHがアルカリ化することが観察されています。
この細胞内のアルカリ化は、解糖系での酵素活性を高め、好気性解糖(ワールブルグ効果)を亢進し、細胞の増殖を促進します。
つまり、細胞のがん化過程においてNHE1活性が亢進し、細胞内のアルカリ化が亢進することが、細胞の解糖系とがん化過程をさらに亢進することになるのです。
がん細胞のエネルギー代謝で最も特徴的なのが、酸素が十分に利用できる状況でも、がん細胞はミトコンドリアでの酸素呼吸(酸化的リン酸化)が抑制され、酸素を使わない解糖系でのグルコース代謝が亢進していることです。これは好気的解糖と言います。この現象は、オットー・ワールブルグ博士によって発見されたのでワールブルグ効果とも呼ばれています。
解糖系と酸化的リン酸化の活性は細胞内pHに依存していますが、その作用は逆です。つまり、細胞内のアルカリ化に伴って、酸素呼吸から解糖に移行するのです。
細胞内pH(pHi)がアルカリ化すると解糖系酵素(ホスホフルクトキナーゼ-1や乳酸脱水素酵素など)の活性が亢進することが明らかになっています。
解糖で1分子のグルコースから2分子のプロトンが産生されます。
NHE1(Na+-H+ 交換輸送体1:Na+-H+ exchanger 1)は細胞外のナトリウムイオンと細胞内のプロトンを交換しながら細胞内のプロトンを細胞外に放出する働きを示す交換輸送体です。
pHiが低下(酸性化)するとNHE1にプロトンが結合して構造が変化し活性化します。
NHE1の発現と活性が亢進すると、細胞内はアルカリ化し、細胞外は酸性になります。
NHE1の発現が多いほど、予後が悪いことが報告されています。
がん細胞内が酸性になるとNHE1にプロトンが結合して活性が亢進するので、細胞内の解糖系を阻害するとNHE1の活性を抑制できます。
また、NHE1の発現は低酸素誘導因子-1(HIF-1)で誘導されるので、HIF-1の活性を抑制すると、NHE1の活性を抑制できます。
モノカルボン酸トランスポーター(Monocarboxylate transporter:MCT)は乳酸やピルビン酸やケトン体と一緒にプロトン(水素イオン)を受動拡散で排出する共輸送体です。これもHIF-1で誘導されます。
HIF-1はプロトンを細胞外に排出するポンプやトランスポーターや酵素の発現を亢進して、細胞内pHをアルカリ性(7.3以上)に維持しようとしています。したがって、HIF-1の発現や活性を抑えることは、がん組織の酸性化を阻止します。
ラパマイシンやジクロロ酢酸やジインドリルメタンはHIF-1の活性を抑制します。(364話参照)
モノカルボン酸トランスポーター(MCT)はpHi(細胞内pH)を高め、pHe(細胞外pH)を低下させます。MCTを阻害するとpHiが低下(酸性化)して増殖活性が低下することが示されています。
液胞型プロトンATPアーゼ(V-ATPases)はATPのエネルギーを使ってプロトンを細胞外に排出します。
NHE1やMCTの阻害剤は抗がん作用が期待できるので開発中ですが、まだ臨床で使用できるものはありません。一方、液胞型プロトンATPアーゼ(V-ATPases)は、胃薬として既に使用されているプロトンポンプ阻害剤で阻害できることが報告されています。
プロトンポンプ阻害剤で細胞外をアルカリ性にして細胞内を酸性にすると、がん細胞の増殖を抑え、抗がん剤の効き目を高めることができます(664話)。
炭酸脱水酵素阻害剤は、すでに使われている薬があります。アセタゾラミド(商品名:ダイアモックス)は炭酸脱水酵素阻害作用によって利尿剤や緑内障の治療に使われています。アセタゾラミドががん治療に役立つという実験結果が複数報告されています。
【炭酸脱水酵素の発現の多いがんは予後が悪い】
がん細胞で発現が増えているものは、がん細胞の生存や増殖に重要な役割を担っている可能性が高いと言えます。そのようなターゲットとしてGLUT1、HIF-1、炭酸脱水酵素IX、アルデヒド脱水素酵素1A1などがあります。
多くの固形がんでは、低酸素の微小環境によって強い低酸素ストレスを受けています。
がん細胞は生存し増殖するためには、この低酸素状態に適応しなければなりません。低酸素誘導性性因子-1(HIF-1)によって発現が誘導される炭酸脱水酵素IX(CA IX)は、がん細胞が低酸素ストレスに適応するために発現が亢進していると言えます。
炭酸脱水酵素は10種類以上のアイソザイムが存在し、構造や局在が異なります。このうち炭酸脱水酵素IX(carbonic anhydrase IX)は低酸素誘導因子-1(HIF-1)によって発現が誘導され、がん細胞内のpHをアルカリ性にする働きを担っています。
炭酸脱水酵素の発現が亢進しているがんは予後が悪いことが多数の研究で明らかになっています。例えば、以下のような報告があります。
Hypoxia-inducible factor 1 promotes chemoresistance of lung cancer by inducing carbonic anhydrase IX expression.(低酸素誘導因子-1は炭酸脱水酵素IXの発現を誘導することによって肺がん細胞の抗がん剤抵抗性を促進する)Cancer Med. 2017 Jan;6(1):288-297.
低酸素誘導因子-1(HIF-1)の活性亢進は抗がん剤抵抗性を引き起こします。
HIF-1はグルコーストランスポーター(GLUT-1)の発現を亢進してグルコースの取り込みを促進します。さらに解糖系酵素の発現を誘導し、解糖系での糖代謝を亢進します。さらに、HIF-1は炭酸脱水酵素IXの発現を亢進します。
この論文では、肺がん細胞株A549を用いたin vitroの実験系で、低酸素で培養してHIF-1の発現を誘導し、GLUT-1と炭酸脱水酵素IXの発現を誘導すると、HIF-1とGLUT-1と炭酸脱水酵素の発現レベルに比例して、肺がん細胞の抗がん剤抵抗性が亢進することを明らかにしています。
したがって、HIF-1と炭酸脱水酵素の活性を阻害すると肺がん患者の予後を良くできると考察しています。
以下のような論文があります。
Prognostic Significance of Carbonic Anhydrase IX Expression in Cancer Patients: A Meta-Analysis.(炭酸脱水酵素IXの発現レベルはがん患者の予後と関連する:メタ解析)Front Oncol. 2016 Mar 29;6:69.
がん組織の低酸素状態は、増殖・浸潤・転移の促進や治療抵抗性と関連しており、がん患者の予後を悪くしています。
炭酸脱水酵素IX(CA IX)は低酸素誘導因子-1で発現が誘導されます。炭酸脱水酵素IXとがんの悪性度やがん患者の予後との関係が多数報告されており、これらの論文(147件の研究結果)のデータをメタ解析しています。
解析の結果、炭酸脱水酵素IX(CA IX)の発現が高いほど、再発が多く、生存期間が短くなることを明らかにしています。
その他、炭酸脱水酵素IXの発現が高いほど、がん細胞の悪性度が高くなることは前立腺がんなど多くのがん種で報告されています。
【celecoxibはCOX-2選択的阻害剤】
アスピリン(アセチルサリチル酸)は、炎症や痛みを引き起こすプロスタグランジンの合成酵素であるシクロオキシゲナーゼ(Cyclooxygenase:COX)の活性を阻害することによって、解熱・鎮痛・抗炎症効果を発揮し、様々な痛み(筋肉痛・歯痛・関節痛・頭痛・月経痛など)や炎症性疾患(急性上気道炎・リウマチ熱・変形性関節症など)の治療に使用されています。
シクロオキシゲナーゼ(COX)はアラキドン酸からプロスタグランジンを産生するときに最初に働く酵素です。COXには、多くの組織において恒常的に発現しているCOX-1と、炎症性刺激や増殖因子によりマクロファージなどの炎症細胞や消化管粘膜上皮細胞において合成されるCOX-2の2つの種類が知られています(下図)。

図:ホスホリパーゼA2(PLA2)の働きで、細胞膜のリン脂質からアラキドン酸が生成される。シクロオキシゲナーゼ(COX)はアラキドン酸からプロスタグランジンを合成するときに最初に働く酵素で、COX-1とCOX-2の2種類がある。COX-1から合成されるプロスタグランジンは生体の生理機能に必要なものであるが、炎症性の刺激でCOX-2から合成される大量のプロスタグランジンは細胞の増殖を促進する。
プロスタグランジンには多くの種類がありますが、COX-1によって産生されるプロスタグランジンは消化管や腎臓や血小板など多くの臓器や細胞の生理機能において重要な役割を果たしています。
一方COX-2は、炎症や発がん過程で合成が刺激され、大量のプロスタグランジンを産生して、がんの発育を促進する働きをします。
多くの消炎鎮痛剤にはシクロオキシゲナーゼ阻害作用がありますが、炎症やがんや肉腫で増加するCOX-2だけでなく、消化管や腎臓や血小板などで生理的な作用をしているCOX-1も阻害するため、がんの治療には使いにくい欠点があります。しかし、COX-2の選択的阻害剤であれば、副作用が少なく抗腫瘍作用が期待できます。
セレコキシブ(Celecoxib)はCOX-2に選択的な阻害剤です。つまり、COX-1は阻害せず、炎症やがんで誘導されるCOX-2を選択的に阻害します。
1999年に米国でcelebrexという商品名で販売され、日本ではセレコックスという商品名で2007年6月に発売されています。
関節リウマチや変形性関節症、腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎、手術後や外傷後や抜歯後などの消炎・鎮痛の目的で保険適用されています。
がん組織の中で、がん細胞や炎症細胞などがCOX-2を多く発現し、COX-2によって産生されるプロスタグランジンE2は、血管新生やがん細胞の増殖を促進し、がん細胞を攻撃する免疫細胞の働きを弱めることが知られています。したがって、COX-2活性を阻害するとがんの転移や再発を予防する効果が期待できます。(下図)

図:がん組織内では、炎症反応が起こり、ホスホリパーゼA2が活性化され(①)、アラキドン酸が生成される(②)。アラキドン酸は炎症刺激によって誘導されるシクロオキシゲナーゼ-2(COX-2)によってプロスタグランジンH2に変換され(③)、さらにプロスタグランジンE2が大量に産生される(④)。プロスタグランジンE2はがん細胞の増殖や浸潤や転移や血管新生を亢進し、アポトーシス(細胞死)に抵抗性にし、がん細胞に対する免疫応答(抗腫瘍免疫)を抑制する(⑤)。セレコキシブはCOX-2を阻害することによって、がん細胞の増殖や浸潤や転移を抑制し、細胞死を誘導する。
例えば、以下のような報告があります。
Celecoxib targets breast cancer stem cells by inhibiting the synthesis of prostaglandin E2 and down-regulating the Wnt pathway activity(セレコキシブは、プロスタグランジンE2の合成を阻害し、Wnt経路の活性を抑制することによって、乳がん幹細胞を標的とする)Oncotarget. 2017 Dec 29; 8(70): 115254–115269.
【要旨】
乳がん幹細胞の小さな細胞集団が腫瘍の発生、進行、再発および抗がん剤耐性の原因となるため、乳がん幹細胞の薬理学的標的化は、乳がんの治療に非常に有望である。
セレコキシブは、最も一般的に使用される非ステロイド性抗炎症薬(NSAID)の1つであり、乳がんおよび結腸直腸がんを含む多くのがんに対して化学予防活性を有する。しかしながら、NSAIDががん予防効果を発揮するメカニズムは、まだ完全に解明されているわけではない。本研究では、乳がん幹細胞に対するセレコキシブの効果およびその潜在的な分子メカニズムを初めて調べた。
我々の研究結果は、セレコキシブががん幹細胞の自己複製を抑制し、抗がん剤耐性を減弱させ、上皮間葉移行を阻害し、転移および腫瘍形成を減弱させることを示した。
セレコキシブは、プロスタグランジンE2の合成を阻害し、Wnt経路活性を抑制することにより、乳がん幹細胞を標的とすることが明らかになった。
我々の知見は、セレコキシブががん幹細胞を標的とすることにより、乳がんの治療成果を改善するための補助化学療法薬として使用される可能性があることを示唆している。
つまり、COX-2選択的阻害剤によるプロスタグランジンE2の産生阻害は様々なメカニズムでがん細胞の増殖を抑制し、細胞死を誘導することが多く報告されています。
さらにセレコキシブにはCOX-2阻害による血管新生阻害や増殖抑制効果だけでなく、COX-2非依存性にがん細胞の増殖を直接抑える作用もあります。
このようなCOX-2非依存性の抗腫瘍効果のメカニズムとして、セレコキシブが炭酸脱水酵素のCAIIとCaIXの両方を阻害する作用が報告されています。
【セレコキシブ(Celecoxib)は炭酸脱水酵素を阻害する】
炭酸脱水酵素IX(CA IX)は低酸素誘導因子-1(HIF-1)で発現が誘導されます。さらにCOX-2がプラスタグランジンE2の産生を介してCa IXの発現を促進することが明らかになっています。
つまり、CA IXは低酸素によるHIF-1活性と炎症によるプロスタグランジンE2の2つのメカニズムで活性化されます。
以下のような報告があります。
Cyclooxygenase-2/carbonic anhydrase-IX up-regulation promotes invasive potential and hypoxia survival in colorectal cancer cells(シクロオキシゲナーゼ-2 /炭酸脱水酵素IXの発現亢進は結腸直腸がん細胞の侵襲性と低酸素生存を促進する)J Cell Mol Med. 2009 Sep;13(9B):3876-87.
【要旨】
炎症は結腸直腸がんの発生を促進する。腫瘍の成長は、がん組織の内部に低酸素環境を生成する。
ここでは、結腸がん細胞では、炎症性酵素のシクロオキシゲナーゼ-2(COX-2)の発現が低酸素応答性の炭酸脱水酵素IX(CA-IX)の発現と関連していることを報告する。
ショートヘアピンRNA(short harpin RNA)を用いたCOX-2遺伝子の発現阻害は、CA-IX遺伝子の発現を抑制した。
結腸直腸がん細胞では、COX-2の主な生成物であるPGE2は、ERK1 / 2の活性化の機序によりCA-IX遺伝子の発現を亢進する。
正常酸素環境では、COX-2とCA-IXの遺伝子発現を阻止した結腸直腸がん細胞は、メタロプロテイナーゼ-2(MMP-2)のレベルの低下を起こし。細胞外マトリックスへの浸潤能力の低下を起こす。
低酸素状態では、COX-2遺伝子の発現とPGE2の産生が増加する。
COX-2 とCA-IXの遺伝子発現阻害は、低酸素症における結腸直腸がん細胞の生存能力を低下させる。
軽度の細胞周囲低酸素環境を作り出す高細胞密度での細胞培養条件では、COX-2 / CA-IX遺伝子の発現が増加し、結腸がん細胞の浸潤能を亢進する。
ヒト結腸がん組織では、ウェスタンブロットおよび免疫組織化学により評価されたCOX-2 / CA-IXタンパク質の発現レベルは相互に相関し、腫瘍の進展とともに増加する。
結論として、これらのデータは、COX-2 / CA-IX相互作用が結腸直腸がん細胞の攻撃的な性質を促進することを示している。
炭酸脱水酵素IX(CA IX)はCOX-2/PGE2とHIF-1の両方で発現が亢進するということです。
COX-2/PGE2はCA IXのは発現を亢進するのでセレコキシブはCOX-2依存性にもCA IXを阻害します。さらにセレコキシブはCOX-2非依存的に炭酸脱水酵素(Ca IIとCa IXなど)を阻害する作用が報告されています。
Acetazolamide(商品名:ダオアモックス)は炭酸脱水酵素の非特異的な阻害剤で、利尿作用や緑内障の治療薬として使用されています。Acetazolamideが抗がん剤やmTORC1阻害剤の抗腫瘍効果を高めることが報告されています。
また、シクロオキシゲナーゼー2(COX-2)阻害剤のcelecoxib(商品名セレコックス)が炭酸脱水酵素の阻害作用があることが報告されています。
以下のような報告があります。
The cyclooxygenase-2 inhibitor celecoxib is a potent inhibitor of human carbonic anhydrase II.(シクロオキシゲナーゼ-2阻害剤のセレコキシブはヒト炭酸脱水酵素の強力な阻害剤)Inflammation. 2004 Oct;28(5):285-90.
【要旨】
シクロオキシゲナーゼー2(Cyclooxygenase-2;COX-2)は間質細胞や炎症細胞で発現が亢進している。この誘導性のシクロオキシゲナーゼ・アイソフォームのCOX-2は炎症やある種のがんや虚血の脳組織などで発現が誘導される。
組織の酸性化は炎症において、疼痛や知覚過敏の原因となる。
最近の研究で、COX-2阻害剤のCOX非依存性のメカニズムによる薬効が報告されており、その中に炭酸脱水酵素(carbonic anhydrase)阻害作用がある。
炭酸脱水酵素は亜鉛を活性部位に含む金属酵素で腎臓などの様々な組織や細胞に存在し、酸-塩基バランスに働いている。
腎臓には、COX-2の発現量が非常に高い。セレコキシブは、炭酸脱水酵素阻害剤の代表であるアセタゾラミド(acetazolamide)と同様に、非置換型のスルホンアミド基を持つ特徴的構造を持っている。
本研究では、セレコキシブがナノモルレベルの低濃度でヒト炭酸脱水酵素II(carbonic anhydrase II)を強力に阻害する作用を有することを報告する。
Valdecoxibは比較的弱い活性を示し、炭酸脱水酵素阻害剤に特徴的な非置換型のスルフォンアミド基を有しないRofecoxibは、ヒト炭酸脱水酵素阻害作用を示さなかった。
非置換スルホンアミド基を有するセレコキシブおよびバルデコキシブによるヒト炭酸脱水酵素の阻害作用を示す。
これらのデータは、作用機序の解明ならびにCOX-2阻害剤に付随する副作用に重要な意味を有する可能性がある。
アセタゾラミドと同様に、非置換型のスルホンアミド基を持つCOX-2阻害剤のセレコキシブとバルデコキシブは炭酸脱水酵素阻害作用を持つという報告です。
アセタゾラミドとCOX-2阻害剤のセレコキシブとバルデコキシブはスルホンアミド基を持つ構造が共通し、この構造が炭酸脱水酵素の阻害作用と関連していると考えられています。(下図)

図:COX-2阻害剤のセレコキシブ(Celecoxib)とバルデコキシブ(Valdecoxib)はアセタゾラミド(Acetazolamide)と同様に炭酸脱水酵素を阻害する作用があると報告されている。これら3つの薬剤はスルホンアミド基を有し、これが炭酸脱水酵素の阻害作用と関連している。
以下のような報告があります。セレコキシブは炭酸脱水酵素の細胞内のアイソフォームのCa IIだけでなく、細胞膜に存在するCa IXも阻害することが示されています。
Unexpected nanomolar inhibition of carbonic anhydrase by COX-2-selective celecoxib: new pharmacological opportunities due to related binding site recognition.(COX-2選択的セレコキシブによる炭酸脱水酵素の予期しないナノモル阻害:関連する結合部位認識による新しい薬理学的機会)J Med Chem. 2004 Jan 29;47(3):550-7.
【要旨の抜粋】
現代の薬物学は、標的タンパク質への作用の選択性を高めることにより、病気の治療のための安全で効果的な薬剤の開発を行っている。
選択性の高い薬物作用は、望ましくない副作用を最小限に抑えることを目的としている。
セレコキシブ(Celecoxib)、バルデコキシブ(Valdecoxib)およびロフェコキシブ(Rofecoxib)は、恒常的に発現しているCOX-1の阻害はなく、誘導性シクロオキシゲナーゼのCOX-2を選択的に阻害する非ステロイド系抗炎症薬である。
ロフェコキシブにはメチルスルホン構造が含まれているが、セレコキシブとバルデコキシブには非置換性のアリルスルホンアミド構造(arylsulfonamide moiety)がある。後者のアリルスルホンアミド構造は多くの炭酸脱水酵素阻害剤に共通している。
酵素動力学とX線結晶構造解析を使用して、アリルスルフォンアミド型のCOX-2阻害剤のセレコキシブとバルデコキシブが、COX-2とは無関係な炭酸脱水酵素ファミリーのCa I,Ca II, CaIV, CaIXと予想外のナノモル(nM)レベルでの親和性を有することを実証した。一方、メチルスルホン型のロフェコキシブには炭酸脱水酵素との親和性は認めなかった。
緑内障ウサギに経口投与した場合、セレコキシブとバルデコキシブは眼圧を低下させ、これらの薬剤が緑内障の治療に有用である可能性が示唆された。
CA IIとセレコキシブの複合体の結晶構造の解析は、セレコキシブの炭酸脱水酵素の阻害の一部がCA IIの触媒亜鉛へのスルホンアミド基の結合によって引き起こされることを明らかにした。
COX-2選択的阻害剤のうちアリルスルホンアミド構造を持つセレコキシブ(Celecoxib)とバルデコキシブ(Valdecoxib)はナノモル(nM)レベルの低濃度で炭酸脱水酵素ののCa I,Ca II, CaIV, CaIXを阻害する効果があることを報告しています。
つまり、セレコキシブは炭酸脱水酵素のCa IIとCa IXの両方を阻害する作用で、がん細胞の細胞内を酸性にし、細胞外をアルカリにする効果が期待できると言えます。
プロトンポンプ阻害剤とセレコキシブを併用することによって、がん組織の酸性化を改善し(アルカリ化する)、がん細胞内を酸性化することによって、がん細胞を死滅できるようになります。(下図)
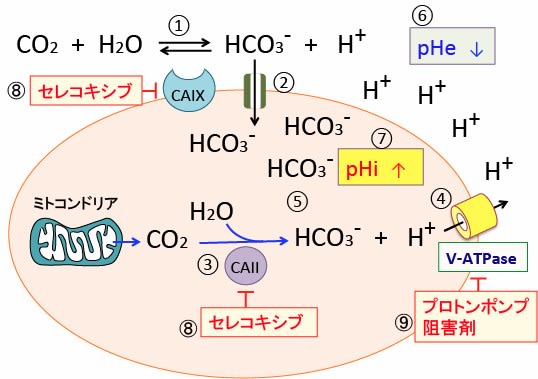
図:炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する(①)。細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる(②)。細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素を重炭酸イオンと水素イオンに変換する(③)。V型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)は細胞内の水素イオン(プロトン)を細胞外に排出する(④)。重炭酸イオンは細胞内に保持される(⑤)。その結果、細胞外pH(pHe)は低下してより酸性化し(⑥)、細胞内pH(pHi)はよりアルカリ化される(⑦)。COX-2阻害剤のセレコキシブはCa IIとCa IXの両方を阻害する(⑧)。プロトンポンプ阻害剤はV-ATPaseを阻害する(⑨)。すなわち、セレコキシブとプロトンポンプ阻害剤を併用すると、がん細胞内pHが低下(酸性化)して増殖が低下し死滅する。がん細胞外pH(pHe)がアルカリ化すると、がん細胞の浸潤や転移が抑制され、がん細胞に対する免疫細胞(T細胞やNK細胞)の働きが良くなる。
【セレコキシブはがんの補完・代替医療にもっと利用されてよいと思う】
私が17年前(2002年)に「がんの漢方治療」を中心にしたクリニックを開業した時、漢方薬以外で最初に採用したのがCOX-2阻害剤のcelecoxibです。当時は日本では承認されていませんでしたので、米国製のセレブレックス(Cerebrex)を輸入して使用していました。
1990年代の初めころ、鎮痛剤として日常的にアスピリンを服用している人には、大腸がんの発生頻度が低いことが、幾つかの疫学研究の結果明らかになりました。
米国ジョージア州アトランタのアメリカがん協会(American Cancer Society)の疫学部門のヒース博士らは、約66万人の成人を1982年から1988年まで追跡調査し、アスピリンの服用と大腸がんによる死亡の関係を検討しました。
その結果、一ヶ月に16回以上のアスピリン服用を1年以上続けている人たちは、アスピリンを服用していない人に比べて大腸がんになるリスクは約60%に減少することを明らかにしました。
この報告がきっかけとなって、その後多くの疫学的研究が行われ、アスピリンなどのNSAIDのがん予防効果が報告されています。
1日75~100mg程度の低用量のアスピリンでも毎日長期間服用すると、がんによる死亡を6~7割くらい(消化器系がんは半分程度)に減らすことができると報告されています。
その後、生理作用のあるCOX-1を阻害せず、炎症やがんで発現が誘導されるCOX-2を選択的に阻害するCelecoxibが1999年に米国で発売されるようになりました。
私が国立がんセンター(現在の国立がん研究センター)の研究所のがん予防研究部の第一次予防研究室の室長としてがんの第一次予防(がんにならないこと)を研究していた頃(1995年から1998年)は、「COX-2阻害剤によるがん予防」に関する研究が、がん予防の研究の中心でした。そのため、COX-2阻害剤のがん予防効果や抗がん作用について研究していたため、開業したときの最初の治療メニューが「漢方薬+セレコキシブ」でした。
COX-2の阻害はがんを悪化させる炎症を抑制し、漢方治療と併用することによって免疫増強作用や抗腫瘍効果を高めることができます。
その後、抗がん剤との併用などセレコキシブの抗がん作用に関する臨床試験が数多く実施されましたが、予想されたほどの有効性が認められずに現在に至っているのが実情です。
しかし、COX-2阻害は、抗腫瘍免疫の増強やがん組織の微小環境の改善など、有益な作用を持っている事は確かです。がんの補完・代替医療でもっと積極的に利用してよい薬剤だと思っています。他の薬剤との併用などの工夫によって、かなりの効果を期待できます。ポイントは何と組み合わせるかです。
著書紹介:

詳しくはこちらへ:
著書紹介

(くわしくはこちらへ)
| « 664)がんのア... | 666)がんのア... » |



