がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
664)がんのアルカリ療法(その1):プロトンポンプ阻害剤+ジクロロ酢酸ナトリウム
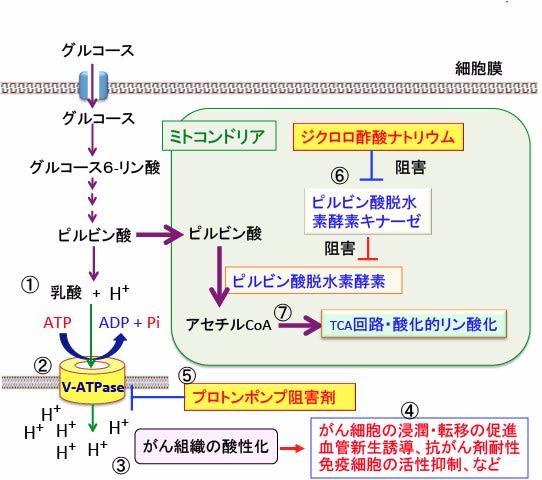
図:がん細胞内では解糖系が亢進して乳酸と水素イオン(プロトン)の産生が亢進している(①)。がん細胞内での酸性化を回避するため、液胞型プロトンATPアーゼ(V-ATPase)などのイオンポンプやトランスポーターなどを使って、プロトン(H+)を細胞外に排出している(②)。その結果、がん組織が酸性化する(③)。がん組織の酸性化はがん細胞の浸潤・転移を促進し、血管新生を誘導し、抗がん剤の効き目を弱め、免疫細胞の働きを弱めるなどの機序によって、がんを悪化させる(④)。胃酸分泌阻害剤のプロトンポンプ阻害剤はV-ATPaseを阻害してがん組織の酸性化を抑制する(⑤)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによって(⑥)ピルビン酸脱水素酵素を活性化し、ミトコンドリアでの代謝を亢進する(⑦)。その結果、乳酸とプロトンの産生を減らす。プロトンポンプ阻害剤とジクロロ酢酸ナトリウムは相乗的にがん組織の酸性化を阻止し、がん細胞の浸潤や転移を抑制し、抗がん剤治療や免疫療法の効き目を高める。
664)がんのアルカリ療法(その1):プロトンポンプ阻害剤+ジクロロ酢酸ナトリウム
【がん細胞は大量のプロトン(水素イオン)を産生している】
がん細胞では、酸素が十分に利用できる状況でもミトコンドリアでの酸素呼吸が抑制され、グルコース(ブドウ糖)の取込みと解糖系が亢進し、乳酸の生成が増えているという物質代謝の特徴を持っています。これを好気的解糖(Aerobic glycolysis)あるいはワールブルグ効果(Warburg effect)と言います。
がん細胞では、ミトコンドリアでの酸素呼吸は解糖系に比べると相対的には抑制されていますが、正常の細胞レベルには起こっています(下図)。
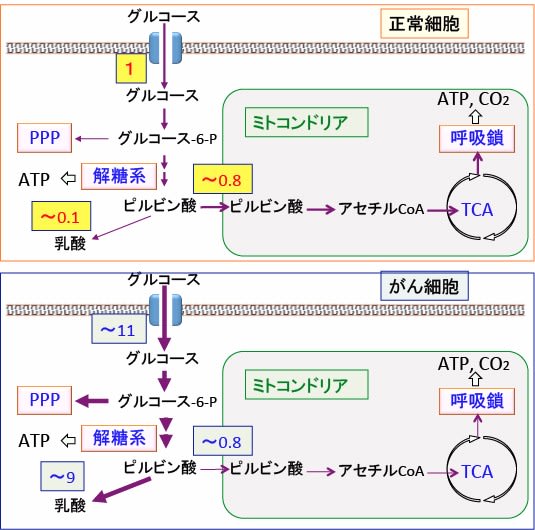
図:がん細胞ではグルコースの取り込みと解糖系が亢進し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)は抑制されている。そのレベルはがん細胞によって異なるが、一つの平均的な数値として、正常細胞のグルコースの取込み量を1とした相対値を記載している。正常細胞では取り込まれたグルコースの8割くらいがミトコンドリアでの代謝に使われている(上図)。がん細胞でもミトコンドリアでの代謝は同程度に起こっているが、グルコースの取込みは10倍程度に亢進し、その多く(80〜90%)は解糖系で代謝され、乳酸の産生が顕著に増えている(下図)。(参考:Free Radic Biol Med 2015 Feb; 0: 253-263)
がん細胞は解糖系が亢進し、乳酸とプロトン(水素イオン)の産生が増えています。グルコース1分子が解糖で2分子の乳酸になるときに2分子のプロトン(H+)が産生されます(下図)。

図:解糖系ではグルコースからピルビン酸、ATP、NADH + H+が作られる。嫌気性解糖系や乳酸発酵では、NADH + H+を還元剤として用いてピルビン酸を還元して乳酸にする。乳酸に変換する反応によってNAD+を再生することによって解糖系での代謝が続けられる。したがって、解糖系が亢進すると、細胞内で乳酸とプロトン(H+)が増える。
水素イオン(H+)が蓄積して細胞内のpHが低下して酸性になると細胞内のタンパク質の活性や働きは阻害され、pH低下が顕著になれば細胞は死滅します。そこで、がん細胞は乳酸や水素イオン(プロトン)を細胞外に積極的に排出しています。
乳酸はモノカルボン酸トランスポーター(MCT)という輸送担体で細胞外に排出され、水素イオンは液胞型プロトンATPアーゼ(vacuolar H+-ATPases)、モノカルボン酸輸送体(monocarboxylate transporter:乳酸-プロトン共輸送体)、Na+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などによって細胞外に放出されます。
がん組織の微小環境は血液やリンパ液の循環が悪いので、水素イオンはがん組織に蓄積します。その結果、がん細胞の周囲の組織は水素イオンの濃度が高くなってpHが低下します。正常の組織のpHは7.3〜7.4程度とややアルカリ性ですが、がん組織の微小環境のpHは6.2〜6.9とより酸性になっていると言われています。
がん組織の酸性化した微小環境は、がん細胞の生存にとって様々なメリットを与えます。
組織が酸性化すると正常な細胞が弱り、結合組織を分解する酵素の活性が高まるため、がん細胞が周囲に広がりやすくなり、さらに血管新生が誘導されるので、がん細胞の浸潤や転移が促進されます。
組織が酸性になるとがん細胞を攻撃しにきた免疫細胞の働きが弱ります。
さらに乳酸には、がん細胞を攻撃する細胞傷害性T細胞の増殖や、免疫細胞の働きを高めるサイトカインの産生を抑制する作用があり、がんに対する免疫応答を低下させる作用もあります。
抗がん剤の多くは塩基性なので、酸性の組織では活性が低下するということも指摘されています。

図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。その結果、がん細胞の周囲はpHが低下してがん組織は酸性化している。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される。
したがって、がん組織の酸性化を抑制しアルカリ化を促進すれば、がん細胞の浸潤や転移を抑制し、さらに抗がん剤治療や免疫療法の効き目を高めることができることになります。
さらに、水素イオンの排出メカニズムを阻害してがん細胞内のpHを低下させれば、がん細胞を死滅させることもできます。
これが、がん組織をアルカリ化する「がんのアルカリ療法」ががん治療に役立つ根拠です。がん組織をアルカリにする方法は多数あり、これらを組み合わせて、がん組織をアルカリ化できれば、がん細胞の増殖を抑え、さらにがん細胞を死滅することができます。
【がん細胞内は正常細胞よりもアルカリ性になっている】
がん細胞では解糖系の亢進によって、乳酸と水素イオン(プロトン)の細胞内での産生が亢進しています。したがって、「がん細胞内も酸性化している」と思うかもしれません。
しかし事実は逆で、がん細胞内では正常細胞よりアルカリ性になっていることが明らかになっています。そして、細胞内をアルカリにすることが、細胞の発がん過程の初期から起こっており、これが解糖系を亢進する重要な要因になっているのです。
つまり、がん細胞でワールブルグ効果(解糖系亢進と酸化的リン酸化の抑制)が成立する前に細胞内のアルカリ化が起こっていることが明らかになっています。
発がん過程における、がん遺伝子やがん抑制遺伝子の様々な関与については多くの研究が行われています。
一方、細胞の内外における水素イオン(プロトン)の動態については、最近になってやっと研究が行われるようになりました。
水素イオン指数(pH:potential of hydrogen)は水素イオンの濃度を表す物理量です。pHの読みは「ピーエイチ」(英語読み)、または「ペーハー」(ドイツ語読み)です。
pHは水素イオンのモル濃度を mol/Lで表した数値の逆数の常用対数で示したもので、数値が低いほど酸性(プロトン量が多い)、数値が高いほどアルカリ性(プロトン量が少ない)になります。
細胞内のpH(pHi)と細胞外のpH(pHe)のpH勾配(pH gradient)は正常細胞とがん細胞では逆になっています。
すなわち、正常細胞では細胞内に比べて細胞外の方がよりアルカリ性で、がん細胞では細胞内がアルカリ性で細胞外が酸性になっています。
がん遺伝子を導入して細胞をがん化させる実験で、細胞ががん化する過程で、細胞内のエネルギー産生系がミトコンドリアの酸素呼吸(酸化的リン酸化)から解糖系にシフトします。
この実験系で、細胞のがん化が進むにつれて、細胞内がよりアルカリ性になり、細胞外がより酸性になることが示されています。
そこで、このpH勾配を少なくする、あるいは正常化する(細胞内を酸性にして、細胞外をアルカリ性にする)ことががん治療のターゲットとして注目されています。
がん細胞における好気的解糖(酸素が十分にあっても解糖系に依存)を中心とする代謝と、がん細胞の増殖を支える血管新生をターゲットにしたがん治療を考えたとき、細胞内外のプロトン動態が重要なターゲットになるのです。
細胞内のpHは、細胞増殖の制御、増殖因子やがん遺伝子の活性、ミトコンドリアの活性、酵素活性、DNA合成、分化など様々な細胞機能に影響しています。
正常細胞では細胞内のpH(pHi)は6.99〜7.05とほぼ中性で、がん細胞では細胞内のpH(pHi)は7.12〜7.7とアルカリ性です。
一方、細胞外のpH(pHe)は正常細胞が7.3 〜7.4とアルカリ性であるのに対して、がん細胞の細胞外のpH(pHe)は6.2〜6.9と酸性です。
したがって、細胞内外のpH勾配は正常細胞とがん細胞では逆になっています。

図:正常細胞では細胞内pH(pHi)は6.99〜7.05とほぼ中性で、細胞外pH(pHe)は7.3〜7.4とアルカリ性になっていて、pHeがpHiより高い。一方、がん細胞では細胞内pHは7.12〜7.7とアルカリ性になって、細胞外pHは6.2〜6.9と酸性になって、pHiがpHeより高い。
【がん組織の酸性化に関与するV型ATPアーゼ(V-ATPase)】
がん細胞の水素イオンの排出に大きな役割を果たしているのがV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)です。
がん細胞ではこのV型ATPアーゼの発現が亢進しており、がん組織の酸性化に関与しています。V型ATPアーゼの発現量が多いほど、がん治療に抵抗し、再発しやすく生存期間が短いという報告もあります。
V型ATPアーゼの阻害薬ががんの治療薬として開発が行われていますが、胃酸分泌阻害剤として使用されているプロトンポンプ阻害剤がV型ATPアーゼを阻害する作用があることが知られています。
胃潰瘍の治療に使われるプロトンポンプ阻害剤は、主に胃のH+/K+ATPasesを阻害しますが、V型ATPaseも阻害します。
実際に、動物の移植腫瘍を使った実験などで、プロトンポンプ阻害剤が腫瘍組織の酸性化を改善して抗がん剤や免疫療法の効果を高める作用が報告されています。
細胞膜を隔てた物質の輸送には、濃度の高い方から低い方に向かって行われる受動拡散と、濃度勾配に逆らって物質の輸送を行う能動輸送の2種類があります。
受動拡散の場合の膜を通るルートの膜貫通タンパク質はチャネル(channel)と言い、能動輸送に関与する膜貫通タンパク質はポンプ(pump)と言います。濃度勾配に逆らって物質を輸送するためにはATPによるエネルギーが必要です。
ATPのエネルギーを使って、水素イオンを能動的に輸送するトランスポーターとしてがん細胞における水素イオンの細胞外への排出に関与しているのがV型ATPアーゼ(vacuolar ATPase, V-ATPase)です。つまり、ATP依存性のプロトンポンプです。
V-ATPase は、細胞のゴルジ体、液胞、リソソーム、細胞膜等の膜系に存在し、10数個の異なるサブユニットから構成される複合体です。ATP の加水分解反応と共役した回転触媒機構により水素イオン(プロトン)を輸送し、空胞内部を酸性化します。
例えばリソソームは細胞内に蓄積された不要物を分解したり、細胞外から取り込んだ物質を分解する小胞で、リソソームの内部は酸性条件下で活性化される加水分解酵素が含まれています。このリソソームの空胞内部に水素イオンを輸送して内部を酸性にするのがV-ATPaseです。
細胞内では、外部の物質を取り込んで消化するエンドサイトーシスや、細胞内の古くなった小器官などを消化するオートファジーなど、細胞内での物質の分解は膜で囲まれた小胞内で行われ、この内部の加水分解酵素の活性化に必要なpHに下げる役割がV-ATPaseです。
そして、がん細胞では、細胞内で大量に生成した水素イオンを細胞の外に排出する役割も担っています。
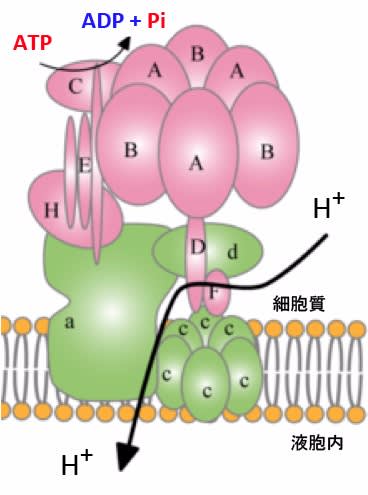
図:V-ATPaseの構造。V-ATPase(vacuolar ATPase)は液胞型ATPアーゼ, V型ATPアーゼ, 液胞型プロトンポンプなどと訳されている。ATPアーゼとはATP(アデノシン三リン酸)の末端高エネルギーリン酸結合を加水分解する酵素群の総称で、ATPを使って生物活動に行うタンパク質の多くがこの活性を持っている。V型ATPアーゼは液胞のプロトン(水素イオン)の能動輸送を行うATPアーゼ活性をもったタンパク質で、ATPのエネルギーを使ってプロトン(水素イオン)を能動的に細胞膜を通して輸送する。V-ATPase は、10数個の異なるサブユニットから構成される分子量約 800 KDaの分子複合体で、ATP の加水分解反応と共役した回転触媒機構により水素イオン(プロトン)を輸送し、空胞内部を酸性化する。
【V-ATPaseを阻害するとがん細胞の増殖・転移は抑制される】
Vacuolar ATPaseはATP依存性のプロトンポンプで、プロトン(H+:水素イオン)を細胞膜を通して外に排出します。正常細胞では細胞内pHの調節に重要な役割を果たしています。
がん細胞では、さらに重要な役割を担っています。それはがん細胞では、解糖系の亢進によって乳酸と水素イオンの産生が増えて、細胞内が酸性になりやすい状況になり、細胞内の酸性化を防がないと細胞死を起こすからです。
したがって、がん細胞ではこのV-ATPaseの発現量が顕著に増えています。V-ATPaseの発現量増加ががん細胞の浸潤や転移や抗がん剤抵抗性と関連していることが明らかになっています。
がん細胞の周囲が酸性になると、正常細胞(特に免疫細胞)がダメージを受けて働きが抑制され、結合組織を分解する酵素が活性化されて、転移や浸潤や血管新生が促進されます。
さらに、がん細胞の周囲が酸性だと、多くの抗がん剤は塩基性であるため、がん細胞内に集まりにくくなります。
そのため、がん細胞におけるプロトンポンプの働きを阻害すると、がん細胞の浸潤や転移や抗がん剤抵抗性を抑制できると考えられています。
V-ATPaseそのものの阻害を目的にした抗がん剤の開発も行われていますが、まだ臨床で使えるものはありません。しかし、胃潰瘍の治療に使用されるプロトンポンプ阻害剤が、このV 型 ATPaseを阻害することが報告されています。

図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える(①)。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する(②)。その結果がん細胞の周囲はpHが低下してがん組織は酸性化している(③)。組織が酸性化すると、細胞傷害性T細胞のようながん細胞を攻撃する免疫細胞の働きが阻害される。塩基性の抗がん剤は酸性の組織に到達しにくくなり抗がん剤が効かなくなる。さらに、周囲の正常細胞がダメージを受け、タンパク分解酵素が活性化してがん細胞の浸潤や転移が促進される。腫瘍を養う血管の新生も誘導される(④)。胃酸分泌阻害剤として使われているプロトンポンプ阻害剤はV型ATPアーゼ(V-ATPase)を阻害することによって、がん組織の酸性化を抑制し、がん細胞の浸潤や転移を抑制し、抗がん剤や免疫療法が効きやすくする(⑤)。さらに、がん細胞内の酸性化が亢進すると、がん細胞を死滅できる(⑥)。
プロトンポンプ阻害剤(Proton Pump Inhibitor: PPI)は胃の壁細胞のプロトンポンプに作用し、胃酸の分泌を抑制する薬です。医薬品としては、オメプラゾール(オメプラール、オメプラゾン)、ランソプラゾール(タケプロン)、ラベプラゾールナトリウム(パリエット)、エソメプラゾール(ネキシウム)など多数の薬が販売されています。
【プロトンポンプ阻害剤は抗がん剤の効き目を高める】
動物実験のレベルでは、プロトンポンプ阻害剤ががん細胞の抗がん剤感受性を高める効果、がん細胞に対する免疫細胞の働きを高める効果、がん細胞内の水素イオン濃度を高めてがん細胞を死滅させる効果などが多数報告されています。
臨床試験での有効性も報告されています。以下のような報告があります。
Effects of omeprazole in improving concurrent chemoradiotherapy efficacy in rectal cancer.(直腸がんの同時化学放射線療法の有効性の改善におけるオメプラゾールの効果)World J Gastroenterol. 2017 Apr 14;23(14):2575-2584.
【要旨】
目的:直腸がんにおける化学放射線療法の有効性と腫瘍再発に対するオメプラゾールの効果を調査する。
方法:同じ術前化学放射線療法を受けた後に手術を受けた125人の直腸がん患者の医療データを収集した。
オメプラゾールを20 mgの用量で6日間少なくとも1日1回の経口投与および/または1日40 mgを静脈内投与した患者は、オメプラゾール使用者群に分類した。それ以外の場合、患者はオメプラゾール非使用群に分類された。腫瘍再発の比較においてはオメプラゾール服用量のカットオフ値を200 mgに設定し、オメプラゾール総服用量が200mg以上のオメプラゾール使用群とオメプラゾール総服用量が200mg以下のメプラゾール非使用群の2つのグループに分けられた。
結果:化学放射線療法の奏功率はオメプラゾール使用群は50.8%で、オメプラゾール非使用群の30.6%と比較して大幅に増加した(P = 0.02)。 オメプラゾール使用群の再発率は10.3%で、オメプラゾール非使用群の31.3%と比較して有意に低かった(P = 0.025)。
結論:化学療法の副作用を軽減するための治療の補助薬として適用される場合、オメプラゾールは化学放射線療法の有効性を改善し、直腸癌の再発を減少させる相乗効果がある。
この研究では、同じ術前化学放射線療法を受け、その後に手術を受けた125人の直腸がん患者を対象に、オメプラゾールを併用した場合の効果を検討しています。術前化学放射線療法中にオメプラゾール総使用量200mg以上をオメプラゾール併用群とし、オメプラゾール非使用または総使用量が200mg以下をコントロールとして比較しています。
術前化学放射線療法の奏功率は、オメプラゾール併用群が50.8%で、非併用群の30.6%と比較して有意に増加しました。
再発率はオメプラゾール併用群で10.3%であり、非併用群の31.3%と比較して有意に減少していました。
つまり、オメプラゾールは術前化学放射線療法の有効性を改善し直腸癌の再発を減少させるという相乗効果が認められています。
以下のような論文があります。
Proton pump inhibitor chemosensitization in human osteosarcoma: from the bench to the patients' bed.(ヒト線維肉腫におけるプロトンポンプ阻害剤による抗がん剤感受性の亢進;実験台の結果から臨床へ) J Transl Med. 2013 Oct 24;11:268. doi: 10.1186/1479-5876-11-268.
【要旨】
研究の背景: がんの基礎研究を臨床応用に反映させる上で最も大きな目標は、現行の抗がん剤治療の全身的な毒性を減らし、抗腫瘍効果を高めることである。 多くのがん組織において認められる微小環境の酸性化は、がん細胞が抗がん剤の効き目を減弱させるメカニズムとしては非常に有効な方法である。 それは、水素イオン(プロトン:H+)が多い環境に抗がん剤が到達すると、その抗がん剤はプロトン付加(protonation)と中性化によってがん細胞内に入り込みにくくなるからである。この腫瘍組織の性状をプロトンポンプ阻害剤が変えることによってがん細胞の抗がん剤感受性が高まることを、我々は以前の研究で示している。この研究では、プロトンポンプ阻害剤が骨肉腫に対する抗がん剤感受性を高める効果があるかどうかを検討した。
方法: MG-63 と Saos-2 の2種類のヒト骨肉腫細胞の細胞株を用いて実験を行った。 マウスに肉腫細胞を移植する実験系でプロトンポンプ阻害剤で前処理したあとにシスプラチンを投与し、細胞増殖に対する作用を評価した。 臨床において、メソトレキセートとシスプラチンとアドリアマイシンによる補助化学療法においてプロトンポンプ阻害剤の前投与による効果を検討する多施設臨床試験を実施した。
結果:培養細胞を使った実験と移植腫瘍を用いた実験で2種類のヒト骨肉腫細胞株のどちらに対しても、プロトンポンプ阻害剤はシスプラチンに対する抗がん剤感受性を高めた。 プロトンポンプ阻害剤のエソメプラゾール(esomeprazole)を前投与する臨床試験では、 がん組織の壊死した組織の割合から評価した抗がん剤治療による抗腫瘍効果をエソメプラゾールは増強した。 この作用は、治療が困難な骨肉腫の組織型である軟骨芽細胞骨肉腫(chondroblastic osteosarcoma)において特に顕著に認められた。プロトンポンプ阻害剤投与によって副作用が増強することはなかった。
結論:標準的な抗がん剤治療にプロトンポンプ阻害剤を併用することが有効であることの証拠を本研究は示している。
この臨床試験では手術可能な骨肉腫の患者を対象にして、プロトンポンプ阻害剤のエソメプラゾール(esomeprazole)を術前補助化学療法(メソトレキセート+シスプラチン+アドリアマイシン)の投与を受ける前の2日間の内服を受けています。そして手術後の腫瘍組織の病理検査で、抗がん剤治療によってがん組織が壊死した程度を、過去のデータと比較しています。
その結果、抗がん剤治療が良く効いた症例(good responder:壊死した腫瘍部分が90%以上)の割合は抗がん剤治療単独では47%に対して、抗がん剤にプロトンポンプ阻害剤を併用した場合は57%に増加するという結果が得られています。
治療に抵抗性の軟骨芽骨肉腫(chondroblastic osteosarcoma)の場合は、抗がん剤単独ではgood responderは25%に対してプロトンポンプ阻害剤を併用すると61%になるという結果が得られています。そして、副作用の程度は両群で差は認められていません。
プロトンポンプ阻害剤を服用してがん組織のpHをアルカリ側にすることはがん治療にプラスになると言えそうです。 次のような論文もあります。
Lansoprazole as a rescue agent in chemoresistant tumors: a phase I/II study in companion animals with spontaneously occurring tumors (抗がん剤抵抗性腫瘍の救援成分としてのランソプラゾール:自然発症腫瘍をもつペット動物における第I/II相試験)J Transl Med. 2011; 9: 221.
ランソプラゾールはタケプロンという商品名の胃酸分泌阻害剤です。
抗がん剤単独(犬10匹+猫7匹)と 抗がん剤+ランソプラゾール((犬27匹+猫7匹)で検討し、抗がん剤単独群では17%に短期間の部分奏功を認めましたが、その他は全て2ヶ月以内に死亡しました。ランソプラゾールを併用した群では部分奏功+完全奏功が67.6%で、奏功しなかった動物でもQOLの改善を認めました。
【プロトンポンプ阻害剤とジクロロ酢酸ナトリウムは相乗効果でがん組織の酸性化を軽減する】
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素効果を活性化して、ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進し、乳酸とプロトンの産生を抑制します。
ジクロロ酢酸ナトリウムは低酸素誘導因子-1(HIF-1)の活性を抑える作用もあります。HIF-1はピルビン酸脱水素酵素キナーゼの発現を誘導します。さらにHIF-1は乳酸脱水素酵素を活性化するので、HIF-1の活性阻害は乳酸とプロトンの産生を減らします。
ジクロロ酢酸ナトリウムでピルビン酸からアセチルCoAへの変換を促進すると乳酸の産生が抑制されます。プロトンポンプ阻害剤とジクロロ酢酸ナトリウムの併用は、がん組織の酸性化を抑制する効果を高めることになります。

図:がん細胞内では解糖系が亢進し、ピルビン酸を乳酸に変換する乳酸脱水素酵素(LDH)の活性が亢進して乳酸と水素イオン(プロトン)の産生が亢進している(①)。がん細胞内での酸性化を回避するため、液胞型プロトンATPアーゼ(V-ATPase)などのイオンポンプやトランスポーターなどを使って、プロトン(H+)を細胞外に排出している(②)。その結果、がん組織が酸性化する(③)。がん細胞では低酸素誘導性因子-1(HIF-1)の活性が亢進し、ピルビン酸脱水素酵素キナーゼの活性が亢進して、ピルビン酸脱水素酵素の活性が阻害されている(④)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによって(⑤)ピルビン酸脱水素酵素を活性化し、ミトコンドリアでの代謝を亢進する(⑥)。その結果、乳酸とプロトンの産生を減らす。ジクロロ酢酸ナトリウムは低酸素誘導因子-1(HIF-1)の活性を抑える作用もある(⑦)。HIF-1は乳酸脱水素酵素(LDH)を活性化するので(⑧)、ジクロロ酢酸ナトリウムはHIF-1の活性阻害を介してLDHの活性を抑制して乳酸とプロトンの産生を減らす作用もある。
線維肉腫細胞(HT1080)を移植したヌードマウスの実験モデルで、ジクロロ酢酸ナトリウムとオメプラゾールは相乗的に増殖を抑制するという報告があります。
Cotreatment with dichloroacetate and omeprazole exhibits a synergistic antiproliferative effect on malignant tumors. (ジクロロ酢酸とオメプラゾールの併用投与は悪性腫瘍に対して相乗的な増殖抑制効果を示す)Oncol Lett. 3(3): 726–728.2012年
線維肉腫細胞を移植したヌードマウスの実験で、ジクロロ酢酸ナトリウム50mg/kg+オメプラゾール2mg/kgの併用で著明な腫瘍の縮小が認められています。 それぞれ単独では腫瘍の縮小は認めなかったが併用すると著明な縮小効果が認められたという結果です。
正常な線維芽細胞に対しては増殖抑制効果は認めなかったと報告されています。
プロトンポンプ阻害剤はがん細胞に対する免疫細胞の攻撃力を高めます。プロトンポンプ阻害剤が骨肉腫や転移性乳がんや頭頚部がんの抗がん剤治療の効き目を高めることが臨床試験で示されています。
ジクロロ酢酸ナトリウムの投与でがん組織の酸性化が緩和されると免疫細胞の働きが良くなって抗腫瘍免疫による抗がん作用が強化されることが報告されています。がん組織の酸性化が免疫細胞の働きを抑制するからです。
したがって、ジクロロ酢酸ナトリウムとプロトンポンプ阻害剤の併用は抗腫瘍免疫の活性化にも効果が期待できます。
プロトンポンプ阻害剤は抗がん剤治療による胃粘膜障害による副作用や消化器症状を緩和するという臨床試験の結果も報告されています。
したがって、抗がん剤治療中や免疫療法を受けているときに、胃腸症状を緩和する目的とがん組織の酸性化を軽減する目的でプロトンポンプ阻害剤を併用するメリットはあると言えます。
その他、ミトコンドリアを活性化するジクロロ酢酸ナトリウム、解糖系を阻害する2-デオキシ-D-グルコースやケトン食や重曹(炭酸水素ナトリウム)の併用も、がん組織の酸性化を抑制して、抗がん剤治療の効き目を高めると言えます。
著書紹介:

詳しくはこちらへ:

(くわしくはこちらへ)
| « 663)β-カリオ... | 665)がんのア... » |



