がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
666)がんのアルカリ療法(その3):重曹(重炭酸ナトリウム)とトリス塩基
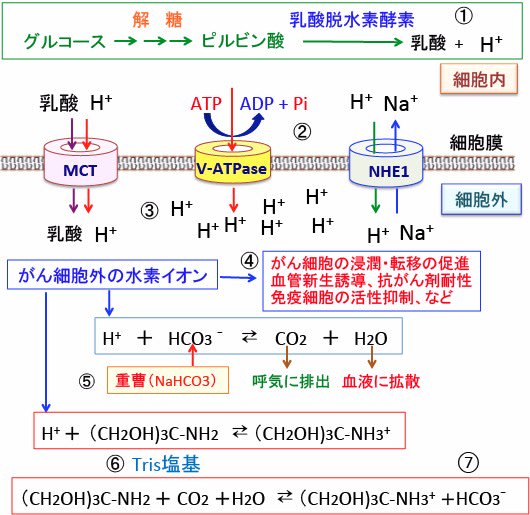
図:がん細胞はグルコース(ブドウ糖)の取り込みと解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増えている(①)。細胞内の酸性化は細胞にとって障害(毒)になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する(②)。その結果がん細胞の周囲は水素イオンが増え、pHが低下してがん組織は酸性化している(③)。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される(④)。重曹(重炭酸ナトリウム)を摂取すると、血中に入った重炭酸イオン(HCO3-)ががん組織に蓄積している水素イオン(プロトン)と反応して二酸化炭素(CO2)と水(H2O)になり、二酸化炭素は呼気に排出され、水は血液に拡散する。この中和反応によってがん組織の酸性化を軽減できる(⑤)。Tris塩基を摂取すると、がん細胞外の水素イオン(H+)と反応してがん組織の酸性化を抑制できる(⑥)。トリス塩基は血中のCO2を減らし重炭酸イオン(HCO3-)を増やす作用もある。がん組織の酸性化の改善には、重曹よりTris塩基の方が優れてる。
666)がんのアルカリ療法(その3):重曹(重炭酸ナトリウム)とトリス塩基
【がん組織の微小環境をターゲットにしたがん治療】
20世紀末までのがん研究では、「がんとは細胞の病気」という考えで研究を行われていました。つまり、がん細胞で起こっているシグナル伝達系や遺伝子の異常の解明ががん研究の主体になっていました。そして、がん治療もがん細胞だけをターゲットに考えていました。がん細胞の増殖を抑制し、細胞死を誘導する方法ががん治療法の中心と考えられてきました。
しかし、がん治療はがん細胞だけをターゲットにすればいいという単純なものではありません。
がん組織は、正常組織から血管や間質細胞を取込み、がん細胞の生存と増殖に有利な特殊な微小環境を形成しています。
一般的に、がん組織のうち30%以上が正常細胞と言われています。がん細胞の塊のように思えても、がん細胞を養う血管や増殖の基盤になる結合組織を作る線維芽細胞が必要です。がん組織の中にはがん細胞は数%しか占めていない場合もあります。
がん組織中の正常細胞が、結合組織や細胞外マトリックス、増殖因子、サイトカイン、血管網を提供し、がん細胞の増殖や転移を支配しています。
つまり、腫瘍というのは、「増殖異常を来したがん細胞の単なる集まり」ではなく、「がん細胞とその周囲に集まった正常細胞(腫瘍微小環境)から構成された制御を失った組織」であり、腫瘍微小環境(tumor microenvironment)ががん組織の進行性の増大をサポートしているのです。このようながん微小環境をターゲットにしたがん治療(Tumor stroma-directed therapy)の重要性が認識されています。
免疫担当細胞やがん関連線維芽細胞が産生する増殖因子や炎症性サイトカインやフリーラジカルやプロスタグランジンなどの伝達物質などが、がん細胞の増殖や浸潤や転移や悪性進展を防ぐためのターゲットになっています。
がん組織の酸性化(pH低下)もがん治療のターゲットとして重要性が認識されています。がん組織の酸性化を改善すると、がん細胞の増殖や浸潤や転移を抑制できることが明らかになっています。
【がん細胞外は酸性になっている】
がん細胞では、グルコース(ブドウ糖)の取込みと解糖系でのグルコース代謝が亢進し、ミトコンドリアでの酸化的リン酸化が抑制されています。これを好気的解糖あるいはワールブルグ効果と言います。
解糖系は、地球の大気に酸素が存在するようになる前から生物に存在した高度に保存された経路です。解糖の英語のGlycolysisのlysisは「分ける」という意味です。つまり解糖(Glycolysis)というのは、1分子のグルコース(ブドウ糖)を2分子のピルビン酸に分けることに由来する命名です。
解糖系は細胞質内で起こる10の酵素反応からなり、1分子のブドウ糖から2分子のATPを酸素を使わずに作り出します。グルコース1分子が解糖で2分子の乳酸になるときに2分子のプロトン(H+)が産生されます。

細胞内のpHが低下して酸性になると細胞内のタンパク質の活性や働きは阻害され、pH低下が顕著になれば細胞は死滅します。そこで、がん細胞は乳酸や水素イオン(プロトン)を細胞外に積極的に排出しています。
乳酸はモノカルボン酸トランスポーターという輸送担体で細胞外に排出され、水素イオンは液胞型プロトンATPアーゼ(vacuolar H+-ATPases)、モノカルボン酸輸送体(monocarboxylate transporter:乳酸-プロトン共輸送体)、Na+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などによって細胞外に放出されます。
このような機序でがん細胞は積極的にプロトンを細胞外に排出するので、細胞外は酸性になります。
がん組織の微小環境は血液やリンパ液の循環が悪いので、水素イオンはがん組織に蓄積します。その結果、がん細胞の周囲の組織は水素イオンの濃度が高くなってpHが低下します。
正常の組織のpHは7.3〜7.4程度とややアルカリ性ですが、がん組織の微小環境のpHは6.2〜6.9とより酸性になっていると言われています。
正常な細胞はpHが7.4というややアルカリ側でないと働くことができません。がん組織ではがん細胞外のpHが6.2〜6.9と酸性になっており、このような酸性の状態では、リンパ球は正常な働きができません。
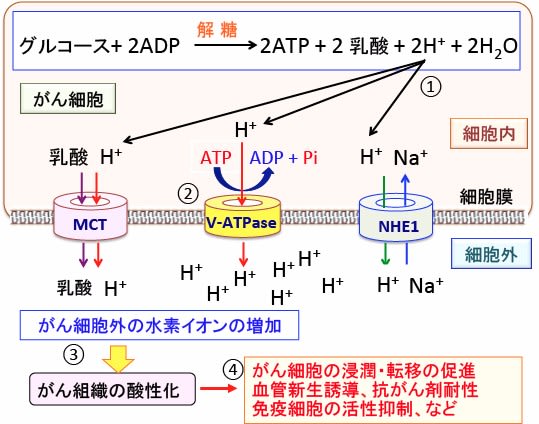
図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える(①)。細胞内の酸性化は細胞にとって障害(毒)になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する(②)。その結果、がん細胞の周囲はpHが低下(水素イオンが増加)してがん組織は酸性化している(③)。組織が酸性化すると、がん細胞の浸潤や転移や血管新生が亢進し、抗がん剤の効き目が弱められ、免疫細胞の働きが抑制される(④)。
【がん組織の酸性化ががん細胞の浸潤や転移を促進している】
がん組織の酸性化した微小環境は、がん細胞の生存にとって以下のような様々なメリットを与えます。
1)組織が酸性化すると正常な細胞が弱り、結合組織を分解する酵素の活性が高まるため、がん細胞が周囲に広がりやすくなり、さらに血管新生が誘導されるので、がん細胞の浸潤や転移が促進されます。
2)組織が酸性になるとがん細胞を攻撃しにきた免疫細胞の働きが弱ります。
3)さらに乳酸には、がん細胞を攻撃する細胞傷害性T細胞の増殖や、免疫細胞の働きを高めるサイトカインの産生を抑制する作用があり、がんに対する免疫応答を低下させる作用もあります。
4)抗がん剤の多くは塩基性なので、酸性の組織では、塩基性の抗がん剤が酸性化されて、活性が低下するということも指摘されています。
つまり、がん組織の酸性化はがん細胞の生存に有利になるので、この「がん組織を酸性化する」という性質は維持され、さらに強化されていきます。
したがって、がん組織の酸性化を改善あるいは阻止できれば、抗がん剤治療や免疫療法の効き目を高めることができることになります。
さらに、水素イオンの排出メカニズムを阻害してがん細胞内のpHを低下させれば、がん細胞を死滅させることもできます。
がん組織の酸性化を阻止する方法として胃潰瘍の治療に使うプロトンポンプ阻害剤とジクロロ酢酸ナトリウムの併用療法について664話で解説しています。

図:がん細胞内では解糖系が亢進して乳酸と水素イオン(プロトン)の産生が亢進している(①)。がん細胞内での酸性化を回避するため、液胞型プロトンATPアーゼ(V-ATPase)などのイオンポンプやトランスポーターなどを使って、プロトン(H+)を細胞外に排出している(②)。その結果、がん組織が酸性化する(③)。胃酸分泌阻害剤のプロトンポンプ阻害剤はV-ATPaseを阻害してがん組織の酸性化を抑制する(④)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによって(⑤)ピルビン酸脱水素酵素を活性化し、ミトコンドリアでの代謝を亢進する(⑥)。その結果、乳酸とプロトンの産生を減らす。プロトンポンプ阻害剤とジクロロ酢酸ナトリウムは相乗的にがん組織の酸性化を阻止し、がん細胞の浸潤や転移を抑制し、抗がん剤治療や免疫療法の効き目を高める。
さらに、シクロオキシゲナーゼ-2(COX-2)選択的阻害剤のセレコキシブ(Celecoxib)は炭酸脱水酵素のCa IIとCa IXの両方をナノモル(nM)レベルの低濃度で阻害する作用が報告されています。この作用は、セレコキシブが、がん細胞の細胞内を酸性にし、細胞外をアルカリにする効果を示唆しています(665話参照)
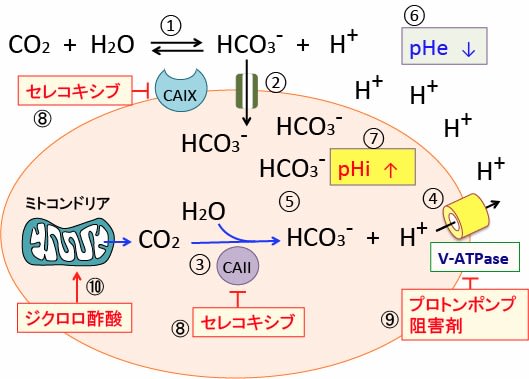
図:炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する(①)。細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる(②)。細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素(CO2)を重炭酸イオンと水素イオンに変換する(③)。V型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)は細胞内の水素イオン(プロトン)を細胞外に排出する(④)。重炭酸イオンは細胞内に保持される(⑤)。その結果、細胞外pH(pHe)は低下してより酸性化し(⑥)、細胞内pH(pHi)はよりアルカリ化される(⑦)。COX-2阻害剤のセレコキシブはCa IIとCa IXの両方を阻害する(⑧)。プロトンポンプ阻害剤はV-ATPaseを阻害する(⑨)。ジクロロ酢酸ナトリウムはミトコンドリアの代謝を活性化してCO2の産生を増やす(⑩)。したがって、セレコキシブとプロトンポンプ阻害剤とジクロロ酢酸ナトリウムの3種類を併用すると、がん細胞内pHが低下(酸性化)して増殖が低下し死滅する。がん細胞外pH(pHe)がアルカリ化すると、がん細胞の浸潤や転移が抑制され、がん細胞に対する免疫細胞(T細胞やNK細胞)の働きが良くなる。
上記のセレコキシブとプロトンポンプ阻害剤とジクロロ酢酸ナトリウムの3種類の組み合わせに、水素イオン(プロトン)を直接消去する重炭酸ナトリウム(炭酸水素ナトリウムや重曹とも言う)の摂取を併用すると、さらにがん組織の酸性化を抑制できます。
重曹療法は単独でもある程度の抗腫瘍効果はあるようです。さらに、抗がん剤治療や免疫療法の抗腫瘍効果を高めることが多くの研究で明らかになっています。
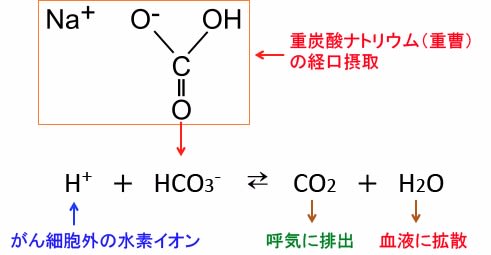
図:重炭酸ナトリウムを経口摂取すると、血中に入った重炭酸イオン(HCO3-)ががん組織に蓄積している水素イオン(プロトン)と反応して二酸化炭素(CO2)と水(H2O)になり、二酸化炭素は呼気に排出され、水は血液に拡散する。この反応によってがん組織の酸性化を抑制できる。
【重炭酸ナトリウムは食品や医薬品として利用されている】
重炭酸ナトリウム(sodium bicarbonate)は重炭酸ソーダ(略して重曹)や炭酸水素ナトリウム(sodium hydrogen carbonate)とも呼ばれます。
日本語では、炭酸水素ナトリウムや重曹の呼び名が多いようですが、英文の論文ではほとんどがsodium bicarbonateとなっていますので、ここでは「重炭酸ナトリウム(sodium bicarbonate)」や重曹を使っています。
化学式は NaHCO3で表わされます。ナトリウムの炭酸水素塩です。
重炭酸ナトリウムは加熱によって二酸化炭素を発生する性質を利用してベーキングパウダーとして調理に使用されます。口中で炭酸ガスを発生させるソーダ飴などには粉末で封入されます。
水に重炭酸ナトリウムとクエン酸を混ぜると炭酸ガスが発生し炭酸水となるので、飲料の材料としても用いられます。砂糖を加え「サイダー」にしたり、レモンを加え「レモンソーダ」にするということもできます。
医薬品としては、胃酸過多に対して制酸剤として使われたり、酸性血症(アシドーシス)の治療に使われています。過剰に摂取するとナトリウムの過剰摂取が問題になりますが、適切な量であれば、安全性の高い化合物です。
重炭酸ナトリウムは水素イオン(プロトン)と反応して、二酸化炭素(CO2)と水(H2O)になります。この反応を利用して、がん組織に多く蓄積している水素イオンを除去してがん組織の酸性化を阻止することができます。
このような重炭酸ナトリウム(重曹)を摂取するがん治療の有効性を示す報告が増えています。

図:がん細胞はグルコースの取り込みと解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増えている(①)。細胞内の酸性化は細胞にとって障害(毒)になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する(②)。その結果、がん細胞の周囲は水素イオンが増え、pHが低下してがん組織は酸性化している(③)。重曹(重炭酸ナトリウム)を経口摂取すると、血中に入った重炭酸イオン(HCO3-)ががん組織に蓄積している水素イオン(プロトン)と反応して二酸化炭素(CO2)と水(H2O)になり、二酸化炭素は呼気に排出され、水は血液に拡散する。この反応によってがん組織の酸性化を抑制できる。
【重炭酸ナトリウムは発がん過程を抑制する】
以下のような論文があります。
Systemic Buffers Inhibit Carcinogenesis in TRAMP Mice.(全身性のpH緩衝はTRAMPマウスの発がんを阻害する)J Urol. 2012 Aug; 188(2): 624–631.
がん組織の微小環境において、組織の低酸素や酸性化が発がん過程を促進することが知られています。さらに、がん組織の低酸素や酸性化が、がん細胞の浸潤性や転移を促進することが報告されています。
そこで、初期のがん組織の段階で、pH緩衝剤(重炭酸ナトリウム)を使って、がん組織の酸性化を阻止すると、がんの進行や浸潤性の性質が抑えられるかどうかを検討する目的で実験が行われています。
低酸素はグルコースの解糖系での代謝への移行を促進し、乳酸と水素イオン(プロトン)の産生を増やして、がん組織の酸性化を促進します。がん組織の酸性化はさらに、がん細胞の浸潤や転移を促進します。その結果、初期のがんが進行がんになっていきます。
TRAMPマウスは、発がんたんぱく質のSV40抗原を発現させることによって自然発症の前立腺がんを発生させることができる遺伝子改変マウスです。がん予防効果のある成分の探索などにも使われます。
この前立腺がんを自然発症するマウスを用いて、重炭酸ナトリウムを経口投与すると、がんの発生が予防できるかどうかを検討しています。
重炭酸ナトリウムの投与は200mMの濃度で重炭酸ナトリウムを溶かした飲水の自由摂取を4週齢と10週齢から開始しています。
コントロール群(重炭酸ナトリウム非投与)ではTRAMPマウスの18匹全てで、平均13週齢で、超音波検査で前立腺がんの発生を認めました。全てのマウスが52週齢以内(中央値37週齢)に死亡しました。
重炭酸ナトリウムの投与を6週齢以前に開始した10匹のマウスでは、全てが76週以上まで生存し、超音波検査で前立腺がんの発生は認めませんでした。解剖による前立腺の組織学的検査では、前立腺組織の過形成(hyperplasia)は認めましたが、70%にはがんは認めず、のこり30%では高分化型の小さな前立腺がんが認められました。
重炭酸ナトリウムの摂取を6週以降に開始した9匹のTRAMPマウスでは、前立腺がんの発生はコントロール群と同じでした。
つまり、重炭酸ナトリウムの摂取を早い段階から開始すれば、前立腺がんの自然発症モデルのTRAMPマウスの発がんを抑制できるという結果です。
全身性のpH緩衝剤としての重炭酸ナトリウムが、初期のがんから浸潤性のがんへの進展を抑制できるという結果です。この実験系で6週齢以前に重炭酸ナトリウムの摂取を開始するとがんの発生を阻止して天寿まで生きれるという結果です。
TRAMPマウスはがんウイルス抗原のSV40たんぱく質を発現させて強力に発がんさせるモデルなので、がんの発生を完全に抑制できる効果は、かなり強いがん予防効果と言えます。
この論文では、マウスに投与した重炭酸ナトリウムの量は人間に換算すると1日約0.4g/kgと記載されています。60kgで24グラムです。
この投与量は鎌状赤血球症の臨床試験で1年以上の投与が行われています。
しかし、人間でがん予防の目的での臨床試験には使うのか困難かもしれません。
人間でのがん予防効果の評価には数年以上の長期間の試験が必要だからです。
しかし、もっと安全で有効なpH緩衝剤が開発できれば、長期のがん予防試験にも利用できるかもしれないと言っています。
【重炭酸ナトリウムによるがん組織のアルカリ化は免疫療法の効き目を高める】
免疫療法として注目されているオプジーボやヤーボイや養子免疫療法のときに、重曹(重炭酸ナトリウム)治療を併用する価値はありそうです。以下のような報告があります。
Neutralization of Tumor Acidity Improves Antitumor Responses to Immunotherapy.(腫瘍組織の酸性度の中性化は免疫療法の抗腫瘍応答を改善する)Cancer Res. 2016 Mar 15;76(6):1381-90.
【要旨】
免疫チェックポイント阻害剤や養子T細胞療法のようながんの免疫療法は、臨床効果を発揮する場合もあるが、まだ解明されていない抑制メカニズムの存在によって、その有効性は低い。
固形がんの微小環境は高度に酸性化している特徴があり、この環境が抗腫瘍免疫の効果を妨げている可能性がある。
この研究においては、免疫療法における腫瘍組織の酸性化の影響を検討した。
培養細胞を使った実験で、pHが酸性の条件では、T細胞の活性化が阻害され、解糖によるグルコース代謝が抑制された。
酸性pHによるインターフェロン-γの産生阻害は、mRNA転写のレベルではなく、たんぱく質の翻訳後の阻害であることが示された。
がん組織の酸性化は細胞内pHには影響しない。これは、細胞膜に発現している特殊なpH感受性受容体が細胞外の酸性化を感知して細胞内にシグナルを送ることを示唆している。T細胞にはこのようなpH感受性受容体が4種類発現している。
注目すべきことに、マウスにがん細胞を移植した実験系で、重炭酸ナトリウム治療で腫瘍の酸性度を中和すると、移植腫瘍の増殖が抑制され、この腫瘍組織内でTリンパ球の浸潤の増加が認められた。
さらに、抗CTLA-4抗体や抗PD1抗体による治療や養子T細胞療法に重炭酸治療を併用すると、多くの実験モデルにおいて抗腫瘍応答を増強し、いくつかの実験系ではがんが治癒した。
以上の結果から、pHをアルカリ化する緩衝剤を経口摂取することによって腫瘍組織内のpHを高めることは、免疫療法の効果を高めることができる。速やかに臨床で使用する価値がある。
【重炭酸ナトリウムはがん細胞の転移を抑制する】
がん組織の酸性化はがん細胞の浸潤や転移を促進します。重炭酸ナトリウム(重曹)を経口摂取するとがん細胞の浸潤や転移を抑制できることが動物実験で報告されています。以下のような報告があります。
Bicarbonate Increases Tumor pH and Inhibits Spontaneous Metastases.(重炭酸ナトリウムは腫瘍のpHを高めて転移を阻止する)Cancer Res. 2009 Mar 15; 69(6): 2260–2268.
【要旨の抜粋】
がん細胞における解糖によるグルコース代謝の亢進と、がん組織では血液やリンパ液の循環が悪いので、がん細胞の外側に水素イオンが蓄積し、その結果、固形がん組織は酸性になっている。培養細胞や動物実験で、組織の酸性化は、がん細胞の浸潤や転移を促進することが明らかになっている。
本研究では、マウスの動物実験モデルを用いて、腫瘍組織の酸性化の阻止ががん細胞の転移を抑制できるかどうかを明らかにする目的で行った。
転移性乳がんのマウスの実験モデルを用いて、重炭酸ナトリウム(NaHCO3)を担がんマウスに経口で投与すると、腫瘍組織のpHは上昇し(アルカリ化し)、自然発生的な転移の形成が減少した。
この治療法はがん細胞外のpHを有意に上昇させ、細胞内pHは上昇させなかった。
重炭酸ナトリウム治療は、血中を循環するがん細胞の数を減らすことはなかった。
一方、がん細胞を脾臓内に注入して肝臓転移を起こす実験系で、肝臓転移が有意に減少した。これは、がん細胞の血管外遊出と着床の段階を阻止していることを示唆している。
この実験では、重炭酸ナトリウムの摂取が血中のpHを上げることはなく、また原発腫瘍の増殖を抑制することは認めませんでした。ただし、転移の発生を有意に抑制しました。
がん組織の酸性化はカテプシンBなどの細胞外マトリックスを分解するタンパク分解酵素を活性化する作用があるので、転移の過程を促進すると考えられています。
経口で重炭酸ナトリウムを摂取すると、酸性化したがん組織がアルカリ性になるので、転移が抑制されるという機序です。
この実験では、コントロールのがん組織のpHは7.0 ± 0.11で、重炭酸ナトリウムを投与したマウスのがん組織のpHは7.4 ± 0.06でした。
細胞内pH(pHi)はコントロール群が7.1 ± 0.09で、重炭酸ナトリウムを投与したマウスのがん細胞では7.0 ± 0.06で有意な差は認めていません。
同じマウスの正常組織(後脚の筋肉組織)の細胞内pHは7.22 ± 0.04、細胞外pHは7.40 ± 0.08で、重炭酸ナトリウムの投与で影響を受けませんでした。
このマウスを使った実験では、200 mmol/Lの濃度の重炭酸ナトリウム(NaHCO3)が入った飲料水を自由摂取で与えています。
重炭酸ナトリウムの分子量は84ですので、200mmol/Lは16.8g/Lを自由摂取しています。
マウスは人間に比べて体重当たりの飲水摂取量が5〜10倍くらいあります。エサも体重当たりで換算すると5〜10倍くらいです。
この実験では1日の飲水摂取量は4.2 ± 0.2 mLでした。マウスの体重は20g程度ですので、体重の5分の1程度の水を1日に飲みます。60kgの人間で12リットルに換算されます。
ネズミと人間は体重当たりの代謝率が異なり、小さい動物ほど体重当たりの飲水やエサの摂取量は多くなります。
標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。体表面積ではほぼ同じになります。これについては293話で解説しています。
このような計算では、この実験でマウスが摂取した重炭酸ナトリウムは体表1m2当たり、1日に9.4gになります。9.4 g/m2/dは70kgの人間で1日12.5gになるとこの論文の考察に記述されています。
ただし、このような面倒な計算をしなくても、水分摂取量と代謝量が比例すると考えると、人間の場合も200mmol/L(=16.8g/L)を自由摂取するという計算で良いと思います。
この計算では1日20g程度の重曹を摂取するというのが一つの目安になります。
重曹を1日30程度摂取しても問題ないという報告もあります。多く摂取すれば、がん組織の酸性化をより強く抑制できます。
しかし、重曹の摂取は、ナトリウムの摂取が増えるというデメリットがあります。また二酸化炭素の産生が増えるので、呼吸機能が低下している場合には重曹は使いにくいと言えます。
NaHCO3の分子量84のうちナトリウムの分子量が23なので、1日20gの重曹を摂取すると5.5gのナトリウムを摂取することになります。5.5gのナトリウムは食塩換算で約14gの食塩の摂取になります。ナトリウム摂取量が多いと、腸管を刺激して下痢になる場合もあります。
したがって、重曹の摂取は1日10g程度が妥当かもしれません。ただし、摂取量が少ないとがん組織のアルカリ化の効果が弱まります。ナトリウム摂取量を増やさないでがん組織をアルカリ化する緩衝液としてTris塩基の有用性が報告されています(後述)。
【重炭酸ナトリウムはpH緩衝剤として安全に利用できる?】
上記の論文と同じCancer Researchの同じ号に以下のような論文も掲載されています。
The Potential Role of Systemic Buffers in Reducing Intratumoral Extracellular pH and Acid-Mediated Invasion.(腫瘍組織内の細胞外酸性化と酸誘導性の浸潤の軽減における全身性緩衝剤の可能性)Cancer Res. 2009 Mar 15; 69(6): 2677–2684.
【要旨】
正常組織に比べてがん組織の細胞外pHは低下(酸性化)しており、この細胞外pH(pHe)の酸性化ががんの原発巣や転移巣において増殖や浸潤を促進していることは多くの研究によって示されている。この研究は、pH緩衝剤を全身性に投与することによってがん組織内およびがん組織周囲の酸性化を軽減し、がん細胞の増殖と悪性進展を阻止できるという仮説を検証するために行った。
生体内において全身性のpH緩衝剤によって腫瘍組織の細胞外pH(pHe)を高めるために必要な投与量を決めるのにコンピューターシュミレーションを利用し、この目的に適する化合物を探索した。
重炭酸ナトリウム(NaHCO3)が通常の臨床試験で使用されている量の摂取によって、この目的に利用できることを明らかにした。
さらに、腫瘍組織の酸性化の軽減が、血液や正常組織のpHに影響することなく、腫瘍の増大と浸潤を有意に抑制することを認めた。
ある物質のpHの緩衝作用の有効性を決める重要な要素はそのpKa(酸解離定数)である。
重炭酸ナトリウム(NaHCO3)のpKaが6.1であり、これは細胞外のpH緩衝剤としては理想とは言えない。
細胞外pH(pHe)を高めるためには、pKaが7に近いものがより有効である。
がん組織のpHeを高め、がん細胞の増殖・浸潤を阻害する目的で全身性のpH緩衝剤を利用することは有用である。
正常細胞の細胞外のpHは7.2〜7.4で、がん細胞の細胞外pHは6.6〜7.0と酸性化しています。このがん組織の酸性化を中和して酸性度を低下させる全身性のpH緩衝剤の服用はがん治療に有効に作用することが明らかになっています。
理想的なpH緩衝剤はpKa(酸解離定数)が7に近いものが良く、重炭酸ナトリウム(NaHCO3)はpKaが6.1であるため、まだより有効性の高いものがないか探索しています。しかし、他のバッファー(pH緩衝剤)では、副作用などの観点から、現時点では重炭酸ナトリウム(重曹)が最も使いやすいという考察です。
重炭酸イオンは水素イオンと反応して二酸化炭素(呼気から排出)と水(血液に拡散)になるので、副作用は起こりにくいという理由のようです。ただ、二酸化炭素を呼気から排出できないと、アシドーシスを引き起こします。重炭酸ナトリウムを使用するときには呼吸機能が正常であることが必要です。
重炭酸イオンは体内で生理的はpH緩衝剤として働いており、人工的なpH緩衝剤は長期間の服用には安全性に問題があるということです。
重曹は食品や医薬品として利用され、1日10〜20グラム程度でがん組織の酸性化の軽減に有効に作用し、この程度の量であれば、長期に使用しても安全性に問題がないことが知られているからです。
この論文では、血中の重炭酸イオン(HCO3-)の上昇は、血液のpHには影響せずに、がん組織とがん組織周辺の酸性血症(アシドーシス)を正常化することを確認しています。
重炭酸ナトリウムは血液のような正常なpH(7.35–7.45)をアルカリ化することはせずに、酸性化したがん組織(pHが6.6〜6.9)は正常なpHに向けて緩衝作用を示すことが示されています。
この論文では、70kgの人間換算で1日37gの重炭酸ナトリウムの摂取で行っています。
この論文の考察では、重炭酸ナトリウムの1日の推奨量は25から50グラム程度を推奨しています。
この程度の投与量は、尿細管性アシドーシスや鎌状赤血球症などの治療で、長期間(1年以上)使用されており、安全性には問題ないと記述されています。
さらに、この論文では、79歳の全身転移のある腎臓がんの患者の例を記載しています。
最初の抗がん剤治療が無効だったために、その患者さんは標準治療を中止し、ビタミンやサプリメントと一緒に60gの重炭酸ナトリウムを摂取する代替医療を自分で開始しました。そして、この論文を投稿するまでの10ヶ月間、がんの進行は止まって、病状が安定しているという症例を紹介しています。
ただし、私自身で試してみて、1日30gの重曹の摂取は無理だと思います。
30gの重曹は8.2gのナトリウムの摂取になります。これは食塩換算で21gの食塩(NaCl)の摂取になります。1日の食塩摂取量は日本人の平均は10gを超えていますが、健康のため1日6g程度に減らすことが推奨されています。1日30gの重曹を摂取して、他の食事を加えると1日30g以上の食塩摂取になってしまい、血圧上昇などの副作用が問題になります。
そこで、ナトリウムも二酸化炭素も増やさないTris塩基を使った方法が注目されています。
【トリス塩基緩衝液はがん組織の酸性化を改善する作用が重炭酸ナトリウムより強い】
緩衝液というのは、溶液のpHをある程度一定に保つ溶液です。
例えば、弱酸(酢酸など)と、その塩(酢酸ナトリウムなど)を共存させた水溶液は、多少の酸や塩基が加えられても、ほとんどpHが変動しないという作用(緩衝作用)を持ちます。
緩衝液に酸 (H+) や塩基 (OH−)を加える場合、緩衝液内に存在する塩や電離したイオンと結びつき中和されるため、結果pHの変化が緩やかとなるのです。
「酸」というのは水素イオン(H+)を放出する物質で、「塩基」というのは水素イオン(H+)を受け取る物質です(下図)。

図:酸は水素イオンを放出し、塩基は水素イオンを受け取る
正常な動脈血のpHは7.35〜7.45という非常に狭い範囲で調節されています。このpHの調節は主に血液の重炭酸緩衝系によって行われます。
この系は、重炭酸イオン(HCO3-)が塩基となってプロトン(水素イオン)を受けとって中和してpHを一定に維持します。

体内で産生される水素イオンを重炭酸イオンが中和して、二酸化炭素は肺から排出されて血液・体液のpHが一定に維持されます。
トリス(Tris)塩基緩衝液は、化学やバイオの実験をした人なら誰でも知っている緩衝液です。臨床でも、トロメタモールという名前でアシドーシスの治療に点滴薬として使用されています。このTris塩基緩衝液ががん組織の酸性化の改善に有用という論文があります。
Tris–base buffer: a promising new inhibitor for cancer progression and metastasis(トリス塩基緩衝液:がんの進行と転移の有望な新しい阻害剤)Cancer Med. 2017 Jul; 6(7): 1720–1729.
【要旨】
経口緩衝液でがん細胞の外部の酸性度を中和することは、がん細胞の転移の予防と抑制に有効であることが、いくつかのマウスの実験モデルで証明されている。
がん細胞の解糖系の亢進と、がん組織の不十分な血液循環の結果として、がん組織は非常に酸性化している。これまでの我々の研究では、重炭酸ナトリウム、イミダゾール、および遊離塩基(プロトン化されていない)のリジンが腫瘍の進行と転移の抑制に有効であることが示されている。
しかし、これらの実験結果を人間の治療に応用する際の問題は、対イオンの存在とそれらの潜在的な望ましくない副作用(例えば、高ナトリウム血症)である。
この報告では、前立腺がんおよび膵臓がんのin vivoの動物実験モデルを用いて、対イオンを含まない第一級アミンであるトリス(ヒドロキシメチル)アミノメタン(THAMまたはTris)のがん細胞の転移と進行に対する効果を、MRIおよび生物発光イメージングを使用して検討した。
200 mmol / L濃度のTrisの液体の自由摂取は、前立腺がんと膵臓がんの両方の実験モデルにおいて、転移を効果的に抑制し、さらに主要なグルコース輸送体であるGLUT-1の発現を減少させた。
また、pH8.4のトリス塩基緩衝液(Tris-baseバッファー)は、高用量(400 mmol / L)でもC3Hマウスに対して明白な毒性を示さなかった。
結論として、我々は臨床試験に容易に適応できる腫瘍細胞外pH(pHe)を操作するための新しい治療アプローチを開発した。
Tris の正式名称は Tris (hydroxymethyl) aminomethane です。Tris の 「tri」は3の意味で、置換基が 3つ をあることを示します。つまり、ヒドロキシメチル (-CH2OH) という基が 3 個あることを意味します。この3つのヒドロキシメチル(-CH2OH) 基が、アミノメタン(aminomethane) に結合している構造です。
Tris は、水分子と反応して ヒドロキシイオン(OH-)を生成します。この解離反応の pKb が約 8 なので、Tris 溶液は弱アルカリ域の緩衝液として働きます。つまり、pHが8付近で最大の緩衝能を発揮します。

トリス塩基はアシドーシスの治療薬として300 mmol/Lの濃度で点滴で使用されています。
重炭酸ナトリウムは対イオンのナトリウムが増えるという問題がありますが、Tris塩基はそのような問題はありません。
マウスの実験では200 や400 mmol/Lの濃度の飲水を長期間(90日間)自由摂取しても毒性は認めないと報告されています。
Tris塩基の分子量は121ですので、200mmol/Lは24.2g/Lです。
200 mmol/Lの自由摂取でがん細胞の転移を抑制され、さらにグルコーストランスポーターのGLUT-1の発現量を低下させるという結果です。がん細胞の細胞内が酸性化すると解糖系が抑制されるためと考えられています。
Tris塩基はトロメタモールという名前で点滴剤として使用されています。
炭酸水素ナトリウム(重曹)はNa+や CO2 が蓄積するという問題がありますが、トロメタモールにはそのような問題はありません。代謝性アシドーシスを速やかに是正します。pHが8付近で最大の緩衝能を発揮するので、pKa(酸解離定数)が6.1の重炭酸ナトリウムより強力にがん組織の酸性化を軽減します。Tris塩基は、血中の酸や炭酸ガス(CO2)と反応してこれらを減少させます。
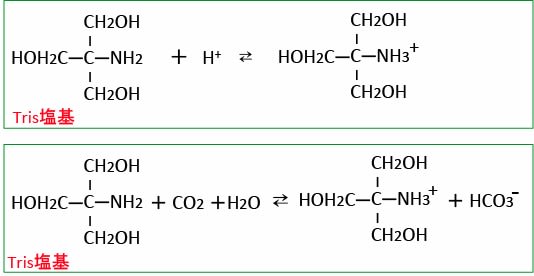
トリスヒドロキシメチルアミノメタンと重炭酸ナトリウムの両方を併用すると代謝性アシドーシスの改善により良いという報告もあります。
Tris-hydroxymethyl aminomethane and sodium bicarbonate to buffer metabolic acidosis in an isolated heart model.(分離した心臓モデルにおける代謝性アシドーシスを緩衝するためのトリスヒドロキシメチルアミノメタンと重炭酸ナトリウム)Am J Respir Crit Care Med. 1997 Mar;155(3):957-63.
【要旨】
代謝性アシドーシスは、興奮-収縮連関経路のすべてのステップに影響を及ぼすことにより、心筋の発達力の低下を誘発する。
細胞内アシドーシスの一時的な悪化を引き起こすことから、急性アシドーシスの治療に重炭酸ナトリウムを投与することの有効性が疑問視されている。
代替治療薬であるトリスヒドロキシメチルアミノメタンには、細胞内空間に拡散するという利点がある。この研究は、代謝性アシドーシスが心筋機能に及ぼす影響を評価し、重炭酸ナトリウム、トリスヒドロキシメチルアミノメタン、およびそれらの組み合わせによるアルカリ化の影響を検討する目的で行った。
血液灌流分離心臓標本を使用して、左心室収縮性と弛緩を正常pHおよび代謝性アシドーシス(pH = 7.0)において測定した。
アシドーシスは、心筋の収縮性と弛緩を劇的に低下させた。
重炭酸ナトリウムで緩衝化した後、血漿重炭酸塩濃度は正常化されたが、PaCO2の増加によりpHは正常より低いままであった。
収縮性と関係は最初は悪化し、その後わずかに改善して正常値に戻った。
トリスヒドロキシメチルアミノメタンはアシドーシスの正常化は不十分であったが、心筋の収縮性と弛緩を大幅に改善した。
トリスヒドロキシメチルアミノメタンと重炭酸ナトリウムの組み合わせは、PaCO2に影響せずにアシドーシスを完全に緩衝し、心筋の収縮性を大幅に改善した。
トリスヒドロキシメチルアミノメタンと炭酸水素ナトリウムの組み合わせは、重炭酸ナトリウム緩衝液によって生成されたCO2を捕捉するトリスヒドロキシメチルアミノメタンの能力に基づいている。この組み合わせにより、代謝性アシドーシスの完全な補正が達成され、心筋のパフォーマンスが向上する。
重炭酸ナトリウムはクエン酸と混ぜると二酸化炭素(CO2)が発生しますが、Tris塩基はCO2は発生しません。
Trisはそのまま水に溶かして摂取するとアルカリが強いので、胃腸に刺激になります。
そこでTris塩基とクエン酸を一緒に溶かして中和させて服用すると飲みやすくなり、緩衝作用は維持され、クエン酸の抗がん作用も加わって、がん治療の効果を高めます。(クエン酸の抗がん作用は658話参照)
実際に私自身で試してみました。
具体的にはTris塩基10gにクエン酸3gを水500ccに混ぜて溶かし、酸味のあるジュース(オレンジやグレープフルーツやトマトなど)に混ぜて飲用すると、全く飲みやすい飲料になり、しかも、尿のpHを測定するとアルカリ性(pHが8程度)を維持します。
Tris塩基(1日10g程度)、クエン酸(1日10g程度)、プロトンポンプ阻害剤、ジクロロ酢酸ナトリウム、COX-2阻害剤のセレコキシブを併用して、がん組織の酸性化を軽減し、むしろアルカリ化すると、がん細胞が縮小する可能性があります。
「がんのアルカリ療法」は進行がんで治療が行き詰まっているときは試してみる価値はあると思います。がん組織を徹底的にアルカリ化すると、がん細胞は死滅する可能性があります。
少なくとも、この組み合わせは、私自身が1週間試しましたが、副作用はありません。
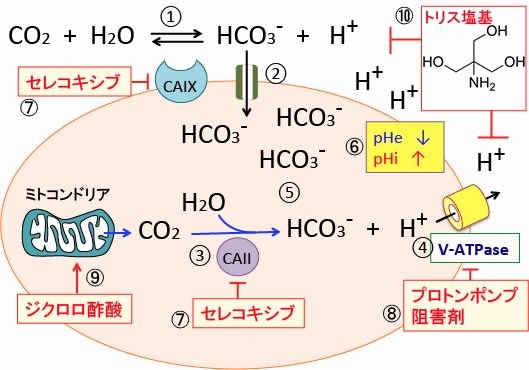
図:炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する(①)。細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる(②)。細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素(CO2)を重炭酸イオンと水素イオンに変換する(③)。V型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)は細胞内の水素イオン(プロトン)を細胞外に排出する(④)。重炭酸イオンは細胞内に保持される(⑤)。その結果、細胞外pH(pHe)は低下してより酸性化し、細胞内pH(pHi)はよりアルカリ化される(⑥)。COX-2阻害剤のセレコキシブはCa IIとCa IXの両方を阻害する(⑦)。プロトンポンプ阻害剤はV-ATPaseを阻害する(⑧)。ジクロロ酢酸ナトリウムはミトコンドリアの代謝を活性化してCO2の酸性を増やす(⑨)。トリス塩基は細胞外のプロトン(水素イオン:H+)を消去する(⑩)。したがって、セレコキシブとプロトンポンプ阻害剤とジクロロ酢酸ナトリウムとトリス塩基を併用すると、がん細胞内pHが低下(酸性化)して増殖が低下し死滅する。がん細胞外pH(pHe)がアルカリ化すると、がん細胞の浸潤や転移が抑制され、がん細胞に対する免疫細胞(T細胞やNK細胞)の働きが良くなる。
著書紹介:

詳しくはこちらへ:
著書紹介

(くわしくはこちらへ)
| « 665)がんのア... | 667)抗がん作... » |



