がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
721)時を戻そう(その2): NAD+前駆体の補充による免疫老化と炎症加齢の阻止
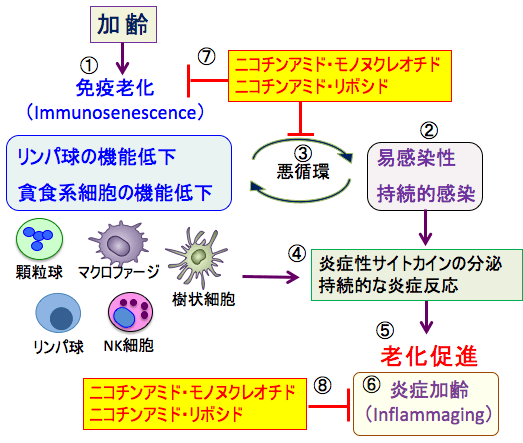
図:加齢に伴ってリンパ球(T細胞やB細胞など)や貪食細胞(マアクロファージや樹状細胞など)などの免疫細胞の機能が低下し(①)、この免疫老化(Immunosenescence)によって感染症に罹りやすくなり、さらに感染が持続(遷延化)しやすくなる(②)。持続的感染はさらに免疫機能を低下させ、悪循環を形成して免疫老化がさらに進行する(③)。持続的感染は持続的な炎症反応(慢性炎症)を引き起こして、炎症性サイトカインの分泌が亢進する(④)。このような慢性炎症状態は組織障害を介して細胞や組織の老化を促進する(⑤)。このような慢性炎症の持続によって老化が促進される現象を炎症加齢(Inflammaging)という(⑥)。NAD+前駆物質のニコチンアミド・モノヌクレオチドやニコチンアミド・リボシドは免疫細胞のNAD+の量を増やし、免疫老化を阻止し(⑦)、感染症に対する抵抗性を高めて炎症加齢による老化促進を阻止する(⑧)。
721)時を戻そう(その2): NAD+前駆体の補充による免疫老化と炎症加齢の阻止
【正常細胞は分裂できる回数に限界がある】
1960年代にアメリカの生物学者レオナルド・ヘイフリック(Leonard Hayflick)は、培養した正常細胞の分裂回数には限界があることを発見しました。
人間の胎児から取り出した線維芽細胞を培養すると次第に分裂の速度が落ちて、約50回の分裂回数が限界で、いくら栄養物質や増殖を促進する物質を加えても分裂することはできずに最後は死んでしまいます。
一方、成人の人間から取り出した線維芽細胞の分裂できる回数はその年齢に応じて減少していることも明らかになっています。すなわち、細胞の中には細胞の分裂した回数をきちんと数える装置があって、ある回数を過ぎると細胞は死を向かえるプログラムが働き出すのです。
このように、正常な細胞が分裂できる回数には限界があることを「ヘイフリックの限界(Hayflick Limit)」と言います。ヒトの正常細胞の分裂回数は約50回が限界ということで、それ以上は分裂できないので、寿命があるということになります。

図:ヘイフリックの実験。赤ん坊や成人や老人の皮膚から線維芽細胞を採取してシャーレで培養すると、年齢が若い個体から採取した細胞ほど多く分裂できる。赤ん坊の細胞の方が老人より多く分裂できるが、赤ん坊の細胞もやがて細胞分裂を停止して死滅する。細胞の分裂回数はヒトの場合は約50回が限界で、これ以上は分裂できない。これをヘイフリック限界という。
【細胞分裂するたびにDNAのテロメアが短くなる】
細胞の分裂回数に限界を設けているのが遺伝子の末端のテロメアの存在です。
染色体DNAの末端部分にはTTAGGGという配列が多数繰り返された構造がみつかりテロメアと名付けられました。この6塩基のリピート部分には遺伝情報が入っていないので、無くなっても遺伝子の発現には問題ない部分です。
しかし、テロメアが無くなると細胞はDNAの複製ができなくなります。
DNAは2本の鎖状で、それぞれの鎖を鋳型にして新しいDNA鎖を合成します。新しい鎖を作るとき、DNAポリメラーゼという酵素が鋳型のDNA上を移動しながら、新生DNAを作ります。
この酵素が鋳型のDNAに結合するためには、まずプライマーとよばれるRNAが鋳型のDNAの末端に結合する必要があります。
DNAポリメラーゼはRNAプライマーに結合し、そこから新生DNAの合成を開始します。その際、プライマーが結合した鋳型DNAの末端部は複製されません。そのため、細胞分裂でDNAを複製するたびに、染色体のDNA末端は少しづつ切れて短くなっていきます。
短くなっても問題ないように、最初から遺伝情報とは関係なく必要のないDNA配列(TTAGGGの繰り返し配列)がテロメアとして存在しているのです。
しかし、テロメアの長さに限界があるので、いずれはテロメアが無くなると、もはや細胞分裂ができなくなります。

図:染色体の末端にはテロメアという構造があり(①)、この部分のDNAはTTAGGGという配列が多数繰り返されている(②)。細胞分裂するたびに、このテロメア部分のDNAは短くなり(③)、テロメアが無くなった時点で、細胞はそれ以上に分裂することができなくなる(④)。
つまり、テロメアとは「命の回数券」のようなものであり、分裂する度に回数券を一枚づつちぎって使い、やがて使い切ってしまうと細胞の寿命がくるというわけです。
生殖細胞や幹細胞(骨髄の造血細胞や消化管粘膜上皮細胞のように細胞回転が早い細胞を供給している細胞)やがん細胞のように無限に分裂できる細胞もありますが、これはテロメアを延ばすことができるテロメラーゼという酵素が働いて、テロメアの長さを維持しているからです。普通の細胞にはテロメラーゼ活性はほとんどありません。
がん治療の領域では、がん細胞のテロメラーゼ活性を阻害できれば、がん細胞の無限の増殖能を阻止できます。
一方、抗老化の研究分野では、テロメラーゼの活性を高めて幹細胞の分裂能を高め、組織や臓器の老化による機能低下を抑制することを目的にした治療法が研究されています。
【テロメア短縮が免疫老化を引き起こす】
高齢者ほど感染症に罹りやすく、重症化率や死亡率が高くなることが知られています。
その理由は、高齢になると免疫系自体が老化性の機能低下を起こすからです。高齢者では細胞のテロメアが短縮しているため、リンパ球などの免疫細胞の増殖が制限されることが指摘されています。以下のような論文があります。
Telomere shortening and ageing of the immune system(テロメア短縮と免疫系の老化)J Physiol Pharmacol. 2008 Dec;59 Suppl 9:169-86.
【要旨】
テロメアは6個のヌクレオチドのリピートと関連タンパク質によって構成される染色体の末端に局在するタンパク質-DNA複合体である。テロメアの長さは細胞分裂とともに短くなり、年齢と反比例する。
テロメアの長さは、遺伝的および後天的要因、性ホルモン、活性酸素種および炎症反応によって修飾される可能性がある。
テロメアの長さの短縮が限界に達すると、細胞周期の停止または細胞の老化を引き起こす。
免疫系の能力はT細胞およびB細胞集団の細胞再生およびクローン増殖に厳密に依存するため、免疫系はテロメアの短縮に非常に敏感である。
通常の体細胞はテロメアを伸長する酵素であるテロメラーゼ活性は無いが、免疫系の細胞では、活性化されて細胞増殖する過程でテロメラーゼの発現と活性を亢進することができる特徴を有し、その結果、テロメアの消耗を制限できる。
テロメアの長さは個人間で非常に違いがある。 CD4 +、CD8 + Tリンパ球、Bリンパ球、顆粒球、単球およびNK細胞集団では、テロメア短縮の動態に違いが観察された。
免疫老化は、抗原への暴露と酸化ストレスによって引き起こされる免疫系の特別な変化によって特徴付けられる。加齢免疫系では、ナイーブTおよびB細胞の進行性の低下とTおよびBリンパ球の絶対数の減少により、適応免疫が低下する。
免疫システムにおける自然免疫は比較的よく保存されているが、いくつかの年齢に依存する変化も観察できる。
90歳代または100歳以上に生存できている人は、免疫パラメーターのほとんどがよく保存されており、免疫システムの老化が抑えられていることが示唆される。
免疫システムは病原体やがん細胞から生体を守る働きを担っています。この免疫システムは自然免疫と獲得免疫に分けられます。
自然免疫は先天的に備わった免疫で、微生物などに特有の分子パターンを認識して異物を攻撃します。マクロファージや好中球には細菌などの病原体に共通した情報を認識できる受容体を細胞表面に持っていて病原体を認識して貪食します。さらにマクロファージはナチュラルキラー細胞を活性化します。
一方、獲得免疫は,後天的に外来異物の刺激に応じて形成される免疫です。高度な抗原特異性と免疫記憶を特徴とします。(下図)

図:細菌やウイルスなどの病原菌に対して好中球やマクロファージやナチュラルキラー(NK)細胞が排除する。抗原による感作の必要のない病原菌に対する第一次防衛機構が「自然免疫」となる(①)。病原菌の抗原が樹状細胞に取り込まれ(②)、抗原を貪食した樹状細胞はリンパ節に移動して抗原の情報をT細胞やB細胞に渡して活性化し(③)、病原菌に対する抗原特異的な免疫応答によって病原菌を排除する(④)。この抗原特異的な免疫応答が「獲得免疫」となる(⑤)。
病原微生物が侵入したり、何らかの原因で炎症が起こると、血管から顆粒球や単球などが遊走して来ます。このように炎症反応によって集まってきたり、あるいは組織に常在していた樹状細胞やマクロファージは、侵入した細菌やウイルス粒子、あるいは死滅した細胞の死骸や断片などを取り込み、リンパ液の流れに沿って所属リンパ節に移動します。
樹状細胞やマクロファージは取り込んだタンパク質を分解し、その結果産生されたペプチド(アミノ酸が数個から数十個つながったもの)をMHC(major histocompatibility complex:主要組織適合抗原複合体)分子の上に提示します。
活性化した樹状細胞はリンパ節で手当たり次第にナイーブT細胞(まだ一度も活性化されたことのないT細胞)とくっつきあって、何かを確かめます。ナイーブT細胞はその表面にT細胞抗原認識受容体(TCR)を持っています。樹状細胞の表面に提示されたMHC+抗原ペプチドとピタッとくっつく受容体(TCR)をもったナイーブT細胞と出会うと、そのT細胞を活性化します。
抗原を提示して活性化している樹状細胞にはCD80/86という補助刺激因子が発現しており、T細胞のCD28と結合し、刺激を送ります。
さらに、活性化した樹状細胞はサイトカインを放出しており、ナイーブT細胞はそれを浴びることになります。
このようにTCRを介するシグナルとCD28を介する補助刺激とサイトカインによる刺激を同時に受けたTリンパ球は初めて活性化し、TCRの特異性を保ったままで分裂・増殖して自らのクローンを増やします。
CD4陽性T細胞(ヘルパーT細胞)は、Th1またはTh2のパターンを示すサイトカイン産生細胞へと分化します。
CD8陽性T細胞(キラーT細胞)は成熟し、細胞質内にパーフォリンやグランザイムなどを含んだ細胞傷害顆粒を持つエフェクター細胞になります。
エフェクター細胞はリンパ節を離れ、胸管を経て循環血液中へと流れ込み、血流に従って全身を巡ります。炎症の起こっている組織から産生されるサイトカインやケモカインなどの作用でエフェクターT細胞は炎症部位に集まり、病原菌やがん細胞の攻撃に参加します。

図:病原菌(細菌やウイルスなど)に由来する抗原(①)やがん細胞から放出されたがん抗原(②)を未熟樹状細胞(③)が取り込んで成熟して抗原を提示するとき(④)、MCH(major histocompatibility complex:主要組織適合抗原複合体)分子にペプチド抗原を載せて細胞傷害性T細胞やヘルパーT細胞に提示する(⑤)。このとき、MCH+ペプチド抗原にぴったり結合するTCR(T細胞受容体)を持つT細胞は、補助刺激因子(CD28とCD80/86など)や樹状細胞から放出されるサイトカインの働きで活性化され、がん抗原を認識するT細胞がクローン性に増殖し(⑥)、病原菌やがん細胞を抗原特異的に攻撃する(⑦)。
病原菌やがん細胞に対してリンパ球が抗原特異的に攻撃する場合、T細胞やB細胞などのリンパ球がクローン性に増殖する必要があります。
リンパ球のテロメアが短く、例えば10回しか分裂できないと2の10乗(210)の細胞数は1024個です。1000個程度のリンパ球では病原菌やがん細胞に十分な抗原特異的な攻撃はできません。がん細胞の場合、1gのがん組織には約10億個のがん細胞が存在します。
20回の細胞分裂(220)で約100万個です。30回の細胞分裂(230)で約10億個です。
リンパ球がクローン性に増殖する場合、テロメラーゼ活性が亢進して、細胞分裂が継続できるように働いていますが、高齢になると、リンパ球のテロメラーゼ活性は低下しています。テロメラーゼ活性が低下していると、抗原に特異的なリンパ球のクローン増殖に限界があります。
これが、高齢者が感染症やがんの発症が多いことの理由の一つです。病原菌やがん細胞を排除する免疫細胞のクローン性の増殖が十分にできないためです。
高齢者になってもこの免疫機能が良好に保持されている人は、90歳代や100歳代の超高齢が達成できるということです。逆にいうと、90歳代以上に長生きしたければ、免疫機能を良好な状態に維持することが必要条件になるということです。
【NAD+を増やすと免疫力が向上してCOVID-19の死亡リスクを低下できる】
最近の話題では新型コロナウイルス感染症(COVID-19)でも、高齢者ほど死亡率が高いことが明らかになっています。
高齢者は心臓や呼吸器の機能が低下し、動脈硬化や糖尿病や高血圧などの併存疾患を持つ人が多く、これらの状態がCOVID-19に対する死亡リスクを高めています。
高齢者では免疫機能が低下していることも、重症化しやすい理由と思われます。
以下のような報告があります。
Influence of NAD+ as an ageing-related immunomodulator on COVID 19 infection: A hypothesis(COVID 19感染に対する加齢関連免疫調節剤としてのNAD+の影響:仮説)J Infect Public Health. 2020 Sep; 13(9): 1196–1201.
【要旨】
老化に関連した生物学的機能の低下は、人間の病気の罹患率と死亡率の増加に対する重要な要因である。これらの生物学的機能の低下の中には、心臓機能の大幅な低下、肺のガス交換の障害、免疫機能の障害がある。
加齢の過程において、液性免疫および細胞性免疫応答における多くの変化が観察される。循環している炎症誘発性サイトカインが増加し、ナイーブリンパ球が減少し、抗原提示細胞の数が上昇し、全体的な免疫応答が損なわれている。
さらに、老化はテロメアの長さの進行性の短縮と関連している。テロメアは染色体の末端に位置し、染色体の安定性を維持する上で重要な役割を果たす。
また、テロメアの短縮に対して免疫細胞は感受性が高いため、テロメアの長さは免疫系にとって非常に重要である。
テロメアの短縮は、免疫細胞の機能と発達に悪影響を及ぼす。これらの有害な変化により、感染症の重症化、入院のリスク、さらには死亡のリスクが高まる。
高齢のCOVID-19患者は、免疫機能障害、サイトカインストーム、および呼吸機能障害により、実際に合併症のリスクが高くなる。
抗老化作用と免疫調節作用のあるニコチンアミドアデニンジヌクレオチド(NAD+)のような因子を投与すると、その強力な免疫調節効果と寿命延長効果により、これらの病的変化を最小限に抑えることができる。
NAD+はPARP-1を直接阻害する作用があり、炎症誘発性サイトカインの過剰活性化を防ぐことができる。
NAD+レベルを上げると、テロメアが安定し、免疫細胞の機能にプラスの影響がある。
新型コロナウイルス(COVID-19)に感染した場合、高齢者は重症化しやすく、子供はほとんど軽症で終わります。この違いは免疫力の違いと簡単に片付けることもできますが、それでは、なぜ高齢になると免疫力が低下するのでしょうか。
老齢の個人と子供のDNAレベルでの重要な違いの1つは、テロメアの長さです。
テロメアは染色体末端の反復ヌクレオチド配列の領域を表します。免疫系はテロメアの短縮に非常に敏感で、その機能は厳密に細胞の再生とTおよびB型の細胞のクローン性増殖に依存するためです。テロメア短縮は細胞の分裂増殖能を制限します。
人間の個人間では白血球のテロメア長(LTL)に顕著な違いがあります。この違いは通常、性別、人種/民族、受胎時の父方の年齢、および環境暴露の特異な影響に起因します。
あるコホート研究では白血球のテロメア長が短いと、肺炎による入院のリスクが高く、感染に関連する死亡のリスクが高いことが報告されています。
インフルエンザワクチン接種後の免疫反応に関する別の重要な研究では、Bリンパ球のテロメア長が長い人は、Bリンパ球テロメアが短い人と比較して、より強力な抗体反応を示しました。
白血球テロメア長(LTL)に関する疫学データでは、加齢、肥満、男性、白人、アルコール依存症、アテローム性動脈硬化、糖尿病、感染症、心血管疾患がLTLの短縮と関連することが報告されています。
テロメアの長さが様々な要因で影響を受け、寿命に影響することが指摘されています。
【慢性炎症は免疫力を低下し、老化を促進する】
老化というのは、加齢に伴って個体の生存に必要な様々な生命機能が低下していく現象です。
加齢に伴って免疫系が老化(機能低下)する結果,免疫系本来の非自己を排除する機構と炎症反応を制御する機構が低下し,その結果、高齢者では易感染性や炎症の持続(慢性炎症)が引き起こされます。
加齢に伴う免疫系の老化を特徴づける現象として「免疫老化(Immunosenescence)」と「炎症加齢(Inflammaging)」があります。
「免疫老化」は免疫系本来の役割である「非自己を排除する機能」が加齢に伴って低下することを指し、高齢者で認められる易感染性の原因となっています。
「炎症加齢」は炎症反応を制御する機構が加齢に伴って低下する結果、慢性的に炎症が持続することによって老化が促進されることです。
「Inflammaging」はinflammation(炎症)+aging(加齢)から作られた用語で、炎症が老化や、老化に伴う様々な疾患と密接な関係があることから生まれた造語です。
加齢に伴って免疫機能は個体・細胞レベルで低下していますが、一方で高齢者の血中において インターロイキン6(IL-6)や 腫瘍壊死因子α(TNFα) などの炎症性サイトカイン、C-反応性タンパク質(CRP)や種々の補体分子などの炎症性タンパクが慢性的に増加しています。
このような血中の炎症性物質の増加に加えて、高齢者では自己抗体の保有率が上昇しています。老化に伴う慢性炎症が状態が様々な老化関連疾患の発症を促進しています。
図:加齢に伴ってリンパ球(T細胞やB細胞など)や貪食細胞(マアクロファージ、樹状細胞など)の免疫細胞の機能が低下し(①)、この免疫老化(Immunosenescence)によって、感染症に罹りやすくなり、さらに感染が持続しやすくなる(②)。持続的感染はさらに免疫機能を低下させ、悪循環を形成して免疫老化が進行する(③)。持続的感染は持続的な炎症反応(慢性炎症)を引き起こして、炎症性サイトカインの分泌が亢進する(④)。このような慢性炎症状態は組織障害を介して細胞や組織の老化を促進する(⑤)。このような慢性炎症の持続によって老化が促進される現象を炎症加齢(Inflammaging)という(⑥)。
体の若返りが可能な理由の一つは、老化に伴う臓器機能の低下に、幾つかの生体内成分の減少や増加が関与していることです。
2 匹のマウスの脇腹の皮膚を縫い合わせる並体結合(parabiosis)という手法を用いて、若い個体と老齢個体を並体結合し、両者の血液を一緒に循環させて1ヶ月ほどすると、老齢個体が若返りの兆候を示すことが報告されています。
老化によって低下していた骨格筋の筋力が増加し、神経幹細胞の増殖能が促進されて認知機能が良くなり、心臓や肝臓や膵臓などの臓器機能が改善することが認められています。
逆に若いマウスは老化の徴候が進行することが示されています。
これは、加齢とともに老化を促進する「老化因子」が次第に増加し,体を若い状態に維持する「若返り因子」が加齢とともに減少することが老化の原因である可能性を示唆します。

図:高齢マウスと若いマウスの脇腹の皮膚を縫い合わせる並体結合によって両者の血液循環を共有させると、高齢マウスの老化因子によって若いマウスの老化の徴候が促進される(①)。一方、高齢マウスは若いマウスの若返り因子によって老化の徴候が減少する。
体内の生命活動に必須の補酵素のニコチンアミド・アデニン・ジヌクレオチド(nicotinamide adenine dinucleotide:NAD+)はそのような若返り因子の一つとして研究されています。
NAD+は加齢とともに減少し、NAD+を増やす方法は老化の徴候を低下させることが明らかになっています。
前述のようにNAD+の前駆物質であるニコチンアミド・モノヌクレオチド(NMN)やニコチンアミド・リボシド(NR)をサプリメントとして補充すると体内のNAD+の量を増やし、免疫老化と炎症加齢を抑制し、免疫機能を若い人のレベルに回復させることが可能になります。
さらに加齢に伴って慢性的に血中に増えてくる炎症性サイトカイン(IL-6やTNF-α) やC-反応性タンパク質(CRP)や補体分子などの炎症性タンパクを減少させることは老化を抑制し、体の若返りに有効です。
実際、COX-2阻害剤などの抗炎症剤が老化抑制に効果が期待できる可能性が報告されています。
100歳以上の超高齢まで生きるには、免疫機能が十分に良好に維持されることが極めて重要と思われます。この観点からもニコチンアミド・モノヌクレオチド(NMN)やニコチンアミド・リボシド(NR)をサプリメントとして補充する価値はあると思います。
○ NRやNMNについてはこちらへ:
| « 720)時を戻そ... | 722)オートフ... » |




