がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
697)ミトコンドリアを活性化するとCOVID-19による死亡を阻止できる?:ジクロロ酢酸とL-カルニチンとベザフィブラート

図:新型コロナウイルスのSARS-CoV-2(①)の感染によって肺炎(COVID-19)が発症する(②)。肺炎は炎症反応を引き起こして炎症性サイトカインやケモカインの産生を亢進し、炎症応答が制御不能になると過剰なサイトカイン産生によってサイトカイン・ストームを引き起こす(③)。さらに、活性酸素の産生が亢進して、細胞や組織の酸化傷害が引き起こされる(④)。サイトカイン・ストームや酸化傷害は肺組織にダメージを与え、血管内皮細胞の透過性亢進を引き起こして、急性肺損傷や急性呼吸窮迫症候群を引き起こし(⑤)、さらに悪化すると敗血症や多臓器不全を引き起こして死に至る(⑥)。このような病態では、多くの細胞のミトコンドリアがダメージを受けて機能障害を起こし(⑦)、ATP 産生が低下してエネルギー・クライシス(Energy crisis)に陥り、多臓器不全を促進する(⑧)。ジクロロ酢酸ジイソプロピルアミン、L-カルニチン、ベザフィブラート、メラトニンはミトコンドリアの機能障害とATP産生低下を阻止することによって多臓器不全への移行を阻止する可能性が報告されている。
697)ミトコンドリアを活性化するとCOVID-19による死亡を阻止できる?:ジクロロ酢酸とL-カルニチンとベザフィブラート
【肥満はCOVID-19の感染と重症化のリスクを高める】
米国ではCOVID-19の感染者と死亡が増えていますが、その理由として様々な要因が指摘されています。心疾患や呼吸器疾患など持病を持つ人が多いことや、衛生環境など多くのリスク要因が提示されています。肥満との関連も指摘されています。実際に、重症化した症例に肥満者が多いことが米国から報告されています。
アメリカ国民全体で18歳以上人口の肥満(BMIが30以上)の比率は33%で、これは日本の約10倍です。
感染症においては、栄養不良も栄養過多(肥満)も、重症化のリスクを高めます。
日本は、栄養状態が良いわりに肥満が少ないことが、COVID-19感染の軽減に有利に作用している可能性も指摘されています。
肥満がCOVID-19の感染を増やし、重症化症例を増やす事が指摘されています。
以下のような論文があります。
Influenza and obesity: its odd relationship and the lessons for COVID-19 pandemic(インフルエンザと肥満:その奇妙な関係とCOVID-19パンデミックの教訓)Acta Diabetol. 2020 Apr 5 : 1–6. doi: 10.1007/s00592-020-01522-8 [Epub ahead of print]
イタリアの研究者からの論文です。以下は論文の一部の日本語訳です。
イントロダクション:
COVID-19の流行は、インフルエンザ様ウイルス株(SARS-CoV-2)によって引き起こされる。 1918年のスペインインフルエンザのパンデミック以来、栄養失調(低栄養および高栄養の両方)はウイルス感染の予後不良に関連していることが知られている。1957〜1960年のアジアインフルエンザおよび1968年の香港インフルエンザは、肥満と糖尿病が死亡率の上昇と病気の長期化につながることを確認した。
2009年のインフルエンザAウイルスH1N1パンデミックの間、肥満は重症化のリスクの増加と入院および死亡の危険因子と関連していた。
先進国では、人口の約50%が過体重または肥満であり、有病率は毎年増加している。
アメリカでは、最近のレポートで、34%のアメリカ人がWHO基準に従って肥満(BMIが30以上)であることが示された。
なぜ肥満患者は痩せた被験者よりも臨床像が悪いのか?:
肥満および肥満糖尿病の患者は、軽度の慢性炎症状態を特徴とし、自然免疫および適応免疫応答のさまざまな段階で異常がある。
第一に、肥満者は炎症誘発性アディポカインのレプチンが慢性的に高く、抗炎症性アディポカインのアディポネクチンの濃度が低い。
基礎状態では、肥満患者は、TNF-α、MCP-1、IL-6のようないくつかの炎症誘発性サイトカインの濃度が高く、これらは主に内臓脂肪および皮下脂肪組織によって産生され、自然免疫を弱めている。 抗原が提示される時、肥満関連の慢性炎症により、マクロファージの活性化が低下し、サイトカインの産生が低下する。
抗原が提示された後のマクロファージの活性化の低下は、肥満者ではワクチン接種後の抗体の上昇が不十分であることと関連する。 このような状況は、肥満集団ではウイルスが抗ウイルス剤に対して耐性を獲得したり、ワクチンが効かない変異体の出現を引き起こす。 また、B細胞およびT細胞の応答は、肥満および肥満糖尿病の患者で低下し、ウイルスに感染しやすく、治癒が遅れる。
肥満者のもう一つの重要な問題は、身体の不活動である。身体活動自体の低下やインスリン抵抗性は、マクロファージの活性化や炎症誘発性サイトカイン産生の阻害など、免疫応答のいくつかの段階で微生物に対する免疫応答を低下させる。
なぜ肥満者は痩せた者よりも潜在的に伝染性が高いのか?:
3つの要因により、肥満の被験者は痩せ型よりも伝染性が高くなる。
まず、インフルエンザに感染した肥満患者は、痩せ型の被験者よりも長期間(最大104%長く)ウイルスを放出し、ウイルスが他の人に広がる可能性が高くなる。
第二に、肥満の微小環境は、新しいより毒性の強いウイルス株の出現を促進する。 これは主に、肥満した個人や動物がインターフェロンを産生する能力が低下しているためである。ウイルス複製を阻止するためのインターフェロン産生が遅延することは、より多くのウイルスRNA複製を可能にし、新規のより毒性の高いウイルス株の出現の可能性を増加させる。
第三に、ボディマス指数(BMI)は呼気中の感染性ウイルスと正の相関がある。 この事実は特に男性にとって重要であり、より高い換気量または異なる胸部構造がこの事実を説明するかもしれない。
肥満における過去のインフルエンザウイルス感染から学ぶべき教訓は何か?:
COVID-19の潜伏期間は、長くても14日間と考えられている。しかし、肥満の被験者ではウイルスの放出期間が長いという考えがあり、痩せた被験者に比べて、肥満者では隔離期間は2倍くらいに延長されるべきである。
特定のワクチンが利用可能になるまで、取ることのできる唯一の行動は、感染患者の隔離と免疫応答の増強である。
体重の減量だけでなく、免疫機能を迅速に改善するためには、食事と特に身体運動が重要である。実際に、ウイルス感染の罹患率と死亡率は、実質的な体重減少がなくても、定期的な運動で減少する可能性がある。
いくつかの研究は、定期的な身体運動が病原菌感染中のトル様受容体シグナル伝達経路を介して誘導されるサイトカイン産生のレベルを高め、病原体の侵入に対する宿主の抵抗性を高めることを示唆している。運動は抗酸化防御システムの強化と酸化ストレスの軽減という効果もある。
肥満マウスと非肥満マウスの両方において、運動がインフルエンザAウイルス感染に対する宿主免疫を改善することが示されている。
身体活動が感染の初期に免疫活性化(気管支肺胞洗浄液中のサイトカイン、ケモカイン、細胞浸潤)を増加させ、肥満マウスの免疫応答を「正常な表現型」に「回復」させることを示唆している。
運動はレプチン応答性、I型IFN応答性、筋肉のミトコンドリアのピルビン酸脱水素酵素複合体(PDC)活性化だけでなくエネルギーバランスにも影響を与え、さらに気管支肺胞洗浄液中の血清抗インフルエンザウイルス特異的IgG2c抗体とCD8 + T細胞の割合を増加させる。 これら全てが感染からの宿主保護に不可欠である。
要約すると、定期的な身体運動は、肥満者だけでなく全ての人における、インフルエンザウイルス感染やその他の代謝性疾患に対する宿主防御を改善するための基礎的方法として重要である。
インフルエンザを予防するための免疫調節療法はあるのか?:
薬を使わないで最も強力な免疫調節介入は運動である。適度な有酸素運動(ウォーキング、サイクリング、水泳、ジョギング)には抗炎症作用があり、炎症性サイトカイン(TNF-α、MCP-1、IL-6など)を減少させ、抗炎症性のサイトカインのIL-10を増加させる。
さらに、運動はホルモン環境を改善し、アディポネクチンを増やし、インスリン感受性を増加させ、インスリンとレプチンのレベルを低下させ、肥満患者のホルモン環境の変化を逆転させる。
定期的な運動がヒトの微生物抗原に対する免疫反応を高めることが示されてる。
興味深いのは、ポジティブな免疫調節が軽度から中程度の強度の運動でのみ達成できることである。対照的に、高強度または長時間の運動(マラソンなど)は、主に内因性コルチゾールの増加により、免疫応答を低下させることが知られている。
身体運動がその効果のほとんどを発揮する基本的な細胞メカニズムは、AMPキナーゼの活性化である。
結論:
肥満であることは、肥満者個人の感染および合併症のリスクを増加させるだけでなく、大きな肥満集団がより毒性の高いウイルス株の出現の可能性を増加させ、集団全体でのウイルス排出を延長し、インフルエンザパンデミックの全体的な死亡率を最終的に増加する可能性があることが示されている。
過去のインフルエンザの大流行からの証拠は、私たちの肥満および肥満糖尿病患者に対して以下を示唆している。
- 軽度のカロリー制限で体重を減らす。体重減少の明らかなプラスの効果に加えて、カロリー制限はAMPキナーゼを活性化し、運動の免疫調節効果を増強する。
- 2型糖尿病の薬物治療にメトホルミンとピオグリタゾン(禁忌でない場合)を含める。
- ポジティブな免疫調節を強化するために、軽度から中程度の運動を行う。
最後に、成人および青年の肥満患者における隔離期間の延長の必要性を示すエビデンスがある。
以前は脂肪組織は単なる脂肪を貯蔵する組織と思われていたのですが、最近の研究では、脂肪組織から様々な生理活性物質が産生され、糖や脂肪の代謝を調節する内分泌器官のような役割を持つことが明らかになっています。
脂肪細胞の働きは単に脂肪を蓄えるだけでなく、様々なアディポカイン(アディポサイトカイン)という生理活性のある蛋白質を分泌し、個体の恒常性維持や代謝の調節に大きく関わっています。アディポネクチンはアディポカインの一つで、肝臓や筋肉細胞の受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。
肥満になると、脂肪組織にマクロファージなどの炎症細胞が浸潤し、TNF-αやIL-6などの炎症性サイトカインの産生が増えます。これらの炎症性サイトカインは脂肪細胞からのアディポネクチンの産生を減少させます。
アディポネクチンは抗炎症作用があり、TNF-αやIL-6は炎症を増悪させ、酸化ストレスを高めます。
つまり、体脂肪の増加は体内で炎症性サイトカインの増加とアディポネクチンの産生低下を起こしています。したがって、感染症を引き起こすと、炎症性サイトカインの産生亢進が起こりやすいということです。(下図)

図:体脂肪の増加は体内でアディポネクチンの産生低下と炎症性サイトカインの増加を起こしている。
前述の論文は、肥満の多い集団はインフルエンザや新型コロナウイルスの感染が広がりやすく、重症化しやすいエビデンスが十分にあるということを言及しています。
肥満をすぐに解決できなければ、適度な運動や、AMP活性化キナーゼを活性化するメトホルミン服用の有効性を示唆しています。運動とメトホルミンは体内のATPを減少し、AMPを増加してAMP活性化プロテインキナーゼ(AMPK)を活性化します。このAMPKの活性化がウイルス感染に有効に作用するということです。
重症の感染症ではピルビン酸脱水素酵素キナーゼの活性が誘導され、ピルビン酸脱水素酵素の活性を阻害します。運動は筋肉のミトコンドリアのピルビン酸脱水素酵素を活性化します。
ピルビン酸脱水素酵素を活性化してミトコンドリアを活性化する方法としてジクロロ酢酸があります。
ジクロロ酢酸などを使ってミトコンドリアを活性化することは、運動と同様に新型コロナウイルスの感染や重症化抑制に役立つ可能性が示唆されています。
【サイトカインストームがCOVID-19の病状悪化に関連する】
新型コロナウイルス感染症(Coronavirus Disease 2019:COVID-19)から分離されたコロナウイルスはSARS-CoV-2(Severe Acute Respiratory Syndrome CoronaVirus 2)と命名されています。
SARS(Severe Acute Respiratory Syndrome)は日本語では「重症急性呼吸器症候群」と訳されています。つまり、重症の肺炎を引きおこすウイルスです。
SARS-CoV-2に感染しても8割くらいは軽い症状で推移して自然に治癒します。
しかし、2割くらいは肺炎を発症し、肺炎に進展した患者のさらに⼀部が、重症化して集中治療や⼈⼯呼吸を要する病状になります。
普通の風邪やインフルエンザでは肺炎などの⼊院を要する状態に⾄ることは⽐較的稀です。
⼊院を要するような肺炎を約2割という⾼い確率で合併するのが、新型コロナウイルス(SARS-CoV-2)感染症(COVID-19)の特徴です。
致死率は国や性別によって異なりますが、中国での致死率は2.3%と報告されています。3月12日時点でのWHOリポートによると、COVID-19の致死率は約3.7%と推定されています。しかし、致死率は次第に高くなっているという指摘もあります
WHO(世界保健機関)のテドロス事務局長は4月13日の記者会見で、新型コロナウイルス感染症(COVID-19)について「2009年の新型インフルエンザによるパンデミックより10倍も致命的だ」との認識を示しています。
SARS-CoV-2感染で死亡する場合は、肺と全身で重度の炎症反応が起こって、急性肺損傷、急性呼吸窮迫症候群、敗血症、多臓器不全が起こることが主な原因となっていることが明らかになっています。これは他のコロナウイルス(SARSやMERS)や新型インフルエンザでも重症例は同じです。
急性呼吸窮迫症候群(Acute Respiratory Distress Syndrome:ARDS)は、肺炎や敗血症などがきっかけとなって、重症の呼吸不全をきたす病気です。さまざまな原因によって肺の血管透過性(血液中の成分が血管を通り抜けること)が進行した結果、血液中の成分が肺胞腔内に移動して肺水腫を起こします。
このような病態は、サイトカイン・ストームが関与していると考えられています。
COVID-19症例の死亡の予測因子としてフェリチンやIL-6の上昇が確認されており、COVID-19患者の死亡が、ウイルスによって誘発された過剰炎症による可能性を示唆しています。
体内に細菌やウイルスが侵入すると、体に備わった免疫システムが、これらの病原菌を排除するために働きます。このとき、サイトカインやケモカインというタンパク質が免疫細胞や炎症細胞から産生され、免疫細胞が活性化され、病原菌を排除します。敵が排除されれば、免疫システムは自らオフになるように制御されています。
しかし、一部の人では、炎症反応や免疫応答が過剰に発現し、サイトカインが過剰に産生され、そうしたサイトカインが誤って肺や肝臓など複数の臓器を傷害し、急性呼吸窮迫症候群(ARDS)や多臓器不全を引き起こします。
このようにサイトカインが過剰に産生される状態がサイトカイン・ストーム(cytokine storm)です。ストーム(Storm)は嵐という意味です。

図:ウイルスは肺胞上皮細胞(①)や肺胞内のマクロファージ(②)に感染し、細胞内で増殖して数を増やし放出される(③)。感染した上皮細胞からサイトカインやケモカインが産生される(④)。マクロファージはT細胞にウイルス抗原を提示し(⑤)、活性化されたT細胞(⑥)や活性化したマクロファージ(⑦)からも炎症性サイトカインやケモカインが産生される。このような炎症応答が過剰に起こりサイトカイン産生抑制の制御が不能な状態になるとサイトカインストームが起こる(⑧)。サイトカインストームは、敗血症や急性呼吸窮迫症候群(ARDS)を引き起こす(⑨)。
サイトカインストームはあらゆる年齢の人を襲う可能性があります。
1918年のインフルエンザのパンデミック(スペイン風邪)や、もっと最近のSARSやMERS(中東呼吸器症候群: Middle East respiratory syndrome)や2009年の新型インフルエンザ(H1N1インフルエンザ)の流行の期間に健康な若者が亡くなったのは、サイトカインストームで説明できると言われています。
つまり、若くて強靭で、免疫力に自信があっても、COVID-19で死亡する可能性があることを理解しておくことが重要です。
急性呼吸窮迫症候群(ARDS)や多臓器不全は、究極的には細胞レベルのミトコンドリア呼吸の破綻によるエネルギー・クライシス(energy crisis)によって細胞死が起こるので、全ての細胞のミトコンドリアの酸化傷害を軽減し、ダメージから保護し、ミトコンドリア機能を高めることはARDSや多臓器不全の予防と軽減に有効性が期待できます。
その観点からミトコンドリアを酸化傷害から保護する作用が強いメラトニンの摂取は試してみる価値はあると思います(696話参照)。
ミトコンドリアの呼吸機能を高めことによってエネルギークライシス(Energy crisis)を避ける方法としてジクロロ酢酸ジイソプロピルアミン、L-カルニチン、ベザフィブラートという報告があります。この話も動物実験レベルのエビデンスですが、個人的には試してみる価値は十分にあると思っています。
【重症インフルエンザではミトコンドリア不全によるエネルギー・クライシスが発生する】
以下の論文は、徳島大学先端酵素学研究所の木戸博教授の研究グループからの報告です。
Energy Metabolic Disorder Is a Major Risk Factor in Severe Influenza Virus Infection: Proposals for New Therapeutic Options Based on Animal Model Experiments(エネルギー代謝障害は重度のインフルエンザウイルス感染の主要な危険因子:動物モデル実験に基づく新しい治療法の提案)Respir Investig. 2016 Sep;54(5):312-9.
【要旨】
重度のインフルエンザは、サイトカイン・ストームと多臓器不全を特徴とする。基礎疾患を持つインフルエンザ患者は、疾患の重症度が急速に進行する。
感染の進行段階における多臓器不全の根底にある主要なメカニズムは、特に潜在的な危険因子を持つ患者では、ミトコンドリアのエネルギー危機(energy crisis)である。
インフルエンザウイルス、サイトカイン、ウイルス増殖のためのヘマグルチニン・プロセシング・プロテアーゼ(hemagglutinin processing protease)としての細胞トリプシンのようなインフルエンザ感染の重症度を決定する因子の関係、ミトコンドリアにおける代謝中間体の蓄積およびATP産生低下は、「インフルエンザウイルス-サイトカイン-トリプシン」サイクルと呼ばれる。これは感染の初期段階で発生し、感染の中期から後期の「代謝障害-サイトカイン」サイクルと相互に関連している。
動物モデルを使用した実験は、これらの2つのサイクル間の複雑な関係を明らかにしている。
初期段階で機能するノイラミニダーゼ阻害剤による抗ウイルス治療ではなく、感染後期のATP危機と多臓器不全を対象とする新しい治療方法が提案されている。
これらの治療法には、
(i)感染誘発性のピルビン酸脱水素酵素キナーゼ4活性を阻害するジクロロ酢酸ジイソプロピルアミン(diisopropylamine dichloroacetate)によるミトコンドリアでのグルコース酸化の回復、
(ii)ミトコンドリアでの長鎖脂肪酸酸化を回復させるL-カルニチンとペルオキシソーム増殖活性化受容体-β/δの活性化剤であるベザフィブラートの使用がある。ペルオキシソーム増殖活性化受容体-β/δはカルニチンパルミトイルトランスフェラーゼII(carnitine palmitoyltransferase II)の転写を亢進するので、カルニチンパルミトイルトランスフェラーゼIIの熱不安定性で半減期の短い変異体を有するインフルエンザ関連脳症の患者に特に効果的である。
インフルエンザの場合はノイラミニダーゼ阻害剤で感染の拡散を防ぐことができますので、感染初期の段階で進行を阻止できるので、この点は新型コロナウイルスとは異なります。
しかし、重症化した場合は、インフルエンザも新型コロナウイルスも、基本はサイトカインストームによる多臓器の障害で、そのベースにはミトコンドリア障害によるエネルギー・クライシスが存在します。
このような病態には、ミトコンドリアでの酸素呼吸を活性化するジクロロ酢酸ジイソプロピルアミンや、脂肪酸の代謝(酸化)を促進するサプリメントのL-カルニチンや高脂血症治療薬のベザフィブラートが有効という報告です。
このメカニズムの詳細は後で解説します。
以下の論文も徳島大学先端酵素学研究所の木戸博教授の研究グループからの報告です。第一三共研究所(R&D Department, Daiichi Sankyo Healthcare Co., Ltd., Tokyo, Japan)の研究者も共著になっています。
Diisopropylamine Dichloroacetate, a Novel Pyruvate Dehydrogenase Kinase 4 Inhibitor, as a Potential Therapeutic Agent for Metabolic Disorders and Multiorgan Failure in Severe Influenza(重症インフルエンザにおける代謝異常と多臓器不全の治療薬として可能性がある新規のピルビン酸脱水素酵素キナーゼ4阻害剤のジクロロ酢酸ジイソプロピルアミン)PLoS One. 2014; 9(5): e98032.
【要旨】
重度のインフルエンザは、サイトカイン・ストームと代謝エネルギー障害および血管透過性亢進を伴う多臓器不全を特徴とする。
エネルギー恒常性の調節において、ピルビン酸脱水素酵素(PDH)複合体は、ピルビン酸の酸化的脱炭酸を触媒し、解糖系とトリカルボン酸回路(TCA回路)および脂肪酸合成系をリンクさせる働きを有し、その活性はエネルギー恒常性と関連する。
本研究では、重症インフルエンザのマウスの実験系で、新しいPDHキナーゼ4(PDK4)阻害剤であるジクロロ酢酸ジイソプロピルアミン(diisopropylamine dichloroacetate :DADA)の効果を検討した。
マウスにインフルエンザA PR / 8/34(H1N1)ウイルスを感染させると、PDH活性とATPレベルが著しく低下し、骨格筋、心臓、肝臓、肺でPDK4が選択的に上昇した。
感染直後から12時間間隔で14日間DADA(ジクロロ酢酸ジイソプロピルアミン)を経口投与すると、さまざまな臓器のPDH活性とATPレベルが大幅に回復し、血中のグルコースと脂質代謝の障害が改善された。
さらに、サイトカインストームが抑制され、トリプシンの発現亢進とウイルスの複製が抑制され、生存率が著しく改善した。
これらの結果は、ジクロロ酢酸ジイソプロピルアミンがPDK4(ピルビン酸脱水素酵素キナーゼ)を阻害することにより、インフルエンザウイルス-サイトカイン-トリプシンサイクルと密接に関連している宿主の代謝障害-サイトカインサイクルを効果的に抑制し、重度のインフルエンザにおける多臓器不全の予防をもたらすことを示している。
ジクロロ酢酸ジイソプロピルアミン(diisopropylamine dichloroacetate)はビタミン様物質として知られ、食品ではゴマやビール酵母などによく含まれるパンガミン酸の構成成分です。
一般用医薬品では、肝臓の働きをサポートし、疲れを改善する効果を期待して、肉体疲労時の滋養強壮・栄養補給ドリンク剤などに配合されています。
リゲイン、新グロモント、ヘパリーゼ、リポビタンDなど多くのドリンク剤に配合されています。
医薬品としてはリバオール(Liverall)があります。50年以上前から慢性肝疾患の治療薬として使用されています。
リバオールは第一三共が製造販売していました(現在は製造販売権をアルフレッサファーマに譲渡されています)。20mg1錠の薬価が5.9円と極めて安価な薬です。健康ドリンクのリゲインなどにはリバオールとビタミンB1が入っています。この組合せはミトコンドリアの酸素呼吸を活性化するので体力を高める効果があることが医学的に納得できます。

図:ジクロロ酢酸ジイソプロピルアミンは多くのドリンク剤に配合されている。医薬品としてはリバオールがある。
【グルコースと脂肪酸が分解されてミトコンドリアでアセチルCoAが作られる】
「ミトコンドリア障害によるエネルギークライシスの治療に、ミトコンドリアでの酸素呼吸を活性化するジクロロ酢酸ジイソプロピルアミンや、脂肪酸の代謝(酸化)を促進するL-カルニチンやベザフィブラートが有効」という木戸博教授らの論文を理解するためには、ミトコンドリアにおけるアセチルCoAの役割と代謝を理解する必要があります。
コエンザイムA(CoA)は補酵素Aとも呼ばれ、生物にとって極めて重要な補酵素で、様々な化合物を結合することによって糖質や脂質やアミノ酸などの代謝反応に関わります。
補酵素Aはパントテン酸とアデノシン二リン酸、および 2-メルカプトエチルアミンから構成されており、末端にあるチオール基に様々な化合物のアシル基がチオエステル結合することによってクエン酸回路やβ酸化などの代謝反応に関わります。例えばアセチル基が結合したものがアセチルCoAです。

図:コエンザイムA(Coenzyme A; CoA)は補酵素Aとも言う。CoAにアセチル基が結合したものがアセチルCoAになる。
コエンザイムAは1945年にフリッツ・アルベルト・リップマンによって発見されています。リップマンはTCA回路を発見したハンス・クレブスと一緒に1953年にノーベル賞(生理学・医学賞)を受賞しています。
グルコース代謝の場合は、グルコース(ブドウ糖)が解糖系で作られたピルビン酸がミトコンドリア内に取り込まれてピルビン酸脱水素酵素複合体の作用で二酸化炭素(CO2)が除去されてアセチル基になり、このアセチル基にコエンザイムA(CoA)が結合してアセチルCoAに変換され、アセチルCoAはクエン酸に変換されてTCA回路と電子伝達系によってさらにATPの産生が行われます。
脂肪酸はミトコンドリアにおけるβ酸化によってアセチルCoAを産生し、同様にTCA回路と電子伝達系によってさらにATPの産生が行われます。
つまり、ミトコンドリアでのエネルギー産生では、グルコース(ブドウ糖)と脂肪酸はアセチルCoAを作るところでリンクします。(下図)

図:グルコースは解糖系でピルビン酸に変換され(①)、ピルビン酸はミトコンドリアに入ってピルビン酸脱水素酵素によって二酸化炭素(CO2)が除去されてアセチル基になり、このアセチル基にコエンザイムA(CoA)が結合してアセチルCoAに変換される(②)。脂肪酸はβ酸化によってアセチルCoAを産生する(③)。アセチルCoAとオキサロ酢酸からクエン酸が生成される反応がTCA回路の最初のステップになる(④)。TCA(Tricarboxylic acid)というのは3つのカルボキシル酸基(COOH)を持つクエン酸のことで、TCA回路はクエン酸回路とも言う。
脂肪酸合成が必要なときは、TCA回路で産生されたクエン酸の一部が細胞質に移行して、ATPクエン酸リアーゼによってアセチルCoAに変換され、脂肪酸合成に使われます。アセチルCoAは細胞膜を通過できないので、ミトコンドリアでできたクエン酸が細胞質に移行してアセチルCoAの合成に使われます。
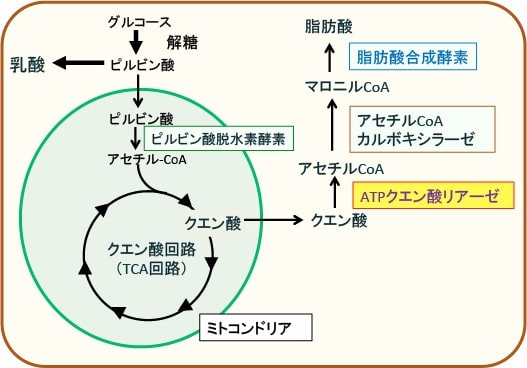
図:TCA回路で産生されたクエン酸の一部は細胞質でATPクエン酸リアーゼによってアセチルCoAに変換され、さらにマロニルCoAから脂肪酸が合成される。
細胞内ではエネルギー産生と物質合成とシグナル伝達系は密接にリンクしています。その中心となっているのがアセチルCoAです。
すなわち、糖や脂肪やタンパク質が分解(異化)されてアセチルCoAになり、アセチルCoAはミトコンドリアでTCA回路と電子伝達系でエネルギー(ATP)を産生します。
このATPのエネルギーを使って、アセチルCoAは3-ヒドロキシ-3-メチルグルタリルCoA (HMG-CoA)からメバロン酸を経由してコレステロールを合成します。また、アセチルCoAはアセチルCoAカルボキシラーゼ(ACC)によってマロニルCoAとなり、脂肪酸合成酵素によって脂肪酸が合成されます。
さらに、アセチルCoAはタンパク質アセチル化のアセチル基のドナーとなり、タンパク質機能の制御に関わっています。
このように、アセチルCoAはエネルギー産生(異化)と物質合成(同化)とシグナル伝達のハブとなっているのです。

図:食事から摂取した糖と脂肪とタンパク質は、それぞれグルコース、脂肪酸、アミノ酸に分解されて体内に吸収され、細胞内で分解(異化)されてアセチルCoAになる(①)。アセチルCoAから、3-ヒドロキシ-3-メチルグルタリルCoA (HMG-CoA)とメバロン酸を経由してコレステロールが合成される(②)。アセチルCoAはマロニルCoAを経由して脂肪酸が合成される(③)。アセチルCoAはミトコンドリアでTCA回路と電子伝達系でエネルギー(ATP)を産生する(④)。さらに、アセチルCoAはタンパク質のアセチル化のアセチル基のドナーとなり、タンパク質機能の変化によってシグナル伝達系の制御にも関わっている(⑤)。このように、アセチルCoAはエネルギー産生(異化)と物質合成(同化)とシグナル伝達系のリンクの中心となっている。
したがって、ミトコンドリアの機能が低下し、アセチルCoAの産生が低下すると、細胞はエネルギー危機状態になって、死滅します。
【サイトカインストームはピルビン酸脱水素酵素活性とATPレベルの低下を引き起こす】
前述の木戸教授らの実験では、インフルエンザウイルスに感染したマウスでは、ピルビン酸脱水素酵素の活性とATPレベルの著しい低下があり、骨格筋、心臓、肝臓、肺でのピルビン酸脱水素酵素キナーゼ4(PDK4)の選択的な発現亢進が認められています。
COVID-19の場合も、重症化してサイトカインストームが起こっている状況では、多くの臓器で同様にPDK4の発現が亢進していると考えられます。(ただし、確認はされていませんので、あくまで推測です。)
ピルビン酸脱水素酵素キナーゼ(pyruvate dehydrogenase kinase; PDK)はピルビン酸脱水素酵素をリン酸化して不活性化する酵素です。
ピルビン酸脱水素酵素キナーゼにはPDK1〜4の4種類のアイソフォームが存在します。
PDK1は低酸素で活性化されます。PDK2はPDHの産物であるアセチルCoAとNADHで活性化され、ADPとピリビン酸で阻害されます。
PDK3はATPで活性化されます。ATPが過剰に産生されるとフィードバックでPDK3を活性化してミトコンドリアでのATP産生を阻害することになります。
PDK4はホルモンやレチノイン酸や副腎皮質ホルモンで転写が活性化され、インスリンで抑制されます。
HIF-1(低酸素誘導性因子-1)で誘導されるのはPDK1とPDK3です。
がんの代替療法で使用されるジクロロ酢酸ナトリウムはPDK1を阻害します。がん細胞のミトコンドリアを活性化する目的では通常はジクロロ酢酸ナトリウムを使いますが。最近はPDK4もがん治療のターゲットとして注目されています。例えば、PDK4阻害作用のあるリバオールが乳がん治療に有効という報告などがあります。(549話参照)
ジクロロ酢酸ジイソプロピルアミンがPDK4の選択的阻害作用があり、この作用によってミトコンドリアの代謝を活性化して、エネルギー危機を阻止することによって多臓器不全を防ぐというメカニズムです(下図参照)。

図:細胞内に入ったグルコースは解糖系でピルビン酸に変換され(①)、ミトコンドリアに入ってピルビン酸脱水素酵素でアセチル-CoAに変換される(②)。アセチルCoAはクエン酸回路で代謝され(③)、呼吸酵素複合体(呼吸鎖)における酸化的リン酸化(④)でATPが産生される(⑤)。重症インフルエンザでは骨格筋、心臓、肝臓、肺でのピルビン酸脱水素酵素キナーゼ4(PDK4)の選択的な発現亢進が認められている(⑥)。PDK4の発現亢進はピルビン酸脱水素酵素を阻害してアセチルCoAの産生を阻害し、ATP産生を低下する。ジクロロ酢酸ジイソプロピルアミンはPDK4を阻害することによってミトコンドリアにおけるATP産生を維持する(⑦)。
【L-カルニチンを補えば、脂肪酸酸化を高めることができる】
L-カルニチンは生体の脂質代謝に関与するビタミン様物質です。L-カルニチンは脂肪酸と結合し、脂肪酸をミトコンドリアの内部に運搬する役割を担っています。
脂肪酸を燃焼してエネルギーを産生する際には、脂肪酸を燃焼の場であるミトコンドリアに運ばなければなりません。中鎖脂肪酸(炭素の数が8~12個)の場合は直接ミトコンドリアに入ることができますが、長鎖脂肪酸(炭素数が13以上)の場合は、L-カルニチンが結合しないとミトコンドリアの中に入ることができません(下図)。

図:脂肪酸はミトコンドリアでβ酸化によって分解されてアセチルCoAが作られ、アセチルCoAはTCA回路で代謝されるかケトン体産生に使われる。炭素数12以下の中鎖脂肪酸はカルニチンが無くてもミトコンドリアに入ることができるが、炭素数が13以上の長鎖脂肪酸はミトコンドリアに入るのにカルニチンの助けが必要。
L-カルニチンはヒトの体内で合成されます。カルニチンの合成には2つの必須アミノ酸(リジン、メチオニン)、3つのビタミン(ビタミンC、ナイアシン、ビタミンB6)、還元型鉄イオンが必要で、これらの栄養素の一つでも不足すればカルニチンは不足することになります。体内のL-カルニチンのうち約1割はアセチル-L-カルニチンの状態で存在しています。

L-カルニチンの合成は肝臓、腎臓、脳でのみ起こります。心臓と骨格筋のように、脂肪酸の酸化によって主なエネルギーを得ている組織は、カルニチンを合成できないため、血液中のカルニチンを取り込んで利用しています。
食事性カルニチンの主な供給源は肉類と乳製品であり、穀類、果物、野菜にはほとんど含まれていません。体内で合成されますが、がんの治療で体力が消耗したり、栄要素が不足するとL-カルニチンの欠乏がおこり、細胞内でのエネルギー産生が低下します。抗がん剤治療中には、腸粘膜の障害で食事性カルニチンの吸収が低下し、肝臓や腎臓機能のダメージで体内での合成が低下し、尿中の排泄も増えることが指摘されています。
がんの代替医療では菜食主義を徹底する治療法もありますが、肉や乳製品を完全に排除する食事はカルニチンの不足を引き起こしやすくします。
L-カルニチンは体重減少のサプリメントとして人気がありますが、それは脂肪酸酸化を高めることができるためです。以下のような報告があります。
健常成人における長鎖脂肪酸の酸化に対するL-カルニチンのサプリメントによる補充の効果(Effects of oral L-carnitine supplementation on in vivo long-chain fatty acid oxidation in healthy adults.)Metabolism 51 (11): 1389-91, 2002
【要旨】
L-カルニチンの基本的な作用機序に関する文献は多数あるが、健常な人間に正常な状態においてL-カルニチンをサプリメントとして経口投与したとき、脂肪酸の酸化に対する効果に関しては不明な点も多い。
カルニチン欠乏のある時には、L-カルニチンの補充が長鎖脂肪酸の代謝を正常化させることは良く知られている。
しかしながら、脂肪酸代謝に異常が無い健常人にL-カルニチンを投与した場合に、長鎖脂肪酸の代謝にどのような影響を及ぼすのかに関しては、検討されていない。
そこで、この研究では、L-カルニチンをサプリメントで投与(1日1gづつを3回、10日間服用)し、投与前と投与後で、同位元素(13C)で標識したパルミチン酸の酸化を測定した。その結果、L-カルニチンを投与すると、13CO2の呼気への排泄が著明に増加した。
この研究結果より、カルニチン欠乏や脂肪酸代謝異常が無い健常人においても、L-カルニチンをサプリメントで補うことによって、長鎖脂肪酸の酸化を高めることが明らかになった。
前述のように、炭素数が14以上の長鎖脂肪酸は、小腸で吸収されたあと、カイロミクロンとなってリンパ管へ入り、胸管から血液に入って、主に脂肪組織や筋肉組織に運ばれ、多くは貯蔵されます。エネルギーが必要になったとき、脂肪酸に分解され、ミトコンドリアに入って代謝されますが、このときL-カルニチンが必要です。つまり、L-カルニチンが無いと長鎖脂肪酸はミトコンドリアには入れないのです。
健常な人では、体内にカルニチンが十分あるので、L-カルニチンをサプリメントで補充しても、意味が無い可能性もあります。しかし、この研究では、カルニチン欠乏の無い健常な人に対しても、L-カルニチンをサプリメントで補充すれば、長鎖脂肪酸の代謝を高めることができることが示されています。
長鎖脂肪酸の代謝を促進するためにL-カルニチンをサプリメントで1日1〜3グラム程度補充する意味はあるようです。
L-カルニチンがカルニチン・パルミトイル基転移酵素の発現を亢進する作用が報告されています。カルニチンパルミトイルトランスフェラーゼは長鎖脂肪酸のアシル基をカルニチンに転移するタンパク質で、この働きにより長鎖脂肪酸はマトリックスへ移行することが可能となります。以下のような報告があります。
L-carnitine ameliorates cancer cachexia in mice by regulating the expression and activity of carnitine palmityl transferase.(L-カルニチンはカルニチン・パルミトイル基転移酵素(の発現と活性を制御することによってマウスのがん性悪液質を緩和する)Cancer Biol Ther. 2011 Jul 15;12(2):125-30.
【要旨】
がん性悪液質は脂肪組織と筋肉組織の減少を伴う進行性の体重減少によって特徴づけられる。主に肝臓におけるカルニチン・パルミトイル基転移酵素IとIIの活性の低下による脂肪酸酸化の障害が、がん性悪液質の発生に関与する重要な要因である。
最近の研究によってがん性悪液質の治療にL-カルニチンの投与の有効性が示されているが、その作用機序は不明である。
今回の研究では、がん性悪液質を起こしたマウスの肝臓におけるカルニチン・パルミトイル基転移酵素IとIIの活性と発現に対するL-カルニチンの作用を検討することを目的とした。
マウスに大腸がん細胞のcolon-26腺がん細胞を移植すると、食餌摂取量の低下と腓腹筋の筋肉量の減少と副睾丸の脂肪量の減少によって特徴づけられるがん性悪液質が発生した。さらに、がん性悪液質マウスでは、肝臓のカルニチン・パルミトイル基転移酵素IとIIのmRNA量と活性と血清中のフリーのカルニチンとアセチル・カルニチンの量は顕著に低下し、炎症性サイトカインの腫瘍壊死因子アルファ(TNF-α)とインターロイキン-6(IL-6)の血清濃度は上昇した。
がん性悪液質を呈したマウスに1日に18mg/kgのL-カルニチンを投与すると、食餌摂取量と腓腹筋の筋肉量と副睾丸の脂肪組織の量が増加し、血中のグルコースとアルブミン量が増加し、総コレステロール量は減少した。しかし、がん組織の増殖には影響しなかった。
がん性悪液質のマウスにL-カルニチンと投与すると、肝臓におけるカルニチン・パルミトイル基転移酵素IとIIのmRNA量と活性が上昇し、血清TNF-αとIL-6の量が減少した。これらの結果から、L-カルニチンは、血清TNF-αとIL-6量と、肝臓におけるカルニチン・パルミトイル基転移酵素IとIIの発現と活性に作用することによって、がん性悪液質を緩和することが示された。
L-カルニチンによって脂肪酸の分解を亢進することはミトコンドリアの活性を高めることができます。アセチル-L-カルニチンもミトコンドリア機能を高めます。ミトコンドリア活性化作用はL-カルニチンより強いと思います。(557話参照)
【高脂血症治療薬ベザフィブラートはミトコンドリアを増やす】
ミトコンドリアが増えることを「Mitochondrial Biogenesis」と言います。「ミトコンドリア新生」や「ミトコンドリア発生」と訳されています。細胞内でミトコンドリアが新しく発生することです。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferative activated receptor gamma coactivator-1α)です。日本訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PPARのリガンド(ベザフィブラート、ピオグリタゾンなど)やメトホルミンやカロリー制限やケトン体や運動はこのPGC-1αを活性化する作用があります。
ベザフィブラートはペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptor:PPAR)の汎アゴニスト(pan-agonist)です。高脂血症治療薬として使われています。安価です。
PPARにはアルファ型(PPARα)、ガンマ型(PPARγ)、デルタ型(PPARδ)の3種類のサブタイプがありますが、ベザフィブラートはこの3種類のPPARを活性化する作用があります。ベザフィブラートがミトコンドリアを増やして機能を高め、その結果、細胞のがん化や悪性進展を阻止することが報告されています。ベザフィブラートによるミトコンドリア活性化作用は486話で解説しています。
このベザフィブラートによるミトコンドリアの活性化やカルニチン・パルミトイル基転移酵素の発現亢進が、重症インフルエンザによるエネルギークライシスの改善に役立つ可能性を指摘したのが、前述の木戸博教授らの論文です。
つまり、ジクロロ酢酸ジイソプロピルアミンやL-カルニチンやベザフィブラートはミトコンドリア障害によるエネルギークライシスを阻止して、サイトカインストームによる多臓器不全を阻止するというメカニズムです。
新型コロナウイルス感染症(COVID-19)に対しては「命を救うための対策」が重要であり、そのためには他人との接触を避け、手洗いやマスクなどの感染予防の対策を実践することが大切です。
さらに、感染したときに重症化しないような対策も必要です。
この「重症化の予防」は医療の対策には入っておらず、個人で実践するレベルの対策です。つまり、栄養状態を良くし、抵抗力や免疫力を高め、適度に運動し、睡眠を十分にとり、ストレスを避ける、タバコは吸わないなどの生活習慣の改善が主です。
さらに、漢方薬やサプリメントや医薬品を使って、積極的に抵抗力や免疫力を高めることは自己防衛においてプラスになるかもしれませんが、臨床的有効性について特にエビデンスがあるわけではありません。重症化を避けるための個人の自己判断と自己責任のレベルでの対策です。
前回(696話)のメラトニンの話も、動物実験までのエビデンスです。動物実験レベルでは、かなり有効ですが、人間での臨床試験の結果が出るまでは、人間で有効かどうかは不明です。
しかし、サプリメントを使った臨床試験が行われる可能性は低いので、自己判断と自己責任に基づいて判断するしかありません。
急性呼吸窮迫症候群(ARDS)や多臓器不全は、究極的には細胞レベルのミトコンドリア呼吸の破綻によるエネルギークライシス(energy crisis)によって細胞死が起こるので、全ての細胞のミトコンドリアの酸化傷害を軽減し、ダメージから保護し、ミトコンドリア機能を高めることはARDSや多臓器不全の予防と軽減に有効性が期待でき、その観点からメラトニンの摂取は試してみる価値はあると思います。
駆虫薬のイベルメクチンの新型コロナウイルスの複製阻害作用(965話)も、まだ培養細胞レベルの研究結果しか出ていません。したがって、イベルメクチンの使用も自己責任です。
しかし、有効な抗ウイルス剤やワクチンが使用できる前にコロナウイルス感染で死なないためには、副作用がなければダメ元で試してみるのも選択の一つです。
今回紹介した徳島大学先端酵素学研究所の木戸博教授の研究グループの報告は、ミトコンドリアの呼吸機能を高めことによってエネルギークライシス(Energy crisis)を避ける方法としてジクロロ酢酸ジイソプロピルアミン、L-カルニチン、ベザフィブラートが役立つ可能性の話です。この話も動物実験レベルのエビデンスですが、個人的には試してみる価値は十分にあると思っています。リバオールとL-カルニチンは副作用がほとんどなく、健康作用があるので、ミトコンドリア機能を良くする目的でCOVID-19の流行が収束するまで服用しても良いかもしれません。しかし、これも自己責任のレベルです。ただ、多くの人がサプリメントを服用している理由がこのレベルの理由です。気休めのレベルのものも多いと思います。
ミトコンドリアを活性化する方法は582話でも解説しています。
運動やサプリメント(メラトニン、L-カルニチン、アセチルーLーカルニチン)や医薬品(ジクロロ酢酸ジイソプロピルアミン)や食事からの栄養摂取や肥満を防ぐなどで、ミトコンドリアの機能を日頃から良くしておくことは、新型コロナウイルス感染症の発症や重症化の予防に役立つと思います。
私自身は、以前から服用していた漢方薬やメラトニンなどに加えて、最近はリバオールとアセチルーLーカルニチンも追加しています。効果があるかどうかは別にして、重症化しやすいリスク因子(65歳以上と高血圧)があるので、命を守るための自分なりの自己防衛策(自己満足?)です。
| « 696)メラトニ... | 698)水素ガス... » |



