がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
677)ミトコンドリア・リボソームをターゲットにしたがん治療:ドキシサイクリンとアジスロマイシン

図:リボソームはmRNAの遺伝情報を読み取って(①)、アミノ酸を結合してタンパク質(ポリペプチド鎖)を合成する(②)。リボソームは大小2種類のサブユニットから構成され、真核生物のリボソームは40Sサブユニットと60Sサブユニットから構成される(③)。細菌は少し小さく、30Sサブユニットと50Sサブユニットの2つから構成される(④)。ミトコンドリアは細菌由来の細胞内小器官で、ミトコンドリア固有のリボソームは28Sと39Sの2つのサブユニットから構成される(⑤)。抗生物質のドキシサイクリンは細菌のリボソームの30Sサブユニットに結合して、ポリペプチド鎖へのアミノ酸の結合を阻害して、細菌のタンパク合成を阻害する機序で抗菌作用を発揮する(⑥)。アジスロマイシンは50Sリボソームに作用してタンパク質合成を阻害する(⑦)。ミトコンドリアは細菌に由来するため、細菌のリボソームの30Sサブユニットと50Sサブユニットは、それぞれミトコンドリア・リボソームの28Sサブユニットと39Sサブユニットと相同性がある(⑧)。したがって、ドキシサイクリンとアジスロマイシンはミトコンドリアのタンパク質合成を阻害する作用もあり、この作用によってミトコンドリア機能やミトコンドリア新生を阻害する。
677)ミトコンドリア・リボソームをターゲットにしたがん治療:ドキシサイクリンとアジスロマイシン
【タンパク質はリボソームで作られる】
タンパク質を作る遺伝子情報はDNAに並ぶ塩基配列によって保存されています。(下図)

図:DNAは2本のポリヌクレオチド鎖がより合わさった二重らせん構造になっており、そこには4種類の塩基という物質(アデニン、グアニン、シトシン、チミン)が、文字列のように延々と一列に並んでおり、遺伝情報を保存している。2本のポリヌクレオチド鎖はアデニン(Adenine)とチミン(Thymine)、グアニン(Guanine)とシトシン(Cytosine)が水素結合を介して結合して二重らせん構造を形成している。
細胞核内のDNAが転写されてメッセンジャーRNA(mRNA)となり、リボソームで20種類のアミノ酸からなるタンパク質へと翻訳されます。
タンパク質はアミノ酸の複数結合した直鎖状の分子です。リボソームで作られたタンパク質は、小胞体で特定の立体構造に折り畳まれて、機能を発揮するようになります。

図:DNA上の遺伝子からRNAポリメラーゼや転写因子の働きによってmRNA(メッセンジャーRNA)が生成される過程を転写という(①)。mRNAの情報に基づき、アミノ酸が順番に結合してタンパク質が生成されることを翻訳といい、これはリボソームで行われる(②)。翻訳後のポリペプチド鎖は小胞体で3次元的に折り畳まれて、機能を発揮する(③)。
リボソームはタンパク質を作る細胞構造です。タンパク質は、多くの細胞機能に必要です。リボソームは、細胞質内に浮遊しているか、小胞体に付着しています。
細胞内に自由に浮遊しているリボソームは細胞内で利用されるタンパク質を生成しています。小胞体に付着しているリボソームは細胞内または細胞外で使用されるタンパク質を合成しています。リボソームが付着した小胞体を粗面小胞体といいます。
リボソームで合成された膜タンパク質や分泌タンパク質は、小胞体やゴルジ体で「タンパク質の折り畳み」や、糖鎖の結合などたんぱく質の翻訳後修飾を受けて正しい機能を発揮できるタンパク質として完成します。

図:リボソームで作られたタンパク質は、小胞体で修飾を受けて高次構造(折り畳み)を形成し、さらにゴルジ体で糖鎖の結合などによって成熟タンパク質となって細胞外へ搬出、あるいは細胞内で利用される。
リボソームは、メッセンジャーRNA(mRNA)、トランスファーRNA(tRNA)、および複数の翻訳因子と協調してタンパク質合成のプロセスを調整する非常に複雑な高分子構造です。
大きなサブユニットと小さいサブユニットの2つのサブユニットが結合した構造です。
大サブユニットはペプチジルトランスフェラーゼ反応の触媒作用に関与し、小サブユニットはmRNAの結合と解読のプラットフォームを提供します。
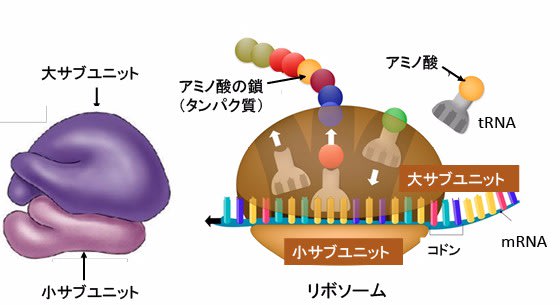
図:リボソームは大きなサブユニットと小さいサブユニットが結合した構造をしている。リボソーム内では、mRNAに転写された遺伝情報をトランスファーRNA(tRNA)を用いて解読し、対応するアミノ酸を連結することで、タンパク質を合成する。mRNAのコドン(3文字の塩基配列)が一つのアミノ酸をコードする。
タンパク質の大きさは分子量で比較します。
一方、リボソームのような複雑で大きい細胞内分子の大きさは「沈降係数」で比較します。
沈降係数(S値)とは、単位加速度あたりの沈降速度で、超遠心機を開発したスベドベリ(Svedverg)にちなむ単位です。
より大きな粒子はより速く沈降し、より大きな沈降係数を有します。
しかしながら、沈降係数は相加的ではなく、粒子の質量あるいは体積にのみ依存するわけではなく、2つの粒子が互いに結合している時は表面積の損失が必然的に起こるために、結合粒子の沈降係数は、個々の粒子の個別に測定されたスヴェドベリ値の和にはなりません。通常、個々の粒子のS値の和より小さくなります。
リボソームはほとんどの場合それらの沈降係数によって同定されます。例えば、細菌由来の70Sリボソームは実際に70スヴェドベリの沈降係数を有しています。一方、70Sリボソームは50Sサブユニットと30Sとサブユニットから構成されており、サブユニットのスヴェドベリ値の合算よりも小さくなります。
私たち人類やその他の動物、植物、菌類などの真核細胞にあるリボソームは細菌や古細菌のものより大きく、「80Sリボソーム」と呼ばれています。こちらは、小さい方の40Sサブユニットと大きい方の60Sサブユニットで構成されています。
私たちの細胞にあるミトコンドリア(mitochondria)は細胞本体が持つものより小さい55Sリボソームを持っていて、細胞質にあるものとは別々に作られます。

図:リボソームは大小2種類のサブユニットから構成され、真核生物は40Sサブユニットと60Sサブユニットから構成される80Sリボソームを持っている。細菌(原核生物)は少し小さく、30Sサブユニットと50Sサブユニットの2つから構成される70S リボソームを持っている。真核生物のミトコンドリアは細菌由来の細胞内小器官で、ミトコンドリア固有のリボソームは28Sと39Sの2つのサブユニットから構成される55S リボソームを持ってる。
細菌とヒトなどの真核生物ではリボソームの構造が異なるため、細菌のリボソームにのみ特異的な阻害剤は、病原細菌に対する毒性は高くヒトに対する毒性が低い抗生物質になります。
そのような抗生物質としてアミノグリコシド系化合物(ストレプトマイシン、ネオマイシン、カナマイシン)やテトラサイクリン、クロラムフェニコール、マクロライド系化合物などがあります。
このような抗生物質はミトコンドリアの働きを阻害する目的で使用することもできます。
【一人の個体の体内には数千兆個のミトコンドリアが存在する】
ミトコンドリアは赤血球以外の全ての細胞に存在する細胞小器官です。1個の細胞当たり平均で300~400個のミトコンドリアが存在します。肝臓や腎臓や筋肉や脳など代謝が活発な細胞には数千個のミトコンドリアが存在し、細胞質の40%程度を占めています。全部で体重の約10%を占めると言われています。
一般的に人体の細胞の数は約60兆個と言われていますが、最近の論文では約37兆個と報告されています。(Annals of Human Biology, 40(6): 463-471, 2013年)
しかし、そのうちの20兆個ほどの細胞は赤血球です。したがって、10〜20兆個程度の細胞が1個の細胞当たり平均で300〜400個のミトコンドリアを持つとすると、体全体で5000兆個から1京個(1兆の1万倍)のレベルのミトコンドリアが存在することになります。つまり、一人の個体の体内には数千兆個のミトコンドリアが存在することになります。

図:ミトコンドリアは、直径1ミクロン以下で、長さは1〜4ミクロン程度で、俵型やいも虫様の立体構造をしており、細胞内で酸素を使ってエネルギー(ATP)を産生している。肝細胞のような代謝が活発な細胞では細胞1個当たり数千個のミトコンドリアが存在し、細胞質の40%程度を占めている。
【ミトコンドリアは元は細菌だった】
真核細胞のミトコンドリアは好気性細菌のαプロテオバクテリアが原始真核細胞に寄生したものという「細胞内共生説」が定説になっています。
まだ酸素が無い太古の地球に生きていた生物は解糖系のみでエネルギーを得ていました。ところが、海中に発生した藻類が光合成によって吐き出す酸素が大気中に増えていくと、酸素の無い環境で生きていた生物は酸化力の強い酸素に触れることでダメージを受けるようになります。
そのためこの時期には原始真核生物の多くが絶滅し、あるいは酸素の影響を受けることのない深海などに移動していきました。
このような状況で誕生したのが、酸素を使ってATPを生成する好気性細菌です。
そして、約20億年前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。
好気性細菌は生体にダメージを与える酸素をブドウ糖に結合させ、二酸化炭素と水に分解し、さらにその過程でATPを大量に生成することができます。この細胞内共生によって酸素が豊富な環境で生物が急速に進化することになります。
つまり、原始真核生物は、酸素を利用できるα-プロテオバクテリアを細胞内に取り込んで、共生することによって、酸素分圧の高い環境で生きていけるようになったのです。(下図)

図:嫌気性の原始真核細胞に好気性細菌のαプロテオバクテリアが食作用で取り込まれ、共生するようになり、ミトコンドリアになった。αプロテオバクテリアに存在していた遺伝子の多くは真核細胞の核内に移動し、ミトコンドリアのたんぱく質の多くは核の遺伝情報によって作られるようになった。
このように、ミトコンドリアはかつて細菌であったため、見かけは細菌に似ています。
直径は1ミクロン(1ミクロンは1000分の1ミリ)以下で、長さは1~4ミクロン程度で、俵型やいも虫様の立体構造をしています。
ミトコンドリアは2枚の膜(内膜と外膜)によって細胞質から隔てられ、内膜は複雑に入り組んで「クリステ」という無数の襞や管を形成しています。内膜が襞上にくびれているのは、表面積を増やすためで、この内膜でATPの産生が行われています。
内膜上に電子伝達系やATP合成にかかわる酵素群などが一定の配置で並んでいます。
マトリックスには、TCA回路に関わる酵素やミトコンドリア独自のDNAなどが含まれています。
たんぱく質合成のためにリボソームも持っていてミトコンドリア内でたんぱく合成もできます。そして、ミトコンドリア自身が増殖もします。(下図)
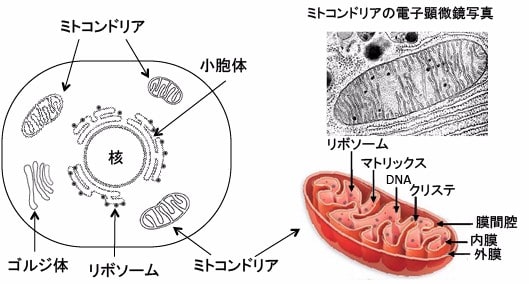
図:細胞内には機能を分担するために、様々な小器官が存在する。ミトコンドリアは酸素を使ってグルコースや脂肪酸やアミノ酸を燃焼してATPを産生する働きや、物質代謝やアポトーシスの制御など多彩は機能を持っている。
【ミトコンドリアのタンパク質の一部はミトコンドリアで合成される】
嫌気性原始真核細胞と好気性細菌のα-プロテオバクテリアが共生を始めた初期の段階で、α-プロテオバクテリアのDNAの大半は核に移行してゲノムDNAに組み込まれました(下図)。

図:ミトコンドリアの祖先のα-プロテオバクテリアのDNAの多くは、原始真核生物の核ゲノムDNAに組み込まれた。ごく一部のDNAがミトコンドリアDNAとしてミトコンドリアに残った。
α-プロテオバクテリアの頃の遺伝子の大半は細胞の核のDNAに移行していますが、ミトコンドリア固有の遺伝子の一部はミトコンドリア内のDNAに存在しています。
ミトコンドリアDNAは16,569bpの環状の分子で、37個の遺伝子が存在し、22個のトランスファーRNA(tRNA)と2個のリボソームRNA(rRNA)の遺伝子と、酸化的リン酸化に関与するたんぱく複合体の85種類のサブユニットのうち13種類のたんぱく質を作成する遺伝子が存在します。
ミトコンドリアのタンパク質の大半は核内DNA にコードされています。核内DNA にコードされているタンパク質は、細胞質で合成された後、ミトコンドリア外膜と内膜を通過してミトコンドリア内部に輸送されて来ます。

図:ミトコンドリアを構成するタンパク質の大半は核のゲノムDNAの遺伝情報で作られるが、呼吸酵素複合体を構成するタンパク質の内の13種類はミトコンドリアDNAでコードされていてミトコンドリア内で作られる。したがって、ミトコンドリアが正しく機能するには核のゲノムDNAとミトコンドリアDNAの両方の遺伝情報が必要。
ミトコンドリアの祖先のα-プロテオバクテリアと原始真核細胞が共生した初期の段階で、α-プロテオバクテリアの遺伝子(DNA)は核に移動しています。それは、ミトコンドリアでは活性酸素が多く発生してDNAがダメージを受けるので、「細胞核に遺伝子を避難させた」というふうに理解されています。
ミトコンドリアでは、電子伝達の際に複合体Iや複合体IIIから漏れ出した電子によって、酸素分子が一電子還元され、スーパーオキシドが発生します。ミトコンドリアは生体内の約95%の酸素を消費し、そのうち1〜3%が活性酸素種に変換されると推測されています。つまり、ミトコンドリア内では活性酸素が大量に発生するので、遺伝子(DNA)を安全な核に移動させたのです。
ミトコンドリアDNA にコードされているミトコンドリア・タンパク質は、核内DNA にコードされているものと比較すると、その種類は少数です。しかし、ミトコンドリアでのタンパク質合成が阻害されると、酸素呼吸(酸化的リン酸化)ができなくなり、ミトコンドリアでのエネルギー産生が阻害されます。
ミトコンドリアのリボソームはミトリボソームとも呼ばれています。
ミトコンドリアは、独自の遺伝物質とリボソームを含む遺伝子発現機構を運ぶ細胞内小器官です。哺乳類のミトコンドリアは、酸化的リン酸化機構の必須成分を形成する13のポリペプチドを合成します。
ミトコンドリアのリボソームのリボソームRNA(rRNA)成分はミトコンドリアDNAによってコードされますが、ミトコンドリアのリボソームタンパク質および翻訳に必要なすべてのタンパク質は核遺伝子によってコードされ、細胞質のリボソームにより合成され、ミトコンドリアに輸送されます。
ミトコンドリアのタンパク質合成は、すべての哺乳類にとって不可欠であり、酸化的リン酸化複合体の重要な成分を提供する役割を担っています。たった13種類のポリペプチドしか作られていませんが、ミトコンドリアでの蛋白合成が阻害されると細胞は生きていけません。
ミトコンドリアは核とは別に独自のDNA(mtDNA)を有しており、このmtDNAにコードされた蛋白質を合成するための独自の蛋白質合成系をもっています。ミトコンドリアは細菌の共生が起源と考えられていて、ミトコンドリアの蛋白質合成系の仕組みは、原則的には原核細胞のものに類似しています。
哺乳類のミトコンドリアリボソーム(55S)は、細胞質リボソーム(80S)より細菌リボソーム(70S)に近いと言えます。したがって、細菌リボソームを阻害するある種の抗生物質はミトコンドリアの働きを阻害する作用があります。
【がんを感染症のように治療する】
ミトコンドリアのリボソームをターゲットにしたがん治療法が注目されています。以下のような論文があります。
Antibiotics that target mitochondria effectively eradicate cancer stem cells, across multiple tumor types: treating cancer like an infectious disease.(ミトコンドリアを標的とする抗生物質は、複数の腫瘍タイプにわたってがん幹細胞を効果的に根絶させる:がんを感染症のように治療する)Oncotarget. 2015 Mar 10;6(7):4569-84.
【要旨】
この論文では、がん幹細胞を選択的に標的化することによって、がんを治療する新しい戦略を提案する。
がん治療における遺伝子変異に依存しない治療法を提供するために、複数の腫瘍タイプにわたってがん幹細胞の間で高度に保存されている細胞の特徴を探索した。これにより、がんの種類とは関係なく、「がん幹細胞」を単一の疾患として、全てのがんを効果的に治療することができる。
がん幹細胞のクローン性の増殖および生存には、ミトコンドリア新生に対して厳密な依存性が存在し、これががん幹細胞の弱点になっていることを明らかにした。
興味深いことに、FDA承認の抗生物質の中には、ミトコンドリアの生合成を阻害することが「副作用」としてなっているものがあり、この作用はがん治療においては「治療効果」として利用できる。
この分析に基づいて、8つの異なる腫瘍タイプ(乳がん、非浸潤性乳管がん、卵巣がん、前立腺がん、肺がん、膵臓がん、メラノーマおよび膠芽腫)の12種類のがん細胞株を用いて、FDAが認可した4〜5種類の抗生物質ががん幹細胞を根絶するのに使用できることを示す。
ミトコンドリアを標的とする抗生物質の5つのクラスには、エリスロマイシン系薬、テトラサイクリン系薬、グリシルサイクリン系薬、抗寄生虫薬およびクロラムフェニコールが含まれる。
それぞれの薬剤クラスの中から1個づつを選び、アジスロマイシン、ドキシサイクリン、チゲサイクリン、パモ酸ピルビニウム、クロラムフェニコールの解析結果を報告する。
重要なことは、これらの薬物の多くは、正常細胞に対して無毒であり、抗がん剤治療の副作用を軽減する可能性がある。
したがって、複数の腫瘍タイプにおけるがん治療のためにFDA承認の抗生物質を再利用することにより、感染症のようにがんを治療することを提案する。
最後に、がん幹細胞を根絶する能力はまだ臨床的には評価されていないが、がん関連感染症を標的として行われた(がん細胞自体をターゲットとしたものではない)ドキシサイクリンおよびアジスロマイシンを用いた最近の臨床試験は、がん患者において既に有効な治療効果を示している。
がんの研究では、トップクラスの研究者が何をターゲットにしているかは常に気にかけている必要があります。この論文はイギリスのマンチェスター大学のがん研究所の画期的乳がん研究ユニット(The Breakthrough Breast Cancer Research Unit, Institute of Cancer Sciences, University of Manchester, UK.)と米国のキンメルがんセンター(Kimmel Cancer Center)やアルバート・アインシュタイン医科大学病理学の研究グループです。
以下の論文も同じ研究グループからの報告です。
Doxycycline, Azithromycin and Vitamin C (DAV): A potent combination therapy for targeting mitochondria and eradicating cancer stem cells (CSCs).(ドキシサイクリンとアジスロマイシンとビタミンC:ミトコンドリアを標的とし、がん幹細胞を根絶するための強力な併用療法) Aging (Albany NY). 2019 Apr 19;11(8):2202-2216.
【要旨の抜粋】
FDA承認済み抗生物質2種類と食事性ビタミンサプリメントを用いたがん細胞の代謝をターゲットとした、がん幹細胞を根絶するための新しい治療法を考案した。
この治療法では、2種類の抗生物質を極めて低用量で使用して、がん幹細胞を相乗的に根絶できる。2つのターゲットは、ミトコンドリアの大きいリボソームと小さいリボソームである。
アジスロマイシンは、標的外の副作用として大きなミトコンドリアのリボソームを阻害する。さらに、ドキシサイクリンは、標的外の副作用として小さなミトコンドリアを阻害する。
ビタミンCは穏やかな酸化促進剤として働き、フリーラジカルを生成し、その結果、ミトコンドリアの新生(増生)を誘導する。
ER陽性MCF7乳がん細胞株を使用した実験で、ドキシサイクリン(1μM)とアジスロマイシン(1μM)およびビタミンC(250μM)の組み合わせで治療すると、がん幹細胞の増殖が90%以上阻害された。
この3種類の併用によるミトコンドリアの酸素消費とATP生産に対する強力な阻害効果は、代謝フラックス分析を使用して直接検証された。
したがって、軽度の酸化ストレスによるミトコンドリア新生(増生)の誘導は、ミトコンドリアのタンパク質翻訳の阻害と組み合わさると、癌治療における新しい有望な戦略となる可能性がある。
これらの所見と一致して、ビタミンCは、特定の輸送体、すなわちSVCT2によって、ミトコンドリア内に高度に濃縮されることが知られている。
また、ここで使用される抗生物質の濃度は、抗菌目的で使用されるドキシサイクリンおよびアジスロマイシンの濃度より低いので、抗生物質耐性菌出現に関連する潜在的な問題を回避できる。
最後に、アジスロマイシンは老化線維芽細胞を選択的に殺して除去する老化細胞破壊剤として作用する抗老化薬であるため、健康寿命と寿命を改善するための可能な影響についても議論する。
アジスロマイシンとドキシサイクリンの本来のターゲットは細菌のリボソームです。細菌を死滅する抗生物質として作用します。
これらの抗生物質は「標的外の副作用」としてミトコンドリアの機能を障害する作用も有します。このミトコンドリアに対する副作用ががん治療に利用できるという研究です。
アジスロマイシンはマクロライド系の抗生物質で、細菌の50Sリボソームに結合してmRNAから蛋白質への合成を阻害します。細菌の50Sリボソームはミトコンドリアの39Sリボソームと相同性が高いので、ミトコンドリアの39Sリボソームも阻害されます。
ドキシサイクリンはリボソームの小さいサブユニットを阻害します。
したがって、抗生物質として使用されているアジスルマイシンとドキシサイクリンを併用すると、ミトコンドリア新生を阻害し、その結果、がん細胞の増殖を抑制できます。
細菌のリボソームを阻害する抗生物質(ドキシサイクリンとアジスロマイシン)とビタミンCを併用するとがん幹細胞を根絶できるという報告です。
臨床試験も行われています。以下の論文も同じ研究グループからの報告です。
Doxycycline, an Inhibitor of Mitochondrial Biogenesis, Effectively Reduces Cancer Stem Cells (CSCs) in Early Breast Cancer Patients: A Clinical Pilot Study.(ミトコンドリア新生の阻害剤であるドキシサイクリンは、早期乳がん患者のがん幹細胞を効果的に減少させる:臨床予備試験)Front Oncol. 2018 Oct 12;8:452. doi: 10.3389/fonc.2018.00452. eCollection 2018.
【要旨】
背景と目的:がん幹細胞は、乳がんを含む複数の種類の腫瘍の発生、再発、転移、生存率の低下に関係している。がん幹細胞は、主要なミトコンドリア関連タンパク質を選択的に過剰発現し、ミトコンドリア機能の阻害は、がん幹細胞の根絶のための新規の治療手段となる可能性がある。
ミトコンドリアは細菌から進化したため、ドキシサイクリンを含む多くのクラスのFDA承認の抗生物質は、実際にはミトコンドリアをも標的としている。この臨床予備試験は、経口ドキシサイクリンによる短期の術前治療が早期乳がん患者のがん幹細胞の減少をもたらすかどうかを決定することを目的とした。
方法:ドキシサイクリンは、手術前の14日間、200 mgの1日量で経口投与された。15人の患者のうち6人が対照(治療なし)で、9人がドキシサイクリンで治療された。
ホルマリン固定パラフィン包埋サンプルの免疫組織化学分析によって、がん幹細胞(CD44、ALDH1)、ミトコンドリア(TOMM20)、細胞増殖(Ki67、p27)、アポトーシス(切断カスパーゼ-3)、および血管新生(CD31)のバイオマーカーを解析した。各患者について、術前生検標本と外科切除標本の両方で分析を実施した。ベースラインから治療後までの変化は、統計的に比較検討した。
結果:ドキシサイクリン投与前の生検サンプルと比較して、ドキシサイクリン投与後の腫瘍サンプルは、がん幹細胞のマーカーのCD44の統計的に有意な減少を認めた(p値<0.005)。より具体的には、ドキシサイクリンで治療された患者9人中8人で、CD44レベルが17.65〜66.67%低下した。対照的に、一人の患者はCD44の15%の増加を1示した。全体として、約90%の症例においてがん幹細胞の性質の減少を認めた。
別のがん幹細胞のマーカーであるALDH1でも同様の結果が得られた。対照的に、ミトコンドリア、増殖、アポトーシス、および血管新生のマーカーは、2つのグループ間ですべて類似していた。
結論: CD44およびALDH1発現量の定量的減少は前臨床実験と一致しており、ドキシサイクリンが生体内(in vivo)で乳がん患者のがん幹細胞を選択的に根絶できることを示唆している。これらの有望な予備試験の結果を検証するために、さらに多くの患者を対象にした臨床試験の実施が望まれる。
以上のように、細菌のリボソームを阻害して抗菌作用を発揮する抗生物質は、ミトコンドリアのリボソームの働きを阻害する副作用を持ちますが、この作用をがん治療に利用できるというアイデアです。がんを感染症にように治療するというアイデアです。
その理論的根拠の一つが、がん幹細胞にはミトコンドリアの働きが重要だという事実があるようです。
【がん幹細胞はミトコンドリアの量が増えている】
一般に、がん細胞では、酸素が十分に利用できる状況でもミトコンドリアでの酸素呼吸が抑制され、グルコース(ブドウ糖)の取込みと解糖系が亢進し、乳酸の生成が増えているという物質代謝の特徴を持っています。これを好気的解糖(Aerobic glycolysis)あるいはワールブルグ効果(Warburg effect)と言います。
しかし、がん細胞はこの基本法則を厳密に守っているわけではありません。特にがん幹細胞(Cancer Stem Cell)では、エネルギー産生や物質代謝において、かなりの柔軟性(フレキシビリティ)を持っています。
エネルギー産生には酸素を使わない解糖系とミトコンドリアで酸素を使う酸素呼吸(酸化的リン酸化)があります。
エネルギー産生の材料には、グルコースだけでなく、アミノ酸、脂肪酸、ケトン体、乳酸などを使います。
脂肪酸やケトン体をエネルギー産生に利用するには、ミトコンドリアでの代謝になるので、解糖系が亢進しミトコンドリアでの酸素呼吸が低下している「通常のがん細胞」では、脂肪酸やケトン体を利用しにくい状態にあります。これが、超低糖質高脂肪食のケトン食の抗がん作用の根拠の一つです。しかし、ケトン食の抗腫瘍効果には限界があります。
グルコースが枯渇して利用できなくなったり、解糖系が阻害されると、ミトコンドリアでの酸素呼吸によるエネルギー産生を亢進します。エネルギー産生の材料が脂肪酸とケトン体しかなければ、これらを利用します。
このような代謝の状況を「代謝の柔軟性(metabolic flexibility)」と言います。
解糖系を阻害する方法やケトン食だけでは、がん幹細胞を死滅できません。代謝の柔軟性によってミトコンドリアを利用するエネルギー産生にスイッチを切り替えることができるからです。
グルコースが利用できない状況でがん細胞が生きていくためには、脂肪酸やケトン体も利用するようになるのです。
がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。
がん幹細胞が生き残れば、がんはいずれ再燃・再発するので、がん幹細胞の放射線感受性や抗がん剤感受性を高める方法の開発が重要と考えられています。
がん幹細胞のマーカーとしてアルデヒド脱水素酵素(Aldehyde dehydrogenase)が知られています。アルデヒド脱水素酵素はがん幹細胞に多く発現し、この酵素の発現が多いがんほど増殖が早く予後が悪いことが報告されています。
アルデヒド脱水素酵素は細胞内のアルデヒドを酸化することによってがん細胞内の酸化ストレスを軽減しています。
さらに、がん幹細胞では、ミトコンドリアの量が増えていることが報告されています。
がん幹細胞が細胞分裂を繰り返し、腫瘍塊を作る時にミトコンドリアでの物質代謝やエネルギー産生が必要だからです。ミトコンドリアで酸素呼吸を行うと活性酸素が増えて酸化ストレスが亢進するので、アルデヒド脱水素酵素などの抗酸化システムが亢進していると考えられます。
したがって、ミトコンドリアの機能を阻害し、アルデヒド脱水素酵素を阻害するとがん幹細胞を死滅することができます。このとき、がん細胞の解糖系を阻害し、ミトコンドリアでの酸素呼吸を無理矢理増やすと、がん細胞は酸化ストレスが亢進して死滅します。

図:がん組織にはがん幹細胞 (cancer stem cells)と呼ばれる細胞が存在して、通常のがん細胞(成熟がん細胞)を供給しながらがん組織を構成している。がん幹細胞は自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっている。 成熟がん細胞はミトコンドリアが少なく、アルデヒド脱水素酵素(Aldehyde dehydrogenase;ALDH)の活性は低く、腫瘍形成能を持たない。一方、がん幹細胞は、ミトコンドリアが多く、アルデヒド脱水素酵素(ALDH)の活性が高い。この性質が腫瘍形成能やアポトーシス抵抗性の原因となっている。したがって、がん幹細胞を死滅させるにはミトコンドリア機能とアルデヒド脱水素酵素(ALDH)は重要なターゲットになる。
抗がん剤治療が効いている場合でも、治療開始して半年から1年くらいで再増殖します。これは、がん細胞が抗がん剤に耐性を獲得する結果です。
がん組織は不均一な組織であり、元々耐性を持ったがん細胞が存在する場合もあります。この場合は、抗がん剤治療によって抗がん剤耐性のがん細胞が選択的に残って増殖が加速されるので、もっと早く効かなくなります(554話参照)。
このような抗がん剤抵抗性にはがん幹細胞の存在が重要視されています。
がん幹細胞の増殖と生存と腫瘍形成には、ミトコンドリア新生が必要という報告があります。
正常な上皮細胞が増殖・生存するためには、インテグリンを介した細胞外マトリックスとの接着が必要です。上皮細胞は細胞や細胞外基質と接着して増殖し、浮遊状態では増殖できず細胞死が誘導されます。
一方、がん細胞では足場が無くても増殖できます。
がん細胞を培養する実験で、がん細胞が腫瘍の塊を作るとき、単層で増殖するときに比べて60種類以上のミトコンドリア関連タンパク質が過剰に発現するという報告があります。つまり、がん幹細胞の腫瘍形成能(腫瘍塊を形成する能力)にはミトコンドリア新生(biogenesis)が必要だということです。
そこで、この論文では、がん幹細胞の腫瘍形成能を指標にしてミトコンドリア毒性のある抗生物質の作用を検討しています。
その結果、人間のミトコンドリアに毒性のある抗菌剤を添加するとがん幹細胞の腫瘍形成能が阻止されたという結果を報告しています。
【ドキシサイクリンはミトコンドリアのATP産生を阻害する】
ドキシサイクリンはテトラサイクリン誘導体の抗生物質です。テトラサイクリンの有効性と安定性を改善した医薬品で、50年以上前(1960年代後半)にFDAが承認しています。グラム陽性とグラム陰性の両方の細菌に効き、にきびの治療に使われています。
テトラサイクリンは細菌のリボソームの30Sサブユニットに結合して、細菌のタンパク合成を阻害します。この細菌の30Sリボソーム・サブユニットはミトコンドリアの28Sリボソーム・サブユニットと相同性があるため、ミトコンドリアのタンパク質合成を阻害する作用もあり、この作用によってミトコンドリア機能を阻害します。

図:ドキシサイクリンは細菌のリボソームの30Sサブユニットに結合して、ポリペプチド鎖へのアミノ酸の結合を阻害して、細菌のタンパク合成を阻害する。
前述のように、ドキシシクリンの抗がん作用が注目されています。がん細胞の増殖や腫瘍形成能を阻害する作用が多数報告されています。以下のような報告もあります。
Induction of Mitochondrial Dysfunction and Oxidative Damage by Antibiotic Drug Doxycycline Enhances the Responsiveness of Glioblastoma to Chemotherapy.(抗生物質のドキシサイクリンはミトコンドリアの機能異常と酸化障害を引き起こして、グリオブラストーマの抗がん剤に対する反応性を亢進する)Med Sci Monit. 2017 Aug 26;23:4117-4125.
【要旨】
研究の背景:がん治療において、ミトコンドリアの機能異常を誘導する方法の有効性が指摘されている。抗生物質のドキシサイクリンが、ミトコンドリアをターゲットにすることによって抗がん作用を示すことが報告されている。この研究では、ドキシサイクリンがグリオブラストーマ(膠芽腫)の治療に有効かどうかを検討した。
実験方法:グリオブラストーマの増殖や生存やミトコンドリアでの代謝に対するドキシサイクリンの効果を検討した。40匹のマウスを用いた移植腫瘍の実験系で、テモゾロマイドとドキシルビシンの併用による治療効果を検討した。
結果:ドキシサイクリンは、グリオブラストーマ細胞株に対して、細胞増殖を抑制し、アポトーシス(細胞死)を誘導した。培養細胞の実験系(in vitro)および移植腫瘍の動物実験系(in vivo)で、ドキシサイクリンはグルオブラストーマのテモゾロマイド感受性を亢進した。
作用機序として、ドキシサイクリンはミトコンドリア膜ポテンシャルを低下させ、ミトコンドリアの呼吸を阻害することによってミトコンドリア機能を阻害した。
ドキシサイクリンはミトコンドリアのATP産生を低下させ、ミトコンドリアのスーパーオキシドと細胞内の活性酸素種の量を高め、酸化傷害の指標である8-OHdGと蛋白質のカルボニル化と脂質過酸化を増やした。これは、ドキシサイクリンはミトコンドリアにおけるエネルギー産生を破綻させ、酸化ストレスを高めて細胞の酸化傷害によって、グリオブラストーマ細胞を死滅させることを示している。
抗酸化剤のN-アセチル-L-システインを投与すると、ドキシサイクリンの増殖抑制とアポトーシス誘導作用が阻止された。これは、ドキシサイクリンがグリオブラストーマに酸化ストレスを高めて抗腫瘍作用を示すことを示している。
結論:我々の研究では、抗生物質のドキシサイクリンが、ミトコンドリアの機能不全および酸化的ストレスを誘導することによって、グリオブラストーマの治療に有効であることを示している。 我々の研究はまた、グリオブラストーマにおけるミトコンドリア代謝の重要性を示している。
ドキシサイクリンはミトコンドリアの酸素呼吸を阻害してATP産生を低下させ、さらに活性酸素の産生を高めて、酸化傷害を引き起こすという結果です。ドキシサイクリンは細胞内エネルギー(ATP)を減少させ、同時に酸化ストレスを高めることによってがん細胞を死滅させるというメカニズムです。
ドキシサイクリンとラパマイシンの相乗効果が報告されています。
Targeting cellular metabolism using rapamycin and/or doxycycline enhances anti-tumour effects in human glioma cells.(ラパマイシンおよび/またはドキシサイクリンを使用した細胞代謝の標的化は、ヒト神経膠腫細胞の抗腫瘍効果を高める)Cancer Cell Int. 2018 Dec 19;18:211.
【要旨の抜粋】
背景:神経膠腫は高度の浸潤性を示し、治療に抵抗し、予後は極めて悪い。血管新生やキナーゼ活性や細胞代謝を標的とする効果的な治療法の開発が注目されている。多くのがん細胞はmTOR(哺乳類ラパマイシン標的タンパク質)の活性が亢進し、その結果、代謝の変化を引き起こし、高分子の生合成や細胞の成長と生存を促進する。残念なことに、毒性が低いmTOR阻害剤は、目に見えるほどの生存利益をもたらさない。mTOR阻害剤の抗腫瘍効果を高める治療法の検討が重要である。
方法:インビトロ増殖アッセイ、タンパク質発現および代謝産物分析を使用して、神経膠腫細胞株におけるmTOR阻害剤、他の代謝治療およびそれらの組み合わせの効果を検討した。さらに、mTOR活性と細胞代謝関連のタンパク質発現パターンを、ヒト生検における免疫組織化学により解析した。
テモゾロミドおよび/またはラパマイシン治療は、代謝順応の結果として、脂質合成、解糖、およびミトコンドリア機能に関連する酵素の発現を変化させた。そのため、他の抗代謝薬(クロロキン、エトモキシル、ドキシサイクリン)をin vitroで組み合わせた。
結果:代謝経路をターゲットにした複数の阻害剤は、がん細胞依存性に相加的あるいは相乗的効果を示す。特にラパマイシン+ドキシサイクリンは、神経膠腫に有望な抗腫瘍効果をもたらす可能性がある。さらに、免疫組織化学の結果は、代謝およびmTOR活性の変化が最近の神経膠腫の分類に相関しておらず、これらのタンパク質発現プロファイルが患者個々において個人差があることを示唆している。
結論:細胞代謝を標的とする異なる薬の組み合わせは、代謝シフトに応じて腫瘍細胞の高い適応能力を阻害することによって治療効果を高める可能性がある。
ネットワークを形成している代謝経路の一部を阻害しても迂回経路の存在によって、がん細胞の代謝を阻害することはできません。複数の箇所で阻害する必要があるということです。以下のような報告もあります。
Doxycycline inhibits the cancer stem cell phenotype and epithelial-to-mesenchymal transition in breast cancer.(ドキシサイクリンは乳がん細胞におけるがん幹細胞の性質と上皮-間葉移行を阻止する)Cell Cycle. 2017 Apr 18;16(8):737-745.
【要旨】
乳がん細胞は乳がん幹細胞から発生し、乳がん幹細胞の足場非依存性の増殖と生存にはミトコンドリア新生が必要であることが示されている。したがって、乳がん治療においてミトコンドリアは重要なターゲットになる。
FDA(米国食品医薬品局)の認可薬であるドキシサイクリンの副作用の一つにミトコンドリア新生の阻害がある。
この研究では、乳がん細胞と乳がん幹細胞の腫瘍形成や浸潤、移動、アポトーシス、がん幹細胞のマーカー、上皮-間葉移行に関連したマーカーに対するドキシサイクリンの作用とそのメカニズムを検討した。さらに、乳がん細胞に対するドキシサイクリンの阻害作用におけるオートファジーの関与を検討した。
我々は、ドキシサイクリンが乳がん細胞と乳がん幹細胞の生存と増殖を阻害し、乳がん細胞の腫瘍形成能と移動と浸潤と上皮-間葉移行を低下させることを明らかにした。
ドキシサイクリン投与は、がん幹細胞のマーカーであるOct4、Sox2、Nanog 、CD44の発現を有意に低下させた。さらに、ドキシサイクリンはオートファジーのマーカーのLC-3BI とLC-3BIIの発現を低下させ、上皮-間葉移行とがん幹細胞のマーカーに対する作用にオートファジー阻害作用の関与が示唆された。
ドキシサイクリンは乳がん細胞の上皮-間葉移行とがん幹細胞の性質を阻害する作用を有することが示され、乳がん治療に利用できる可能性が示唆された。
ドキシサイクリンが、乳がん幹細胞の幹細胞として能力を維持させる作用と上皮-間葉移行(上皮細胞が線維芽細胞のような間葉系細胞の性質を獲得して周囲組織への浸潤性が高まること)を阻止するという結果です。そのメカニズムとしてミトコンドリアの働きを阻害する作用を指摘しています。
以上の研究結果から、抗がん剤治療や高濃度ビタミンC点滴を行っているときに、ドキシサイクリンとアジスロマイシンの併用を試してみる価値はあります。副作用がでない低用量で効果が期待でき、しかも安価です(1ヶ月数千円程度)。
| « 676) Hippo経... | 678)解糖系と... » |



