がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
678)解糖系とミトコンドリアと抗酸化システムをターゲットにしたがん治療
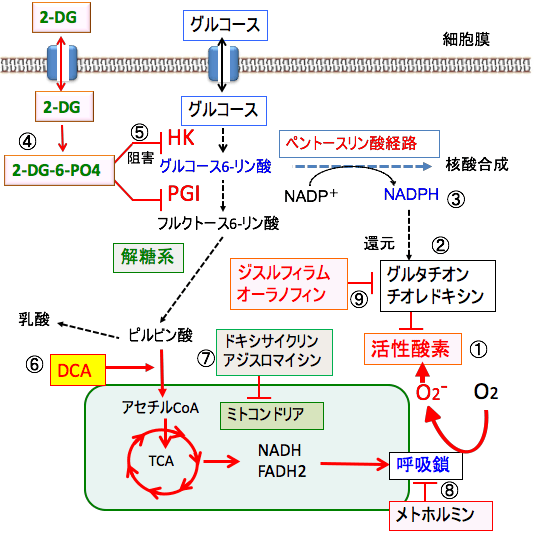
図:ミトコンドリアの酸化的リン酸化で活性酸素種が産生される(①)。細胞は活性酸素種を消去するためにグルタチオンやチオレドキシンなどの抗酸化システムを持っている(②)。酸化したグルタチオンとチオレドキシンを還元するための還元剤(NADPH)はペントースリン酸経路から供給される(③)。2−デオキシ-D-グルコース(2-DG)はヘキソキナーゼ(HK)によって2-DG-6リン酸(2-DG-6-PO4)に変換される(④)。2-DG-6リン酸はヘキソキナーゼ(HK)とホスホグルコースイソメラーゼ(PGI)を阻害して解糖系とペントースリン酸経路を阻害する(⑤)。ジクロロ酢酸ナトリウム(DCA)は、ピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAの変換を亢進してミトコンドリアでの代謝を亢進し、解糖系とペントースリン酸経路の活性を阻害する(⑥)。抗生物質のドキシサイクリンとアジスロマイシンはミトコンドリアのリボソームの働きを阻害して、ミトコンドリア機能を障害し、ATP産生を阻害する(⑦)。メトホルミンは呼吸酵素複合体の働きを阻害してATP産生を阻害し、同時に活性酸素の産生を増やす(⑧)。ジスルフィラムとオーラノフィンは抗酸化システム(グルタチオン、チオレドキシン)を阻害する(⑨)。以上の組合せは、がん細胞に選択的に、ATP産生を抑制し、酸化ストレスを高めて、増殖を抑制し、細胞死を誘導できる。
678)解糖系とミトコンドリアと抗酸化システムをターゲットにしたがん治療
【エネルギー産生と物質合成と抗酸化システムをターゲットにしたがん治療とは】
がん細胞は正常細胞に比べて細胞増殖が亢進しています。
したがって、がん細胞を死滅させる手段としては、DNAの合成や複製の過程、細胞分裂のメカニズム(微小管の働きなど)がターゲットになります。すなわち、細胞傷害性の抗がん剤の多くは、細胞分裂の過程を阻害して、がん細胞の増殖を抑え、細胞死を誘導することを目標にしています。
しかし、正常細胞でも、骨髄細胞や消化管粘膜上皮細胞や免疫組織(リンパ球)や毛根細胞も盛んに細胞分裂を行っているので、細胞増殖を阻害する抗がん剤は、骨髄抑制(白血球減少、血小板減少、貧血)や消化管障害(食欲低下、吐き気、嘔吐、便通障害など)や免疫力低下(リンパ球減少)や脱毛などの副作用が出てきます。
ある特定の分子を標的として、その機能を制御することにより治療する分子標的薬も多く開発されています。がんの分子標的薬の多くは、細胞の増殖や生存のシグナル伝達系のタンパク質がターゲットになっています。
しかし、複数の経路が相互にクロストークしながらネットワークを形成しているので、シグナル伝達経路の一部を阻害しても、迂回経路の存在によって、がん細胞の増殖を十分に阻害することに限界があり、したがってその効果は限定的です。
この他のがん治療のターゲットとしては、「エネルギー産生と物質合成」や「抗酸化システム」があります。
前者に関しては、解糖系やペントース・リン酸経路やミトコンドリアがターゲットになります。後者に関しては、グルタチオンやチオレドキシンなどがターゲットになります。
解糖系とペントース・リン酸経路とミトコンドリアと抗酸化システム(グルタチオンやチオレドキシン)を同時にターゲットにしたがん治療は、正常細胞へのダメージは少なく、がん細胞に選択的に作用して、増殖抑制と細胞死誘導の効果が期待できます。
【ペントースリン酸経路は核酸の原料と還元剤のNADPHを産生する】
ペントースリン酸経路とは、解糖系の中間体のグルコース6リン酸から分岐し、同じく解糖系の中間体 グリセルアルデヒド3リン酸に戻る経路(回路)です。解糖系と同様に細胞質に存在する経路で、補酵素の一つであるNADPHを産生し、核酸の原料となるリボース5リン酸などの5単糖 (ペントース) を産生します(下図)。

図:解糖系は1分子のグルコースが2分子のピルビン酸に分解される過程で2分子のATPが産生される(①)。グルコース6リン酸から派生するペントースリン酸経路では、還元剤のNADPHが2分子産生され、グルタチオン還元や脂肪酸合成など還元力を必要とする生合成反応に使われる(②)。さらに、核酸合成の材料になるリボース5リン酸が産生される(③)。がん細胞ではグルコースの取込みが増え、解糖系とペントースリン酸経路が亢進して、細胞分裂のためのエネルギー(ATP)と物質合成(核酸、脂肪酸、NADPHなど)が亢進している。
NADPHは還元剤です。脂肪酸やステロイドの合成、抗酸化物質のグルタチオンやチオレドキシンの還元剤として使用されます。
解糖系はATPを産生します。ペントースリン酸経路はATP産生には関与せず、核酸の原料や還元剤(NADPH)の産生を行っています。
細胞が増殖するにはエネルギー(ATP)だけでなく、核酸や脂肪酸などの物質合成や、酸化ストレスを軽減する還元剤の需要も増えます。したがって、がん細胞では、解糖系とペントースリン酸経路が亢進しています。
【還元型グルタチオンと酸化型グルタチオン】
グルタチオン(Glutathione)というのは、グルタミン酸とシステインとグリシンの3つのアミノ酸が結合したトリペプチドです。
γ-グルタミルシステイン合成酵素によってグルタミン酸とシステインが結合してγ-グルタミルシステインを合成します。引き続いてグルタチオン合成酵素によってγ-グルタミルシステインにグリシンが結合してグルタチオンが合成されます。この合成にはATPが必要です。
つまり、グルタミン酸やシステインやグリシンが不足したり、ATPが十分に産生できなかったり、γ-グルタミルシステイン合成酵素やグルタチオン合成酵素の活性が阻害されれば、グルタチオンの濃度は低下して、酸化ストレスに対する抵抗力が低下することになります。

図:グルタチオンは3つのアミノ酸(グルタミン酸、システイン、グリシン)がATPを使って結合して合成される。
グルタチオンは細胞内に0.5〜10mMという非常に高濃度で存在します。チオール基(SH基)を持ち、この水素が電子を供与することによって活性酸素やフリーラジカルを消去します。
還元型のグルタチオンはGSH(Glutathione-SH)と表記され、GSHが活性酸素などで酸化されると酸化型グルタチオンGSSG(Glutathione-S-S-Glutathione)になります。
つまり、酸化型は、二分子の還元型グルタチオンがジスルフィド結合(2個のイオウ原子が繋がった状態)によってつながった分子です。
細胞内で発生した活性酸素やフリーラジカルに電子を与えて酸化型になったグルタチオンを還元型に戻す酵素がグルタチオンレダクターゼ(グルタチオン還元酵素)で、このときNADPH(ニコチンアミドアデニンジヌクレオチドリン酸、nicotinamide adenine dinucleotide phosphate)から水素をもらいます。このNADPHはペントース・リン酸経路で産生されます。

図:還元型グルタチオンは活性酸素(スーパーオキサイド、過酸化水素など)などと反応して酸化され、2量体化した酸化型グルタチオン(GSSG)に変化するが、グルタチオン還元酵素がNADPHからの電子をGSSGに転移して、GSH(還元型グルタチオン)に再生される。
がん細胞は還元型グルタチオン(GSH)の産生を促進することで、酸化ストレス抵抗性を高め、増殖や転移や治療抵抗性を高めていることが知られています。
NADPHはペントース・リン酸経路で産生されます。つまり、がん細胞のグルコース取り込みや解糖系やペントース・リン酸経路を阻害するケトン食や2−デオキシ-D-グルコースやジクロロ酢酸はNHDPHの供給を減らすことによって、グルタチオンの合成を低下させ、酸化ストレスに対する抵抗性を減弱させることができます。(ATP産生低下はグルタチオン合成を低下させます)
【ジクロロ酢酸ナトリウムと2-デオキシグルコースはペントースリン酸経路を阻害する】
がん治療において、還元剤と核酸の原料を供給するペントースリン酸経路の阻害は重要な治療法になります。
ピルビン酸脱水素酵素キナーゼを阻害してミトコンドリアを活性化するジクロロ酢酸ナトリウムがペントースリン酸経路を阻害することが報告されています。以下のような論文があります。
Inhibition of the pentose phosphate pathway by dichloroacetate unravels a missing link between aerobic glycolysis and cancer cell proliferation(ジクロロ酢酸によるペントースリン酸経路の阻害は、好気性解糖とがん細胞増殖との間の失われた関連を明らかにする)Oncotarget. 2016 Jan 19; 7(3): 2910–2920.
【要旨】
がん細胞は酸素の存在下でも解糖によるグルコースの発酵を行っており、これはワールブルグ(Warburg)効果と呼ばれている。このワールブルグ効果は、がんの治療法の開発において魅力的なターゲットになっているがん細胞に共通の特徴である。
本研究は、がん細胞における代謝、エネルギー貯蔵および増殖速度の間の関係を分析することを目的とした。6つのがん細胞株において、DNA合成量によって評価した細胞増殖能は、解糖の効率と相関することを見出した。
解糖と増殖の関係をさらに調べるために、ペントースリン酸経路の薬理学的阻害を使用した。
我々は、ペントースリン酸経路の活性の低下ががん細胞の増殖を減少させ、その作用はワールブルグ効果の代謝が強いがん細胞ほど大きな影響を及ぼすことを実証した。
ペントースリン酸経路の最初の律速酵素であるグルコース-6-リン酸デヒドロゲナーゼに対するsiRNAを用いて、がん細胞の増殖を維持する上でのペントースリン酸経路の重要な役割が確認された。
さらに、ジクロロ酢酸が、がん細胞の解糖系優位の代謝からミトコンドリアでの酸化的リン酸化を亢進するように代謝を変換させ、それに応じて増殖能が減少することを見出した。
ジクロロ酢酸がペントースリン酸経路の活性を低下させたことを実証することにより、ジクロロ酢酸ががん細胞の増殖を制御する新しいメカニズムを提供する。
正常細胞では解糖と酸化的リン酸化が連動して働き、ATPを産生しています。
がん細胞では解糖と酸化的リン酸化が連動していません。解糖の最終産物のピルビン酸は乳酸に変換され、ミトコンドリアでの酸化的リン酸化は抑制されています。
増殖する細胞にとっては、エネルギー産生と物質合成を両立させるためにはグルコースの取込みを亢進し、解糖系とペントースリン酸経路を亢進する必要があります。
ジクロロ酢酸はミトコンドリアの酸化的リン酸化を促進し、その結果、解糖系とペントースリン酸経路を抑制する結果になります。
つまりジクロロ酢酸と2−DGで解糖系とペントースリン酸経路を抑制すると、ATP産生と物質合成を低下させて、がん細胞の増殖を抑制できます。(下図)

図:2−デオキシ-D-グルコース(2-DG)はヘキソキナーゼ(HK)で2-DG-6リン酸(2-DG-6-PO4)に変換される(①)。2-DG-6リン酸はヘキソキナーゼ(HK)とホスホグルコースイソメラーゼ(PGI)を阻害して解糖系とペントースリン酸経路を阻害する(②)。ジクロロ酢酸ナトリウムは、ピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAの変換を亢進してミトコンドリアでの代謝を亢進し、解糖系とペントースリン酸経路を阻害する。解糖系とペントースリン酸経路の阻害は、エネルギー産生や物質合成や抗酸化システムを阻害してがん細胞の増殖を抑制し、細胞死を誘導する。
【解糖系とペントースリン酸経路と抗酸化システムを同時に阻害するとがん細胞は死滅する】
解糖とペントースリン酸回路と抗酸化システム(グルタチオンやチオレドキシン代謝やNrf2活性など)を同時に阻害すると、がん細胞に選択的に酸化ストレスを高めて増殖を阻害することが報告されています。以下のような報告があります。
Combined inhibition of glycolysis, the pentose cycle, and thioredoxin metabolism selectively increases cytotoxicity and oxidative stress in human breast and prostate cancer(解糖系とペントースリン酸回路とチオレドキシン代謝の同時阻害は,ヒトの乳がんと前立腺がんにおいて細胞毒性と酸化ストレスを選択的に亢進する)Redox Biol. 2015 Apr; 4: 127–135.
【要旨】
ヒト前立腺がん細胞株(PC-3とDU145)とヒト乳がん細胞株(MDA-MB231)を使った実験系において、培養細胞の解糖系を2-デオキシ-d-グルコース(2DG; 20mM, 24-48 hr)で阻害し、同時にペントースリン酸回路をデヒドロエピアンドロステロン(DHEA, 300μM, 24-48 hr)で阻害すると、チオール基を介した酸化ストレスの亢進によって細胞死が誘導できる。
驚くべきことに、2DG+DHEAを培養液に添加するときに、細胞内のグルタチオン量を90%枯渇させる濃度のグルタチオン合成の阻害薬(l-buthionine sulfoximine; BSO, 1mM)を同時に添加して48時間経過しても、2DG+DHEAでみられた細胞死のレベルを増強することはなかった。
これとは対象的に、チオレドキシン還元酵素の活性を阻害するオーラノフィン(Auranofin; 1μM)を2DG+DHEA あるいはDHEAのみを添加した培養液に添加すると、3つの細胞株全てにおいて、24時間後には細胞死は顕著に増加した。
さらに、DHEA+オーラノフィンの組合せによって増加した細胞死誘導は、チオールの抗酸化剤であるN-アセチルシステイン(NAC, 20mM)の添加によってほぼ完全に阻止された。
PC-3細胞を用いた解析で、DHEA+オーラノフィンの併用投与でチオレドキシン-1の酸化が促進され、N-アセチルシステインによって阻害される事が示された。
重要な点は、正常なヒト乳腺上皮細胞は2DG+DHEA+オーラノフィンの組合せに対して、がん細胞のような細胞死が起こらなかった。
これらの結果は、解糖系とペントースリン酸回路とチオレドキシン代謝を同時に阻害する方法は、がん細胞に選択的に酸化ストレスを誘導して死滅させる有効な手段となる可能性を示唆している。
DHEA(デヒドロエピアンドロステロン)はペントース・リン酸回路でNADPHを産生するグルコース-6-リン酸デヒドロゲナーゼ(G6PD)を阻害する作用があります。
この実験は培養細胞を使ったin vitroの実験であるため、この結果をそのまま生体内の効果に結びつけることはできません。
その理由は、この実験で使用されている20mMの2-デオキシグルコース(2-DG)と300μMのDHEA(デヒドロエピアンドロステロン)は生体内では達成できない濃度だからです。
しかし1μMのオーラノフィンの濃度は現実的な数値であり、関節リュウマチの治療に使用される服用量で生体内の細胞のチオレドキシン還元酵素を阻害することは可能です。
また、ケトン食や2-DGやジクロロ酢酸などを併用するとがん細胞に選択的にがん細胞の解糖系とペントースリン酸回路の阻害は可能です。
また、グルタチオンの産生を阻害するスルファサラジン(サラゾスルファピリジン)の併用はオーラノフィンの抗腫瘍効果を高めることができます。
抗酸化システムの阻害はがん細胞の抗がん剤感受性を高めます。以下のような報告があります。
Enhancement of carboplatin-mediated lung cancer cell killing by simultaneous disruption of glutathione and thioredoxin metabolism.(グルタチオンとチオレドキシン代謝の同時阻害による肺がん細胞に対するカプボプラチンの抗腫瘍効果の増強)Clin Cancer Res. 2011 Oct 1;17(19):6206-17.
【要旨】
目的:正常細胞に比べて、がん細胞では細胞内のヒドロペルオキシド(過酸化物)のレベルが定常的に高くなっている。そのため、がん細胞内のグルコース代謝とヒドロペルオキシド代謝が亢進している。本研究では、グルコースとヒドロペルオキシドの代謝の阻害剤が、肺がん細胞において酸化ストレスを高めることによって、抗がん剤や放射線の感受性を高めるかどうかを検討した。
実験計画:ヒト肺がん細胞株のA549およびNCI-H292を用い、カルボプラチン+電離放射線と2-デオキシ-d-グルコース(2DG)の組合せで処理した。さらに、in vitroおよびin vivoの実験系において、グルタチオン合成阻害薬のブチオニンスルホキシミン(buthionine sulfoximine)およびチオレドキシン依存性代謝の阻害薬のオーラノフィンを用いて、カルボプラチンおよび電離放射線に対する肺がん細胞の感受性を高めた。
結果:2DGをカルボプラチン+ 電離放射線と組み合わせた場合、A549細胞およびNCI-H292肺がん細胞において細胞死滅が増強され、この組み合わせはパクリタキセル+カルボプラチン+ 電離放射線より有効であった。
チオール性抗酸化剤(N-アセチルシステイン)は、2DG +カルボプラチン誘発細胞殺傷からがん細胞を保護することができた。単一の薬剤として毒性の出ない用量でのBSOおよびオーラノフィンの同時投与は、肺がん細胞の2DG +カルボプラチンに対する感受性を増強した。
この治療の組合せは、グルタチオンとチオレドキシンの両方の酸化を増加させ、この作用はN-アセチルシステインによって阻害された。
オーラノフィン+ BSOで処置したマウスは、血液中の白血球または赤血球に変化を示さなかった。
マウスの移植腫瘍を用いた実験系では、カルボプラチンまたはオーラノフィン+ BSO単独で処置した動物よりも、オーラノフィン+ BSO +カルボプラチンでの処置によってより効果的に腫瘍増殖が阻害された。
結論:これらの結果は、in vitroとin vivoの実験系において、グルタチオンおよびチオレドキシン代謝の同時阻害が、肺がん細胞の増殖を効果的に阻害し、チオール媒介性酸化ストレスを含む機構によって、抗がん剤および放射線に対する感受性を高めることができることを示している。
以上の報告から、抗がん剤治療や放射線治療に解糖系とペントースリン酸経路と抗酸化システムを阻害する治療の併用が有効であることが理解できます。
抗がん剤治療や放射線治療と併用しなくても、がん細胞に十分に酸化ストレスを高めればがん細胞の増殖を抑制し、細胞死を誘導できます。
ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進したり(ジクロロ酢酸ナトリウム)、細胞内で活性酸素の産生を高める薬剤(高濃度ビタミンC点滴、アルテスネイト、メトホルミン)を使って細胞内の活性酸素の産生量を高め、同時に、活性酸素を消去する細胞内の抗酸化システム(抗酸化力)抑制すると、細胞内の酸化ストレスが高度に亢進し、酸化傷害によってがん細胞を死滅できます。これが「がんの酸化治療」になります。(下図)

図:放射線と抗がん剤治療は活性酸素の産生を高めて細胞を死滅させる(①)。ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進するジクロロ酢酸ナトリウム(②)、細胞内で活性酸素の産生を高める薬剤(アルテスネイト、高濃度ビタミンC点滴、メトホルミン)も活性酸素の産生を増やす(③)。活性酸素の産生量が増えると、活性酸素を消去する抗酸化物質や抗酸化酵素による抗酸化力を高めて酸化還元バランスを維持しようとする。オーラノフィン、ジスルフィラム、2-デオキシ-D-グルコースは抗酸化システムを阻害する(④)。がん細胞内の活性酸素の産生量を増やし、同時に活性酸素消去能(抗酸化力)を阻害すると、酸化還元バランスが破綻して強い酸化ストレスを引き起こし、がん細胞を死滅できる(⑤)。
【ジスルフィラムは還元型グルタチオンを枯渇する】
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです(下図)。

図:エチルアルコール(エタノール)はアルデヒド脱水素酵素でアセトアルデヒドに代謝され、アセトルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。ジスルフィラムはアルデヒド脱水素酵素を阻害する。アセトアルデヒドは毒性が強いので、細胞や組織にダメージを与える。
アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。ジスルフィラムと銅の組合せ(複合体)はプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。
プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソーム・システムと呼ばれ、細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。
プロテオソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
つまり、ジスルフィラムはプロテアソーム阻害作用による抗がん作用もあるということです(573 話)。
ジスルフィラムはタンパク質のシステインに反応して活性を阻害する機序によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼなど様々ながん促進性のタンパク質を阻害します。
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります(下図)。

図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
抗がん剤治療にジスルフィラムを併用すると、がん細胞の抗がん剤感受性を高めることができます。ただし、点滴の抗がん剤の中にはアルコールで溶解して使用するものもありますので、アルコールを使用しない抗がん剤であることを確認することが重要です。
【オーラノフィンはチオレドキシン還元酵素を阻害する】
チオレドキシン(Thioredoxin: Trx)はグルタチオンとならんで細胞内を還元状態に保つ重要な物質で、様々なストレスから細胞を保護する機能を持ちます。分子内に酸化還元活性を有するSH基を持つ抗酸化酵素で、活性酸素から細胞を保護する作用を示すほか、細胞内シグナル伝達にも関与する多機能タンパク質です。
細胞内における主要な抗酸化機構の一つであり、細菌からヒトに至るまで普遍的に存在しています。チオレドキシン・システムは、チオレドキシン、チオレドキシン還元酵素、NADPHより構成されます。
還元型チオレドキシンは、酸化された標的タンパク質に結合し、標的タンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身のチオール基は酸化されます。
酸化型チオレドキシンは、NADPHの存在下でチオレドキシン還元酵素の作用により還元され、 再び還元型に戻ります。NADPHはペントースリン酸回路で産生されます。オーラノフィンはチオレドキシン還元酵素を阻害します。(下図)
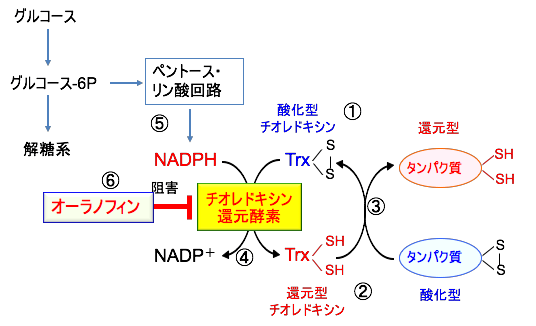
図:チオレドキシンは活性部位の2つのシステイン基の間でジスルフィド(S-S)結合を作る酸化型(①)とジチオール(-SH-SH)を作る還元型(②)が存在する。還元型チオレドキシンは酸化された標的タンパク質に結合してタンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身のチオール基(-SH)は酸化されてジスルフィド(S-S)になる(③)。酸化型チオレドキシンはNADPHの存在下でチオレドキシン還元酵素の作用により還元され、再び還元型に戻る(④)。NADPHはペントースリン酸回路で産生される(⑤)。オーラノフィンはチオレドキシン還元酵素を阻害する(⑥)。
放射線や抗がん剤はがん細胞に活性酸素の産生を高めて酸化傷害を引き起こして死滅させます。これに対してがん細胞はチオレドキシン・システムを使って酸化傷害を軽減して細胞死に抵抗性を示します。
オーラノフィンはチオレドキシン(Trx)還元酵素を阻害してがん細胞の抗酸化力を低下させることによって、放射線治療や抗がん剤治療の効果を高めることができます。
一方、抗酸化剤は放射線や抗がん剤の抗腫瘍効果を阻害します。外来性にグルタチオンやN-アセチルシステインなどの抗酸化剤を摂取すると抗がん剤や放射線治療の効き目を弱めます。
DNAの構造の解明でノーベル賞を受賞したジェームズ・ワトソンは、「抗酸化性のサプリメントは、がん細胞の増殖を促進する」、「がん細胞の抗酸化力を減弱させる抗-抗酸化剤(Anti-antioxidant)はがん治療薬として有望である」という趣旨の発現をしています。(357話参照)

図:放射線や多くの抗がん剤は活性酸素種を産生してがん細胞にダメージを与えて死滅させる。がん細胞はチオレドキシン活性が高めて、活性酸素種によるダメージに抵抗性を示す。オーラノフィンはチオレドキシン還元酵素の活性を阻害して、がん細胞の抗酸化力を減弱させる。したがって、オーラノフィンは放射線や抗がん剤の抗腫瘍効果を増強する。
オーラノフィンはがん細胞のチオレドキシン還元酵素を阻害する作用によって、酸化ストレスを高め、放射線治療や抗がん剤治療の効果を高めることが多くの実験で明らかになっています。以下のような報告があります。
Auranofin radiosensitizes tumor cells through targeting thioredoxin reductase and resulting overproduction of reactive oxygen species(オーラノフィンは、チオレドキシンレダクターゼを阻害して活性酸素種の過剰産生を引き起こしてがん細胞の放射線感受性を増強する)Oncotarget. 2017 May 30; 8(22): 35728–35742.
【要旨】
オーラノフィンは関節リュウマチの治療薬であるが、がん細胞における酸化還元バランスを崩す作用があるため、抗がん剤治療との併用が検討されている。
この研究では、オーラノフィンが、還元性タンパク質のチオレドキシンを介して作用する抗酸化防御システムにおける重要な酵素であるチオレドキシン還元酵素を阻害することによって、がん細胞の放射線感受性を増強するかどうかを検討した。
マウスのがん細胞株の4T1およびEMT6を用いた実験で、3~10μMのオーラノフィンがインビトロで強力な放射線増感剤であり、少なくとも2つのメカニズムがチオレドキシン還元酵素による放射線感受性増強に関与することを明らかにした。
第1に、活性酸素を消去するN-アセチルシステインを添加するとオーラノフィンによる放射線感受性増強作用を妨げられるため、オーラノフィンの作用は酸化ストレスと関連している。
我々はまた、ミトコンドリアでの酸素消費を減少させることによって、低酸素条件下で放射線増感剤として作用する酸素を増やすことを認めた。
全体として、オーラノフィンによる放射線増感には、活性酸素の過剰産生、ミトコンドリア機能不全、DNA損傷およびアポトーシスが伴っており、これがオーラノフィンの細胞毒性と抗腫瘍効果のメカニズムになっていることが示された。
担癌マウスでは、オーラノフィンとブチオミン・スルホキシミン(buthionine sulfoximine)の併用によるチオレドキシンおよびグルタチオン系の同時阻害は、がん細胞の放射線感受性を有意に改善することが示された。
以上の結果から、放射線治療における抗腫瘍効果増強のターゲットとしてのチオレドキシン還元酵素の役割を明らかにし、放射線療法におけるオーラノフィンの併用の有用性について、さらに検討する必要性が示された。
このような医薬品再利用を使って、がん幹細胞の酸化ストレスを高めてがん組織の消滅を目的とした研究が注目されています。以下のような報告があります。
Repurposing drugs as pro-oxidant redox modifiers to eliminate cancer stem cells and improve the treatment of advanced stage cancers.(がん幹細胞を排除し、進行期がんの治療を改善するための酸化促進性レドックス修飾剤としての医薬品の再利用)Med Res Rev. 2019 May 20. doi: 10.1002/med.21589. [Epub ahead of print]
【要旨】
過去10年間で、3つの大きな進歩ががんの治療効果の改善に貢献した。一つは免疫療法の進歩である。2つ目は発がんにおける分子、生化学、および細胞メカニズムの解明により、新たな薬物標的が発見されたことである。さらに3つ目は、早期発見のための信頼できるバイオマーカーの特定により、病気の早期治療が促進された。
上記の治療法の組み合わせによりがん患者の生存率が確実に改善されたにもかかわらず、単一の万能のがん治療法はまだ見つかっていない。
したがって、薬剤耐性の発生が頻繁に発生し、より悪性度の高いがん細胞の発生を促進するデメリットがあるにもかかわらず、化学療法はがん治療のための重要な治療法のままである。
ここでの焦点は、酸化ストレスを促進することによって、化学療法に対する耐性の発現を克服し、特に転移がんに対する化学療法の効き目を強化するために既存の医薬品の再利用を探ることである。
米国食品医薬品局が承認した医薬品の中で再利用に適した優れた例は、強力で特異的なチオレドキシン還元酵素阻害剤のオーラノフィン(auranofin)と非ステロイド性抗炎症薬であるセレコキシブ(celecoxib)である。
最近、この2つの薬物は、主にミトコンドリアの活性酸素種の産生を促進することにより、転移性がん細胞およびがん幹細胞を選択的に標的として、死滅することが示された。
このように進行期の転移がん細胞およびがん幹細胞の細胞内酸化還元システムをターゲットにすると、酸化ストレスを亢進し、アポトーシス(プログラムされた細胞死)の内因性経路が活性化される。がん細胞の酸化還元システムを標的としたオーラノフィンやセレコキシブなどの医薬品の再利用によって、化学療法の奏功率と生存率の向上が期待できる。
つまり、リュウマチ治療薬として使用されているオーラノフィンと抗炎症剤のセレコキシブを組み合わせると、がん細胞の酸化ストレスが亢進して、抗がん剤治療の効き目を高めることができるということです。がん細胞の酸化還元(レドックス)システムをターゲットにするとがん治療の効果を高めることができ、その目的にオーラノフィンとセレコキシブの組み合わせが有効という話です。
【オーラノフィンとセレコキシブはがん細胞の酸化ストレスを高める】
前述の論文で紹介されていたオーラノフィンとセレコキシブの組み合わせの論文は以下です。
Synergy between Auranofin and Celecoxib against Colon Cancer In Vitro and In Vivo through a Novel Redox-Mediated Mechanism.(酸化還元システムによる新規な作用機序によるin vitroおよびin vivoでの結腸がんに対するオーラノフィンとセレコキシブの相乗効果)Cancers (Basel). 2019 Jul 3;11(7). pii: E931. doi: 10.3390/cancers11070931.
【要旨】
関節リウマチの治療のための米国食品医薬品局(FDA)承認薬であるオーラノフィンが、さまざまな実験モデルで選択的な抗がん活性を持っていることが最近の多くの研究で示されている。しかし、臨床試験の結果は、オーラノフィンは単剤として使用した場合の抗がん作用は弱いことが明らかになっている。
この研究では、オーラノフィンの抗がん活性を強化する化合物を見つけるために、FDA承認薬物ライブラリーのスクリーニングを実施し、抗炎症薬のセレコキシブがオーラノフィンの抗がん活性をin vitroおよびin vivoで強力に強化するという予想外の結果を得た。
作用機序的には、オーラノフィンとセレコキシブの組み合わせは、活性酸素の産生を増やして酸化ストレスを亢進し、活性酸素種を介したヘキソキナーゼの阻害とミトコンドリアの酸化還元恒常性の障害を引き起こして、ATP生成の大幅な減少を引き起こした。
セレコキシブによって誘導された活性酸素種産生と、オーラノフィンによるチオレドキシン還元酵素の阻害作用は、チオレドキシン還元酵素を酸化状態へシフトし、MTCO2の分解と電子輸送鎖の機能不全を引き起こす。
私たちの研究は、in vivoでがん細胞を効果的に除去する新しい薬物の組み合わせを特定した。 オーラノフィンとセレコキシブは現在臨床で使用されているFDA承認薬であるため、この研究の結果をがん治療に臨床応用することは可能である。
オーラノフィンは関節リュウマチの治療薬として古くから臨床で使用されています。前述のように、オーラノフィンはチオレドキシン還元酵素を阻害して酸化ストレスを高め、抗がん作用を発揮することが知られています。
培養細胞や動物を使った研究で抗がん作用が明らかになり、白血病、肺がん、卵巣がんなどで臨床試験が実施されています。しかし、その結果はあまり良くないようです。つまり、オーラノフィン単独での抗腫瘍効果は弱いことが明らかになっているのです。
そこで、オーラノフィンの抗腫瘍効果を高める医薬品がないかを探索する目的で、FDAが認可している1280種類の医薬品をスクリーニングしています。すでにFDAが認可している薬なので、もしオーラノフィンの抗腫瘍効果を高める効果があれば、すぐに臨床で使用できるメリットがあるわけです。
そのスクリーニングの結果、シクロオキシゲナーゼ-2の選択的阻害剤のセレコキシブがオーラノフィンの抗腫瘍効果を増強することが明らかになったのです。
この2つの組み合わせは、がん細胞のミトコンドリアの活性酸素の産生を高めて、解糖系酵素のヘキソキナーゼの活性を不活性化することが示されています。さらに、ミトコンドリアの呼吸酵素の働きを阻害してATPの産生を大きく阻害して、細胞を破綻させることを示しています。
また、セレコキシブの活性酸素産生亢進作用はCOX-2に依存しないことが示されています。すなわち、COX-2の遺伝子をノックダウンしたがん細胞でも同様な作用が見られたためです。
セレコキシブはCOX-2阻害作用以外に、この作用とは関係ないメカニズムで抗がん作用を発揮することが多く報告されています。
オーラノフィンとセレコキシブに、さらに、ジスルフィラムやジクロロ酢酸や2-デオキシ-D-グルコースやメトホルミンなどを組み合わせると、がん細胞の酸化ストレスを高めて死滅できます(下図)。

図:がん細胞はグルコーストランスポーター1(GLUT1)からのグルコースの細胞内取り込みが増えている。細胞内に取り込まれたグルコースはヘキソキナーゼでグルコース6-リン酸に変換され(①)、解糖系でピルビン酸まで代謝されたあと、乳酸脱水素酵素(LDH)で乳酸になる(②)。この解糖系では1分子のグルコースから2分子のATPが産生される(③)。ミトコンドリアに入ったピルビン酸はピルビン酸脱水素酵素(PDH)でアセチルCoAに変換され(④)、TCA回路と呼吸鎖(電子伝達系)による酸化的リン酸化によって(⑤)、大量のATP(グルコース1分子当たり約30分子のATP)が産生される(⑥)。オーラノフィンとセレコキシブを併用すると細胞内の活性酸素種(ROS)の産生が亢進し、酸化傷害によってヘキソキナーゼの活性が阻害される(⑦)。同様にミトコンドリアでも活性酸素種の産生が亢進し、呼吸鎖の酵素がダメージを受けてATP産生が阻害される(⑧)。ジスルフィラム、ジクロロ酢酸ナトリウム、2-デオキシ-D-グルコース、アルテスネイト、高濃度ビタミンC点滴、メトホルミンなども多彩なメカニズムで活性酸素種(ROS)の産生を高める(⑨)。これらの治療法を組み合わせて、がん細胞内の活性酸素種の産生を増やして酸化ストレスを亢進すると細胞死を誘導できる(⑩)。
【メトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害する】
ミトコンドリアの呼吸鎖や酸化的リン酸化の過程が阻害されると、プロトン(水素イオン)がうっ滞して、ミトコンドリアからの活性酸素種の産生が増加します。
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。さらに、ミトコンドリアのグリセロールリン酸脱水素酵素を阻害することも報告されています。
その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。
活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。AMPKはインスリン感受性を高めるので、少ないインスリンで血糖をコントロールできるようになります。
インスリンは老化と発がんを促進し、がん細胞の増殖を促進するので、糖尿病でない人でも抗老化とがん予防の目的でメトホルミンを服用している人は多くいます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。運動でATPが減少してAMPKが活性化されるのと同じメカニズムです。ATP産生が減少するのでAMPKが活性化します。
このメトホルミンの呼吸酵素阻害作用は、がん細胞において活性酸素の産生を増やす目的でがん治療への応用が検討されています。

図:メトホルミンはミトコンドリアの呼吸酵素を阻害する(①)。その結果、ATP産生が減少してAMP/ATP比が上昇し(②)、AMP活性化プロテインキナーゼ(AMPK)が活性化する(③)。AMPKの活性化は細胞の増殖を抑制する。ATP産生の減少(エネルギー低下)は増殖を抑制する(④)。呼吸鎖の阻害によってミトコンドリアでの活性酸素の産生が増え(⑤)、酸化ストレスで細胞は障害される(⑥)。
ミトコンドリアはエネルギー(ATP)産生だけでなく、細胞内カルシウムの恒常性維持、アポトーシス制御、細胞内シグナル伝達系など多くの機能において重要な働きを担っています。
がん細胞は活性酸素の産生を抑えるためにミトコンドリアの酸素呼吸を抑制していますが、ミトコンドリアが破綻して機能が阻害されると、がん細胞は生存できません。
ミトコンドリアを活性化して(酸素呼吸を増やして)、同時にミトコンドリアの呼吸鎖や機能を阻害すると、活性酸素の発生が増え、酸化ストレスが亢進して、がん細胞特異的にミトコンドリアを破綻できることになります。
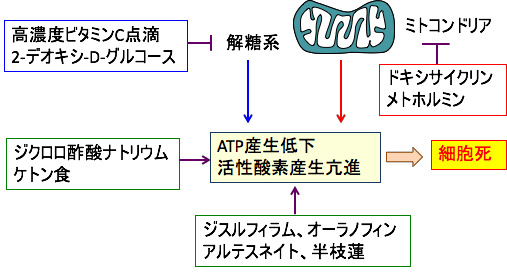
図:細胞質での解糖系とミトコンドリアでの酸素呼吸(酸化的リン酸化)を同時に阻害すれば、エネルギー(ATP)が枯渇して細胞は死滅する。解糖系阻害の方法として高濃度ビタミンC点滴や2-デオキシグルコースがある。ミトコンドリアでのエネルギー阻害にはメトホルミンやドキシサイクリンがある。さらに、酸化ストレスを高める方法としてジクロロ酢酸ナトリウム、ケトン食、ジスルフィアム、オーラノフィン、アルテスネイト、半枝蓮などの併用も有効。これらを組み合せることによってがん細胞に選択的を死滅できる。
| « 677)ミトコン... | 679)イベルメ... » |



