がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
741)断酒薬ジスルフィラムの抗がん作用(その3):転用薬を組み合わせたがん代替療法
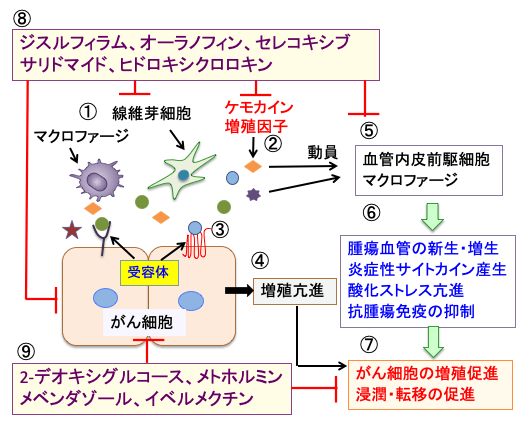
図:がん組織はがん細胞以外にマクロファージや線維芽細胞などの間質細胞が存在する(①)。がん組織中の線維芽細胞やマクロファージはケモカインや増殖因子を産生し(②)、がん細胞の受容体が刺激されて(③)、増殖や浸潤が亢進する(④)。ケモカインや増殖因子は骨髄の血管内皮前駆細胞や炎症細胞(マクロファージなど)をがん組織に動員する(⑤)。その結果、がん組織は血管の新生・増生や炎症性サイトカインの産生、酸化ストレスの亢進、抗腫瘍免疫の抑制が起こり(⑥)、がん細胞の増殖や浸潤や転移が促進される(⑦)。ジスルフィラム、オーラノフィン、セレコキシブ、サリドマイド、ヒドロキシクロロキンはがん細胞と間質細胞の様々なレベルで抑制作用を示す(⑧)。2-デオキシグルコース、メトホルミン、メベンダゾール、イベルメクチンはがん細胞の代謝やシグナル伝達系を阻害して増殖を抑制し、細胞死を誘導する(⑨)。これらの再使用薬(転用薬)を組み合わせると、副作用の少ない方法で、がん細胞の増殖を抑制し、細胞死を誘導できる。
741)断酒薬ジスルフィラムの抗がん作用(その3):転用薬を組み合わせたがん代替療法
【間質の細胞ががん細胞の増殖や転移に影響する】
がん組織はがん細胞と間質から構成されます。
正常な臓器や組織の場合は、その臓器や組織に固有の細胞(粘膜上皮細胞や肝細胞や筋肉細胞など)に対し、それらの間に入り込む結合組織や血管や神経や線維芽細胞などを間質(Stroma)と言います。
がん組織の場合は、がん細胞以外の結合組織やその中に存在する炎症細胞や免疫担当細胞や線維芽細胞や血管やリンパ管などからなる部分が間質になります。そしてこのようながん組織の間質は、がんを取りまく特徴的な微小環境を構築しており、「がん微小環境」と言われます。
がん細胞と間質は種(seed)と土壌(soil)の関係と同じで、土壌が悪ければ種は育たないのと同じで、がん細胞の増殖や転移に間質(=がん微小環境)が重要な役割を果たしていることが明らかになっています。
すなわち、がんの増殖・浸潤・転移のしやすさは、がん細胞自体のもつ特性のみならず、がん細胞と微小環境との相互関係が深く関わっているのです。
例えば、がんの増殖や転移には、腫瘍血管の新生が極めて重要で、炎症細胞から産生される増殖因子などが血管新生を促進しています。また、がん間質中の線維芽細胞はがん関連線維芽細胞(Cancer associated fibroblasts: CAFs)と呼ばれ、血管新生を促進したり、がん細胞の増殖や浸潤や転移などに関与することが知られています。
このがん関連線維芽細胞は正常組織の線維芽細胞とは異なる性質を持っていて、がん細胞の増殖を助ける働きがあります。例えば、がん細胞を正常な線維芽細胞を混ぜて移植しても腫瘍を形成しないのに、がん関連線維芽細胞と一緒に移植すると腫瘍を形成するという実験もあります。これは、がん細胞とがん関連線維芽細胞の両者の間で液性因子(増殖因子やサイトカンや化学伝達物質など)を介した相互作用や、細胞間の接触や細胞成分の移動を介した相互作用などががん細胞の増殖や転移や悪性化に大きな影響を及ぼしていることを示しています。
がん細胞は様々なケモカインや増殖因子を分泌して、血管内皮細胞や炎症細胞や線維芽細胞などの間質細胞をがん組織に動員しています。一方、動員された線維芽細胞やマクロファージやリンパ球も様々な因子を産生・分泌してがん細胞の増殖や浸潤や転移を促進しています。つまり、がん組織内ではがん細胞と間質の細胞の相互作用によって増大や転移が制御されているのです。

図:がん細胞は、間質の炎症細胞(マクロファージなど)や線維芽細胞や血管によって生存や増殖が維持され刺激されている。がん細胞と間質細胞は密接に相互作用を行うことによってがん組織は増大する。したがって、がん治療においてより効果的な抗腫瘍効果を得るためには、がん細胞と同時に、間質の細胞もターゲットにすることが重要。
このようながん微小環境(がんの間質)をターゲットにしたがん治療(Tumor stroma-directed therapy)も検討されています。
がん細胞は遺伝子変異が起こり薬剤耐性や悪性化進展が起こるので、薬が効きにくくなりますが、がん細胞の増殖や転移を促進するがん関連線維芽細胞や腫瘍血管は遺伝子的に正常で安定なので、薬剤に対する感受性は変わらないという利点があります。
免疫担当細胞やがん関連線維芽細胞が産生する増殖因子や炎症性サイトカインやフリーラジカルやプロスタグランジンなどの伝達物質などの産生を阻害し、がん細胞を取りまく環境を変えることによって、がん細胞の増殖や浸潤や転移や悪性進展を防ぐことも可能です。
つまり、がんの治療戦略においては、がん細胞だけをターゲットにするのではなく、がんの間質と体全体の治癒力も重要です。
がん治療は「がん細胞に直接作用する効果」だけでなく、「抗炎症作用や血管新生阻害などのがん微小環境に作用する効果」と「免疫力や治癒力を高める効果」の3つを同時にターゲットにする視点が重要だと思います。
【高用量の抗がん剤投与はがん細胞の浸潤性や転移を促進する】
高用量の抗がん剤投与によってがん組織が強くダメージを受けると、がん細胞やがん組織の間質にいる線維芽細胞(がん関連線維芽細胞)などからダメージを受けたがん組織を修復するため様々な炎症性サイトカインやケモカインや増殖因子などが産生されます。
炎症性サイトカインは免疫細胞や炎症細胞から分泌されるたんぱく質で炎症反応の制御に関わります。ケモカインはサイトカインの一種で、白血球などの遊走を引き起こして炎症反応に関わります。
このような因子によって血管内皮前駆細胞が骨髄から動員されて、血管形成が促進されて、がん細胞の増殖や転移が促進することが明らかになっています。
がん組織がダメージを受けるとCXCL12というケモカインの産生が増えます。CXCL12は本来は炎症などにおいてリンパ球や造血幹細胞の移動に関与していますが、骨髄の血管内皮前駆細胞はこのケモカインの受容体を持っているので、がん組織から産生されるCXCL12によってがん組織に動員されて血管新生が促進されることが報告されています。
また、CCL2というケモカインもダメージを受けたがん組織から分泌されます。CCL2は別名を単球走化性タンパク質-1と言い、創傷部位やがん組織にマクロファージや単球を動員する作用があります。CCL2はがん細胞に存在する受容体に結合してがん細胞の増殖や生存や浸潤を亢進します。
がん関連線維芽細胞はCXCL12やCCL2のようなケモカインだけでなく、HGF(Hepatocyte Growth Factor)などの様々な増殖因子や活性酸素を産生することによってがん細胞の増殖や浸潤を促進しています。
そして、抗がん剤治療によって強いダメージを受けると、損傷を受けたがん組織のダメージを修復する目的でケモカインや増殖因子を産生して血管内皮前駆細胞やマクロファージを動員し、その結果、がん細胞の増殖や浸潤は促進され、がんはさらに悪化するという経過を辿ることになります。
これが、高用量の抗がん剤治療がうまくいかない理由の一つです。抗がん剤治療のターゲットはがん細胞だけでなく、間質の細胞(線維芽細胞やマクロファージなど)とがん細胞の相互作用についても十分に考慮することが重要です。

図:抗がん剤治療によってがん組織はダメージを受ける(①)。ダメージを受けた組織を修復するために、がん組織中の線維芽細胞やマクロファージが活性化され(②)、ケモカインや増殖因子が産生される(③)。がん細胞のケモカインや増殖因子に対する受容体が刺激されて(④)、増殖や浸潤が亢進する(⑤)。ケモカインや増殖因子は骨髄の血管内皮前駆細胞や炎症細胞(マクロファージなど)をがん組織に動員する(⑥)。その結果、抗がん剤でダメージを受けたがん組織は血管の新生・増生や炎症性サイトカインの産生、抗腫瘍免疫の抑制が起こり(⑦)、その結果、がん細胞の増殖や浸潤や転移が促進される(⑧)。
【ジスルフィラムはがん組織内へのマクロファージの動員を阻害する】
ジスルフィラムが腫瘍関連マクロファージのがん組織への動員を阻害し、免疫チェックポイント阻害剤の治療効果を高めることが報告されています。以下の論文は東京理科大学の研究グループからの報告です。
Targeting FROUNT with disulfiram suppresses macrophage accumulation and its tumor-promoting properties.(ジスルフィラムによるFROUNTの標的化は、マクロファージの蓄積とその腫瘍促進特性を抑制する)Nat Commun. 2020 Jan 30;11(1):609. doi: 10.1038/s41467-020-14338-5.
【要旨】
腫瘍関連マクロファージは、腫瘍の進行と免疫チェックポイント療法への抵抗に影響する。この研究では、ケモカイン・シグナルの制御因子であるFROUNTが、腫瘍関連マクロファージを制御するための標的になることを明らかにした。
がん患者におけるFROUNT発現の低さは、より良い臨床結果と相関する。
Frount欠損症は腫瘍の進行を著しく低下させ、マクロファージの腫瘍促進活性を低下させる。
FROUNTはマクロファージで高度に発現され、その骨髄特異的欠失は腫瘍の成長を抑制する。さらに、アルコール依存症治療薬のジスルフィラムは、FROUNTを強力に阻害する。
ジスルフィラムは、FROUNTのケモカイン受容体結合ドメインの特定の部位へ直接結合して、FROUNT-ケモカイン受容体の相互作用を妨害し、マクロファージの応答を阻害する。
ジスルフィラムの単独投与は、Frount欠損症の場合と同様に、腫瘍の進行を減少させ、マクロファージによる腫瘍促進活性を減少させる。さらに、ジスルフィラムと免疫チェックポイント抗体との併用治療は、相乗的に腫瘍の成長を阻害する。
したがって、ジスルフィラムによるFROUNTの阻害は、マクロファージを標的としたがん治療の有望な戦略を示唆している。
前述のように、CCL2は別名をmonocyte chemotactic protein-1(単球走化性タンパク質-1;MCP-1)と言い、創傷部位やがん組織にマクロファージや単球を動員する作用があります。誘引されたマクロファージは腫瘍関連マクロファージとしてがん細胞の増殖を助けるようになることが分かっています。
CCL2はがん関連線維眼細胞やがん細胞から分泌され、がん細胞に存在するCCR2に結合してがん細胞の増殖や生存や浸潤を亢進します。
がん関連線維芽細胞はCXCL12やCCL2を分泌します。
この研究グループは、2005年にマクロファージが体内を移動(遊走)する際に動きを制御する細胞内タンパク質としてFROUNT分子を発見、命名していました。
この研究では、このFROUNT分子の生体における機能を明らかにする中で、FROUNTを欠損させたマウスではがん細胞の増殖が弱まっていること、マクロファージの数や活性化も減少していることを見出しました。
ヒトにおいても、FROUNTの発現の低い患者さんでは、発現の高い患者さんと比較して手術後の予後が良いことがわかりました。
そこでFROUNTを標的とした新たな抗がん剤の開発を目指し、およそ13万種類の化合物について創薬スクリーニングを行った結果、既存のアルコール依存症治療薬のジスルフィラムがFROUNT分子内の特定の部位へ結合することでFROUNTの機能を阻害してマクロファージを調節して、がんを治療できることを発見し報告しました。
がん細胞に対するジスルフィラムの直接の抗腫瘍効果のメカニズムに関しては、がん幹細胞で過剰発現しているアルデヒド脱水素酵素を阻害する作用、酸化ストレスを高める作用、プロテアソームを阻害する作用など、多数の報告があります(739話、740話参照)。
この論文は、がん組織において「がん細胞の増殖や転移の促進」や「抗腫瘍免疫の抑制」に関与している腫瘍関連マクロファージに対して、ジスルフィラムが抑制効果を示すという報告です。
この発見は、「新規なメカニズムによるがん治療法」や「安価な既存薬ががん治療に使える」という観点からインパクトはあります。
東京理科大学は2020年1月30日にプレスリリースをしています。そのプレスリリースのタイトルは『アルコール依存症治療薬「ジスルフィラム」が新しい標的タンパク(FROUNT:フロント)を阻害してがんを抑制することを発見 ~世界初:マクロファージを調節する抗がん剤開発への新たな道~』となっています。
このプレスリリースの要旨は以下です。
・マクロファージはがんの悪化に影響するが、マクロファージを調節する抗がん薬はなく、標的分子の発見と制御方法の開発が求められていた。
・マクロファージの動きに関わる細胞内タンパク質FROUNTの働きを阻害することでがん組織へのマクロファージの集積や活性化を抑制し、がんの増殖を抑えられることが明らかになった。
・アルコール依存症治療薬「ジスルフィラム」がFROUNTを阻害し、がんを抑制できることが見出された。また、既存の免疫チェックポイント療法との併用により、同療法の効果が出にくいがん細胞の増殖も抑えられることが明らかになった。
・本研究の成果はNature Communications 2020年1月30日オンライン版に掲載された。
マクロファージはがんを悪化させるので、この腫瘍関連マクロファージをターゲットにすると新規のがん治療薬になるというアイデアです。マクロファージの動きに関わる細胞内タンパク質FROUNT(フロント)の働きを阻害することで、がん組織へのマクロファージの集積や活性化を抑制し、がんの増殖を抑えられることが確認できたという報告です。FROUNTの阻害剤として約13万種類の化合物をスクリーニングし、既存薬のジスルフィラムにその阻害作用が見つかったという報告です。
詳しい内容は東京理科大学のプレスリリースのサイト(https://www.tus.ac.jp/mediarelations/archive/20200130009.html)をご参照ください。
また、M2型の腫瘍関連マクロファージは抗腫瘍免疫を抑制する作用があります。したがって、ジスルフィラムで腫瘍関連マクロファージを減らすとオプジーボなどの免疫チェックポイント阻害剤の効き目を高める効果が期待できます。免疫チェックポイント阻害剤とジスルフィラムとの併用療法の有効性に関して臨床試験を行っていると報告しています。
このプレスリリースでは「マクロファージを調節する抗がん薬はない」と言っていますが、医薬品の再利用(転用)によるがん代替療法の分野では、腫瘍関連マクロファージをターゲットにした薬はいくつか知られています。
例えば、骨転移の治療薬のゾレドロン酸は破骨細胞の働きを阻害して骨を強くする薬ですが、破骨細胞はマクロファージの一種であることから、がん組織中の腫瘍関連マクロファージの抑制によるがん治療にも試みられています。
シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)はM1型の腫瘍関連マクロファージをM2型に変換します。
したがって、COX-2阻害剤のcelecoxib(セレコックス)とSTAT3を阻害するオーラノフィンの併用はM2型の腫瘍関連マクロファージの活性抑制に有効です。
ジスルフィラムとオーラノフィンとセレコキシブの併用は副作用が少なく、直接的な抗腫瘍効果と抗腫瘍免疫の増強効果が期待できます。
サリドマイド、オーラノフィン、カンナビジオールはがん細胞や炎症細胞からの炎症性サイトカインやケモカインの産生を抑制します。(下図参照)

図:高用量の抗がん剤投与によってがん組織がダメージを受けると、腫瘍組織内のがん細胞や炎症細胞や線維芽細胞などから炎症性サイトカインや増殖因子やケモカインが分泌され(①)、がん組織にマクロファージが動員される(②)。シクロオキシゲナーゼ-2(COX-2)とシグナル伝達兼転写活性化因子3(Signal transducer and activator of transcription 3 :STAT3)はがん組織に動員された腫瘍関連マクロファージ(M1型)をM2型腫瘍関連マクロファージに変換し(③)、このM2型腫瘍関連マクロファージは様々なサイトカインや増殖因子を産生してがん細胞の増殖や転移を亢進する(④)。サリドマイド、オーラノフィン、カンナビジオールは炎症性サイトカインや増殖因子やケモカインの産生を抑制し(⑤)、セレコキシブ(celecoxib)はCOX-2を阻害し(⑥)、オーラノフィンはSTAT3を阻害する(⑦)。抗がん剤治療によるがんの悪化を阻止する方法として、これらの薬剤は役立つ。
東京理科大学のこの論文は、大学がプレスリリースするくらい新規性とインパクトのある発見で、Nature Communications という比較的レベルの高い、生物や科学の研究者の多くが読んでいる学術雑誌に掲載されています。Nature Communicationsはオープンアクセスの学術雑誌で、インターネットを通じて誰もが無料で閲覧可能な学術雑誌です。
しかし、この論文を引用した論文は1年たっても3件しかありません(2021年2月10日のデータ)。それもジスルフィラムの総説論文だけです。つまり、がん研究者には、あまり注目されていないということになります。
その理由は、ジスルフィラムが60年以上前から使用されており、物質特許が取れないので、ジスルフィラムの抗がん作用を研究しても、製薬会社も医師も利益につながらないためです。
新規に開発されたがん治療薬であれば、製薬会社も莫大な費用を使って、多くの基礎研究や臨床試験を実施して論文を発表するインセンティブ(動機)が発生しますが、特許がとれない物質の研究は公的なグラント(研究費)でしか実施できません。発表しても研究者の論文数が1個増えるだけで、他の利益は発生しません。
しかし、ジスルフィラムは欧米など外国ではがんの代替療法ではかなり使用されています。ジスルフィラムの抗がん作用に関する基礎研究はここ数年増えています。(740話参照)
私自身、がんの代替療法として6年くらい前からジスルフィラムを100人以上の進行がん患者さんに使用していますが、確かに効いているという手応えは感じています。
飲酒できないという点だけが欠点ですが、飲酒しなければ副作用はほとんど経験しません。(パクリタキセルなどアルコールを溶解に用いる抗がん剤などの使用中も使用できません)
【シクロオキシゲナーゼ-2はM2型の腫瘍関連マクロファージを増やして抗腫瘍免疫を抑制する】
活性化したマクロファージとがん細胞はともにシクロオキシゲナーゼ-2(COX-2)の活性が亢進しています。COX-2活性亢進はプロスタグランジンE2(PGE2)の産生を増やします。PGE2はがん細胞におけるPD-L1の発現を亢進して細胞傷害性T細胞(キラーT細胞)の活性を阻害します。
細胞傷害性T細胞は抗原提示細胞(樹状細胞やマクロファージ)から抗原を提示されると活性化されて、敵(病原菌やがん細胞など)を攻撃します。
細胞傷害性T細胞にはPD-1という受容体が存在します。PD-1はプログラム細胞死1(programmed death-1)の略です。
PD-1にリガンド(受容体に結合して作用する物質)となるPD-L1を抗原提示細胞が持つことによって細胞傷害性T細胞の働きを抑制しています。
つまり、PD-1受容体がPD-L1によって刺激されると、T細胞の増殖が停止し細胞死を来すことになります。このようにして細胞傷害性T細胞の過剰な応答を制御しています。
細胞傷害性T細胞の働きを阻害するPD-L1はがん細胞にも発現しています。つまり、がん細胞は免疫系の制御システムを利用して、がん組織内の細胞傷害性T細胞の働きを阻止しています。プロスタグランジンE2はがん細胞におけるPD-L1の発現を亢進することによって細胞傷害性T細胞の働きを阻害します。(下図)

図:抗原提示細胞上にはMHCクラスII(MHC-II)といわれる分子があり、抗原を介してT細胞上のTCR(T細胞受容体)と反応して細胞傷害性T細胞を活性化する(①)。PD-1(Programmed death-1)は抗原提示細胞のPD-L1と結合することによって抑制型の免疫調節シグナルを活性化させる(②)。がん細胞もPD-L1が発現しており、細胞傷害性T細胞の働きを抑制している(③)。プロスタグランジンE2(PGE2)はがん細胞のPD-L1の発現を亢進して細胞傷害性T細胞の働きを抑制する(④)。
また、PGE2はT細胞を動員するケモカインのCXCL9の働きを阻害することによってT細胞の腫瘍内への動員を阻止しています。
また、PGE2はM1型マクロファージを阻害し、M2型マクロファージの活性を亢進します。その結果、CTL(細胞傷害性T細胞)の活性は抑制され、抗腫瘍免疫は低下します。したがって、COX-2阻害剤のcelecoxib(商品名:セレコックス)は抗腫瘍免疫を高める効果が期待できます。

図:がん組織内のマクロファージやがん細胞はシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進し、プロスタグランジンE2(PGE2)の産生が増えている。PGE2によってM2型に誘導されたマクロファージ(M2)は細胞傷害性T細胞(CTL)の活性を抑制する(①)。M1型マクロファージはヘルパーT細胞タイプ1(Th1)を活性化してCTLの働きを亢進する(②)。しかし、PGE2はマクロファージのM1型への移行を阻害するので、PGE2はM1型マクロファージとTh1の阻害を介してCTLを抑制する(③)。PGE2はcolony stimulating factor-1受容体(CSF-1R)の発現を亢進してマクロファージのがん組織への集積を促進する(④)。がん細胞ではPGE2がPD-L1(Programmed Death-1 ligand)の発現を亢進する(⑤)。PD-L1はCTLのPD-1(Programmed Death-1)に作用してCTLの活性を抑制する(⑥)。PGE2は局所にT細胞を動員するケモカインのCXCL9の発現を抑制することによって、がん組織へのT細胞の移動・集積を阻害する(⑦)。PGE2はナチュラルキラー(NK)細胞の活性を阻止する(⑧)。以上のような様々なメカニズムでCOX-2は抗腫瘍免疫を抑制している。COX-2阻害剤のcelecoxib(セレコックス)はCOX-2活性を阻害することによって抗腫瘍免疫を亢進する効果がある(⑨)。(参考:Oncoimmunology. 2014 Jun 30;3:e29287. eCollection 2014.)
【ジスルフィラムは悪性葉状腫瘍に効く?】
有効な抗がん剤が無いがんは多くあります。膵臓がんや膠芽腫やトリプルネガティブ乳がんなど抗がん剤治療に抵抗性を示すがんは数多くあります。その場合、がん細胞の抗がん剤感受性を高めることが重要ですが、標準治療にはそのような治療戦略はありません。
葉状腫瘍は良性の線維腺腫に類似したものから高異型度の肉腫に近いものまで幅広く、組織学的には良性、境界病変、悪性の3つに分類され、悪性に分類されたものを悪性葉状腫瘍といいます。
葉状腫瘍の治療法は現時点では切除のみです。悪性のものは転移することもありますが、切除できない場合は抗がん剤治療が行われますが、現在使用できる抗がん剤では縮小することは稀です。悪性葉状腫瘍の治療にジスルフィラムが役立つ可能性が報告されています。以下のような報告があります。
Malignant phyllodes tumors display mesenchymal stem cell features and aldehyde dehydrogenase/disialoganglioside identify their tumor stem cells.(悪性葉状腫瘍は間葉系幹細胞の特徴を示し、アルデヒド脱水素酵素/ジシアロガングリオシドは腫瘍幹細胞を特定する)Breast Cancer Res. 2014 Mar 26;16(2):R29. doi: 10.1186/bcr3631.
【要旨】
はじめに:乳房葉状腫瘍は稀な腫瘍であるが、手術以外に効果的な治療法はない。葉状腫瘍の腫瘍生物学についてはほとんど知られていない。 悪性葉状腫瘍は様々な間質細胞を含み、横紋筋肉腫、脂肪肉腫、骨肉腫に変化する可能性がある。 これらの性状から、間葉系幹細胞との関係の可能性を探り、葉状腫瘍におけるがん幹細胞の存在を検索した。
方法:悪性葉状腫瘍のパラフィン切片を使い、免疫組織化学的染色によってさまざまなマーカーについて調べた。 ヒト原発性葉状腫瘍のマウス異種移植腫瘍モデルは、新たに単離された腫瘍細胞を重症複合免疫不全症マウスの乳腺脂肪組織に注入することによって作成した。腫瘍幹細胞を検索するために、異種移植腫瘍細胞をフローサイトメトリーによってさまざまな亜集団に分類し、それらのin vitroにおける腫瘍細胞塊形成能、免疫不全マウスにおけるin vivoでの腫瘍形成能、および分化能について検討した。
結果:免疫組織化学的分析により、CD44、CD29、CD106、CD166、CD105、CD90、ジシアロガングリオシド(GD2)、CD117、アルデヒド脱水素酵素1(ALDH)、Oct-4、および7つの臨床的に関連するマーカー( CD10、CD34、p53、p63、Ki-67、Bcl-2、ビメンチン、およびGlobo H)が、程度は異なるが、調べた51個の悪性葉状腫瘍の全てにおいて、発現が認められた。
4つの異種移植片がヒト原発性葉状腫瘍から確立された。インビトロでは、異種移植片から選別されたALDH発現陽性(ALDH+)細胞は、ALDH発現陰性(ALDH-)細胞よりも約10倍大きい腫瘍細胞塊形成能を示した。
GD2発現陽性(GD+)細胞はGD2発現陰性(GD-)細胞より3.9倍大きい腫瘍細胞塊形成能を示した。 ALDH + / GD2 +細胞は、ALDH- / GD2-細胞よりも12.8倍高い腫瘍細胞塊形成能を示した。
インビボでは、ALDH + / GD2 +細胞の腫瘍形成能はALDH +細胞のそれよりも最大33倍高く、生着にはわずか50個のALDH + / GD2 +細胞で十分であった。
さらに、臨床標本および悪性葉状腫瘍の異種移植片において神経細胞への分化を観察し、ALDH + / GD2 +細胞が様々な系統の神経細胞に分化するように誘導するための最初の証拠を提供した。 ALDH +またはALDH + / GD2 +細胞は、脂肪細胞、骨細胞、または軟骨細胞に分化するように誘導することもできる。
結論:我々の発見は、悪性葉状腫瘍が間葉系幹細胞のの多くの特徴を有しており、それらの腫瘍幹細胞がALDH +およびALDH + / GD2 +亜集団に富んでいることを明らかにした。
つまり、悪性葉状腫瘍は間葉系幹細胞の特徴を有し、アルデヒド脱水素酵素の発現が高いほど、腫瘍形成能と増殖速度が高いということです。したがって、アルデヒド脱水素酵素阻害剤のジスルフィラムは悪性葉状腫瘍の抗がん剤治療の効果を高める可能性が示唆されます。
【オートファジー阻害剤はジスルフィラムの抗腫瘍効果を高める】
以下の様な報告があります。
Suppressing autophagy enhances disulfiram/copper-induced apoptosis in non-small cell lung cancer(オートファジーの抑制は非小細胞肺がんにおけるジスルフィラム/銅によるアポトーシス誘導を増強する) Eur J Pharmacol. 2018 May 15;827:1-12.
【要旨】
オートファジーは細胞の生存メカニズムの一つであり、がん細胞が化学療法を受けたときに細胞内成分のリサイクルによって、薬物誘発性アポトーシスを抑制できると考えられている。
アルコール依存症の治療のために広く使用されているジスルフィラムは、銅(Cu)依存的にin vitroおよびin vivoでがん細胞にアポトーシスによる細胞死を誘導する。
私たちの以前の研究は、ジスルフィラム/ 銅が非小細胞肺がん異種移植モデルにおいて抗腫瘍効果を発揮し、アルデヒド脱水素酵素(ALDH)陽性がん幹細胞によって引き起こされる非小細胞肺がんの再発を阻害することを証明した。
本研究は、ジスルフィラム/ 銅が非小細胞肺がん細胞にオートファジーを誘発できるかどうかを検討し、オートファジーとアポトーシスの関連を明らかにするも目的で行った。
まず、ジスルフィラム / 銅が非小細胞肺がん細胞に有意な細胞毒性とカスパーゼ依存性アポトーシスを誘導し、細胞質に液胞が形成されることを観察した。
次に、LC3II(微小管関連タンパク質1軽鎖3)、ATG5およびp62を含むオートファジーマーカーのレベルを、クロロキンの存在下と非存在下の条件でウエスタンブロットで調べた。
さらに、ジスルフィラム / 銅で処理した後、LC3とリソソームタンパク質LAMP2(リソソーム関連膜タンパク質2)の共局在を観察した。
その結果、ジスルフィラム /銅がオートファジーを誘発することが明らかになった。
最後に、オートファジーをAtg5 siRNAまたは3-MAで抑制すると、非小細胞肺がん細胞におけるジスルフィラム /銅によって誘導されるアポトーシスが大幅に増強された。 ジスルフィラム/銅と3-MAの併用による抗腫瘍効果の相乗効果は、非小細胞肺がん異種移植モデルでさらに確認された。
以上の結果をまとめると、我々の結果は、ジスルフィラム/ 銅が非小細胞肺がん細胞のオートファジーを刺激し、これがジスルフィラム/銅が誘導するアポトーシスを抑制している。
つまり、ジスルフィラム/銅は非小細胞肺がん細胞にアポトーシスによる細胞死を誘導するのですが、がん細胞はオートファジーを亢進して、アポトーシス誘導に抵抗しようとします。したがって、オートファジー阻害剤を併用するとジスルフィラム/銅による非小細胞肺がん細胞のアポトーシスを亢進できるということです。
オートファジー阻害剤のヒドロキシクロロキンとジスルフィラムを併用すると抗腫瘍効果を高めることができる可能性を示唆しています。
他の抗がん剤治療でもオートファジーが誘導されて細胞の生存を高めるメカニズムが働きます。したがって、がん細胞を死滅する目的の治療ではオートファジー阻害剤のヒドロキシクロロキンの併用は有用です。(722話参照)
【ジスルフィラムとメトホルミンの相乗効果】
以下の様な報告があります。
Disulfiram with or without metformin inhibits oesophageal squamous cell carcinoma in vivo(ジスルフィラム単独あるいはジスルフィラムとメトホルミンの併用のインビボにおける食道扁平上皮がんの増殖を阻害する)Cancer Lett. 2018 Mar 28;417:1-10.
【要旨の抜粋】
アルコール依存症の治療に使用されるジスルフィラムはがん細胞の増殖を阻害し、ジスルフィラムがin vitroでタンパク質分解/代謝回転経路を混乱させることが報告されている。ジスルフィラムのin vitroの抗腫瘍効果はを抗糖尿病薬メトホルミンと組み合わせることによって強化された。ここでは、in vivoの実験系で、食道扁平上皮がんに対して、メトホルミンを使用した場合と使用しない場合のジスルフィラムの抗腫瘍効果を検討した。
ヒト食道扁平上皮がん細胞株WHCO1を皮下注射したヌードマウスを、30 mg/kgまたは50mg/kgの量のジスルフィラムを週に3回投与し、メトホルミンの併用の有る無しで21日間経過を観察した。 ジスルフィラム単独およびジスルフィラム/メトホルミンで治療したマウスは、未治療群および陽性対照のシスプラチン治療群と比較して、腫瘍が有意に小さかった。
ジスルフィラムの抗腫瘍効果は銅とは無関係であり、腫瘍内に銅が有意に蓄積することはなく、プロテアソーム活性が維持されていた。しかし、ジスルフィラムおよびジスルフィラム/メトホルミン投与群での総ユビキチン化タンパク質、LC3B-II、LAMP1、およびp62の増加は、オートファジーが阻害されていることを示している。これらの発見は、ジスルフィラムおよびジスルフィラム/ メトホルミンがin vivoで食道扁平上皮がん腫瘍の増殖を著しく阻害し、食道扁平上皮がんの代替治療になる可能性を示している。
ジスルフィラムとメトホルミンの併用が強い抗腫瘍効果を発揮する可能性を報告しています。
【DHAはジスルフィラムの抗腫瘍効果を増強する】
魚油に多く含まれるドコサヘキサエン酸(DHA)がジスルフィラムの抗腫瘍効果を高めることが報告されています。
Docosahexaenoic acid and disulfiram act in concert to kill cancer cells: a mutual enhancement of their anticancer actions(ドコサヘキサエン酸とジスルフィラムが協調して作用してがん細胞を殺す:それらの抗がん作用の相互強化)Oncotarget. 2017 Mar 14; 8(11): 17908–17920.
【要旨】
我々は以前に、ヒトのがん細胞におけるクリオキノール(clioquinol)とドコサヘキサエン酸(DHA)の相乗的な抗がん作用を報告した。しかし、クリオキノールはその神経毒性のために臨床使用が禁止されている。
この研究では、クリオキノールの代替化合物としてジスルフィラムを特定した。ジスルフィラムはDHAと協調して作用して、がん細胞をより効果的に死滅し、腫瘍の成長を抑制した。
ジスルフィラムとDHAによる治療は、in vitroおよびin vivoで、それぞれを単独で使用した場合と比較して、アポトーシス誘導と腫瘍増殖抑制を促進した。
Nrf2を介したヘムオキシゲナーゼ1遺伝子の転写亢進が認められたことから、ジスルフィラムはDHAによって誘発される細胞の酸化ストレスを増強することが示唆された。
一方、DHAはジスルフィラムによる腫瘍細胞塊形成とがん幹細胞数の抑制を強化することが示された。
これは、ジスルフィラムとDHAの組み合わせによる抗がん作用に、がん幹細胞特性の変化が関与していることを示している。したがって、臨床的に承認された薬剤であるDHAとジスルフィラムは、協調して作用し、がん細胞をより効果的に死滅することが示された。この組み合わせ作用には、細胞の酸化ストレスの増強とがん幹細胞特性の抑制が関与している。
【ジスルフィラムが炎症性乳がんに抗腫瘍効果を発揮する】
ジスルフィラムの抗腫瘍効果のメカニズムとして以下のような報告があります。
Disulfiram (DSF) acts as a copper ionophore to induce copper-dependent oxidative stress and mediate anti-tumor efficacy in inflammatory breast cancer.(ジスルフィラムは銅依存性の酸化ストレスを誘導する銅イオノフォアとして作用し、炎症性乳がんの抗腫瘍効果を発揮する)Mol Oncol. 2015 Jun;9(6):1155-68. doi: 10.1016/j.molonc.2015.02.007. Epub 2015 Feb 21.
【要旨】
がん細胞内には活性酸素種の量が増えているが、抗酸化システムの活性を高めることによって酸化ストレスによる細胞死を防ぐように適応している。
炎症性乳がんは乳がんの中でも特殊なタイプで、治療に抵抗性で再発しやすい特徴を持っている。
炎症性乳がんの細胞モデルを用いて、活性酸素の産生を高める薬剤を投与した後に炎症性乳がん細胞が生存するためにどのような酸化ストレス応答を行うかを検討した。
人間の乳がん組織の遺伝子解析の結果、正常組織や通常の乳がん組織に比べて、炎症性乳がんの組織では酸化ストレス応答のスコアが顕著に高くなっていた。放射線治療や抗がん剤治療はがん細胞に酸化ストレスを高めて死滅させるので、炎症性乳がんの組織で酸化ストレス応答の亢進は、放射線治療や抗がん剤治療に対する炎症性乳がんの抵抗性と関連していることが示唆される。
炎症性乳がん細胞におけるこの適応反応を阻止するために、FDA認可の低分子薬剤のジスルフィラムを、単独あるいは銅との併用で使用した。
ジスルフィラムは銅と複合体を形成し、細胞膜のトランスポーターを使わずに、細胞内の銅の濃度を高めることが、培養細胞と動物の腫瘍の両方の実験系で確かめられた。
ジスルフィラムと銅の複合体(DSF-Cu)はNF-κBシグナル伝達系とアルデヒド脱水素酵素の活性を阻害し、抗酸化力を低下させ、炎症性乳がんの複数の実験系で酸化ストレスによるアポトーシスを誘導した。
動物を使った生体内の実験系では、DSF-Cuは生体に毒性を示すことなく、がん細胞にのみアポトーシスを誘導して腫瘍の増殖を顕著に阻害した。
これらの実験結果は、炎症性乳がんは酸化ストレスに高度に適応性が高くなっており、この性質が活性酸素を発生させるがん治療に対する抵抗性の原因になっている。
治療に抵抗性を示す進行性の炎症性乳がんに対して、ジスルフィラムは酸化還元の制御を介して、抗がん剤治療と放射線治療の感受性を高める効果が期待できる。
イオノフォア(ionophore)は、生体膜において、特定のイオンの透過性を増加させる能力を持つ脂溶性分子の総称です。特定のイオンと結合し、生体膜を通過することでイオンを通過させます。この論文では、ジスルフィラムが銅イオンを細胞内に運搬するイオノフォアとしての作用を持っていると報告しています。

炎症性乳がんは治療に抵抗性を示しますが、ジスルフィラムを併用する価値はあります。実際に抗がん剤治療と併用して、抗腫瘍効果の増強を認めています。
ジスルフィラムは様々なタンパク質と反応して、それらのタンパク質の働きを阻害します。その結果、多彩なメカニズムで抗がん作用を発揮します。
抗がん剤治療にジスルフィラムにオーラノフィン、セレコキシブ、ヒドロキシクロロキン、メトホルミンの併用は有効です。抗がん剤治療を行わない(もうできない)場合は、2-デオキシ-D-グルコース、メベンダゾール、イベルメクチンなどの抗がん作用のある代用薬(再利用薬)を併用すると、副作用の少ない方法で、がん細胞の増殖を抑制し、細胞死を誘導できる可能性が高くなります。 (トップの図)
注意:ジスルフィラムはアルコールの代謝を阻害するので、服用中と服用後2週間くらいは飲酒は厳禁です。アルコールの入った食べ物(奈良漬けなど)も食べれません。抗がん剤の中にはアルコールで溶解して投与するもの(例:パクリタキセル)があります。抗がん剤点滴などでアルコールを使っていないことを確認しておきます。
| « 740)断酒薬ジ... | 742)オールト... » |



