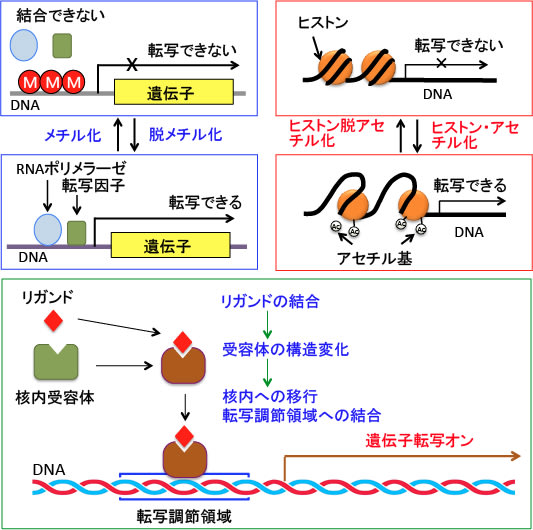
図:がん細胞では、DNAメチル化やヒストン脱アセチル化によるエピジェネティック(epigenetic)な機序によってがん抑制遺伝子などの遺伝子の転写が抑制されている。細胞の増殖や分化やアポトーシスに関与する遺伝子の発現に作用する核内受容体のリガンドによる活性化はがん治療のターゲットになっているが、転写因子が転写調節領域にアクセスできないとこれらの核内受容体のリガンド(受容体に特異的に結合して活性化する物質)は抗腫瘍作用を発揮できない。したがって、DNAの転写調節領域を露出させるDNAの脱メチル化やヒストンのアセチル化促進の方法と核内受容体の活性を促進するリガンドの併用はがん細胞の増殖や分化をターゲットにした治療法として可能性が高い。
369) 代謝と分化を制すれば、がんを征する(その①):がん細胞の分化誘導は可能か?
【がんとの共存を目指すがん治療】
がん細胞は遺伝子に多くの変異が蓄積して、細胞の増殖や死の調節に異常をきたしている細胞です。個々のがん細胞に生じている遺伝子変異を逐一正常化することは不可能です。そこで、遺伝子の変異を起こしているがん細胞そのものを排除しようというのが手術や放射線治療や抗がん剤治療の理論的根拠です。
がん組織が限局している場合は、手術や放射線治療でがん組織を完全に排除できるので、根治治療が行えます。しかし、他の臓器に転移して、がん細胞が全身に広がった場合は、手術や放射線治療のような局所療法は無効なので、抗がん剤治療になります。
しかし、多くの固形がんに対して抗がん剤治療は限界があります。すなわち、抗がん剤治療では固形がんを消滅させることは困難です。(固形がんに対して抗がん剤治療が効きにくい理由については367話参照)
抗がん剤の効果を評価するのに奏功率(がんの消失・縮小の度合い)が使われています。ところが多くの臨床経験から「抗がん剤の奏功率と延命効果は結びつかない」ことが認識されるようになり、「奏功率の高い抗がん剤が良い」という考えには多くの疑問が出されています。(腫瘍の縮小を評価した抗がん剤治療の開発の問題点については121話参照)
がん細胞の攻撃を目標とする抗がん剤治療が必ずしも延命につながらないというジレンマがある中で、がん治療の1つの考え方として、「がんとの共存」という治療戦略が検討されるようになってきました。
がんを「小さく」できなくても「大きくしない」あるいは「進行を遅らせる」方法も、がん治療として価値があることが認識されてきました。「がんは攻撃しないと治らない」という西洋医学の基本戦略に対して「がんをおとなしくさせて共存していく」という発想の転換です。(がんとの共存については282話参照)
このようながんとの共存を目指すがん治療において、がん細胞の代謝異常をターゲットにした治療法や、がん細胞の分化を誘導してがん細胞を正常化するような治療法が注目されています。
前者はがん細胞におけるエネルギー産生の特徴であるワールブルグ効果(がん細胞では酸素がある状況でも解糖系が亢進しミトコンドリアでの酸化的リン酸化が抑制されている)をターゲットにした治療法です。がん細胞における解糖系を阻害し、ミトコンドリアでの酸化的リン酸化を活性化すると、がん細胞の増殖が遅くなったり、アポトーシスを起こしやすくなることが報告されています。(355話参照)
また、がん細胞の分化誘導療法に関しては、ヒストンのアセチル化によるエピジェネティック(epigenetic)な機序や、レチノイド受容体やペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptors:PPARs)のような核内受容体を介した遺伝子転写の制御を利用した治療法などがあります。(エピジェネティクスについては249話参照、レチノイドや分化誘導療法については323話参照)
【がん細胞の代謝と分化の異常を制御できれば、がんを制服できる】
近年、がん細胞の代謝異常(ワールブルグ効果)と細胞分化の異常(脱分化)の正常化(是正)によってがん細胞を正常化する治療の研究が注目されています。
すなわち、がん細胞の解糖系の阻害やミトコンドリアでの酸化的リン酸化の活性化をターゲットにした薬が抗がん作用を示すことが多く報告されています。
さらに、細胞分化を誘導してがん細胞の増殖を抑制しアポトーシスを誘導する治療法のターゲットとして、核内受容体を活性化するレチノイドやペルオキシソーム増殖因子活性化受容体(PPAR)のリガンドや、ビタミンDなどがあります。
レチノイド(ビタミンA誘導体)やビタミンDを使ってがん細胞の細胞分化を誘導する方法は古くから研究されています。
ペルオキシソーム増殖因子活性化受容体(PPAR)は、近年、代謝と分化の接点で重要な役割を担っていることが明らかになっており、がん治療のターゲットとして注目されています。
これらの核内受容体を使っても思うようにがん細胞の分化が誘導できないことも臨床試験などで明らかになっています。すなわち、レチノイドやビタミンDやPPARのリガンドを使った臨床試験では、必ずしも十分は抗腫瘍作用は認められていません。
その理由の一つとして、がん細胞ではヒストンのアセチル化などのエピジェネティックな機序で、がん抑制遺伝子などがん細胞の抑制に関与する遺伝子に核内受容体などの転写因子がアクセスできないことが指摘されています。
そこで、核内受容体の活性化と同時に、ヒストンアセチル化やDNAメチル化を阻害する治療法を併用するというアイデアが検討されています。ヒストン・アセチル化阻害剤やDNAメチル化阻害剤が開発されて、その抗腫瘍効果が検討されています。
ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素を阻害してヒストンのアセチル化を高めることが報告されています(322話参照)。
サプリメントのL-カルニチンとアセチル-L-カルニチンがヒストン・アセチル化を促進することが報告されています。(313話参照)
さて、以上のような最近のがん研究の動向を考察すると、がん細胞の解糖系を阻害する2-デオキシ-D-グルコースや半枝蓮などの抗がん生薬、ミトコンドリアでのATP産生阻害とAMP活性化プロテインキナーゼを活性化によってインスリン分泌低下やmTOTC1(哺乳類ラパマイシン標的タンパク質複合体1)の抑制などの作用があるメトホルミン、ミトコンドリアでの酸化的リン酸化の亢進や低酸素誘導因子-1(HIF-1)の抑制効果が報告されていてワールブルグ効果を抑制するジクロロ酢酸ナトリウム、mTORC1を直接抑制するラパマイシン、HIF-1の活性を阻害する作用が報告されているシリマリンやジインドリルメタン、ヒストンのアセチル化を促進してがん抑制遺伝子の発現を高める中鎖脂肪ケトン食とL-カルニチンとアセチル-L-カルニチン、分化誘導作用のある核内受容体のリガンドであるイソトレチノインやビタミンDやPPARのリガンド(医薬品や食品成分など候補は多数)などを併用すれば、がん細胞の代謝異常と分化異常を正常化に向けて制御し、がん細胞の増殖抑制とアポトーシス誘導が達成できる可能性が高いと言えます。
これらの併用による相乗効果はまだ理論的な段階で、大規模な臨床試験で有効性や安全性が確認されているわけではありません。
ただ、これらの方法に関しては、単独あるいは2~3種類の併用までの臨床効果の報告は多数あります。
また、これらの併用療法を私のクリニックで数年前から実践していますが、かなりの有効性を確認しています。
がんの状況や治療の状況に応じて、これらのうちのいくつかを組み合わせることになりますが、それぞれの薬やサプリメントは1ヶ月分が数千円から2万円程度までであり、あまり費用がかかりません。
標準治療との併用で標準治療の抗腫瘍効果を高める効果もあります。標準治療が効かなくなった場合、このような「がん細胞の代謝と分化の異常の正常化を目指す治療」はがんとの共存を目指す治療法として可能性が高いと感じています。
がん細胞のワールブルグ効果をターゲットにした治療法と中鎖脂肪ケトン食に関しては過去の記事で解説していますので、分化誘導に関する治療法の理論的根拠と具体的方法を数回に分けて解説します。
【がん細胞は分化度が低下している】
私たちの体は様々な機能や形態をもった細胞から成り立っていますが、全ての細胞も元を正せば一つの受精卵が分裂して増えていったものです。たった一つの受精卵が分裂を繰り返し、ある細胞は心臓を作り、ある細胞は脳を作り出します。
このように体の臓器や組織を作っていく過程で、個々の細胞が特徴的な機能や形態を獲得していくことを「分化」といいます。肝細胞や心筋細胞や神経細胞などへ分化していった細胞が集まって、肝臓や心臓や脳などの臓器が形成されるのです。
体を構成する細胞は分化により形態や機能が異なっても、すべて同じ遺伝情報を持っています。遺伝子(遺伝情報を担う構造単位で、通常1つの蛋白質を作り出すことができる)の情報は細胞の核の中にある染色体のDNA(デオキシリボ核酸)に書き込まれています。
一つの細胞核に含まれる染色体の一組をゲノムといい、ヒトの場合1ゲノムは46個(22対の常染色体と1対の性染色体)の染色体があります。1ゲノム中には合計約30億塩基対の塩基配列情報が記録されており、これに含まれる遺伝子の数は22000個程度であることが明らかになっています。
遺伝子(DNA)の情報がmRNA(メッセンジャーRNA)に転写され、さらにタンパク質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います(下図)。

図:細胞の遺伝情報は核の中の染色体に記録されている。遺伝子の本体はデオキシリボ核酸(DNA)で、一つの細胞には46個の染色体があり、合計で約30億塩基対の塩基配列情報がDNAに記録されている。DNAの遺伝子情報(塩基配列情報)はRNAポリメラーゼや転写因子の働きでメッセンジャRNA(mRNA)に転写され、mRNAはリボソームでタンパク質に翻訳されてタンパク質が生成される。このようにして遺伝子情報からmRNAとタンパク質が合成されて細胞の構造や機能に変化が生じる過程を「遺伝子発現」という。
体の中の全ての細胞は同じ遺伝子を持っていますが、細胞の種類によって発現している遺伝子の種類に違いがあります。通常の細胞では全遺伝子の数分の一しか発現しておらず、その種類の違いがそれぞれの細胞の機能の違いの原因なのです。
がんになるとこの遺伝子の発現に異常が起こって、細胞の分化度が低下していきます。これを脱分化といいます。一般に、分化度の高い(=正常細胞の機能を多く保っている)高分化型のがん細胞は悪性度が低く、脱分化の進んだ低分化や未分化型のがん細胞は増殖が早く転移を起こしやすく予後が不良です。
この脱分化(分化度が低下した状態)を正常に戻す(あるいは分化度を高める)ことを分化誘導と言います。
【細胞の分化を調節するエピジェネティクス】
ヒト遺伝子は約22000種類のタンパク質を作る設計図(遺伝情報)をもっていますが、このゲノムの持つ遺伝情報の発現は、DNAの塩基配列と転写装置だけで制御されているわけではなく、DNAのメチル化やヒストン(DNAに結合するタンパク質)の修飾などによって複雑に制御されています。
「ゲノム(遺伝子)の塩基配列以外のメカニズムで遺伝子発現を制御し、細胞や生体に変化を生じさせる現象」のことを、エピジェネティクス(epigenetics)と言います。
エピジェネティクスの「エピ」はギリシャ語の接頭語で「上にある、別の、後から」という意味で、本来の遺伝情報(DNAの塩基配列)の土台の「上にかぶさる別の遺伝情報」や「後天的に獲得した遺伝情報」という意味を示しています。
例えば、私たちの体を構成する細胞は全て同じ遺伝情報を持っていますが、皮膚や神経や筋肉や肝臓など機能の異なる細胞になれるのは、それぞれの細胞において、使う遺伝子と使わない遺伝子に違いがあるからです。
つまり、一つの細胞において遺伝子の全てが発現しているわけではなく、発現している遺伝子の違いによって細胞の種類が決まります。このように、DNAの塩基配列(=遺伝情報)が同じなのに、使う遺伝子と使わない遺伝子に目印をつけて、細胞に変化を生じさせる現象がエピジェネティクスです。
最近までは、遺伝子の突然変異によるがん遺伝子やがん抑制遺伝子の機能異常が細胞のがん化の主な原因と考える研究者がほとんどでした。しかし、最近の研究によって、遺伝子の変異とは関係ない、エピジェネティック(epigenetic)な機序によるがん遺伝子やがん抑制遺伝子の発現異常による発がんメカニズムの重要性が指摘されるようになりました。
つまり、DNAの突然変異とは別に、DNAのメチル化や、DNAに結合するタンパク質のヒストンの修飾(アセチル化など)によって遺伝子発現が変化し、細胞ががん化するという機序です。
DNAのCpG(Cはシトシン塩基、Gはグアニン塩基)という配列の部分でCに-CH3という分子(メチル基)がつくのがDNAメチル化です。遺伝子を使うか使わないかを制御している部分(プロモーター)がメチル化されると、その遺伝子は使うことができなくなります。(下図)
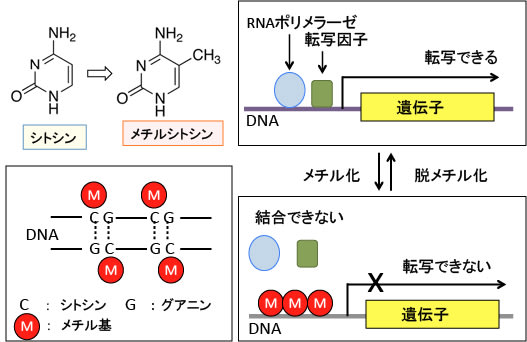
図:遺伝子が発現するためには、DNAからRNAを作るRNAポリメラーゼという酵素や遺伝子発現を調節する転写因子がこのプロモーター領域に結合することが必要。このプロモーター領域には、CpG(C はシトシン、Gはグアニン)という配列が繰り返された部分があり、DNAのCpGという配列の部分でC(シトシン)にメチル基(-CH3)が付いてメチルシトシンに変換することをDNAメチル化という。プロモーター領域のDNAにメチル化が起こると、RNAポリメラーゼや転写因子が結合できなくなり、遺伝子からmRNAが転写される段階が阻害され、遺伝子発現のスイッチがオフになる
DNAのメチル化がたくさん起こっている状態をハイパーメチル化と言いますが、様々な種類のがん細胞において、複数のがん抑制遺伝子のプロモーター部分にハイパーメチル化が起こっていることが報告されています。ハイパーメチル化が起こっているということは、そのがん抑制遺伝子は働いていないということを意味します。つまり、DNAのハイパーメチル化によってがん抑制遺伝子の発現が抑制されると、その細胞はがん化しやすくなります。
逆に、DNAメチル基転移酵素を阻害してDNAメチル化を抑制すると、スイッチがオフになっていたがん抑制遺伝子のスイッチがオンになって、がん細胞の増殖が抑えられる可能性が示唆されています。がん細胞が分裂するときにDNAメチル化の状態はDNAメチル基転移酵素によって維持されますが、この酵素を阻害するとDNAメチル化の状態が維持できなくなるからです。
細胞核内では、DNAはヒストンという球状の蛋白質複合体に巻き付くような状態で存在します。ヒストンはリジンやアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。
遺伝子が転写されるためには、転写因子やRNAポリメラーゼなどの他の蛋白質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。アセチル化というのはアセチル(CH3CO)基が結合することです。
ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応はヒストンアセチル基転移酵素とヒストン脱アセチル化酵素によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています(下図)。

図: DNAはヒストンという球状の蛋白質複合体に巻き付くような状態で存在する。ヒストンのリジン残基のアミノ基(-NH2)がアセチル化という修飾を受けると、リジン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出する結果、遺伝子の転写が促進される。ヒストンのアセチル化と脱アセチル化の反応はヒストンアセチル基転移酵素とヒストン脱アセチル化酵素によって制御されている。
【エピジェネティクスを利用するとがん細胞の分化を誘導できる】
遺伝子変異というのは命令書に誤字や脱字や欠損があるようなものです。命令の文面に間違いがあれば、間違った命令が出されます。
エピジェネティクスによる遺伝子発現の抑制というのは、DNAの指示書は正しいのですが、その指示書が封筒に入れられて封をされた状態で、その文面が読めない状況です。
誤字脱字や欠損があると、正確な情報は得られません。しかし、封筒に入れられてみれない状況であれば、その封を開けることができれば、指示を読むことが可能になります。
同様に、DNAの突然変異が起こると、それを外から人為的に修復することは極めて困難ですが、DNAのメチル化やヒストンのアセチル化の状態は薬によって可逆的に変更できるので、正常化させることは可能です。
一度決定された遺伝子発現の状態が、食物や環境や生活習慣などの外部からの影響を受けて変化するという「エピジェネティクスの可塑性」は、病気の治療に利用できるのではないかと考えられ、異常な遺伝子発現を正常な遺伝子発現の状態に戻すといったエピジェネティクスに関する基礎研究が進められています。
エピジェネティクスを標的としたがん治療薬の開発が進められています。特に、DNAメチル基転移酵素の阻害薬やヒストン脱アセチル化酵素の阻害薬において成果が示されていて、すでに治療に使用されている薬もあります。
【がん細胞の分化を誘導する転写因子の活性化】
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質で、数多くの種類があります。細胞の増殖や分化に関連した遺伝子を調節している転写因子を活性化することによって、細胞の増殖抑制や分化を制御できる可能性が指摘されています。
例えば、
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称です。レチノイドは生体内では活性型である
All-trans retinoic acid (ATRA:以下レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。レチノイドによって発現が調節される遺伝子は細胞の分化や増殖や死(アポトーシス)の制御に重要は働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。(
323話、
339話、
361話参照)
Peroxisome Proliferator-activated Receptor (PPAR:ペルオキシソーム増殖因子活性化受容体)もレチノイド受容体と同じく核内受容体の一種です。
細胞内のペルオキシソームの増生を誘導する受容体として発見され、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群です。PPARを活性化する物質は高脂血症や糖尿病の薬として古くから使用されていますが、これらの薬が一部のがん細胞に対して分化誘導やアポトーシス誘導などの抗腫瘍効果を示すことが報告されています。
ビタミンDも核内受容体に作用して遺伝子発現を調節することによって効果を発揮します。ビタミンD はレイチノイドやPPARのリガンドとの相乗効果がありますが、これはビタミンDの核内受容体がレチノイドX受容体(RXR)やPPARとヘテロ2量体を形成して転写因子として作用するからです。
レチノイド受容体やPPARやビタミンD受容体を刺激してがん細胞の分化を誘導し、増殖抑制やアポトーシス誘導を引き起こすことが一部のがんで可能であることが示されています。転写因子のDNA結合を促進するために、ヒストンのアセチル化に作用する薬とレチノイドX受容体やPPARやビタミンD受容体のような転写因子の活性化を併用する分化誘導法も試されています。
【遺伝子発現を調節する核内受容体とリガンド】
DNAの遺伝情報は、まずRNAポリメラーゼによってRNAに転写され、さらにRNAからリボソームでタンパク質に翻訳されます。
DNAにはプロモーターやエンハンサーといった転写を制御する領域があり、この領域に結合して遺伝子の転写を促進したり抑制したりするタンパク質を転写因子と言います。転写因子は単独で機能する場合もありますが、他のタンパク質と複合体を形成して転写活性を実行する場合もあります。
このようにして、遺伝子(DNA)の情報がmRNA(メッセンジャーRNA)に転写され、さらに蛋白質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います。
つまり、転写因子というのは遺伝子発現を制御する機能を持つタンパク質です。
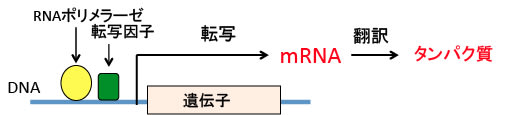
図:遺伝子がメッセンジャーRNA(mRNA)に転写されてタンパク質が作られるためには、RNAポリメラーゼや転写因子などの転写を促進する複数の因子が遺伝子の転写調節領域に結合する必要がある。
ホルモン(甲状腺ホルモンやステロイドホルモンなど)や脂溶性ビタミン(ビタミンAやビタミンD)や体内で生成される生理活性物質(脂肪酸やプロスタグランジンなど)によって遺伝子発現が調節される場合の転写因子として「核内受容体」というタンパク質があります。
核内受容体というのは、細胞核にあって、ホルモンなどが結合することでDNAの転写を調節している受容体タンパク質です。
核内受容体はリガンドが結合すると、構造の変化を起こして転写因子としての活性を持ちます。
リガンド(ligand)というのは、特定の受容体(レセプター)に特異的に結合する物質のことです。
核内受容体群は,1つの原初遺伝子から分子進化した遺伝子スーパーファミリーを形成しており,そのメンバーはヒトゲノム解読の結果,48種存在すると推定されています。
ステロイドホルモンやビタミンAやビタミンDが特定の遺伝子の発現を調節できるのは、これらが特定の核内受容体への結合を介して、そのリガンド依存的な転写制御を発揮するからです。
核内受容体には、リガンドが結合していないときに細胞質にいるものと細胞核にいるものの2種類があります。前者はリガンドが結合すると核内に移行して遺伝子の転写調節領域に結合します。このクラスに分類される受容体としては、グルココルチコイド、アンドロゲン、プロゲステロン、エストロゲなどの受容体があります。
後者はリガンド結合には関係なしに核内に局在し、核内でリガンドが結合すると、構造の変化が起こり、標的遺伝子の転写を活性化します。甲状腺ホルモン、レチノイン酸、9-シスレチノイン酸、ビタミンDなどの受容体があります。
いずれにしても、体内の様々な生理活性物質がリガンドとして特定の受容体に結合することによって遺伝子発現が調節されることになります。
また、単なる栄養素を思われていた脂肪酸や、胆汁酸などの代謝産物も核内受容体に結合し、遺伝子転写を制御していることが明らかになっています。
リガンドと同じ働きをする薬をアゴニスト(agonist)、リガンドの働きを阻害する薬をアンタゴニスト(antagonist)と言います。つまり、核内受容体のアゴニストやアンタゴニストは特定の遺伝子の発現を調節する薬になります。

図:核内受容体にリガンドが結合すると受容体の構造に変化が起こり、核内に移行して遺伝子の転写調節領域に結合し、転写を調節する。
核内受容体の活性化を介した分化誘導療法はがん治療で盛んに研究されており、臨床試験の結果も多数報告されています。ある程度の有効性を認めた研究もありますが、必ずしも満足できるほどの有効性は得られていません。
その理由の一つが、がん細胞で起こっているヒストンアセチル化などによる遺伝子の不活化(クロマチンによってRNAポリメラーゼや転写因子がアクセスできない)です。そこで、ヒストンアセチル化阻害剤やDNAメチル化の阻害などとの併用が検討されています。
ケトン体の産生を高めるケトン食の抗腫瘍効果のメカニズムとしてβヒドロキシ酪酸によるヒストンアセチル化の促進や、脂肪酸代謝産物によるPPAR(ペルオキシソーム増殖因子活性化受容体)の活性化などの機序の関与も指摘されています。
つまり、ケトン食はがん細胞のエネルギー産生の異常と細胞分化の異常の両方に作用して抗腫瘍効果を発揮することが明らかになりつつあります。したがって、この作用機序をさらに高める医薬品やサプリメントを併用すると、抗腫瘍効果を高めることができる可能性があります。
以上のことから、がん細胞の代謝異常と分化異常を是正してがんと共存する方法として、中鎖脂肪ケトン食を中心にして、さらにがん細胞の解糖系の阻害、ミトコンドリアの活性化、低酸素誘導因子の阻害、脂肪分解の促進、ヒストンアセチル化の促進、抗がん作用のある核内受容体の活性化などの組合せが有望だと言えます。そして、これらの作用をターゲットにした新しい治療薬がこれから開発されて使用できるようになるので、代謝と分化をターゲットにしたがん治療法は今後発展すると思われます。
がん細胞の分化誘導療法も、単一のメカニズムだけをターゲットにしても限界がありますが、ヒストンアセチル化促進のようなエピジェネシスや、レチノイドやPPAR活性剤やビタミンDなどの核内転写因子の活性化を組み合わせると、分化誘導の効果が高まると思います。
(続きは次回)


画像をクリックするとサイトに移行します。