がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
322)βヒドロキシ酪酸はヒストンのアセチル化を亢進する:ケトン食の酸化ストレス軽減作用

図:絶食や飢餓やケトン食によってβヒドロキシ酪酸の濃度が上昇すると、ヒストン脱アセチル化酵素が阻害される。これによって遺伝子プロモーター領域のヒストンが高アセチル化し、転写因子FOXOが活性化され、Mnスーパーオキシドジスムターゼ(Mn-SOD)やカタラーゼの発現を誘導し、酸化ストレスに対して耐性が増強する。ケトン食による寿命延長作用や抗がん作用のメカニズムの一つにヒストン脱アセチル化酵素の阻害作用が報告されている。
322)βヒドロキシ酪酸はヒストンのアセチル化を亢進する:ケトン食の酸化ストレス軽減作用
【βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害する!!】
βヒドロキシ酪酸はケトン体の一種です。ケトン体は絶食などで糖質が枯渇した状態で脂肪酸の燃焼(β酸化)が亢進したときに肝臓で産生され、グルコース(ブドウ糖)が枯渇した時の代替エネルギーになります。絶食時などで日常的に産生されています。
ケトン体としてアセト酢酸、βヒドロキシ酪酸、アセトンの3種が作られますが、アセトンは呼気となって排泄され、アセト酢酸とβヒドロキシ酪酸はエネルギー源になります。(ケトン体については296話参照)
最近の論文で、「βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害し、酸化ストレス耐性遺伝子の発現を亢進させ、酸化ストレスを抑制する」ことが示されています。以下のような論文があります。
Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor.(内在性のヒストン脱アセチル化酵素阻害剤であるβヒドロキシ酪酸による酸化ストレスの抑制)Science 339(6116): 211-4, 2013年
【要約】
アセチルCoAおよびNAD+の濃度はヒストンのアセチル化の状態に影響を及ぼすため、その生体における代謝の状態は遺伝子の転写制御と関連する。この論文において、筆者らは、生体における代謝産物であるβヒドロキシ酪酸がクラスIヒストン脱アセチル化酵素を特異的に阻害することを明らかにした。
βヒドロキシ酪酸をマウスへ投与するとヒストンのアセチル化のレベルが上昇したのにくわえ、βヒドロキシ酪酸の蓄積する飢餓状態あるいはカロリーを制限したマウスの組織においてもヒストンのアセチル化のレベルは上昇していた。
さらに,βヒドロキシ酪酸によるクラスIヒストン脱アセチル化酵素の阻害は転写状態のグローバルな変化をともない、このなかには、酸化ストレス耐性遺伝子であるFoxo3a遺伝子やMt2遺伝子の発現の上昇も含まれた。
βヒドロキシ酪酸の処理によりFoxo3a遺伝子およびMt2のプロモーター領域におけるヒストンのアセチル化が亢進すること、さらに、クラスIヒストン脱アセチル化酵素であるHDAC1あるいはHDAC2のノックダウンはこれらの遺伝子の発現を亢進することが見い出された。
以上の現象と一致して、マウスにβヒドロキシ酪酸を投与すると酸化ストレスに対し耐性を示すようになることが明らかになった.
この論文は米国California大学San Francisco校Gladstone Institute of Virology and Immunology からの報告ですが、筆頭著者は日本人の島津忠広博士で、ご本人による論文の日本語訳がネットで公開されています。上記の要約もこのサイトからコピーしたものです。
(著者によるこの論文の日本語訳はこちらのサイトへ:クリック)
論文全体の内容は著者による日本語訳を参考にしていただくとして、簡単に結果をまとめたのがトップの図になります。
すなわち、ヒストン脱アセチル化酵素を阻害してヒストンのアセチル化が増えると、いくつかの遺伝子の発現がオン(on)になり、細胞の機能に変化が起こります。
ヒストン脱アセチル化酵素の阻害剤として単鎖脂肪酸の酪酸が有名です。酪酸は、食物繊維を腸内細菌が嫌気性発酵させてできます。脂肪酸の分解過程で生合成されるほか、バターやチーズ、皮脂にも含まれています。銀杏や足の悪臭の原因にもなっています。培養したがん細胞に酪酸を添加すると、増殖抑制や分化誘導が起こり、その作用機序は酪酸によるヒストン脱アセチル化酵素の阻害作用によるものです。
さて、絶食や飢餓状態やケトン食で産生されるケトン体のβヒドロキシ酪酸は酪酸のHがOHに変わっただけで化学構造が似ています。βヒドロキシ酪酸は長期的な飢餓状態では6~8mMにも達するので、飢餓状態などで産生されるβヒドロキシ酪酸がヒストンのアセチル化を介して遺伝子発現に作用して、細胞機能に影響するのではないかという仮説のもとに、βヒドロキシ酪酸にヒストン脱アセチル化酵素阻害作用があるかどうか検証する目的で本研究が行われています。そして、研究の結果、
1)培養細胞やマウスの動物実験でβヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素を阻害する。
2)飢餓や直接βヒドロキシ酪酸を投与する方法でマウスの血中のβヒドロキシ酪酸の濃度(0.6~1.5mM)を上昇させると、腎臓など複数の臓器においてヒストンのアセチル化が増えていることが確認できた。
3)βヒドロキシ酪酸によって発現が亢進する遺伝子として、細胞周期の停止や酸化ストレス耐性にかかわる転写因子をコードしているFoxo3a遺伝子や、酸化ストレス耐性遺伝子のMt2が同定された。つまり、βヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素を阻害することによってFoxo3aやMt2などの酸化ストレス耐性遺伝子のプロモーターにおけるヒストンの高アセチル化を引き起こしていると考えられた。
4)酸化ストレス耐性に重要は働きを果たしているMnスーパーオキシドジスムターゼおよびカタラーゼは転写因子FOXO3aの標的遺伝子である。βヒドロキシ酪酸の投与によって、マウスの腎臓において、FOXO3aのみならず、Mnスーパーオキシドジスムターゼとカタラーゼの発現量もタンパク質レベルで顕著に増加していた。
5)除草剤のパラコートをマウスに投与して酸化障害によるタンパク質のカルボニル化を測定すると、βヒドロキシ酪酸を投与されたマウスでは、酸化ストレスによって引き起こされるカルボニル化を顕著に抑制した。
以上の結果から、βヒドロキシ酪酸は内在性のヒストン脱アセチル化酵素を阻害し、酸化ストレスに対して抵抗性を高める遺伝子のプロモーター部分におけるヒストンの高アセチル化を引き起こし、これらの遺伝子発現を亢進することによって酸化ストレスを軽減するということが証明されたということです。
酸化ストレスに対する抵抗性の亢進は寿命延長やがん抑制に有効であることが明らかになっています。さらに、ヒストン脱アセチル化酵素の阻害が、寿命の延長やがん細胞の分化誘導や増殖抑制に効果があることも多くの研究で明らかになっています。
つまり、絶食やケトン食による健康作用や寿命延長作用や抗がん作用の一部は、βヒドロキシ酪酸によるヒストン脱アセチル化酵素の阻害作用が関与している可能性を示唆しています。
脂肪酸のβ酸化が亢進すると転写因子のFOXOの活性が高まることは318話で紹介しています。
ニキビ治療薬のイソトレチノインがFOXOを活性化することは321話で紹介しています。
また、脂肪酸のミトコンドリアでのβ酸化に必要なL-カルニチンがヒストンのアセチル化を促進することは313話で解説しています。
このような最近の研究から、「ケトン食」に「ニキビ治療薬のイソトレチノイン」と「L-カルニチン」と「AMPKを活性化するメトホルミン」などの組合せは、がん治療に有望のように思います。(この方法については次回紹介します)
ケトン体を増やすことに関しては、最近は美容やダイエットや長寿に有効であることが報告されています。私はがん治療の観点から中鎖脂肪酸を多く使ったケトン食を推奨しています。(詳しくはこちらへ)
しかし、一方で、ケトン体を増やすことに批判的な意見やケトン体を増やすことは危険だという主張もあります。しかし、重度の糖尿病で無いかぎり、ケトン食は問題ありません。
ケトン体を増やすことに批判的な意見に対して、今回紹介した島津忠広博士の論文は決定的な反論とダメージになったと思います。この論文が超一流の学術雑誌のSienceに掲載されていることが、ケトン食の寿命延長などの健康作用を証明していると思います。『βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害する!!』と「!」を2つつけるくらいのインパクトがある論文です。
抗老化治療で使用されている成長ホルモンやインスリン様成長因子-1が長期的には寿命を短くし、がんの発生率を高めることが明らかになっています。成長ホルモンやインスリン様成長因子-1は美容や一時的な抗老化には効果が期待できますが、長寿とがん予防は犠牲になります。
ケトン食は成長ホルモン/インスリン様成長因子-1のシグナル伝達系に抑制的に作用することが明らかになっています。さらにヒストンのアセチル化による寿命延長と抗がん作用も加わります。
糖質を制限し、脂肪酸の燃焼を増やし、ケトン体を多く出させる中鎖脂肪ケトン食に関しては、ほとんどの人がその効果を信じないのですが、実際にがん治療に使ってみてその効果を実感しています。そして、多くの基礎研究から、美容と寿命延長と抗がん作用を同時に達成できることを示す科学的エビデンスが増えています。
追記
【エピジェネティクスと発がん】
私たちの体を構成する細胞は全て同じ遺伝情報を持っていますが、皮膚や神経や筋肉や肝臓など機能の異なる細胞になれるのは、それぞれの細胞において、使う遺伝子と使わない遺伝子に違いがあるからです。
約2万2千個の遺伝子の全てが発現しているわけではなく、発現している遺伝子の違いによって細胞の種類が決まります。このように、DNAの塩基配列(=遺伝情報)が同じなのに、使う遺伝子と使わない遺伝子に目印をつけて、細胞に変化を生じさせる現象をエピジェネティクス(epigenetics)と言います。エピジェネティクスの「エピ」はギリシャ語の接頭語で「上にある、別の、後から」という意味で、本来の遺伝情報(DNAの塩基配列)の土台の「上にかぶさる別の遺伝情報」や「後天的に獲得した遺伝情報」という意味を示しています。
最近までは、遺伝子の突然変異によるがん遺伝子やがん抑制遺伝子の機能異常が細胞のがん化の主な原因と考えられていました。しかし、最近の研究によって、遺伝子の変異とは関係ない、エピジェネティック(epigenetic)な機序によるがん遺伝子やがん抑制遺伝子の発現異常による発がんメカニズムの重要性が指摘されるようになりました。
遺伝子にはその発現を調節する部分があり、これをプロモーターと言います。遺伝子を使うか使わないかを制御している領域のことです。遺伝子が発現するためには、DNAからメッセンジャーRNAを作るRNAポリメラーゼという酵素や遺伝子発現を調節する転写因子がこのプロモーター領域に結合することが必要です。このプロモーター領域には、CpG(C はシトシン、Gはグアニン)という配列が繰り返された部分があり、DNAメチル化とは、DNAのCpGという配列の部分でC(シトシン)にメチル基(-CH3)いう分子がつくことです。プロモーター領域のDNAにメチル化が起こると、RNAポリメラーゼや転写因子が結合できなくなり、遺伝子からmRNAが転写される段階が阻害され、遺伝子発現のスイッチがオフになります。このように、エピジェネティスによって遺伝子発現のスイッチが切られることを「遺伝子のサイレンシング(silencing)」と呼ばれています。(メチル化については下図参照)

遺伝子サイレンシングの別の方法にヒストンの修飾があります。ヒストンのアセチル化はDNAとヒストンの結合を緩くすることによって遺伝子の転写を促進します。つまり、ヒストン脱アセチル化酵素の阻害薬は、遺伝子の発現を高める効果があります。(詳しくは249話、250話参照)
【ヒストンのアセチル化とは】
人間の1個の細胞の核には、約30億対のヌクレオチドからなるDNA(デオキシリボ核酸)が格納されています。このDNAが遺伝子の本体です。細胞核内では、DNAはヒストンという球状の蛋白質複合体に巻き付くような状態で存在します。
ヒストンはリシン(リジン)やアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。
ヒストンによる遺伝子発現の調節は複雑ですが、簡単にまとめると、「ヒストンとDNAの結合は転写に阻害的に働く」ということです。遺伝子が転写されるためには、転写因子やRNAポリメラーゼなどの他の蛋白質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。
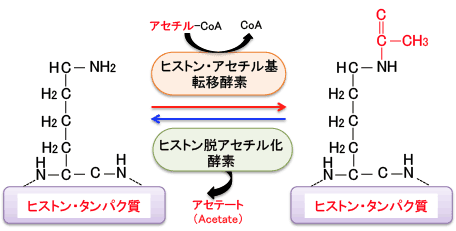
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。アセチル化というのはアセチル(CH3CO)基が結合することです。
ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進(正に制御)し、 反対に、ヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制(負に制御)されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応は「ヒストンアセチル基転移酵素(=ヒストンアセチルトランスフェラーゼ)」と「ヒストン脱アセチル化酵素(=ヒストンデアセチラーゼ)」によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています(下図)。
がん発症の原因は,がん遺伝子やがん抑制遺伝子の変異,すなわち塩基配列上の変化が蓄積し,細胞増殖,接着,細胞死などの制御が異常になることによると考えられています。さらに、遺伝子の塩基配列の変化を伴わない遺伝子の発現異常,すなわちエピジェネティックな変化も発がんに大きく寄与していることが近年明らかになってきました。
このようなエピジェネティックな変化の中で、遺伝子発現の活性を調節するヒストンアセチル化は重要な役割を果たすと考えられています。
P21cip1は細胞周期の進行を担うサイクリン依存性キナーゼ(CDK)の活性を抑制するインヒビターの一つで、細胞増殖の停止、分化や老化に関わっており、がん抑制因子として捉えられています。ヒストン脱アセチル化酵素(histone deacetylase)の阻害は、p21cip1のような細胞周期の進展を阻害する遺伝子の発現を高めることによってがん細胞の増殖を抑える作用が報告されており、ヒストン脱アセチル化酵素阻害剤はがんの治療薬として注目されています。
タンパク質のアセチル化は、ヒストンだけでなく、非ヒストンタンパク質にも起こります。アセチル化を受けるタンパク質には、p53, nuclear factor-κB (NF-κB), p65, CBP, p300, STAT3, tubulin, PC4, GATA factors, nuclear receptors, c-Myc, hypoxia-inducible factor (HIF)-1α, FoxO1, heat-shock protein (Hsp)-90, HMG, E2F, MyoD, Bcr–Abl, the FLT3 kinase, c-Raf kinaseなど多数が知られており、これらの非ヒストンタンパク質のアセチル化は、タンパク質の安定性や局在や他のタンパク質やDNAとの相互作用などに影響して、がん細胞の発生や増殖や転移などに関与しています。
通常、ヒストンや非ヒストンタンパク質のアセチル化はがん細胞の増殖を抑制する方向で働くため、このような作用をもった物質はがんの治療に役立つと考えられています。カテキンやフラボノイドなど天然成分にもこのような作用をもったものが見つかっており、漢方薬の抗がん作用に関しても、このようなエピジェネティックな制御の関与が指摘されています。
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
| « 321)がんと寿... | 323)ケトン食... » |



