がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
323)ケトン食+イソトレチノイン+メトホルミン+L-カルニチン=分化誘導療法?
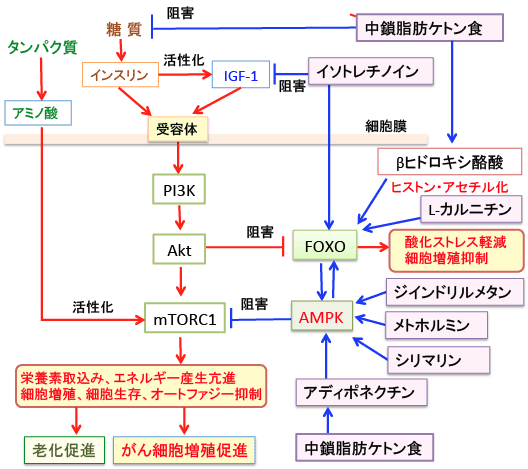
図:中鎖脂肪ケトン食は糖質摂取が少ないため、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系を抑制する。ケトン体のβヒドロキシ酪酸とL-カルニチンはヒストンの高アセチル化を引き起こし、転写因子のFoxOの発現を亢進する。レチノイドのイソトレチノインはIGF-1の産生抑制とFoxO発現を亢進する。FoxOはAMP依存性プロテインキナーゼ(AMPK)の活性を高め、逆にAMPKはFoxOを間接的に活性化するという相互関係にある。ケトン食はアディポネクチンの産生を高めてAMPKの活性を亢進する。メトホルミン、ジインドリルメタン、シリマリンもAMPKを活性化する。AMPKの活性化はmTORC1の活性を阻害することによってがん細胞の増殖を抑制する。FoxOの活性化は酸化ストレスに対する抵抗性を高め、がん細胞の増殖を抑制する作用がある。インスリン/IGF-1シグナル伝達系(PI3K/Akt)の活性抑制とAMPKとFoxOの活性亢進を目標にすることで、抗がん作用を強めることができる。
323)ケトン食+イソトレチノイン+メトホルミン+L-カルニチン=分化誘導療法?
【転写因子FoxOはストレス耐性を高めて寿命延長とがん抑制に関与する】
前回(322話)、ケトン体の一種のβヒドロキシ酪酸がヒストン脱アセチル化酵素を阻害し、Foxo3aやMt2などの酸化ストレス耐性遺伝子のプロモーター領域におけるヒストンの高アセチル化を引き起こし、これらの遺伝子発現を亢進することによって酸化ストレス耐性を高めることが報告されていることを紹介しました。
すなわち、飢餓や絶食による寿命延長効果のメカニズムとして、βヒドロキシ酪酸によって転写因子FoxO3aが活性化され、Mnスーパーオキシドジスムターゼ(Mn-SOD)やカタラーゼの発現を誘導し、酸化ストレスに対して耐性が増強することが関与している可能性が示唆されています。この結果は、血中のβヒドロキシ酪酸が高濃度になるケトン食が、寿命延長やがん抑制に有効である可能性を示唆しています。
さて、寿命延長とストレス耐性が相互に密接に関連することは、1980年代にショウジョウバエの研究で初めて明らかになっています。
老化の遺伝学的研究の第一人者であるマイケル・R・ローズ博士(Michael R. Rose:現カリフォルニア大学アーヴァイン校/生態学・進化生物学部門教授)は、寿命を延ばしたショウジョウバエの集団を作成して、老化の遺伝的研究を行っていました。ローズ博士は長寿化したショウジョウバエ群を初めて作成した研究者ですが、研究の初期のころ(1982年)、実験助手がエサをやるのを忘れてハエを死なせてしまうという出来事がありました。
そのとき、普通のハエはほとんど死んでいたのに、長寿のハエはほとんどが生き残っていました。そこで、ローズ博士は、「長寿バエはストレスに対する抵抗力を高くなっている」、「老化の先送りはストレス耐性の向上と関連している」と考えました。 実際に、長寿バエは普通のハエに比べて、飢餓や乾燥や酸化ストレスに対する耐性が高いことがその後の実験で明らかになっています。
この偶然の発見から、ショウジョウバエを使った長寿の遺伝子の研究は進歩します。 つまり、それまでは、ハエの寿命が延びたかどうかは、ハエが死ぬまで(3ヶ月程度)待たなければなりませんが、若いハエを使ってストレスに対する能力を測定するのは数日で調べられるので、実験のスピードは5~10倍にまで加速することになったということです。
(上記の内容の参考図書:マイケル・R・ローズ「老化の進化論:小さなメトセラが寿命感を変える」熊井ひろ美訳、みすず書房2012年)
最近の研究で、このようなストレス耐性を高めているのがFoxO(Forkhead Box O)という転写因子であることが明らかになっています。
転写因子FoxO(Forkhead Box O)はDNA結合ドメインFox(Forkhead box)を持つForkheadファミリーのサブグループ“O”に属する転写因子です。哺乳類では4種類(FoxO1, FoxO3a, FoxO4, FoxO6)ありショウジョウバエでは1種類(dFOXO)あります。
ハエと哺乳類において、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系は保存されており、FoxO転写因子はこのシグナル伝達系の下流する位置しています。
FoxO1とFoxO3は約650個のアミノ酸からなる蛋白質で、遺伝子のプロモーター領域のTTGTTTACという配列に結合します。アンドロゲン受容体やβカテニンとも相互作用します。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質で、FoxOはストレス応答、代謝制御、細胞周期、アポトーシス、細胞分化、DNA修復、免疫機能、炎症などに関連する多くの遺伝子の発現を促します。
FoxOは様々なストレスに対する抵抗力を高める作用を担っており、たとえば、カタラーゼやスーパーオキシドディスムターゼ(SOD)のような抗酸化酵素の発現を高めることによって酸化ストレスに対する抵抗力を高める作用があります。 がん抑制遺伝子としての性格ももっており、FoxOの活性化は抗がん作用を示します。
【難治性にきびの治療薬のイソトレチノインががんに効く可能性がある】
319話、320話、321話において、にきびと肥満とがんの発生機序が密接に関連していることを解説しました。
これら3つの発症には、インスリンやインスリン様成長因子-1(IGF-1)やmTORC1(哺乳類ラパマイシン標的蛋白質複合体1)が重要な役割を果たしており、これらの治療にインスリンやIGF-1の産生やmTORC1の活性を低下させる方法が有効であることが明らかになっています。
そのような方法として、転写因子のFoxO(Forkhead Box O)やAMP依存性プロテインキナーゼ(AMPK)の活性化する方法が有望であると考えられており、具体的には、カロリー制限や絶食やケトン食などの食事療法、 経口糖尿病薬のメトホルミンなどがあります。
難治性にきびの治療薬であるイソトレチノイン(Isotretinoin)は、レチノイドの一種ですが、IGF-1の産生を減少させる作用や転写因子FoxOを活性化する作用が報告されており、がんの治療に利用する研究が行われています。
【イソトレチノインはIGF-1の産生を低下させる】
成長期の子供がイソトレチノインを服用すると成長が止まることが報告されています。その理由として成長ホルモンやインスリン様成長因子-1への作用が指摘されています。 イソトレチノインがインスリン様成長因子-1(IGF-1)の血中濃度を低下させる作用が報告されています。以下のような研究があります。
Short-term isotretinoin treatment decreases insulin-like growth factor-1 and insulin-like growth factor binding protein-3 levels: does isotretinoin affect growth hormone physiology? (短期間のイソトレチノイン治療はインスリン様成長因子-1とインスリン様成長因子結合蛋白-3の血中レベルを低下させる:イソトレチノインは成長ホルモンの生理機能に影響するのか?)Br J Dermatol 162(4): 798-802, 2010年
この研究では47人のにきび患者(平均年齢21.5±5.1歳)を対象に、イソトレチノインの1日量を最初の1ヶ月間は0.5~0.75mg/kgで開始し、その後維持量として0.88 mg/kgで治療を行っています。そして、治療開始前とイソトレチノン投与開始3ヶ月後に血液検査を行っています。 その結果、インスリン様成長因子-1(IGF-1)とインスリン様成長因子結合蛋白-3( IGFBP3)の血中濃度はイソトレチノイン投与によって顕著に低下しました。成長ホルモンの濃度は変化がありませんでした。 イソトレチノインは小児の腫瘍の神経芽細胞腫(neuroblastoma)の治療に効果があります。この神経芽細胞腫の治療に13-cisレチノイン酸を使った小児の成長が抑制されたという報告があります。
A case of growth failure caused by 13-CIS-retinoic acid administration after bone marrow transplantation for neuroblasoma.(神経芽細胞腫で骨髄移植を行った後に13-cisレチノイン酸投与によって成長障害を起こした1例)Endocr J 46 Suppl:S113-5, 1999
この論文では、神経芽細胞腫の治療で骨髄移植を行った後、長期間にわたって13-cisレチノイン酸を投与した11歳女児の症例を報告しています。この症例では、13-cisレチノイン酸の投与を開始した後の身長の伸びは1年間で1~2cmと発育障害が認められました。成長ホルモンは低下していましたが、IGF-1とIGFBP-3の濃度は正常でした。
1番目の論文では20歳前後の青年期にイソトレチノインを投与すると、成長ホルモンは低下せず、IGF-1とIGFBP-3が低下していましたが、2番目の論文では、成長ホルモンが低下し、IGF-1とIGFBP-3は変化しなかったと報告されています。
成長ホルモンやIGF-1に対するイソトレチノインの影響は年齢によって異なるのかもしれませんが、いずれにしても、イソトレチノインはIGF-1シグナル伝達系を抑制的に作用することは確かなようです。
成長ホルモンやインスリン成長因子-1(IGF-1)は成長期にピークになり20歳代以降は減少し、これが皮膚のたるみや薄毛や性機能低下の原因になってます。したがって、抗老化治療として成長ホルモンやIGF-1の補充が行われています。
しかし、中年以降にこれらの成長因子を補充することは、長期的には寿命の短縮や発がんリスクを高めることになります。つまり、成長ホルモンやIGF-1や性性ホルモンの補充療法は短期的な若返りには有効ですが、長期的な寿命や発がんリスクにはマイナスになるようです。(下図)

【レチノイドは遺伝子の発現を調節する】
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称です。レチノイドは生体内では活性型であるAll-trans retinoic acid (ATRA:以下レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイン酸の核内受容体には、レチノイン酸受容体(retinoic acid receptor: RAR)とレチノイドX受容体(retinoid X receptor: RXR)があり、それぞれα、β、γのサブタイプが存在します。
これらの受容体はリガンドの結合刺激によりホモ二量体(RAR-RARやRXR-RXR)を形成しますが、RXRはRXRとのホモ二量体だけでなく、RARやビタミンD受容体などの核内受容体とのヘテロ二量体(RAR-RXR)も形成します。
そして、これらの二量体は標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列(retinoic acid response element: RARE)あるいはレチノイドX応答配列(retinoid X response element: RXRE)と結合することによって、様々な標的遺伝子の発現を調節しています。
異性体の関係にあるAll-trans-RA (ATRA) と 9-cis-RA (9C-RA)は2つともRARのリガンドになりますが、RXRのリガンドとなるのは9C-RAのみです。
レチノイドによって発現が調節される遺伝子は細胞の分化や増殖や死(アポトーシス)の制御に重要は働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
例えば、レチノイン酸の二重結合がすべてトランス型になったall-trans retinoic acid(ATRA)は急性前骨髄球性白血病の特効薬になっています。また、RXRαのアゴニストとして合成された非環式レチノイドが肝臓がんの再発を予防する効果が報告されています。ある種のがんにはレチノイドは増殖抑制や分化誘導やアポトーシス誘導などの抗がん作用を示します。
難治性にきびの治療に用いられている13-cisレチノイン酸(イソトレチノイン)は、にきびに対する作用機序において、IGF-1産生抑制作用や転写因子のFoxOを活性化する作用などが報告され、また、単独では抗腫瘍効果は弱いのですが、他の治療との組合せで抗腫瘍効果が高まることが報告されています。13-cisレチノイン酸は体内でAll-trans レチノイン酸に変換されて効果を発揮します。

図:ビタミンAの体内における活性本体であるAll-trans retinoic acid(レチノイン酸)はレチノイン酸受容体(retinoic acid receptor: RAR)に結合するとホモ二量体を形成し、標的遺伝子のプロモーター領域にあるレチノイン酸応答配列(RARE)に結合して遺伝子転写のスイッチをオンにする。レチノイン酸の異性体である9-cis retinoic acidはレチノイン酸受容体(RAR)の他にレチノイドX受容体(RXR)にも結合して、ホモ二量体やヘテロ二量体を形成して細胞核内の受容体に結合して標的遺伝子の転写を誘導して生理機能を発揮する。13-cis retinoic acid(イソトレチノイン)はプロドラッグであり、細胞内でAll-trans RAに変換されて、同様の遺伝子発現の調節を行う。
イソトレチノインがFoxO1の活性を高めることが報告されています。以下のような論文があります。
The role of transcription factor FoxO1 in the pathogenesis of acne vulgaris and the mode of isotretinoin action.(尋常性痤瘡の発生メカニズムにおける転写因子FoxO1の役割とイソトレチノインの作用機序) G Ital Dermatol Venereol. 145(5):559-71.2010
この論文は総説(多くの論文のレヴュー)です。
にきび(医学用語では尋常性痤瘡)の発生には、乳製品や高糖質食でインスリン/IGF-1シグナル伝達系が活性化され、mTORC1の活性化やFoxO1の核外移行が促進されることが関連しています。FoxO1の転写活性が低下すると、男性ホルモン受容体の発現が増し、皮脂腺の分泌が増えます。イソトレチノインはFoxO1の発現を亢進し、AMPKを活性化し、mTORC1の活性を抑制します。
つまり、イソトレチノインはIGF-1の産生を低下させ、さらにFoxO1を介してmTORC1の活性を低下させるので、にきびを治す効果があるというわけです。
【ヒストンのアセチル化促進作用とイソトレチノインの相乗効果】
13-cisレチノイン酸(イソトレチノイン)は体内でall-transレチノイン酸(ATRA)に変換され、ATRAは細胞核内のレチノイン酸受容体(retinoic acid receptor:RAR)やレチノイドX受容体(retinoid X receptor: RXR)に結合して2量体を形成して、標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列(retinoic acid response element: RARE)あるいはレチノイドX応答配列(retinoid X response element: RXRE)と結合することによって、様々な標的遺伝子の発現を調節しています。
にきびの治療にはイソトレチノインは劇的に効きます。がんに対する効果も期待されて多くの臨床試験が行われたのですが、あまり良い結果は得られなかったため、次第に注目されなくなっています。
ただ、がん細胞の遺伝子にはエピジェネティックは制御が起こっています。特に細胞増殖を抑制したり細胞死や分化を誘導するようながん抑制遺伝子には、DNAのアセチル化やヒストンの脱アセチル化によって転写因子がアクセスできにくくなっていることが明らかになっています。つまり、レチノイドが思うように効かないのは、これらの遺伝子にレチノイドがアクセスできないためで、アクセスできるようすればレチノイドの抗がん作用が出てくる可能性があります。
中鎖脂肪ケトン食は、糖質を極力摂取しないので、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系を抑制し、脂肪酸のβ酸化が亢進して産生されるケトン体のβヒドロキシ酪酸は、ヒストン脱アセチル化酵素を阻害することによって、ヒストンの高アセチル化によってFoxO遺伝子などのがん抑制作用のある遺伝子の発現を促進します。
ヒストンのアセチル化によって転写因子がアクセスしやすくなると、レチノイドの遺伝子発現誘導作用も促進されます。
実際に、ヒストン脱アセチル化酵素阻害剤とレチノイドを併用したがん治療に関する研究は多く行われており、その相乗効果が報告されています。
つまり、ケトン食ににきび治療薬の13-cisレチノイン酸(イソトレチノイン)を併用するとFoxO遺伝子の発現と転写活性を高めることができる可能性があります。
以上のことをまとめたのが以下の図です。

図:(左)インスリン/インスリン様成長因子-1(IGF-1)はPI3K/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FoxOをリン酸化する。リン酸化されたFoxOは核外(細胞質)へ移行するので、FoxOの転写活性は抑制される。
(右)イソトレチノイン(13-cis retinoic acid)は細胞内でAll-transレチノイン酸
(ATRA)に変換され、レチノイン酸受容体に結合し二量体を形成して標的遺伝子のプロモーター部分のレチノイン酸応答配列(RARE)に結合して遺伝子発現を亢進する。イソトレチノインはIGF-1の産生を抑制する作用がある。さらに、糖質制限はインスリン濃度を低下させ、ケトン食はIGF-1濃度を低下させると同時に、ヒストン脱アセチル化酵素を阻害してヒストンのアセチル化を亢進してFoxO遺伝子の発現を亢進する作用もある。したがって、ケトン体を多く産生する中鎖脂肪ケトン食とイソトレチノインは転写因子のFoxOの活性化などによって相乗効果で抗がん作用を強めることができる。
さらに、脂肪酸の燃焼を促進してケトン食の効果を高めるL-カルニチンにはヒストンのアセチル化を高めて、がん細胞の増殖を抑制することが示されています。(詳しくは313話参照)
すなわち、L-カルニチンは内因性のヒストン脱アセチル化酵素の阻害剤で、生体内でがん細胞の増殖を選択的に阻害することが報告されていま。(PLoS One. 2012; 7(11): e49062.)
さらに、L-カルニチンにアセチル基(CH3CO-)が結合したアセチル-L-カルニチンはヒストンアセチル化のアセチル基を供給する作用があります。
ミトコンドリアで生成されたアセチルCoAは、カルニチン・アシルカルニチン・トランスロカーゼ(carnitine acylcarnitine translocase)の作用で細胞質に運ばれ、ついで細胞核に運ばれ、核でカルニチン・アセチルトランスフェラーゼ(carnitine acetyltransferase)によってアセチルCoAに変換され、ヒストンのアセチル化のアセチル基の供給源となることが報告されています。(Epigenetics 4(6):399-403, 2009年)
アセチル-CoAはグルコース(ブドウ糖)や脂肪酸の分解で生成されます。すなわち、グルコースが解糖系で代謝されてピルピン酸が作られ、ピルビン酸がミトコンドリアに入って、ピルビン酸脱水素酵素の働きでアセチル-CoAに変換されてTCA回路に入ります。脂肪酸もミトコンドリアでβ酸化によって分解されてアセチル-CoAに変換されTCA回路に入ります。このとき、グルコースが枯渇しているとアセチル-CoAは肝臓でケトン体生成に使われます。
グルコース枯渇時にアセチル-CoAがケトン体に変換されるのは、アセチル-CoAが細胞膜を通れないので、細胞膜を通過できるケトン体に変換されて脳などの他の組織の細胞にエネルギー産生の原料として運ばれるためです。
細胞核におけるヒストンのアセチル化では、アセチル-CoAのアセチル基が使われますが、このアセチル-CoAはミトコンドリアで作成され、ミトコンドリアから核への運搬にはL-カルニチンが必要ということです。
この経路をまとめると以下のようになります。

図:グルコースや脂肪酸の分解によって産生されたミトコンドリア内のアセチル-CoAは、カルニチンアセチルトランスフェラーゼ(CAT)の作用により、L-カルニチンと結合してアセチル-L-カルニチンとしてミトコンドリア外の細胞質に輸送され、さらに細胞核に移行する。核に移行したアセチル-L-カルニチンは、L-カルニチンとアセチル-CoAに分解され、アセチル-CoAはヒストンアセチルトランスフェラーゼ(HAT)の作用によってヒストンをアセチル化する。

図:L-カルニチンにはヒストン脱アセチル化酵素阻害作用によってヒストンのアセチル化のレベルを高める。さらにL-カルニチンはアセチル-L-カルニチンとしてミトコンドリアで生成されたアセチルCoAを核に運ぶ役割も担っている。核ではアセチルCoAのアセチル基をヒストンアセチル基転移酵素の働きでヒストンをアセチル化する。つまり、L-カルニチンとアセチル-L-カルニチンは、ヒストンのアセチル化を促進する。
緑茶に含まれるエピガロ・カテキン・ガレート(EGCG)が、がん抑制遺伝子のDNAのメチル化を阻害してがん抑制遺伝子の働きを高めることが報告されています。EGCGのがん予防効果は今まで主に抗酸化作用によるものと考えられてきましたが、DNAメチル化の阻害でがん抑制遺伝子の活性を高める作用も関与しているかもしれないということです。その他、ウコンのクルクミンや、赤ぶどうの皮に含まれるレスベラトロール、アブラナ科野菜のスルフォラファン、大豆のゲニステインなど、がん予防効果が報告されている様々な成分についても、DNAメチル化やヒストンのアセチル化の調節などエピジェネティクスに作用する結果が報告されています。
FoxOの転写活性はPI3K/Aktシグナル伝達系の亢進で抑制されます。FoxOはSestrinというタンパク質を介して間接的にAMPKを活性化します。AMPKもFoxOを活性化する作用があります。つまり、FoxO/Sestrin/AMPKはループを形成して相互に作用してmTORC1を阻害しています。(下図)

FoxOを活性化すると、がん細胞も酸化ストレス耐性を増強して抗がん剤に対しても耐性が高まる可能性が指摘されています。FoxOを活性化するとフィードバックでインスリン受容体の発現が亢進することも報告されています。これはFoxOの活性亢進が行き過ぎないようにするためのフィードバック阻害です。
つまり、FoxOだけを活性化しても、必ずしもがん細胞の抑制にはつながらない可能性があります。
したがって、FoxOを活性化してがん治療に利用するときは、同時にインスリン/IGF-1シグナル伝達系(PI3K/Akt)を効率的に抑制しておくことが必要です。この目的ではケトン食とイソトレチノインが有効です。
さらに、AMP依存性プロテインキナーゼ(AMPK)はmTORC1(哺乳類ラパマイシン標的蛋白複合体-1)を阻害する作用があるので、FoxOを活性化するメトホルミン、シリマリン、ジインドリルメタンなどの併用は、抗がん作用を強化できます。(321話参照)
シリマリンは肝機能障害を予防するので、イソトレチノインの副作用の一つである肝機能障害の予防にも効果が期待できます。
がん治療においては、このように複数の作用点を同時に阻害することが重要です。 (トップの図を参照)
ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
| « 322)βヒドロキ... | 324)漢方薬に... » |



