がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
542)グリオブラストーマ(膠芽腫)の補完・代替医療:医薬品の再開発と保険適用外使用
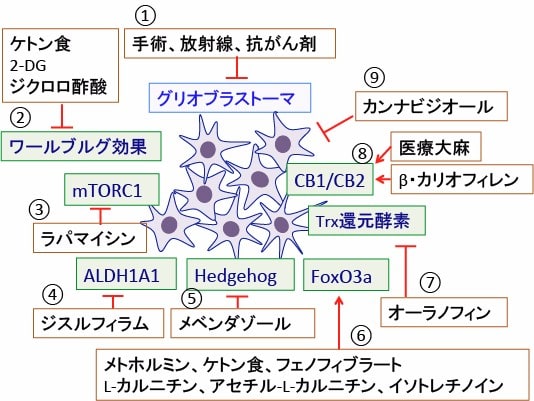
図:①グリオブラストーマ(膠芽腫)は手術・放射線・抗がん剤治療が標準治療として行われているが、予後は極めて悪い。グリオブラストーマの増殖や細胞死に関連する様々なメカニズムが代替医療のターゲットになっている。②解糖系の亢進と酸化的リン酸化の抑制というワールブルグ効果に対して、ケトン食、2-デオキシグルコース(2-DG)、ジクロロ酢酸の効果が期待できる。③哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)阻害剤のラパマイシン、④アルデヒド脱水素酵素1A1(ALDH1A1)の阻害剤のジスルフィラム、⑤ヘッジホッグ(Hedgehog)シグナル伝達系を阻害するメベンダゾール、⑥転写因子のFoxO3aを活性化する治療法は、がん幹細胞を死滅させる。⑦オーラノフィンはチオレドキシン(Trx)還元酵素を阻害して抗腫瘍活性を示す。⑧グリオブラストーマはカンナビノイド受容体のCB1とCB2を発現しており、医療大麻やβカリオフィレンはカンナビノイド受容体を介して抗腫瘍効果を発揮する。⑨大麻成分のカンナビジオールはCB1/CB2とは関係ないメカニズムでグリオブラストーマの増殖を抑制する。これらを組み合せれば、グリオブラストーマの予後を改善できるかもしれない。
542)グリオブラストーマ(膠芽腫)の補完・代替医療:医薬品の再開発と保険適用外使用
【グリオブラストーマ(膠芽腫)は神経膠細胞から発生する】
脳や脊髄など神経組織には大きくわけて2種類の細胞が含まれています。神経細胞(ニューロン)とそれを支える神経膠細胞(グリア細胞)です。その他に血管を構成する細胞もあります。
ニューロンは感覚や運動などの情報を処理する主体で、そのニューロンに栄養を与え、神経組織を健全に維持するのがグリア細胞の役目です。
「グリア細胞」の日本語訳は「膠細胞」です。
「膠」は事典によると、「獣や魚の皮•骨などを水で煮沸し、その溶液からコラーゲンやゼラチンなどを抽出し、濃縮•冷却し凝固させたもの。接着剤•写真乳剤•染色などに用いる」とあります。つまり、動物の腱などから作られた接着剤のようなもので、「膠細胞」は神経細胞の間の組織を埋めるような支持組織で不活性が細胞と考えられていました。
しかし、最近の研究でグリア細胞は脳機能やニューロンの制御に重要な役割を持っていることが明らかになっています。
ヒトの場合はグリア細胞の数はニューロンの10倍程度存在します。
グリア細胞は主に3種類あり、アストロサイト、オリゴデンドロサイト、ミクログリアと呼ばれています。
アストロサイト(星状膠細胞)は多数の突起があり、星のように見えることからこの名があります。神経組織の形態維持、血液脳関門、栄養補給、神経伝達物質の輸送などの役割を担っています。
オリゴデンドロサイト(乏突起膠細胞)は神経細胞の軸策に巻き付いて髄鞘の形成や栄養補給の機能を持っています。
ミクログリア(小膠細胞)は骨髄系のマクロファージに由来し、病原菌の排除や死細胞の除去や傷害を受けた神経組織を修復する働きを担っています。アルツハイマー病など神経変性疾患ではミクログリアが炎症の増悪や神経細胞死に関わってきます。
グリオブラストーマ(膠芽腫)はアストロサイト(星状膠細胞)から発生する悪性腫瘍です。
グリオブラストーマ(膠芽腫)はアストロサイト(星状膠細胞)から発生する悪性腫瘍です。

図:脳組織はニューロン(神経細胞)とグリア細胞(アストロサイト、オリゴデンドロサイト、ミクログリア)と血管組織などから構成される。グリオブラストーマ(膠芽腫)はアストロサイトが悪性化した腫瘍。
【膠芽腫は増殖が早く再発しやすい】
神経膠細胞から発生する腫瘍を神経膠腫(グリオーマ)と言い、神経膠腫の中で最も悪性度の高い腫瘍が膠芽腫(グリオブラストーマ)です。
膠芽腫は増殖活性が高く、進行が早く、ヒトの悪性腫瘍の中で最も予後不良の腫瘍と言われています。
手術や放射線治療や抗がん剤治療などが行われますが、このような集学的治療をおこなっても平均生存期間は12~14カ月程度であり,治療成績はここ30年以上、ほとんど改善がないと言われています。
膠芽腫は周囲の脳組織にしみ込むように広がっていくのが特徴で、腫瘍と正常脳との境界が不鮮明となり、そのため手術によって腫瘍を完全に摘出することは極めて困難です。したがって、手術でできるだけ摘出した後に放射線療法と抗がん剤治療が行われます。
しかし、放射線治療や抗がん剤治療によって生き残るがん細胞がいるため、再発しやすいということです。
このような「放射線治療や抗がん剤治療によって生き残るがん細胞」として「がん幹細胞」の存在が重要と考えられています。
【がん幹細胞は放射線治療や抗がん剤治療に抵抗性が高い】
組織の細胞には幹細胞(stem cell)と成熟した体細胞が存在します。
組織の幹細胞とは、組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる細胞です。
組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出しています。
組織幹細胞は、分裂して自分と同じ細胞を作り出すことができ(自己複製能)、またいろいろな細胞に分化できる(多分化能)という二つの重要な性質を持ち、この性質により、限られた寿命のある体細胞を絶えず供給し、傷ついた組織を修復することができるのです。

図(A)組織の細胞には幹細胞と成熟した体細胞が存在する。幹細胞は組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる。組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出している。
(B)消化管粘膜組織の幹細胞は陰窩の最底部に存在しており、自己複製によって幹細胞を維持すると同時に、不均等分裂によって分化した粘膜上皮細胞を作り出している。粘膜上皮細胞に分化した細胞(体細胞)は、消化管内腔側に向かって移動し、数日で細胞死(アポトーシス)を起こして消化管内に脱落する。
がん組織の中には正常組織における幹細胞システムに類似した階層性が存在し、その中にがん幹細胞 (cancer stem cells)と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成していることが明らかになっています。
すなわち、無限に自己複製を行うがん幹細胞ががん組織中に少数存在し、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっているのです。
多くの場合、このがん幹細胞の起源は通常の組織幹細胞と考えられています。すなわち、組織幹細胞に遺伝子変異が蓄積して、がん幹細胞になるというわけです。
細胞ががん化するためには、複数のがん遺伝子やがん抑制遺伝子に異常が重なる必要があるため、短期間でアポトーシスで死滅する運命の成熟(=分化)した細胞に遺伝子変異が生じても、がん細胞に変化するとは考えにくく、「組織に持続的に存在する幹細胞の遺伝子に変異が蓄積することによってがん細胞(=がん幹細胞)が発生する」と考えられています。
がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境(ニッチ)中に存在し、ニッチより分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞が死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。がん幹細胞が生き残れば、がんはいずれ再燃・再発します。
膠芽腫(グリオブラストーマ)が再発しやすいのは、手術で完全に取りきることが困難なことと、がん幹細胞が放射線治療や抗がん剤で死滅しにくく生き残るためです。
したがって、膠芽腫の再発を防ぎ生存期間を延ばすためには、がん幹細胞の放射線感受性や抗がん剤感受性を高める方法の開発が必要ということになります。(がん幹細胞については163話参照)

図:抗がん剤治療や放射線治療に対して、成熟したがん細胞が死滅しやすいが、がん幹細胞が抵抗性を示す。がん幹細胞が生き残れば、がんはいずれ再燃・再発する。がん幹細胞の抗がん剤感受性を高める方法や、休眠状態を維持する方法を併用すると、がんの縮小効果や再発予防効果を高めることができる。
【医薬品の再開発と適用外使用】
医薬品の開発には莫大な費用と長い年月がかかります。
研究開発に費やされる費用は年々増えているのですが、認可される薬は開発費の増加に比例していないことが指摘されています。
例えば、全世界で医薬品開発に1年間に使われた費用は1975年には40億ドルで、2009年には400億ドルと10倍になっていますが、1年間に認可された新薬は1976年26個で2013年は27個とほぼ同じです。(Int J Biol Sci. 10(7): 654–663.2014年)。
物価上昇分を調整した実質ベースで、10億ドルの研究開発費当たりで認可される新薬の数は、1950年以降、約9年間毎に半減しており、60年間で80分の1になっていると報告されています。(1個の新薬の開発にかかる費用が、物価上昇分を調整した実質ベースで比較して60年前の80倍になっているということです。約9年で2倍になるような指数関数的に増加しているので、54年(=9年x6)で2の6乗=64倍になっているという計算で、60年間で80倍という数字が理解できます)(Nat Rev Drug Discov. 11(3):191-200.2012年)
また、欧米のデータでは、新規の薬効成分が発見されてから薬として認可されるまでの期間は1990年代は平均9.7年で2000年代は13.9年に延びています。(Nat Rev Drug Discov. 10(6):428-38. 2011年)
新薬として認可されるには、既存の医薬品より有効性や安全性で優位性が証明されなければなりません。つまり、新しい薬ほど認可されるハードルが高くなります。
また、既存の薬で病気がコントロールできている場合は新薬の開発は必要ありません。既存薬で病気が治っていない領域の新薬の開発に費用が向けられます。
つまり、がんや神経変性疾患など難病の治療薬(臨床試験で失敗するリスクが高い)の研究開発の比重が次第に増えていることも、一つの新薬が認可されるのに必要な開発費用と期間が増えている理由になっています。
2002年から2012年の間に行われたアルツハイマー病の治療薬の臨床試験は99.6%が失敗に終わっている(治療薬に認可されなかった)という報告があります。
がん治療薬の開発も開発リスクが高いことが指摘されています。米国のデータでは、2003年から2011年の間に第1相臨床試験の開始がFDA(米国食品医薬品局)に認められた物質のうち、最終的に医薬品として認可されたのは6.7%で、この数値は他の領域の医薬品(がん治療薬以外の薬)の半分の成功率と報告されています。
動物実験などの基礎研究でがんの治療薬として効果が期待されて臨床試験の許可を得た候補薬のうち、20個に1個程度しか最終的に薬として成功していません。残りは、開発中止になるので、それまでの研究開発費用は無駄になるということです。
米国で2000年から2009年の10年間に認可された新薬は212種類で、そのうちがん治療薬は24種類で、このうち14種類は血液がんの治療薬です。つまり、固形がんの治療薬は特に開発が難しいようです。
がん治療薬の開発は失敗するリスクが極めて高いので、がん領域の薬の開発に参入しない方針の製薬会社は多いと言われています。
最近は細胞の受容体やシグナル伝達物質をターゲットにした分子標的薬が開発されていますが、それほど大きな治療効果は得られていません。
このように、がん治療薬の開発は製薬会社にとって非常にリスクが高いので、新薬として認可された薬は、その薬自身の研究開発に費やした費用の何十倍もの研究開発費を回収しないと元が取れないために、がんの新薬は年々高額になっています。
このようなお金がかかる新薬の開発において、近年注目されているのが、既存の医薬品が他の治療薬にならないかを検討する医薬品再開発(再利用)です。がん以外の疾患の治療に用いられている既存薬や、がん以外の疾患の治療薬として開発されて臨床試験まで行ったが有効性が証明できなくて開発中止になった物質を、がんの治療薬として再開発(再利用)する研究が注目されています。
医薬品再開発は「ドラッグ・リポジショニング(Drug Repositioning)」あるいは「ドラッグ・リパーポジング(Drug Repurposing)」の日本語訳です。「Repositioning」や「Repurposing」というのは、位置や立場(position)や目的や意図(purpose)を新たにする(re-)という意味です。医薬品の「再開発」や「再利用」という意味です。
ヒトでの安全性や体内動態が既に確認されている既存薬や、ある疾患の治療薬として臨床試験が行われたが有効性が証明できなかった物質を対象にして、これらの物質の新たな薬効を見つけ出し,実用化につなげていこうというのがDrug Repositioning(あるいはDrug Repurposing)という方法です。
新規の開発よりも、開発の費用を減らし期間も短縮できるというメリットがあります。
がん治療薬の場合、そのような既存薬や薬の候補成分を、培養がん細胞(in vitro)や移植腫瘍などを使った動物実験(in vivo)で抗がん活性を見つければ、すでに安全性や薬物動態が判っているので比較的早く臨床試験を実施できます。
最近は、薬剤の候補物質がデータベース化され、細胞の受容体やシグナル伝達物質の構造のデータベースや、抗がん剤による遺伝子発現パターンのデータベースなど様々な情報をコンピューターを使って探索する方法(in silico)もあります。
「in silico」という用語は,「コンピュータ(シリコンチップ)の中で」の意味で、in vitro(試験管内で)やin vivo(生体内で)に対応して作られた用語で、コンピューターを駆使した研究です。
米国では、FDA(米国食品医薬品局)が承認した既存薬や、開発に失敗して製薬企業内で保存されている物質のデーターベースが公開されており、様々な手法で新たな薬効を見つける研究が進んでいます。

図:がん治療薬以外の既存の医薬品や、がん以外の疾患を対象に開発されて臨床試験で開発中止になった薬物を対象に、それらの薬物の抗がん活性を検討してがん治療薬を探索する研究が行われている。他の治療薬として開発された(あるいは臨床試験で効果が証明されずに開発中止になった)薬物から目的外の薬効を探索して別の疾患の治療薬を開発する手法を医薬品の再開発(Drug RepositioningあるいはDrug Repurposing)という。がん以外の疾患を対象に開発された医薬品あるいは薬の候補を、培養細胞(in vivo)や動物実験(in vitro)やコンピューターを使った解析(in silico)などで抗がん活性をスクリーニングする。もし抗がん活性が見つかれば、安全性や薬物動態のデータがあるので、臨床試験などの研究開発の期間を短縮でき、開発費用も節減できる。既に他の治療薬として使用されている場合は、保険適用外の使用でがん治療に直ちに応用できる場合もある。
【がん治療に有効なのに標準治療に使われない薬がある理由】
がんの標準治療の足りない部分を補ったり替わりになる治療法が「補完・代替医療」の定義ですので、がんの補完・代替医療で使用されている薬やサプリメントは基本的には標準治療では使用されていません。
「臨床試験で有効性が証明されていれば標準治療で使われるはずだから、補完・代替医療で使用されている薬やサプリメントは有効性が証明されていないものだ」という意見で、補完・代替医療を否定し、標準治療以外は認めない医師もいます。しかし、これは全くの間違いです。
標準治療で使用されていない医薬品やサプリメントの中に、がん治療に有効性が証明されたものは多数あります。十分なエビデンスがあっても標準治療で使われないのは特許の問題が関連しています。
標準治療で使用される薬は日本では基本的に保険適用薬に限られます。「保険医は、厚生労働大臣の定める医薬品以外の薬物を患者に施用し、叉は処方してはいけない」という規則が定められています。(保険医療機関及び保険医療養担当規則の第19条)
治験用に用いる場合に限って例外は認められていますが、基本的には保険医療機関や保険医が保険適用薬以外を患者に使用することは禁じられているのです。
保険適用されるためには、製薬会社が臨床試験を実施し、有効性や安全性を証明して、厚生労働大臣に製造販売の承認を受けなければなりません。この場合、その物質の特許があれば、その薬を独占して販売できるため利益を得ることができます。
しかし、特許が取れない場合は、莫大な費用(何十億円とは何百億円)を出して臨床試験を実施するメリットがありません。特許がなければジェネリック薬がすぐ出て来て利益が得られないためです。その結果、どの製薬会社も薬として申請しません。誰かが申請しなければ保険薬あるいは承認薬として認可されることはないので、標準治療の中で使用されることは永久にないことになります。
例えば、ジクロロ酢酸ナトリウムや2-デオキシグルコースやメラトニンなど世界中でがんの代替医療で使用され、臨床試験で有効性が示されている物質も、何十年も前から知られている物質で物質特許が取れないので、製薬会社は費用を負担して臨床試験を実施することも、医薬品として開発することもありません。研究者が公的なグラント(研究費)を使って小規模な臨床試験を行っている程度です。
また、サプリメントとして日本でも流通しているビタミンD3やドコサヘキサエン酸(DHA)などがん治療における有効性が臨床試験で証明された物質も、保険薬にはなり得ないので標準治療を行っている保険医が使うことはありません。このような薬やサプリメントは患者さんが自分の意思と自己責任で利用するしかないということになります。
がん治療以外の既存薬でも、抗がん作用が確認されれば、がん患者を対象にして新たに臨床試験を実施して、抗がん剤として適応を追加することはできます。
しかし、特許権の存続期間は原則として特許出願日から20年で、通常は臨床試験を開始する前に出願するので、臨床試験が終了して薬として認可される頃には特許は10年程度しか残っていません。さらにがん治療薬としての別の臨床試験が終わるころには特許が切れるので、そのような申請も行われない可能性が高いと言えます。
例えば、胃酸分泌阻害薬のシメチジン、糖尿病治療薬のメトホルミン、シクロオキシゲナーゼ-2阻害薬のセレコキシブ(celecoxib)など、他の疾患の治療に用いられている薬で抗がん作用が臨床試験で示されている薬があります。これらは特許が切れているので今後がん治療薬として開発されることも認可されることもないと言えます。がん治療の目的で使用しようとすると、保険適用の疾患を持っていなければ処方はできません。つまり、保険診療の医療機関では、保険適用の病気を持っていなければ、たとえがんに対する効果が証明されていても使えないことになります。
しかし、自由診療の医療機関であれば保険適用外の処方も可能になります。このようながん治療において有用な保険適用外使用の例は多くあり、そのような知識があれば、安い費用でがん治療の効果を高めることができます。
以上のような理由で、サプリメントやがん以外の治療に使われている既存薬や古くから知られている抗がん成分などは、たとえがん治療に有効性が証明されても、標準治療に使われることはないことになります。そして、それらはがんの補完・代替医療の重要な薬になります。
最近の抗がん剤の新薬は極めて高額です。がんが根治できる可能性が高ければ、費用が高額で副作用が強くても我慢できます。
しかし実際は、費用が高額で副作用で苦しむ割に、延命効果がわずかであることが多いので、抗がん剤治療に様々な批判があると言えます。
開発に失敗するリスクを減らすため、既存の抗がん剤より少し効果がある程度の薬を目標に設定しているため、新薬が出てもそれまでの治療薬と大差ないという意見もあります。先行薬をベースに多少の改変で新薬を作ると失敗するリスクは減りますが、効果の劇的な改善は望めません。
費用が安く副作用が少なければ、延命効果が少しでも、その方が良いと考えるがん患者さんも多くいます。
そのような患者さんの受け皿になる治療が必要です。これは、「副作用が少なく、費用が安価で、それなりの抗腫瘍効果や延命効果がある」というのが条件になります。
最近、がん以外の既存の治療薬や、がん以外の治療の目的で臨床試験が行われて有効性が証明できなかった物質などからがん治療薬を見つける研究が注目されています。それは、開発の費用を少なくし、期間を短縮することができるからです。
がん以外の治療薬で抗がん作用があるものは、通常の抗がん剤のような強い毒性(副作用)が少ないものが多いと言えます。したがって、このような薬は「副作用が少なく、費用が安価で、それなりの抗腫瘍効果や延命効果がある」という条件に合致する可能性があります。
【副作用の少ない安価な薬の組合せによるがん治療】
単独での抗腫瘍効果は弱くても、組み合わせることによって強い抗腫瘍効果を発揮できる薬もありますが、このような薬は抗がん剤としては認可されることはありません。
しかし最近、このような効果の弱いが抗腫瘍効果が期待できる医薬品やサプリメントを組み合わせてがん治療を行う研究が多く報告されるようになりました。
その理由の一つは、抗がん剤の新薬があまりに高額なわりに、延命効果も少なく、副作用も強いためです。例えば、次のような論文があります。
A conceptually new treatment approach for relapsed glioblastoma: coordinated undermining of survival paths with nine repurposed drugs (CUSP9) by the International Initiative for Accelerated Improvement of Glioblastoma Care.(再発したグリオブラストーマに対する概念的に新規の治療アプローチ:グリオブラストーマの治療成績の改善を促進するための国際的取組みによる9種類の再開発医薬品による生存経路の協調的な弱体化)Oncotarget 4(4):502-30, 2013
【要旨】
再発したグリオブラストーマにおける治療成績を改善するために、従来の細胞毒性のある抗がん剤の組合せに基づく治療法でなく、他の病気の治療薬として使用されていて安全性が高く使用経験の長い既存の医薬品を組み合わせる治療法の確立を目指した。
この治療法で使用する医薬品は、a)薬理学的に十分に研究されている、b)正常細胞に対する毒性が少なく患者に投与して副作用が起こりにくい、c)グリオブラストーマの増殖を促進する良く知られている経路や因子に対して阻害作用を示す根拠がある、d)組み合わせることによってグリオブラストーマの増殖を阻害する効果が相乗的に高まる可能性がある、という4つ基準を満たすものを用いた。
これらの基準に合致する9種類の医薬品を見つけ、再発したグリオブラストーマに標準治療であるStuppプロトコール(Stupp Protocol:放射線治療と低用量のテモゾロマイドの連日服用の組合せの治療法)で治療を行ったあとに、さらにテモゾロマイドの低用量連日投与に加えて、これらの医薬品を併用する治療法を提案した。
この9種類の医薬品の組合せはCUSP9(Coordinated Undermining of Survival Paths;「生存経路の協調的弱体化」)と名付けられ、アプレピタント(aprepitant)、アルテスネイト(artesunate)、オーラノフィン(auranofin)、カプトリル(captopril)、 グルコン酸銅(copper gluconate)、ジスルフィラム(disulfiram)、ケトコナゾール(ketoconazole)、 ネルフィナビル(nelfinavir)、セルトラリン(sertraline)が、低用量のテモゾロマイドの連日投与の治療に追加された。
この論文では、個々の薬がどのようにグリオブラストーマの増殖を抑制し、テモゾロマイドによる治療に対してグリオブラストーマ細胞が抵抗するメカニズムをこれらの薬がどのように阻止するかを考察した。
これらの薬の相互作用のリスクと、これらの薬の組合せが生活の質(QOL)と全生存率の両方を高めることができるかを解説した。
「repurposed drugs」というのは医薬品再開発によって新たな薬効(この場合は抗腫瘍効果)が見つかった薬です。
例えば、がん治療以外の目的で開発された何千種類という既存の薬から、抗がん作用を有する物質を探索する研究が行われており、そのような研究を医薬品再開発(Drug Repositioning あるいはDrug Repurposing)と言います。(400話参照)
グリオブラストーマ(神経膠芽腫)は極めて治療が困難で予後不良の悪性腫瘍です。再発するとほとんどが余命1年以内です。再発したグリオブラストーマの治療成績を高める目的で再開発医薬品の組合せの効果が検討されているという話です。米国のバーモント大学の研究者を中心とした国際的な取組みが行われているようです。
「coordinated undermining of survival paths(生存経路の協調的な弱体化)」というのは、がん細胞の生存のための様々なシグナル伝達系や因子(生存経路)を、9種類の再開発医薬品を組み合せて用いることによって阻害することを意味しています。
この論文で報告された医薬品はがん治療以外で使用されてますが、がん細胞の増殖を抑制する作用が報告されています。そして多くは比較的安価です。
アプレピタント(aprepitant)はニューロキニン-1(NK-1)受容体拮抗薬で、制吐剤として、抗がん剤に伴う悪心・嘔吐の治療に用いられています(商品名:イメンド)
アルテスネイト(Artesunate)は抗マラリア薬で、がん細胞の多く含まれる鉄と反応して活性酸素を産生してがん細胞の酸化ストレスを高めてがん細胞を死滅させます。(459話参照)
オーラノフィン(auranofin)は慢性関節リュウマチの治療に使われる金製剤です。チオレドキシン還元酵素(thioredoxin reductase)を阻害してがん細胞の酸化ストレスを高める作用によってジスルフィラムの抗腫瘍効果を増強します。(424話、427話、431話、509話参照)
カプトリル(captopril)はアンジオテンシン変換酵素阻害薬(ACE阻害薬)と呼ばれる降圧剤です。
ジスルフィラム(disulfiram)はアルデヒド脱水素酵素を阻害する作用によって断酒薬として使用されています。がん幹細胞はアルデヒド脱水素酵素の発現と活性が亢進していることが知られており、その阻害剤の抗腫瘍効果が注目されています。(509話参照)
ケトコナゾール(ketoconazole)はイミダゾール系抗真菌剤で、真菌の細胞膜合成を阻害することにより、抗真菌作用を示します。
ネルフィナビル(nelfinavir)はプロテアーゼ阻害剤でHIV感染症(エイズ)の治療薬です。
セルトラリン(sertraline)は選択的セロトニン再取込阻害薬とよばれる薬で抗うつ作用や抗不安作用があります。
この論文の発表のあと、欧州ではケトコナゾールとネルフィナビルが製造中止になったので、新しいプロトコールではケトコナゾールの代わりにイトラコナゾール(itraconazole)、ナルフィナビルの代わりにリトナビル(ritonavir)が入っています。
ジスルフィラムと銅がキレート(結合)したものが抗腫瘍効果を発揮するという報告から、ジスルフィラムの抗腫瘍効果を高める目的でグルコン酸銅(copper gluconate)が加えられていますが、その後の研究で、胃内でジスルフィラムは銅とキレートすることが報告されたので、新しいプロトコールではグルコン酸銅は省かれています。その代わりにCOX-2阻害剤のcelecoxibが新しく加わっています。
この論文に続いて次のような論文(同じ研究グループからの報告)が出ています。
CUSP9* treatment protocol for recurrent glioblastoma: aprepitant, artesunate, auranofin, captopril, celecoxib, disulfiram, itraconazole, ritonavir, sertraline augmenting continuous low dose temozolomide.(再発グリオブラストーマに対するCUSP9治療プロトコール:持続低用量テモゾロマイド治療の効果を高めるアプレピタント、アルテスネイト、オウラノフィン、カプトリル、 セレコキシブ、ジスルフィラム、イトラコナゾール、 リトナビル、セルトラリンの組合せ)Oncotarget. 5(18):8052-82.2014年
米国のバーモント大学とドイツのウルム大学の研究グループからの報告です。
【要旨】
再発グリオブラストーマに対するCUSP9治療プロトコールを1年前に報告した。今回、このプロトコールに少しの修正を加え、CUSP9*と命名した。
CUSP9*はアプレピタント(aprepitant)、アルテスネイト(artesunate)、オーラノフィン(auranofin)、カプトリル(captopril)、 セレコキシブ(celecoxib)、ジスルフィラム(disulfiram)、イトラコナゾール(itraconazole)、 セルトラリン(sertraline)、リトナビル(ritonavir)の9種類の薬の組合せで、これらは全て国で認可されており、がん以外の治療目的で広く使用されている。
個々の薬は、グリオブラストーマの生存や増殖を促進する経路の一つあるいは幾つかを阻害する作用がある。このような生存のために経路を阻害することによって、グリオブラストーマに対する標準的な抗がん剤治療の効果を高めることができる。
一度に9種類もの多くの薬を使うことに抵抗があるかもしれないが、CUSP9*のオリジナルの組合せ(CUSP9)での経験から、副作用が少なく十分に使用可能である。
これらの薬の組合せは、AKTリン酸化、アルデヒド脱水素酵素、アンジオテンシン変換酵素、 炭酸脱水酵素-2と9と12、 シクロオキシゲナーゼ-1と2、カテプシンB、ヘッジホッグ、インターロイキン-6、5-リポキシゲナーゼ、マトリックス・メタロプロテアーゼ2と9、哺乳類ラパマイシン標的タンパク質、ニューロキン-1、P糖タンパク質、チオレドキシン還元酵素、組織因子、20 kDa translationally controlled tumor protein、血管内皮細胞増殖因子のシグナル伝達経路や活性を阻害する
グリオブラストーマは再発すると予後が極めて悪いので、CUSP9*の臨床試験を実施する価値がある。
つまり、それぞれ単独では抗腫瘍効果が弱くても複数の薬を組み合せることによって、グリオブラストーマの生存や増殖に働いている複数の経路や因子を阻害して、治療に役立てることが可能かもしれないという話です。
この論文で報告されている再開発医薬品はがんの補完・代替医療では既に利用されており、有効性や安全性に関する論文も増えています。

図:グリオブラストーマ(神経膠芽腫)で活性化されている様々な生存経路(増殖シグナル伝達系や因子)の阻害作用がある9種類の既存の医薬品(再開発医薬品)を用いた治療がCUSP9(Coordinated Undermining of Survival Paths with Nine repurposed drugs)という名称で報告されている。このCUSP9は「9種類の再開発医薬品による生存経路の協調的な弱体化」という意味であり、個々の薬の抗腫瘍効果は弱くても、グリオブラストーマ細胞の生存に必須の増殖シグナル伝達系や因子を阻害する医薬品(がん以外の治療で使用されている医薬品)を組み合せることによって抗腫瘍効果を得ることができる可能性が示唆されている。このような副作用の少ない再開発医薬品の組合せによる治療は「体に優しいがん治療」として期待できる。
以上のように、グリオブラストーマの増殖や細胞死を制御する様々なメカニズムが代替医療のターゲットになっています。
グリオグラストーマのグルコース代謝は、解糖系の亢進と酸化的リン酸化の抑制というワールブルグ効果が顕著です。ワールブルグ効果の是正において、ケトン食、2-デオキシグルコース(2-DG)、ジクロロ酢酸の効果が期待できます。
がん幹細胞に多く発現しているアルデヒド脱水素酵素1A1(ALDH1A1)の阻害剤のジスルフィラム(509話参照)、ヘッジホッグ(Hedgehog)シグナル伝達系を阻害するメベンダゾール(401話、522話参照)、転写因子のFoxO3aを活性化する治療法(339話)はがん幹細胞を死滅させる方法として有効です。
多形神経膠腫(glioblastoma multiforme)に対するメベンダゾールの効果は2011年に偶然に発見されました。グリオブラストーマを移植したマウスを使った研究で、マウスにおけるギョウ虫の繁殖を防ぐ目的でフェンベンダゾール(Fenbendazole)を投与したマウスでは移植腫瘍が増大しないことが発見されました。
フェンベンダゾール(Fenbendazole)は動物に使われるベンゾイミダゾール系の寄生虫治療薬の一種です。さらに研究を進め、ベンゾイミダゾール系薬物の中でメベンダゾールが最も強力にグリオブラストーマの増殖を抑制することが明らかになりました。 グリオブラストーマ細胞をマウスに移植する動物実験でメベンダゾールの経口投与(50mg/kg)は顕著に生存期間を延長(63%程度の延長)を示しました。(Neuro Oncol. 13(9): 974–982.2011年)
さらに、グリオブラストーマはカンナビノイド受容体のCB1とCB2を発現しており、医療大麻やβカリオフィレンはカンナビノイド受容体を介して抗腫瘍効果を発揮します。大麻成分のカンナビジオールはCB1/CB2とは関係ないメカニズムでグリオブラストーマの増殖を抑制します。(455話、529話参照)
その他にも、mTORC1阻害剤のラパマイシン、チオレドキシン還元酵素やNF-κB活性を阻害するオーラノフィンなどを組み合せれば、グリオブラストーマの予後を改善できるかもしれません。(トップの図)
新刊紹介:膠芽腫(グリオブラストーマ)の根治を目指す補完・代替医療
本書はプリント・オン・デマンド(Print on Demand)という出版形式で書店では販売していません。アマゾンからの購入になります。
アマゾンからの購入はこちらへ:
| « 541)乳酸脱水... | 543)がん幹細... » |





