がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
543)がん幹細胞とアルデヒド脱水素酵素
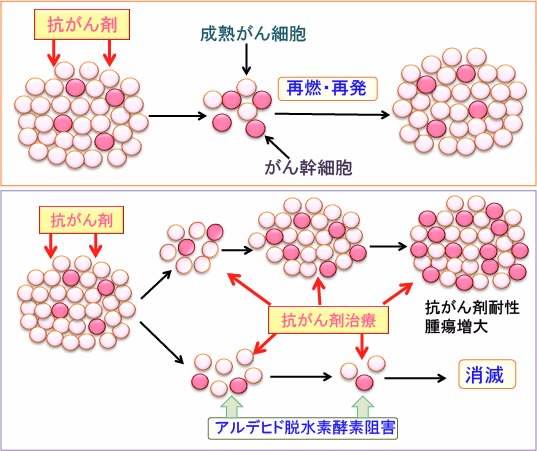
図(上)がん幹細胞は自己複製してがん幹細胞を維持すると同時に、成熟がん細胞を供給してがん組織を構成している。抗がん剤治療に対して、成熟がん細胞が死滅しやすいが、がん幹細胞は様々な機序で抵抗性を示す。がん幹細胞が生き残れば、がんは再燃・再発する。
(下)抗がん剤治療を繰り返すと、抗がん剤に抵抗性のがん幹細胞が生き残り、がん幹細胞が増えることによって、さらに抗がん剤抵抗性が増強し、腫瘍は増大する。がん幹細胞が過剰に発現しているアルデヒド脱水素酵素を阻害するとがん幹細胞は抗がん剤で死滅しやすくなり、がん組織を消滅できる。
543)がん幹細胞とアルデヒド脱水素酵素
【アルデヒド脱水素酵素1A1の発現亢進は予後不良のマーカー】
がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。
がん幹細胞が生き残れば、がんはいずれ再燃・再発するので、がん幹細胞の放射線感受性や抗がん剤感受性を高める方法の開発が重要と考えられています。
その方法の一つとしてアルデヒド脱水素酵素阻害剤が注目されています。
アルデヒド脱水素酵素はがん幹細胞に多く発現し、この酵素の発現が多いがんほど増殖が早く予後が悪いことが報告されています。以下のような報告があります。
Aldehyde dehydrogenase 1A1 circumscribes high invasive glioma cells and predicts poor prognosis(アルデヒド脱水素酵素1A1は高度に浸潤性のグリオーマ細胞に多く発現し、予後不良を示唆する)Am J Cancer Res. 2015; 5(4): 1471–1483.
【要旨】
神経膠腫は高度に浸潤性の性質と予後不良な、極めて悪性度の高い脳腫瘍である。神経膠腫の浸潤性を評価できる信頼できる実践的なマーカーは治療の選択において役にたつ。
この研究では、237例の神経膠腫患者から採取した腫瘍組織におけるアルデヒド脱水素酵素1A1(ALDH1A1)発現が、神経膠腫の診断および予後を評価する上で有用かどうかを検討した。その結果、低悪性度のグリオーマ(WHO grade I-II)に比較して高悪性度のグリオーマ(WHO grade III-IV)ではALDH1A1が過剰に発現していることが明らかになった。
がん細胞内のALDH1A1の発現量は、腫瘍組織の中心部より、腫瘍組織の周辺部(正常組織との境界部)のがん細胞においてより発現が高かった。
ALDH1A1の過剰発現はがん細胞の分化度の低下と予後不良と関連を認めた。
正常組織との境界部にALDH1A1陽性の腫瘍細胞が存在する患者の全生存期間および無進展生存期間はより短かかった。
ALDH1A1の発現はグリオーマ患者の予後不良の独立したマーカーであることが明らかになった。
グリオブラストーマ細胞株U251および原発のグリオブラストーマ組織から採取したALDH1A1陽性の腫瘍細胞は、ALDH1A1陰性の腫瘍細胞に比べて、マトリックス・メタロプロテイネース2, 7, 9(MMP2, MMP7,MMP9)のmRNAとたんぱく質発現が亢進し、浸潤性やクローン形成性や増殖が強かった。
これらの結果は、ALDH1A1がグリオーマの浸潤や増殖を促進し、予後を不良にする因子であることを示している。したがって、高度に悪性度の高い神経膠腫の治療において、ALDH1A1をターゲットにする治療は重要である。
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。

アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。
つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。
細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
多くのがん種においてALDH活性の高いがん細胞は増殖や転移を促進することが報告されています。
ALDH活性の高い腫瘍は生存期間も短く予後が悪いことが報告されています。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。
【抗がん剤治療を繰り返すとALDH陽性の抗がん剤耐性のがん細胞が増えてくる】
抗がん剤治療を行っていると、次第にがん細胞はその抗がん剤に耐性を獲得してきます。そのメカニズムは多数知られていますが、アルデヒド脱水素酵素の発現亢進が関与している場合があります。以下のような報告があります。
The role of aldehyde dehydrogenase (ALDH) in cancer drug resistance.(がん細胞の抗がん剤抵抗性におけるアルデヒド脱水素酵素の役割)Biomed Pharmacother. 2013 Sep;67(7):669-80.
【要旨】
がん患者の抗がん剤治療は、がん細胞の抗がん剤抵抗性によって満足のいく結果が得られてない。抗がん剤抵抗性の主なメカニズムは、がん細胞がABCファミリーのトランスポーターたんぱく質によって抗がん剤を細胞外に盛んに排出するためである。
ABCB1とABCG2はがん細胞における薬剤耐性に関わる腫瘍なたんぱく質である。
最近の研究によって、アルデヒド脱水素酵素(ALDH)も抗がん剤耐性に関わっていることが明らかになった。
ABCトランスポーターとALDH酵素の発現が、組織幹細胞とがん幹細胞と薬剤耐性がん細胞に認められた。
現在の抗がん剤治療は腫瘍組織のがん細胞の多くを死滅させることはできるが、ALDHを発現しているがん幹細胞に対しては効果がない。
その結果、抗がん剤治療を繰り返すとALDH陽性の抗がん剤耐性のがん幹細胞の数が増えてくる。
この事実は、抗がん剤抵抗性のがん幹細胞をターゲットにした治療を開発する必要性を示している。
がん幹細胞をターゲットにした治療法が多く研究・開発されている。
このような治療法として、各種のレチノイン酸を単独で用いたり、レチノイン酸とDNAメチルトランスフェラーゼ阻害剤やヒストン脱アセチル化酵素阻害剤を組み合わせて細胞分化を誘導する方法(細胞分化療法)が提案されている。
がん幹細胞のシグナル伝達系をターゲットにした治療法も検討されている。
ALDH陽性細胞の数を減らしたり、ABCたんぱく質の発現量を減らすようなメカニズムでがん幹細胞の抑制する作用をもった天然成分も多く見つかっている。
従来の抗がん剤治療に分化誘導療法やがん幹細胞のシグナル伝達系に作用する治療薬の組合せは、抗がん作用を高める目的で有望と思われる。
このレヴューでは、がん細胞の抗がん剤抵抗性獲得におけるALDHとABCたんぱく質の役割と、がん幹細胞をターゲットにした治療法について考察する。
この論文は総説ですが、アルデヒド脱水素酵素の発現が多いがん細胞は抗がん剤に抵抗性を示すことが報告されています。したがって、抗がん剤治療を行っていると、抗がん剤が効きにくいアルデヒド脱水素酵素を多く発現するがん細胞が選択的に残ってきます。
その結果、抗がん剤を継続していると、アルデヒド脱水素酵素を多く発現するがん細胞の割合が増え、さらに抗がん剤が効きにくくなるというストーリーです。
経験的に、抗がん剤治療を行っていると、がん細胞は次第に抗がん剤で死ににくくなりますが、そのメカニズムの一つとしてアルデヒド脱水素の関与が重要ということです。
レチノイドやヒストン脱アセチル化酵素阻害による分化誘導については476話で解説しています。
【アルデヒド脱水素酵素は酸化ストレスを軽減している】
人間のゲノムには、機能的なアルデヒド脱水素酵素の遺伝子が19個見つかっています。
これらのアルデヒド脱水素酵素は、内因性および外因性のアルデヒド性物質をNAD(P)+-依存性酸化反応によって解毒する役割を担っています。
内因性のアルデヒドはアミノ酸やアルコールや脂肪酸やビタミンの代謝の過程で発生します。
外来性のアルデヒドは環境中の成分や薬物(タバコの煙、自動車の排気ガス、細胞毒性のある医薬品など)などから由来します。
アルデヒド脱水素酵素はこれらのアルデヒドを解毒する働きがあるのです。
ALDH1にはALDH1A1とALDH1A2とALDH1A3の3つのアイソタイプがあり、正常組織の組織幹細胞とがん組織のがん幹細胞のマーカーとして知られており、幹細胞における自己複製、分化、細胞保護に関与しています。
マウスやヒトの細胞を用いた研究では、とくにALDH1A1アイソタイプの過剰発現および活性亢進は、乳がん、肺がん、食道がん、大腸がん、胃がんなど多くのがん種で、がん患者の予後不良と密接に関連していることが明らかになっています。
20年以上前に、白血病などの造血器腫瘍で、ALDHの活性が高い細胞はアルキル化剤のシクロフォスファミドに抵抗性を示すことが報告され、その後、ALDHの活性が高いがん細胞は多くの抗がん剤や放射線照射に抵抗性になることが明らかになっています。
ALDH1A1は細胞内のアルデヒドを酸化することによってがん細胞内の酸化ストレスを軽減しています。
【アルデヒド脱水素酵素はがん細胞のエネルギー代謝にも関与している】
以下のような報告があります。
Aldehyde dehydrogenase is used by cancer cells for energy metabolism.(アルデヒド脱水素酵素はがん細胞によってエネルギー代謝に使われる)Exp Mol Med. 2016 Nov 25;48(11):e272.
【要旨】
非小細胞性肺がんの組織サンプルを解析した結果、非小細胞性肺がん細胞は多種類のアルデヒド脱水素酵素(ALDH)アイソフォームを過剰に発現していることを明らかにした。
正常なヒト肺細胞IMR-90に比較して、非小細胞性肺がん細胞は多種類のALDHアイソザイムの発現量が多かった。
ALDHの酵素反応の結果、アルデヒドがカルボン酸に変換される反応の副産物としてNADHが産生される。
ALDHによって産生されるNADHが非小細胞性肺がんにおけるATP産生の重要なエネルギー源になるかもしれないと考えた。
本研究では、ALDHによるNADH産生が非小細胞性肺がんのエネルギー(ATP)産生に大きく寄与していることを明らかにした。
さらに、ALDHの多くのアイソフォームの阻害剤であるGossypolは細胞内のATPレベルを低下させた。Gossypolとフェンホルミン(phenformin)は相乗的にATPレベルと低下させ、細胞周期を停止させ細胞死を誘導した。
アルデヒド脱水素酵素が作用するとNADHが産生されます。このNADHがATP産生の原料になるので、アルデヒド脱水素酵素の過剰発現はエネルギー産生にも寄与しているという論文です。
【アルデヒド脱水素酵素の阻害は抗がん剤感受性を高める】
例えば肺腺がんで分子標的薬のチロシンキナーゼ阻害剤(イレッサ、タルセバなど)が効いても、多くは10から14ヶ月程度で効かなくなります。
通常の殺細胞作用を持った抗がん剤治療も、数ヶ月から1年もすれば効かなくなってきます。これは、がん細胞は抗がん剤治療を受けている間に薬剤抵抗性を獲得するからです。
がん細胞が抗がん剤でダメージを受けると、いろんなメカニズムを使って生き残る手段を獲得してきます。
例えば、アポトーシスを誘導するたんぱく質の発現を抑えたり、アポトーシス抵抗性にするたんぱく質の発現を誘導することによって細胞死そのものに抵抗性になるメカニズムもあります。
細胞内に入ってきた抗がん剤を細胞外に排出するたんぱく質や抗がん剤を分解するたんぱく質の発現量を増やして、細胞内の抗がん剤の量を減らすメカニズムもあります。
そして、アルデヒド脱水素酵素が抗がん剤抵抗性に関与していることが多くの研究で明らかになっています。
マウスのがん細胞を移植する実験で、ALDH1A1の発現が陽性の肺がん細胞は、ALDH1A1が陰性の(発現していない)肺がん細胞に比べて、腫瘍形成能が100倍以上という実験結果が報告されています。
ヒトの肺がん細胞での検討でも、肺がん組織のALDH1A1の発現の多い肺がん患者はALDH1A1の発現が少ない肺がん患者よりも予後が悪い(生存期間が短い)と言う報告が複数あります。
低分子干渉RNAや薬剤などでALDH1A1の発現や活性を阻害すると、がん細胞の抗がん剤感受性が亢進することが報告されています。
ゲムシタビン耐性の膵臓がん、白金製剤やタキサン系の抗がん剤に耐性の卵巣がん、多剤耐性の胃がん細胞、シクロフォスファミド耐性のヒトがん細胞などでALDH1A1の発現亢進が報告されており、ALDH1A1は多くの種類のがん細胞における薬剤耐性の原因となっている可能性が示唆されています。
膵臓がん細胞をGEM存在下で長期間培養するとALDH1A1陽性の膵臓がん幹細胞が誘導されてくることが報告されています。
【断酒薬のジスルフィラムはALDH1A1を阻害する】
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは副作用の極めて少ない薬です。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです。
ジスルフィラムはALDH1A1を阻害します。その他、ジスルフィラムはプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。酸化ストレスを高める作用もあります。したがって、抗がん剤治療と併用して抗腫瘍効果を高める方法として、ジスルフィラムは極めて有用です。(419話参照)
進行した肺がんの抗がん剤治療にジスルフィラムを併用すると生存期間を延長する効果が報告されています。
A Phase IIb Trial Assessing the Addition of Disulfiram to Chemotherapy for the Treatment of Metastatic Non-Small Cell Lung Cancer.(転移している非小細胞性肺がんの抗がん剤治療にジスルフィラの併用の効果を検討する第IIb相試験)Oncologist. 2015 Apr;20(4):366-7.
これは多施設のランダム化二重盲検試験で転移を有するステージ4の進行肺がん患者40例を対象に無作為に2群に分け、抗がん剤(シスプラチン+ビノレルビン)のみと抗がん剤+ジスルフィラム(40mg x 3 /日)の群で比較しています。
無増悪生存期間の中央値が抗がん剤のみが4.9ヶ月、ジスルフィラム併用群が5.9ヶ月、全生存期間の中央値が抗がん剤のみが7.1ヶ月に対してジスルフィラム併用群では10.0ヶ月でした。
抗がん剤単独群では24ヶ月以内に全ての患者は死亡していますが、ジスルフィラム併用群では20%の患者が3年以上の長期生存を認めています。
ジスルフィラムはアルデヒド脱水素酵素を阻害する薬で、この酵素はがん幹細胞で過剰に発現していることが報告されており、がん幹細胞のマーカーとしても使用されています。
アルデヒド脱水素酵素の阻害はがん幹細胞を死滅させやすくするので、抗がん剤の効き目を高めるものと考えられます。
臨床試験で有効性が示されているので、試している価値はあります。
ジスルフィラムとドコサヘキサエン酸(DHA)が相乗的に抗がん作用を増強するという報告もあります。
Docosahexaenoic acid and disulfiram act in concert to kill cancer cells: a mutual enhancement of their anticancer actions.(ドコサヘキサエン酸とジスルフィラムはがん細胞の殺作用において協調的に作用する:抗がん作用の相互増強)Oncotarget. 2017 Mar 14;8(11):17908-17920.
ジスルフィラムとドコサヘキサエン酸(DHA)はそれぞれ単独でも抗腫瘍作用を示しますが、両者を併用すると、その抗腫瘍作用が相乗的に増強するという実験結果を報告しています。その機序として、DHAによって誘導される細胞内酸化ストレスをジスルフィラムが増強し、ジスルフィラムによるがん幹細胞の抑制作用をDHAが増強することを示しています。
前述のように、アルデヒド脱水素酵素は酸化ストレスを軽減するので、ジスルフィラムは酸化ストレスを増強します。
魚の油やサプリメントとしてDHAを多く摂取し、ジスルフィラムを服用するという治療は試してみる価値はあります。(魚油サプリメントの抗腫瘍効果に関しては351話参照)
注:ジスルフィラム服用中は飲酒はできません。奈良漬けのようなアルコールの入った食品も食べれません。抗がん剤のパクリタキセルは溶解剤としてエタノールを用いていますので、パクリタキセル治療中はジスルフィラムは使用できません。点滴による抗がん剤治療を受けているときには、溶解剤などでエタノールを使用していないことを確認する必要があります。
エタノールを摂取しなければ、副作用はほとんど経験しません。
◯ ジスルフィラムがプロテオソーム阻害作用によって抗がん作用を示すことがNatureの論文に発表されています。(573話参照)
◯ ジスルフィラムの詳細はこちらへ:
| « 542)グリオブ... | 544)FoxO3aを... » |



