がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
783)「がんのアルカリ療法」の実践法のまとめ

図:がん細胞ではグルコースの取り込みと解糖系での代謝が亢進し、乳酸と水素イオン(H+)が増え(①)、水素イオンはV型ATPアーゼ(V-ATPase)で細胞外に排出され(②)、がん細胞外に水素イオンが貯留して酸性化している(③)。がん細胞では低酸素誘導因子-1(HIF-1)の発現と活性が亢進してピルビン酸脱水素酵素キナーゼの発現を誘導し(④)、ピルビン酸脱水素酵素の活性を阻害している(⑤)。その結果、ピルビン酸からアセチルCoAの変換が阻止され、ミトコンドリアのTCA回路での代謝と酸化的リン酸化によるATP産生が抑制されている。重曹(重炭酸ナトリウム)とトリス塩基はがん細胞外に貯留している水素イオンを中和し(⑥)、プロトンポンプ阻害剤はV型ATPアーゼの活性を阻害して、水素イオンの細胞外排出を阻止する(⑦)。細胞膜の炭酸脱水酵素IX(CAIX)と細胞質内の炭酸脱水酵素II(CAII)は、細胞内の重炭酸イオン濃度を高めて、細胞内pH(pHi)をアルカリ化しており、シクロオキシゲナーゼ-2の阻害剤のセレコキシブと人工甘味料のアセスルファム・カリウムは炭酸脱水酵素IX(CAIX)と炭酸脱水酵素II(CAII)の活性を阻害することによって細胞内のアルカリ化を阻止する(⑧)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼとHIF-1(低酸素誘導因子-1)を阻害する機序で、ピルビン酸脱水素酵素の活性を亢進してミトコンドリアでの代謝とATP産生を促進する(⑨)。メラトニンはHIF-1の活性を抑制する(⑩)。2-デオキシ-D-グルコース(2-DG)はヘキソキナーゼとヘキソース・フォスフェート・イソメラーゼの活性を阻害し(⑪)、クエン酸はフルクトキナーゼの活性を阻害し(⑫)、2-DGとクエン酸はともに解糖系を阻害する。これらの相乗効果によって細胞内pH(pHi)を低下させ(⑬)、細胞外pH(pHe)を上昇して、pHiとpHeを正常細胞に近づけることによって、がん細胞の増殖や細胞死抵抗性を抑制し、抗がん剤治療や免疫療法の抗腫瘍効果を高めることができる。
783)「がんのアルカリ療法」の実践法のまとめ
【重炭酸ナトリウムはpH緩衝剤として安全に利用できる】
がん治療に重曹(重炭酸ナトリウム)を使用する時は、500ml程度の水に10から15g程度の重曹を溶かして、空腹時に1日数回に分けて服用します。重曹は胃酸過多の治療に制酸剤として用いますが、これは重曹が胃酸を中和するためです。胃の中に胃酸が多い時に重曹を服用すると胃酸と反応して炭酸ガスになってしまいます。したがって、体内に重炭酸イオンを増やすためには、胃酸が少ない空腹時の摂取が良いと言えます。

図:重曹(重炭酸ナトリウム)を経口摂取すると体内のがん組織の水素イオンを中和して、二酸化炭素(CO2)と水(H2O)になる。二酸化炭素は呼気に排出され、水は血液に拡散する。
同様に、クエン酸と併用する時は、クエン酸と重曹を一緒に摂取すると胃の中で炭酸ソーダになって重曹によるアルカリ化作用は減弱します。重曹は空腹時に摂取し、クエン酸は食後に摂取するように時間をあけて服用します。

図:重炭酸ナトリウム(重曹)とクエン酸を混ぜるとクエン酸ナトリウムと炭酸水(二酸化炭素+水)になる。
重曹は食品や医薬品として利用され、1日10〜20グラム程度でがん組織の酸性化の軽減に有効に作用し、この程度の量であれば、長期に使用しても安全性に問題がないことが知られています。ただし、二酸化炭素を呼気から排出できないとアシドーシス(酸性血症)を引き起こします。重炭酸ナトリウムを使用するときには呼吸機能が正常であることが必要です。また、ナトリウムが含まれるので、腎臓や心臓の機能が低下している場合は注意が必要です。高齢者や生理機能が低下している場合も、減量など注意が必要です。
血中の重炭酸イオン(HCO3-)の上昇は、血液のpHには影響せずに、がん組織とがん組織周辺の酸性血症(アシドーシス)を正常化することが確認されています。つまり、重炭酸ナトリウムの摂取は血液の正常なpH(7.35–7.45)をアルカリ化することはせずに、酸性化したがん組織(pHが6.6〜6.9)は正常なpHに向けて緩衝作用を示します。
がん治療では、重炭酸ナトリウムの1日の服用量を25から50グラム程度を推奨する報告もあります。この程度の投与量は、尿細管性アシドーシスや鎌状赤血球症などの治療で、長期間(1年以上)使用されており、安全性には問題ないという意見もあります。
しかし、私の意見としては1日20g以上の重曹の摂取は推奨できません。20gの重曹は5.5gのナトリウムの摂取になります。これは食塩換算で14gの食塩(NaCl)の摂取になります。厚生労働省は1日の塩分摂取量(食塩摂取量)の基準を、男性7.5g未満、女性6.5g未満としています。また日本高血圧学会では1日6g未満、WHO(世界保険機関)では1日5g未満としています。つまり、1日14gの食塩の摂取は健康に極めて問題がある量と言えます。従って、重曹の服用は1日に10gから15g程度に制限するのが無難です。
重炭酸ナトリウムの点滴(メイロン点滴)もがんの代替療法として有効であることを経験しています。ただし、腎臓や心臓や呼吸器の機能が低下している場合は、アルカローシスや高ナトリウム血症などの副作用が起こりやすいので、この治療法に精通している医師のもとで受ける必要があります。
【クエン酸は代謝を活性化し、体液をアルカリにする?】
強い運動をして体内で乳酸が増えると、血液は酸性に傾きます。がん細胞はブドウ糖(グルコース)を多く取り込み、酸素を使わない解糖系での代謝が亢進して乳酸の産生が増えています。そのため、進行がんの患者さんでは血液が酸性化しています。
乳酸が蓄積し、血液が酸性化すると、疲労や倦怠感を感じるようになります。体は腎臓から乳酸などの酸性物質の排泄を促進して血液のpHを正常に保とうとします。つまり、尿のpHを測定すると体内の酸性度を知ることができます。
クエン酸の健康作用に関しては、東大教授の秋谷七郎博士(1896〜1978)の研究が有名です。クエン酸を多く摂取すると尿がアルカリになること、さらに体調を良くし体力を高めることを報告しています。
有機酸摂取による尿成分の変化について (第1報):有機酸摂取が尿pH値及び乳酸量に及ぼす影響について 薬学雑誌 1956 年 76 巻 2 号 p. 111-115
秋谷教授は、第2次世界大戦中に、潜水艦で使用する味噌のカビを防止するためクエン酸の添加を試みたところ、カビ防止の効果以外に乗組員の疲労度が目立って低くなり、健康状態が著しく向上して長時間の潜行に耐えられるようになったことを知りました。そこで、自分でもクエン酸を飲用し、尿中の乳酸量が減少する事実を突き止めました。クエン酸が代謝を促進して疲労の原因である乳酸の生成を減少させ、体液をアルカリに維持するというメカニズムを報告しています。
【クエン酸では尿はアルカリにはならない?】
秋谷七郎博士は「クエン酸が代謝を活性化して乳酸を減らして尿のpHをアルカリにする」と報告していますが、実際にクエン酸を単独で摂取しても、尿はアルカリ(pHが7.0以上)にはなりません。クエン酸自体は弱酸性だからです。
私自身、何回も試しましたし、動物実験の結果などからも、「クエン酸では尿はアルカリ(pHが7.0以上)にならない」というのが正確だと思います。
ただし、秋谷教授の論文を読むと、服用前の尿のpHが6.0で、クエン酸5gを摂取して2時間後に尿のpHが6.8程度までは上がると記載されています。つまり、アルカリ(pHが7.0以上)にはならないが、酸性の度合いは低下する(pHは上がる)というのは正しい様です。細胞内の代謝が活性化し、乳酸産生が減少し、体液をアルカリ側に維持するというメカニズムです。
一方、クエン酸ナトリウムやクエン酸カリウムは酸性尿や酸性血症(アシドーシス)の治療に使われています。クエン酸ナトリウムとクエン酸カリウムを配合した製剤が「痛風並びに高尿酸血症における酸性尿の改善」や「アシドーシス(酸性血症)の改善」の目的で、処方薬として承認されています。
クエン酸塩(クエン酸カリウム・クエン酸 ナトリウム)として摂取した場合、ミトコンドリアのクエン酸回路で代謝され、それぞれ炭酸水素ナトリウム(NaHCO3)および炭酸水素カリム(KHCO3) となり、体液中に重炭酸イオン(HCO3-)を増やし、結果として尿アルカリ化効果を発揮すると考えられています。
動物実験データでは、クエン酸カリウム、クエン酸ナトリウム、クエン酸の各成分 2g/kg をラットに投与し、尿 pH への影響 を確認したところ、対照群の尿 pH=5.51±0.07 に対し、クエン酸 K (尿 pH=7.75±0.09)、クエン酸 Na (尿 pH=8.07±0.05)では尿 pH の上昇が確認されましたが、クエン酸(尿 pH=5.20±0.07)では認められませんでした。
(参考:https://www.nc-medical.com/product/faq2/uralyt/doc/uralyt_08.pdf)
マウスの膵臓がん異種移植モデルにおいて、クエン酸カリウム/クエン酸ナトリウムの毎日の経口投与による腫瘍微小環境の酸性化の中和が、抗がん剤の治療効果を増加させることが報告されています。以下の様な実験結果が報告されています。
Neutralization of Acidic Tumor Microenvironment (TME) with Daily Oral Dosing of Sodium Potassium Citrate (K/Na Citrate) Increases Therapeutic Effect of Anti-cancer Agent in Pancreatic Cancer Xenograft Mice Model.(クエン酸カリウム/クエン酸ナトリウム(K / Naクエン酸塩)の毎日の経口投与による腫瘍微小環境の酸性化の中和は、膵臓がん異種移植マウスモデルにおける抗がん剤の治療効果を増加させる)Biol Pharm Bull. 2021;44(2):266-270.
この実験ではマウスに膵臓がん細胞を移植する実験系で、クエン酸カリウム/クエン酸ナトリウム(K / Naクエン酸塩)の毎日の経口投与が、抗がん剤のTS-1の治療効果を増強することを報告しています。
クエン酸カリウム/クエン酸ナトリウムの経口投与が、血中の重炭酸イオン(HCO3-)の血中濃度を高め、がん組織の細胞外pHの酸性化を中和することが、TS-1の効き目を高めると考察しています。膵臓がんに対する抗がん剤治療の効果を高める方法としてクエン酸カリウム/クエン酸ナトリウム製剤の有効性を示唆しています。
【クエン酸は様々なメカニズムでの抗腫瘍活性を発揮する】
がん治療におけるクエン酸の有効性を示した研究報告は多数あります。例えば、抗がん剤抵抗性のヒト中皮腫細胞株を使った培養細胞レベルでの実験で、クエン酸を添加するとアポトーシスが誘導されること、抗がん剤のシスプラチンの効果を高めることが報告されています。そのメカニズムとして解糖系のフルクトキナーゼの活性を阻害することによってATPの産生が減少することを挙げています。
Effect of citrate on malignant pleural mesothelioma cells: a synergistic effect with cisplatin.(悪性中皮腫細胞におけるクエン酸の効果:シスプラチンとの相乗効果)Anticancer Res. 2009 Apr;29(4):1249-54.
ジクロロ酢酸ナトリウムは抗がん剤のパクリタキセルに抵抗性のがん細胞の薬剤感受性を回復する効果があります。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAの変換を亢進してTCA回路を促進し、クエン酸の産生を増やします。このクエン酸が蓄積するとパクリテキセルに抵抗性のがん細胞が、パクリタキセルに感受性を回復するというメカニズムが提案されています。
Dichloroacetate restores drug sensitivity in paclitaxel-resistant cells by inducing citric acid accumulation. (ジクロロ酢酸はクエン酸の蓄積を引き起こすことによってパクリタキセル抵抗性細胞の薬剤感受性を回復させる)Mol Cancer. 2015; 14: 63.
2017年に米国のハーバード大学医学部のヴィカス・スカトメ(Vikas P. Sukhatme)博士らの研究グループから「クエン酸は様々な機序でがん細胞の増殖を抑える」という趣旨の総説論文が発表されています。
Citrate Suppresses Tumor Growth in Multiple Models through Inhibition of Glycolysis, the Tricarboxylic Acid Cycle and the IGF-1R Pathway.(クエン酸は解糖系とTCA回路とIGF-1受容体経路の阻害によって多数の実験モデルにおいて腫瘍の増大を抑制する) Sci Rep. 2017; 7: 4537.
この論文では、様々ながん細胞株を用いた実験系(培養細胞と動物実験)でクエン酸が抗腫瘍効果を示すことを報告しています。そのメカニズムとして、①がん細胞の分化誘導、②腫瘍組織内のリンパ球のT細胞の動員と活性化、③インスリン様増殖因子-1(IGF-1)受容体の活性化(リン酸化)の阻害、④AKTリン酸化の阻害、⑤解糖系とTCA回路の両方の抑制など多様なメカニズムでがん細胞の増殖を阻害し、アポトーシスを誘導することを報告しています。
つまり、クエン酸は、免疫系を活性化し、がん細胞の増殖シグナルの伝達系を抑制し、エネルギー産生系を阻害してATPを枯渇するという結果です。
この論文の結論は「食事からのクエン酸の補充はがん治療として有用であるかもしれない」となっています。この論文の責任著者のヴィカス・スカトメ博士は、がん細胞の代謝や抗腫瘍免疫など腫瘍学の広い範囲における基礎研究や臨床研究で顕著な業績を挙げている研究者です。
フランスのノルマンジー大学医学部のフィリップ・イカード(Philippe Icard)博士のグループもスカトメ博士と同じ内容の研究結果を多数報告しています。クエン酸の外来性の投与ががん細胞の解糖系の阻害、抗がん剤感受性の亢進、アポトーシス(細胞死)誘導、がん組織の酸性化の中和、増殖シグナル伝達系の阻害など、様々なメカニズムで抗がん作用を発揮することを報告しています。
Understanding the Central Role of Citrate in the Metabolism of Cancer Cells and Tumors: An Update.(がん細胞および腫瘍の代謝におけるクエン酸塩の中心的役割の理解:最新情報) Int J Mol Sci. 2021 Jun 19;22(12):6587.
がん組織の酸性化の中和にはクエン酸ナトリウムやクエン酸カリウムが有効ですが、クエン酸単独でも、様々なメカニズムでがん細胞の増殖を抑える効果が得られます。クエン酸の抗がん作用のメカニズムは多彩で、詳細は645話や658話などで解説していますので、ここでは省きます。
【クエン酸の服用法】
クエン酸は単独で様々なメカニズムで抗がん作用を発揮します。重炭酸イオンを増やして体液や血液や尿をアルカリ化する目的ではクエン酸ナトリウムやクエン酸カリウムとして摂取するという方法もあります。しかし、ナトリウム(Na)やカリウム(K)の摂取が増えるというデメリットがあります。クエン酸ナトリウムの重量の約26%がナトリウムで、クエン酸カリウムの約38%がカリウムになります。
クエン酸ナトリウとクエン酸カリウムをがん組織のアルカリ化の目的で1日10から15g程度服用すると、下痢や高ナトリウム血症や高カリウム血症に注意が必要です。
重曹(重炭酸ナトリウム)も10gのうち2.7gがナトリウムです。従って、重曹とクエン酸ナトリウムの併用はナトリウム摂取量が増える点で大きな欠点があります。
以上の理由から、がんのアルカリ療法では、酸性化したがん組織の中和の目的では重曹をメインとし、クエン酸は別の作用機序での抗がん作用を目的としてナトリウム塩やカリウム塩でない、通常のクエン酸の方が良いと思います。
前述のように、クエン酸と重曹(重炭酸ナトリウム)を混ぜると、クエン酸はクエン酸ソーダ(クエン酸ナトリウム)になり、重曹(NaHCO3)は二酸化炭素と水に分解されます。つまり、クエン酸と重曹を混ぜると、クエン酸ナトリウムと二酸化炭素と水になります。
クエン酸の作用だけが目的の時は、重曹で中和して飲みやすくするのは問題ありません。ただ、重曹(炭酸水素ナトリウム)をがん組織の酸性化を中和する目的で飲用する場合は、クエン酸と混ぜると効果が減弱します。
がん細胞は乳酸の産生が亢進し、がん組織周囲は水素イオンが増えて酸性化しています。この酸性化はがん細胞の浸潤や転移や血管新生を促進し、免疫細胞の働きを阻害しています。そのため、重曹を飲用してがん組織の水素イオンを中和して酸性度を低下すると、がん細胞の悪性度を低下させ、増殖や浸潤や転移を抑制する効果があります。免疫細胞の働きも良くなります。クエン酸は解糖系を阻害し、ミトコンドリアの代謝を活性化して、乳酸の産生を減少させます。
このようなアルカリ療法の目的で重曹を飲用している場合は、クエン酸と混ぜると意味が無くなります。重曹による水素イオンを中和する能力が無くなるからです。
がん組織をアルカリ化することはがん細胞の増殖を抑え、免疫細胞によるがん細胞の攻撃を助けます。クエン酸は乳酸産生を低下させ、重曹はがん組織の水素イオンを中和して酸性度と低下させます。したがって、クエン酸と重曹の摂取は有効です。ただし、分けて摂取します。
重曹は1日に10から15g程度を目安にします。重曹は空腹時に摂取し、クエン酸は食後に摂取します。
食後は胃酸が分泌されて重曹を摂取すると胃内で重曹と胃酸が反応して二酸化炭素が発生してゲップになってしまいます。したがって、重曹は胃酸が分泌されていない空腹時が良いと言えます。一方、クエン酸は空腹時に服用すると胃粘膜の刺激になるので、食後に摂取します。このように別々に摂取すれば、クエン酸と重曹の両方の抗がん作用が期待できます。
クエン酸飲用でがん患者を多数治療しているメキシコのハラベ・ブケイ医師の最初のプロトコールは、1日3回、毎食後に10~15gのクエン酸を水やジュースなどの飲料に溶かして摂取するという方法でした。1日の服用量の目安は、体重1kg当たり0.5gです。胃腸に刺激になって下痢になるときは服用量を減らします。しかし、この量は多くの人にとって長く継続するのは困難です。酸っぱい味と胃腸粘膜への刺激症状が問題になります。その後、ハラベ・ブケイ医師は1日に5から10グラム程度の投与を行って、有効例を多数報告しています。
ハーバード大学医学部のヴィカス・スカトメ(Vikas P. Sukhatme)博士らの研究グループのマウスの実験では1日体重1kg当たり4gを投与しています。マウスと人間のように体重が大きく異なる時は、体重でなく体表面積で比較します。標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。したがって、マウスの4g/kgは人間に換算すると1日に体重1kg当たり約0.5gになります。これはハラベ・ブケイ医師が最初の実施した服用量に類似します。
クエン酸の服用量は多いほど良いのですが、多く摂取すると副作用もでます。その兼ね合いから、1日に10から15g程度が妥当と言えます。実際に15gを500ccの水に溶かしてペットボトルに入れ、毎食後に飲む方法だと、それほど苦痛になりません。500ccの水に10〜15gであれば、酸っぱさもそれほど強くありません。
クエン酸ナトリウムなどの塩ではなく、純粋なクエン酸を使用します。クエン酸ナトリウムだと分子量の約4分の1がナトリウムなので、クエン酸を多く摂取する場合にナトリウムの摂取量が過剰になるためです。
また、ハラベ・ブケイ医師はレモンジュースに含まれるクエン酸は他の成分と結合しているので、吸収が悪いので、純粋なクエン酸を使うべきだと言っています。クエン酸の結晶粉末は白色、無臭で純度が高く、水に簡単に溶けます。医薬品用や食品用が販売されています。医療では、緩衝・矯味・発泡の目的で調剤に用いています。また,リモナーデ剤の調剤にも用います。
食品添加物としては、清涼飲料水やアルコールに加えたり、PH調整剤や酸味料として様々な食品に使用されています。食品を適切なpH領域に保つことによって微生物の増殖を防いで食品の保存性を高めることができます。
牛乳やヨーグルトなどに混ぜても問題ありません。クエン酸が胃に刺激になるときは、胃酸の分泌を抑えるプロトンポンプ阻害剤、胃痛や胃部不快感があるときはさらにスクラルファート(アルサルミン)を服用すると良いとハベラ・ブケイ医師は言っています。プロトンポンプ阻害剤はがん組織のアルカリ化にも効果があるので、がん治療に積極的に利用して良いと言えます。
クエン酸はカルシウムを溶かすので、濃い濃度のクエン酸を長く摂取すると歯を溶かす可能性があります。ストローを使って歯につかないように摂取するか、歯につく場合には、服用後に水で口をすすぐのが良いと思います。
クエン酸が酸っぱいのは酸性だからです。味覚の基本は甘味・塩味・酸味・旨味・苦味の5種類で、舌の舌乳頭という小さな突起部に存在する味蕾(みらい)という味を検出するセンサー(化学受容体)でこれらの味覚を感じています。クエン酸は弱酸性で、酸味を検出する受容体を刺激するので、酸っぱい味を感じます。クエン酸を重曹(炭酸水素ナトリウム)で中和すると酸味は感じなくなります。酸味が強くて飲みにくいときはアルカリ性の飲料に混ぜると飲みやすくなります。
【トリス塩基緩衝液はがん組織のアルカリ化が重曹より強い】
緩衝液というのは、溶液のpHをある程度一定に保つ溶液です。
例えば、弱酸(酢酸など)と、その塩(酢酸ナトリウムなど)を共存させた水溶液は、多少の酸や塩基が加えられても、ほとんどpHが変動しないという作用(緩衝作用)を持ちます。
緩衝液に酸 (H+) や塩基 (OH−)を加える場合、緩衝液内に存在する塩や電離したイオンと結びつき中和されるため、結果pHの変化が緩やかとなるのです。
「酸」というのは水素イオン(H+)を放出する物質で、「塩基」というのは水素イオン(H+)を受け取る物質です(下図)。

図:酸は水素イオンを放出し、塩基は水素イオンを受け取る
正常な動脈血のpHは7.35〜7.45という非常に狭い範囲で調節されています。このpHの調節は主に血液の重炭酸緩衝系によって行われます。この系は、重炭酸イオン(HCO3-)が塩基となってプロトン(水素イオン)を受けとって中和してpHを一定に維持します。

体内で産生される水素イオンを重炭酸イオンが中和して、二酸化炭素は肺から排出されて血液・体液のpHが一定に維持されます。
がん細胞の解糖系の亢進とがん組織の不十分な血液循環の結果として、がん組織は非常に酸性化しています。経口緩衝液でがん細胞の外部の酸性度を中和することは、がん細胞の転移の予防と抑制に有効であることが、動物実験モデルで証明されています。
この目的で最も使用されている緩衝液は重炭酸ナトリウムです。重炭酸ナトリウムによる緩衝作用は生理的というメリットはありますが、重炭酸ナトリウム(分子量84)のうちナトリウム(分子量23)が27%を占めるため、ナトリウム過剰になる欠点があります。
トリス(Tris)塩基緩衝液は、化学やバイオの実験をした人なら馴染み深い緩衝液です。試薬として販売されています。
臨床でも、トロメタモールという名前でアシドーシス(酸性血症)の治療に点滴薬として使用されています。
このトリス塩基緩衝液ががん組織の酸性化の改善に有効であることが報告されています。
例えば、前立腺がんと膵臓がんの両方の実験モデルにおいて、トリス塩基緩衝液が転移を効果的に抑制する結果が報告されています。
Tris–base buffer: a promising new inhibitor for cancer progression and metastasis(トリス塩基緩衝液:がんの進行と転移の有望な新しい阻害剤)Cancer Med. 2017 Jul; 6(7): 1720–1729.
トリス(Tris) の正式名称は Tris (hydroxymethyl) aminomethane です。
Tris の 「tri」は3の意味で、置換基が 3つ をあることを示します。つまり、ヒドロキシメチル (-CH2OH) という基が 3 個あることを意味します。この3つのヒドロキシメチル(-CH2OH) 基が、アミノメタン aminomethane に結合している構造です。
Tris は、水分子と反応して ヒドロキシイオン(OH-)を生成します。この解離反応の pKb が約 8 なので、Tris 溶液は弱アルカリ域の緩衝液として働きます。つまり、pHが8付近で最大の緩衝能を発揮します。

トリス塩基はアシドーシスの治療薬として300 mmol/Lの濃度で点滴で使用されています。
重炭酸ナトリウムは対イオンのナトリウムが増えるという問題がありますが、Tris塩基はそのような問題はありません。
マウスの実験では200 や400 mmol/Lの濃度の飲水を長期間(90日間)自由摂取しても毒性は認めないと報告されています。Tris塩基の分子量は121ですので、200mmol/Lは24.2g/Lです。
200 mmol/Lの自由摂取でがん細胞の転移を抑制され、さらにグルコーストランスポーターのGLUT-1の発現量を低下させるという報告があります。がん細胞の細胞内が酸性化すると解糖系が抑制されるためと考えられています。
炭酸水素ナトリウム(重曹)はNa+や CO2 が蓄積するという問題がありますが、トロメタモールにはそのような問題はありません。代謝性アシドーシスを速やかに是正します。
しかも、pHが8付近で最大の緩衝能を発揮するので、pKa(酸解離定数)が6.1の重炭酸ナトリウムより強力にがん組織の酸性化を軽減します。
Tris塩基は、血中の酸や炭酸ガス(CO2)と反応してこれらを減少させます。

トリスヒドロキシメチルアミノメタンと重炭酸ナトリウムの両方を併用すると代謝性アシドーシスの改善により良いという報告もあります。
Tris-hydroxymethyl aminomethane and sodium bicarbonate to buffer metabolic acidosis in an isolated heart model.(分離した心臓モデルにおける代謝性アシドーシスを緩衝するためのトリスヒドロキシメチルアミノメタンと重炭酸ナトリウム)Am J Respir Crit Care Med. 1997 Mar;155(3):957-63.
【要旨】
代謝性アシドーシスは、興奮-収縮連関経路のすべてのステップに影響を及ぼすことにより、心筋の発達力の低下を誘発する。細胞内アシドーシスの一時的な悪化を引き起こすことから、急性アシドーシスの治療に重炭酸ナトリウムを投与することの有効性が疑問視されている。
代替治療薬であるトリスヒドロキシメチルアミノメタンには、細胞内空間に拡散するという利点がある。この研究は、代謝性アシドーシスが心筋機能に及ぼす影響を評価し、重炭酸ナトリウム、トリスヒドロキシメチルアミノメタン、およびそれらの組み合わせによるアルカリ化の影響を検討する目的で行った。
血液灌流分離心臓標本を使用して、左心室収縮性と弛緩を正常pHおよび代謝性アシドーシス(pH = 7.0)において測定した。
アシドーシスは、心筋の収縮性と弛緩を劇的に低下させた。
重炭酸ナトリウムで緩衝化した後、血漿重炭酸塩濃度は正常化されたが、PaCO2の増加によりpHは正常より低いままであった。収縮性と関係は最初は悪化し、その後わずかに改善して正常値に戻った。
トリスヒドロキシメチルアミノメタンはアシドーシスの正常化は不十分であったが、心筋の収縮性と弛緩を大幅に改善した。
トリスヒドロキシメチルアミノメタンと重炭酸ナトリウムの組み合わせは、PaCO2に影響せずにアシドーシスを完全に緩衝し、心筋の収縮性を大幅に改善した。
トリスヒドロキシメチルアミノメタンと炭酸水素ナトリウムの組み合わせは、重炭酸ナトリウム緩衝液によって生成されたCO2を捕捉するトリスヒドロキシメチルアミノメタンの能力に基づいている。この組み合わせにより、代謝性アシドーシスの完全な補正が達成され、心筋のパフォーマンスが向上する。
重炭酸ナトリウムはクエン酸と混ぜると二酸化炭素(CO2)が発生しますが、Tris塩基はCO2は発生しません。
Trisはそのまま水に溶かして摂取するとアルカリが強いので、胃腸に刺激になります。
そこでクエン酸と一緒に溶かして中和させて服用すると飲みやすくなり、緩衝作用は維持され、クエン酸の抗がん作用も加わって、がん治療の効果を高めます。
実際に私自身で試してみました。
具体的にはTris塩基10gにクエン酸10gを水500ccに混ぜて溶かし、酸味のあるジュース(オレンジやグレープフルーツやトマトなど)に混ぜて飲用すると飲みやすい飲料になり、しかも、尿のpHを測定するとアルカリになります。
Tris塩基(1日10g程度)、クエン酸(1日10g程度)、プロトンポンプ阻害剤、ジクロロ酢酸ナトリウム、COX-2阻害剤のセレコキシブを併用して、がん組織の酸性化を軽減し、むしろアルカリ化すると、がん細胞が縮小する効果が期待できます。進行がんで治療が行き詰まっているときは試してみる価値はあると思います。
少なくとも、この組み合わせは、私自身が試して、副作用はありません。
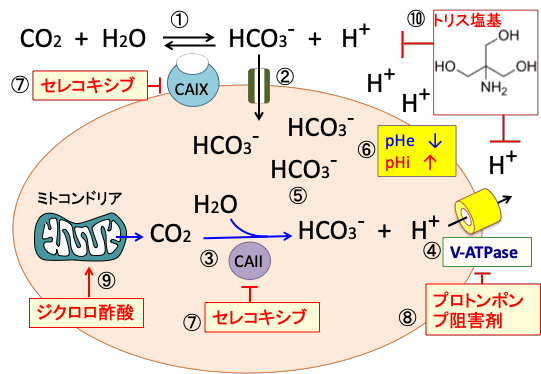
図:炭酸脱水酵素IX(CAIX)は細胞膜に存在し、細胞外の二酸化炭素と水から重炭酸イオン(HCO3-)と水素イオン(H+)に変換する(①)。細胞外の重炭酸イオンは共輸送体によって細胞内に取り込まれる(②)。細胞質内の炭酸脱水酵素II(CAII)はミトコンドリアから産生される二酸化炭素(CO2)を重炭酸イオンと水素イオンに変換する(③)。V型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)は細胞内の水素イオン(プロトン)を細胞外に排出する(④)。重炭酸イオンは細胞内に保持される(⑤)。その結果、細胞外pH(pHe)は低下してより酸性化し、細胞内pH(pHi)はよりアルカリ化される(⑥)。COX-2阻害剤のセレコキシブはCa IIとCa IXの両方を阻害する(⑦)。プロトンポンプ阻害剤はV-ATPaseを阻害する(⑧)。ジクロロ酢酸ナトリウムはミトコンドリアの代謝を活性化してCO2の酸性を増やす(⑨)。トリス塩基は細胞外のプロトン(水素イオン:H+)を消去する(⑩)。したがって、セレコキシブとプロトンポンプ阻害剤とジクロロ酢酸ナトリウムとトリス塩基を併用すると、がん細胞内pHが低下(酸性化)して増殖が低下し死滅する。がん細胞外pH(pHe)がアルカリ化すると、がん細胞の浸潤や転移が抑制され、がん細胞に対する免疫細胞(T細胞やNK細胞)の働きが良くなる。
【ジクロロ酢酸ナトリウムの使用法】
正常細胞では低酸素誘導因子-1(HIF-1)は細胞が低酸素状態におかれた場合しか活性化されません。
一方、多くのがん細胞では、低酸素状態でなくてもHIF-1の活性が亢進しています。がん細胞では、がん遺伝子のc-Mycの活性や増殖のシグナル伝達系のPI3K/Akt/mTORC1が恒常的に亢進しており、その結果としてHIF-1の活性が恒常的に亢進しているからです。
がん細胞の代謝の特徴である「解糖系の亢進とミトコンドリアでの酸化的リン酸化の抑制」というワールブルグ効果(Warburg effect)を根本で制御しているのがHIF-1と言っても過言ではありません。
HIF-1は乳酸脱水素酵素(LDH)などの解糖系酵素の発現を亢進し、一方、ピルビン酸脱水素酵素キナーゼ(PDK)の発現を亢進して、ミトコンドリアでの酸素呼吸を抑制します。
解糖系で産生されたピルビン酸がミトコンドリアで代謝されるとき、その第一ステップとしてピルビン酸脱水素酵素(PDH)によってピルビン酸がアセチルCoAに変換されます。
このピルビン酸脱水素酵素(PDH)をリン酸化して不活性化するのがピルビン酸脱水素酵素キナーゼ(PDK)です。このピルビン酸脱水素酵素キナーゼはHIF-1によって発現が亢進します。
つまり、がん細胞では、HIF-1によってピルビン酸脱水素酵素キナーゼ(PDK)の発現が亢進し、PDKがピルビン酸脱水素酵素(PDH)の活性を阻害し、ピルビン酸からアセチルCoAへの変換が阻害されるので、ミトコンドリアでの酸素を使った代謝が抑制されることになります。(下図)

図:正常細胞では、グルコースは解糖系でピルビン酸に変換され、ピルビン酸脱水素酵素(①)でアセチルCoAに変換され(②)、TCA回路(③)と呼吸鎖における酸化的リン酸化によってATPが産生される(④)。がん細胞では低酸素やPI3K/Akt/mTORC1シグナル伝達系の活性化によって低酸素誘導因子-1(HIF-1)の活性が恒常的に亢進している(⑤)。HIF-1は解糖系酵素や乳酸脱水素酵素(LDH)の発現を亢進し(⑥)、乳酸産生を増やす(⑦)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を誘導し(⑧)、ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素をリン酸化してその活性を阻害する(⑨)。その結果、ピルビン酸からアセチルCoAへの変換が阻止されてミトコンドリアでの糖代謝(酸化的リン酸化)は抑制される。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってがん細胞の解糖系を抑制し、副作用が少なく抗腫瘍効果を示すことが報告されています。
高度に転移性の性質をもった乳がん細胞を移植した動物実験モデルで、ジクロロ酢酸ナトリウムは増殖を抑制し、肺への転移巣の数を減少させました。
ジクロロ酢酸ナトリウムはがん細胞における機能低下したミトコンドリアを活性化してアポトーシス(細胞死)を起こしやすくします。 動物実験では、ジクロロ酢酸単独で腫瘍の著明な縮小が観察されていますが、人間の腫瘍の場合は、ジクロロ酢酸ナトリウム単独では、腫瘍を縮小させる効果には限界があるようです。
しかし、がん細胞を死滅する作用をもった医薬品と併用すると、がん細胞のアポトーシス感受性を高めるジクロロ酢酸ナトリウムの効果によって、腫瘍の縮小効果が高まる可能性があります。実際に、抗がん剤や放射線照射の効き目(感受性)を高める効果が多数報告されています。
服用量は1日に体重1kg当たり10から15mgで、1〜2回に分けて服用します。体重60kgの人で600mg~900mgになります。ジクロロ酢酸ナトリウムは熱で不活性化しやすいので、水に溶かして服用します。胃粘膜に刺激になるので食後に服用します。
注意する副作用は末梢神経障害です。ピルビン酸脱水素酵素はビタミンB1を補因子として使用するので、ビタミンB1が消耗すると神経障害がおこります。この副作用を予防(軽減)するために、ビタミンB1製剤を一緒に服用します。ビタミンB1は1日に100mg以上を服用します。
ピルビン酸脱水素酵素の補因子であるR体αリポ酸を併用するとさらに抗腫瘍効果を高めることができます。R体αリポ酸は体内で合成されるので、サプリメントでの補充は必須ではありませんが、サプリメントとして補充するとミトコンドリアの活性化を増強できます。(図)

図:グルコースを解糖系で分解して産生されたピルビン酸はピルビン酸脱水素酵素によってアセチルCoAになってミトコンドリアのTCA回路でさらに代謝される(①)。がん細胞では低酸素誘導性因子-1(HIF-1)の活性が亢進し(②)、HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進する(③)。ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素を阻害する(④)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する(⑤)。R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働く(⑥)。
ジクロロ酢酸ナトリウムの体内での半減期は約24時間ですので、1回服用したジクロロ酢酸ナトリウムが体内からほとんど排泄されるのに数日かかります。したがって、毎日服用すると少しづつ体内に蓄積して副作用が起こりやすくなります。高齢者では体内での代謝(分解と排泄)が遅くなる傾向にあります。 がんの進行状況や体調などによって、1日の服用量や1週間の服用回数などを調節します。1日おきの服用や、1週間のうち5日間服用して2日間休むというような服用法を考慮します。
副作用と思われる症状が現れたときは、その症状が消失するまで服用を中断します。副作用が消失した後、少量から再開します。ジクロロ酢酸ナトリウムの体内濃度を急速に上げたり中断するより、低用量を長期間にわたって服用する方が良いようです。
腫瘍の縮小がみられた場合は、ジクロロ酢酸ナトリウムの量を体重1kg当たり1日2~3mgに減らし、ビタミンB1を併用する維持療法が試されています。緑茶、紅茶、コーヒーを1日5~10杯くらい飲用するとDCAの効果が高まるという意見があります。これはカフェインによる効果であることが推測されています。
【プロトンポンプ阻害剤、セレコキシブ、アセスルファム・カリウム】
がん細胞の水素イオンの排出に大きな役割を果たしているのがV型ATPアーゼ(V-ATPase)です。V型ATPアーゼ (vacuolar ATPase)は液胞型ATPアーゼ、液胞型プロトンポンプなどと訳されています。
ATPアーゼとはATP(アデノシン三リン酸)の末端高エネルギーリン酸結合を加水分解する酵素群の総称で、ATPを使って生物活動に行うタンパク質の多くがこの活性を持っています。V型ATPアーゼは液胞のプロトン(水素イオン)の能動輸送を行うATPアーゼ活性をもったタンパク質で、ATPのエネルギーを使ってプロトン(水素イオン)を能動的に細胞膜を通して輸送します。
がん細胞ではこのV型ATPアーゼの発現が亢進しており、がん組織の酸性化に関与しています。V型ATPアーゼの発現量が多いほど、がん治療に抵抗し、再発しやすく生存期間が短いという報告もあります。
V型ATPアーゼの阻害薬ががんの治療薬として開発が行われていますが、胃酸分泌阻害剤として使用されているプロトンポンプ阻害剤がV型ATPアーゼを阻害する作用があることが知られています。
胃潰瘍の治療に使われるプロトンポンプ阻害剤は、主に胃のH+/K+ATPasesを阻害しますが、V型ATPaseも阻害します。実際に、動物の移植腫瘍を使った実験などで、プロトンポンプ阻害剤が腫瘍組織の酸性化を改善して抗がん剤や免疫療法の効果を高める作用が報告されています。
プロトンポンプ阻害剤(Proton Pump Inhibitor)は胃の壁細胞のプロトンポンプに作用し、胃酸の分泌を抑制する薬です。医薬品としては、オメプラゾール、ランソプラゾール、ラベプラゾールナトリウム、エソメプラゾールなど多数の薬が販売されています。胃潰瘍や逆流性食道炎の治療に使われています。
がんのアルカリ療法では私はエソメプラゾール(商品名:ネキシウム)を使っています。エソメプラゾールは別のプロトンポンプ阻害剤のオメプラゾールの光学異性体(S体)です。ラセミ体のオメプラゾールに比べ、血中への移行が良好で、高い血中濃度が得られます。また、薬の代謝に個人差がそれほどないため、ばらつきのない より安定した臨床効果が期待できます。
エソメプラゾールは、他のプロトンポンプ阻害剤と同様に、壁細胞の酸性環境に対して高い特異性を持っており、そこで蓄積され、活性化され、プロトンポンプを共有結合的に阻害します。
そのほかに、炭酸脱水酵素を阻害するCOX-2阻害剤のセレコキシブや人工甘味料のアセスルファム・カリウムもがん組織のアルカリ化に役立ちます。
メラトニンは低酸素誘導因子-1(HIF-1)を阻害して、ワールブルグ効果を阻止します。(774話参照)
さらに2-デオキシ-D-グルコースはがん細胞の解糖系を阻害する効果によって乳酸産生を抑制します。
2-デオキシ-D-グルコース(2-Deoxy-D-glucose)は、2-ヒドロキシル基が水素原子に置換されたグルコース分子です。
2-デオキシグルコース(2-DG)はグルコースと同じようにグルコース輸送体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれます。
グルコースと2-DGは細胞内に入るとヘキソキナーゼ(Hexokinase)によってリン酸化され、グルコース-6-リン酸あるいは2-デオキシ-D-グルコース-6-リン酸(2-DG-6-リン酸)に変換されます。
リン酸化されるとグルコース・トランスポーター(GLUT1)を通過できないため細胞外へ出れなくなります。このヘキソキナーゼによる6位のリン酸化は解糖系によるグルコースの代謝の最初のステップで、細胞内に取込んだグルコースを細胞内に停めておく目的があります。
リン酸化反応後は、グルコース-6-リン酸はヘキソース・フォスフェート・イソメラーゼによってフルクトース-6-リン酸に変換(異性化)され、さらに解糖系酵素で代謝されてエネルギー産生や物質合成へと使用されます。
しかし、2-DG-6-リン酸は、解糖系酵素で代謝できないため、細胞内にトラップされます。
がん細胞はグルコース・トランスポーターのGLUT1の発現量が増えてグルコースの取り込みと同時に2-DGの取り込み量も多いので、摂取した2-DGの多くががん細胞に蓄積します。2-DGによってエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーターの発現がさらに増え、グルコースの取り込みが増えます。このことは2DGの取り込みがさらrに増えることにもなります。
グルコース-6-リン酸や2-DG-6-リン酸を脱リン酸化するフォスファターゼは糖新生を行う肝臓や腎臓の細胞にはありますが、多くのがん細胞はフォスファターゼの活性が低いので、一旦入った2DGは2DG-6-リン酸に変換されたあとは細胞外に出ることができず、さらにそれ以上代謝されることもできないので、2-DG-6-リン酸の状態で蓄積します。
細胞内で蓄積した2-DG-6-リン酸はヘキソキナーゼとヘキソース・フォスフェート・イソメラーゼを阻害します(拮抗阻害)。
したがって、2-DGを経口摂取すると、がん細胞に多く取り込まれ、がん細胞の解糖系を阻害するので、グルコースの代謝によるエネルギー産生と物質合成を阻害することになります。

図:2-デオキシ-D-グルコースはグルコース(ブドウ糖)の2位の炭素についている水酸基(OH)が水素(H)に置換したグルコース類縁物質。2-デオキシ-D-グルコースはグルコーストランスポーターを介してがん細胞に多く取込まれる。ヘキソキナーゼでリン酸化されて2-デオキシグルコース-6リン酸(2-DG-6-PO4)に変換されるが、それ以上は解糖系酵素で代謝できないので、細胞内で2-DG-6-PO4が蓄積する。細胞内で蓄積した2-DG-6-PO4はヘキソキナーゼを阻害するので、グルコースの代謝も阻害されることになる。
以上の様に、重曹(重炭酸ナトリウム)、クエン酸、トリス塩基緩衝剤、ジクロロ酢酸ナトリウム(ビタミンB1とR体アルファリポ酸を併用)、エソメプラゾール、セレコキシブ、セファスルファム・カリウム、メラトニン、2-デオキシ-D-グルコースを併用すると、がん細胞の細胞内pHを酸性化し、細胞外pHをアルカリ化して、細胞内外のpHを正常化し、がん細胞の増殖を抑制し、細胞死を誘導できます(トップの図)。
著書紹介:

詳しくはこちらへ:
著書紹介

(くわしくはこちらへ)
| « 782)セレコキ... | 784)抗腫瘍免... » |



